pektroskopia UV/vis
S
Przejścia elektronowe ze stanu podstawowego do stanu
wzbudzonego
energia :
10
3
– 10
2
kJ/mol
(310
2
– 310
1
kcal/mol)
widmo :
elektronowo – oscylacyjno – rotacyjnym
zakres długości fali:
100 – 800 nm,
100 – 200 nm - daleki (próżniowy) nadfiolet -
100.000 – 50.000 cm
-1
200 – 400 nm - bliski nadfiolet
-
50.000 – 25.000 cm
-1
400 – 800 nm - zakres widzialny
-
25.000 – 12.500 cm
-1
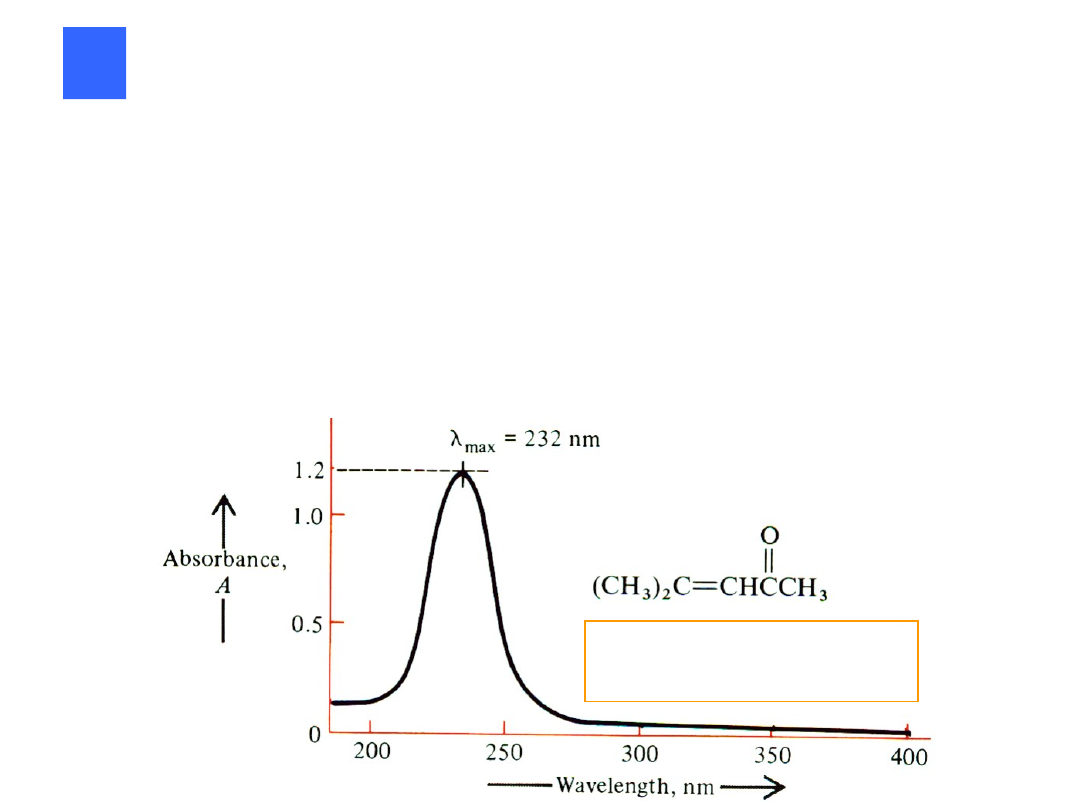
max
= 232 nm;
max
= 130
STAN
WZBUDZONY
orbitale
antywiążące
orbital *
orbital *
STAN PODSTAWOWY
orbital n - orbital
niewiążący
orbital
orbital
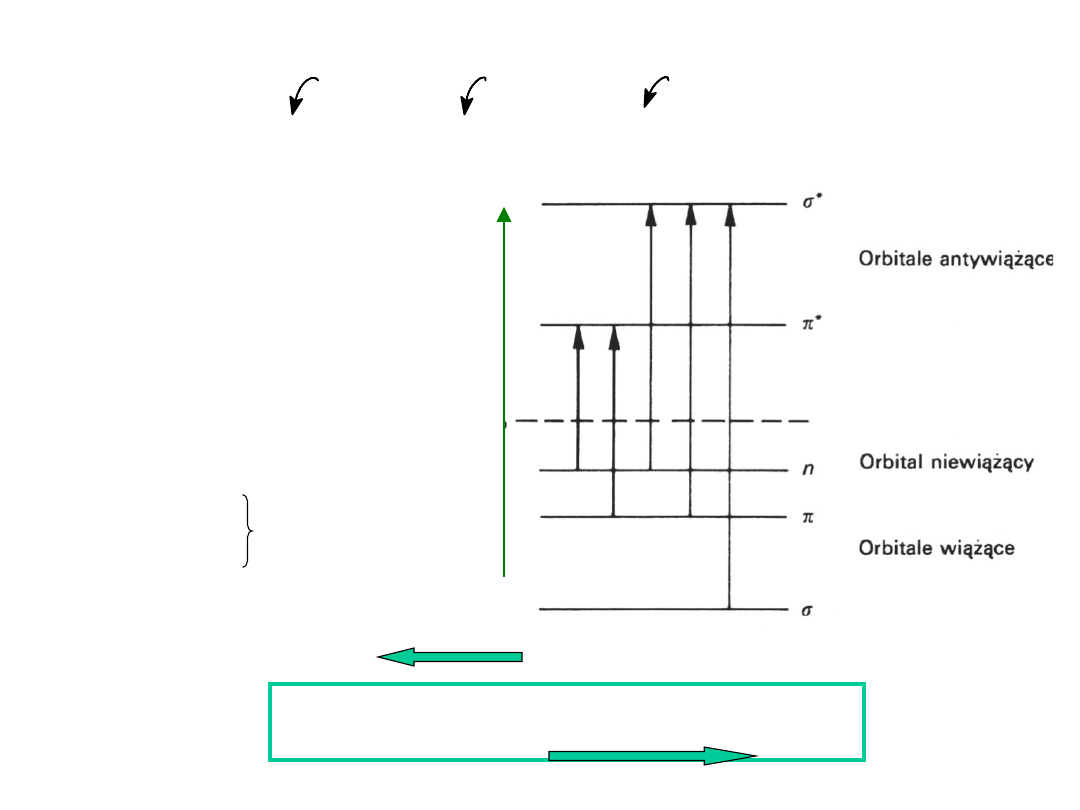
* > n * > * > n
*
H
:
CH
3
H
2
C
::
CH
2
CH
3
OH
..
..
elektrony
elektrony
elektrony n
TYPY PRZEJŚĆ
ELEKTRONOWYCH
orbitale
wiążące
długość
fali
energia przejść
elektronowych
E
N
E
R
G
I
A
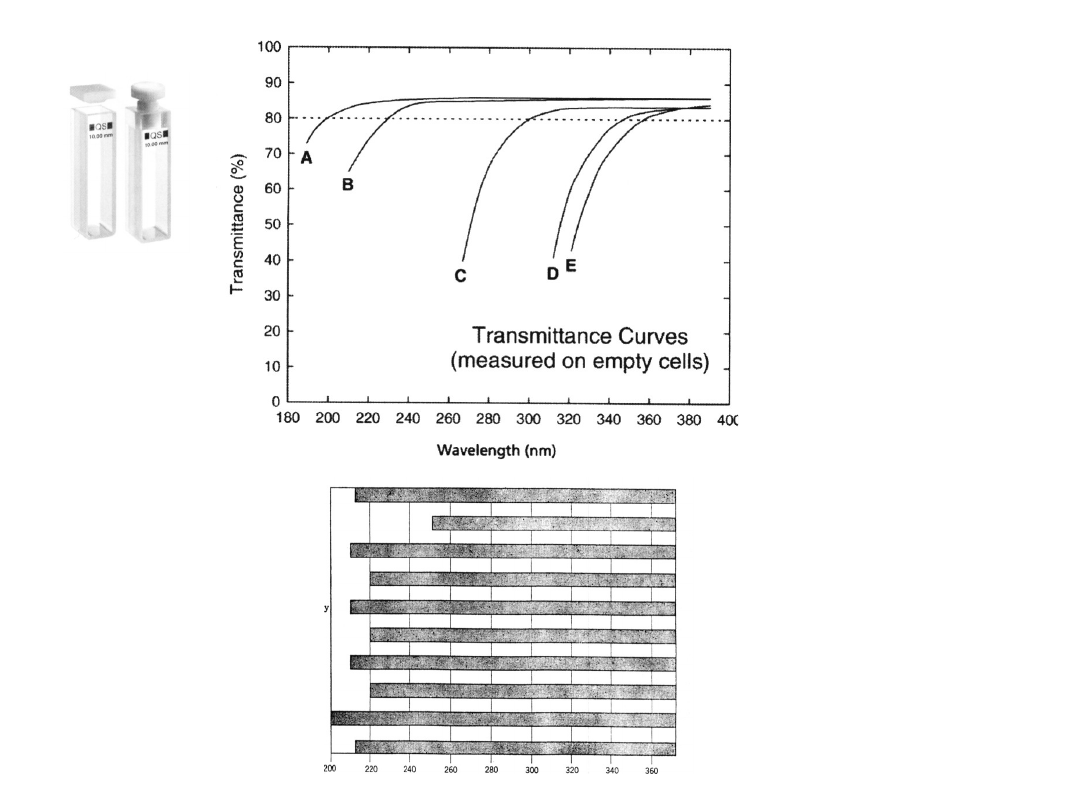
KUWET
Y
l = 1
cm
Acetonitryl (190)
Chloroform (240)
Cykloheksan
(195)
1,4-Dioksan (215)
Etanol 95% (205)
n-Heksan (201)
Metanol (205)
Izooktan (195)
Woda (190)
Fosforan trimetylu
(210)
ROZPUSZCZALNI
KI
Zakresy
praktycznej
przezroczystości
rozpuszczalnikó
w
Objętość:
3 ml
(standard)
0,5 ml (pół-
mikro)
100 l (mikro)
STĘZENIE
ROZTWORU
10
-5
-
10
-3
mol/l
MATERIAŁ
A, B – kwarc
C –
polimetakrylan
D – polistyren
E – szkło
(>320 nm)
Przepuszczalnoś
ć kuwet
napełnionych
wodą wzrasta o
ok. 8 %
ŹRÓDŁO
PROMIENIOWAN
IA
Lampa wodorowa
(deuterium lamp)
Lampa
wolframowa
(tungsten lamp)

WARTOŚCI MOLOWEGO
WSPÓŁCZYNNIKA ABSORPCJI
Wielkość molowego współczynnika
absorpcji
(molar
absorptivity)
jest
proporcjonalna
do
prawdopodobieństwa
przejścia elektronowego:
= kPa
(k – stała, a – powierzchnia
chromoforowa)
Absorpcja o wysokiej intensywności (high-
intensity absorptions)
Przejścia dozwolone (P 1, Q 0) - rzędu
10
4
– 10
6
Absorpcja o niskiej intensywności (low-intensity
absorptions)
Przejścia wzbronione (P ~ 10
-3
, Q 0) - <
10
3
Im bardziej prawdopodobne jest dane przejście
elektronowe tym większy jest molowy
współczynnik absorpcji
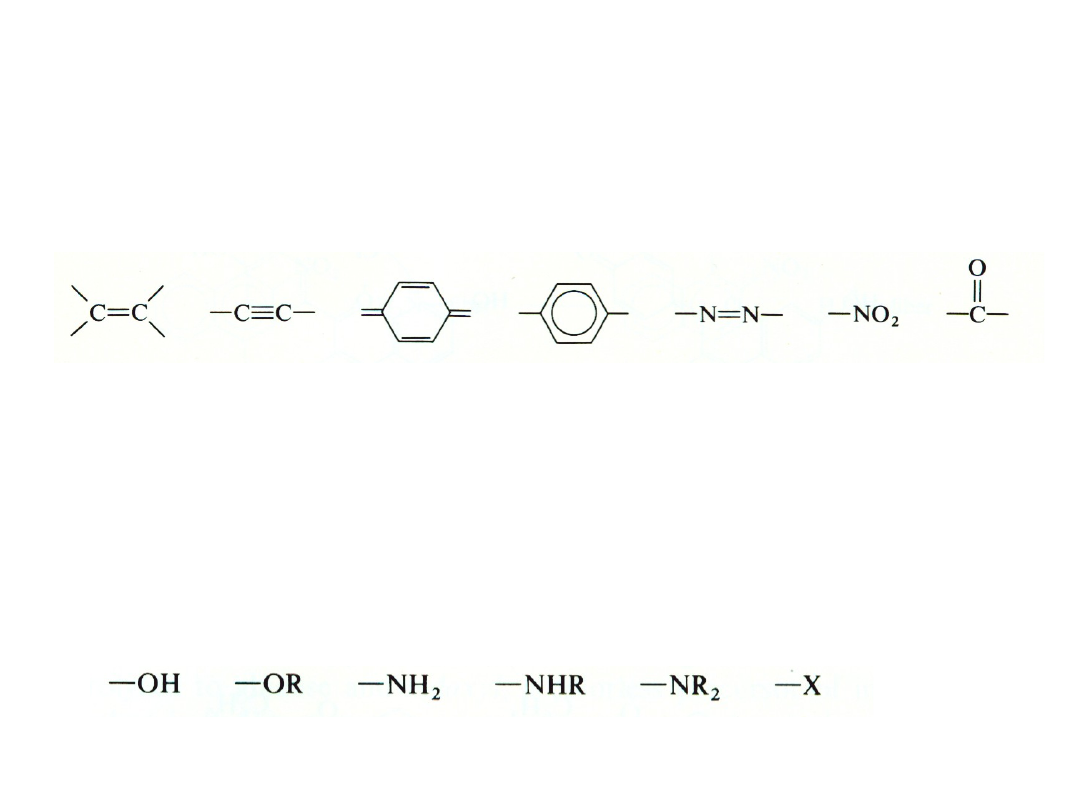
Chromofor
(gr. chroma phoros – „niosący
kolor”) – grupa (najczęściej nienasycona)
odpowiedzialna za absorpcję spowodowaną
przejściem elektronowym ( *, n *)
Auksochrom
(gr. auxanein – „zwiększać”) –
podstawnik (zawierający elektrony n), który
zwiększa intensywność (efekt hiperchromowy)
i/lub położenie pasma absorpcji (przesunięcie
batochromowy) chromofora
CHROMOFORY I
AUKSOCHROMY
–
CH
3

Podstawienie lub zmiana rozpuszczalnika mogą
wywoływać cztery rodzaje efektów w paśmie
absorpcji:
Przesunięcie batochromowe
(ang.
„red
shift“) –
przesunięcie absorpcji w kierunku niższych energii,
dłuższych fal
Przesunięcie hipsochromowe (ang. „blue
shift”) –
przesunięcie absorpcji w kierunku wyższych energii,
krótszych fal
Efekt
hiperchromowy
–
podwyższenie
intensywności absorpcji
Efekt
hipochromowy
–
zmniejszenie
intensywności absorpcji

OZNACZANIE PASM ABSORPCJI
CHARAKTERYSTYCZNYCH
DLA POSZCZEGÓLNYCH
STRUKTUR ELEKTRONOWYCH
(wg. Burawoya i Braude’a)
Pasma R
(niem. radikalartig)
– < 100
Przejścia n * w pojedynczych grupach
chromoforowych (C=O, NO
2
); przesunięcie
hipsochromowe w miarę wzrostu polarności
rozpuszczalnika
Pasma K
(niem. konjugierte)
– > 10 000
Przejścia * w widmach cząsteczek o układach
sprzężonych:
w układach dienowych i polienowych (C=C-C=C)
n
- nie
zależą od
polarności rozpuszczalnika
pasma K enonów C=C-C=O ulegają przesunięciu
batochromowemu, (któremu
często towarzyszy efekt hiperchromowy) przy wzroście
polarności rozp.
Pasma B
(pasma benzenoidowe)
– < 450
Charakterystyczne dla widm związków aromatycznych
(benzen 230-270 nm);
wykazują charakterystyczną strukturę subtelną zanikającą
w rozp. polarnych
Pasma E
(pasma etylenowe)
– 2000 – 14 000
Przejścia * charakterystyczne dla układów
benzenoidowych;
pasmo E
1
benzenu (180 nm)
pasmo E
2
benzenu (200 nm)
podstawniki auksochromowe i sprzężenie -przesunięcie
batochromowe pasm E
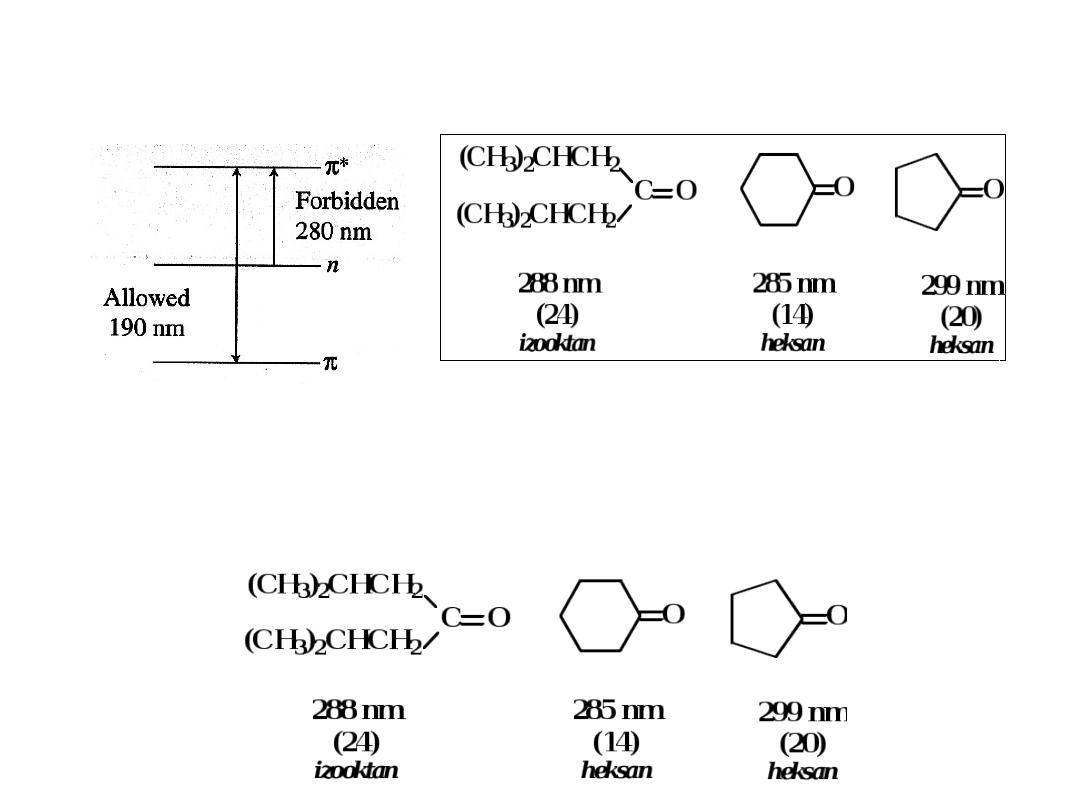
Aldehydy i ketony –
dla prostych grup chromoforowych
najłatwiejsza do zaobserwowania jest absorpcja typu
n
*
przy
280-290 nm
Efekt batochromowy towarzyszy wprowadzeniu
większych i bardziej rozgałęzionych grup alkilowych
W większości przypadków przejścia n * są
zabronione ( = 15)
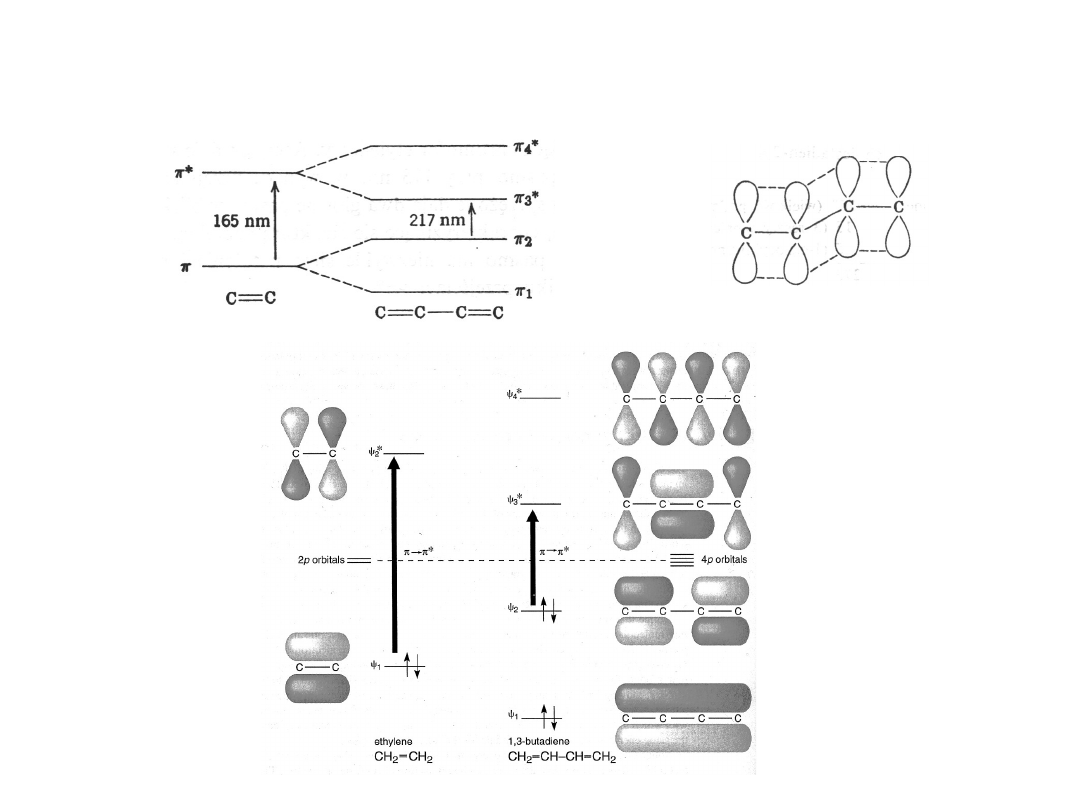
EFEKT SPRZĘŻENIA W ALKENACH
LUMO
HOM
O
WPŁYW SPRZĘŻENIA NA PRZEJŚCIA
ELEKTRONOWE
Każde wydłużenie układu sprzężonego przesuwa pasmo
absorpcji ( *, n *) w kierunku dłuższych fal
(batochromowo) o ok. 15-45 nm
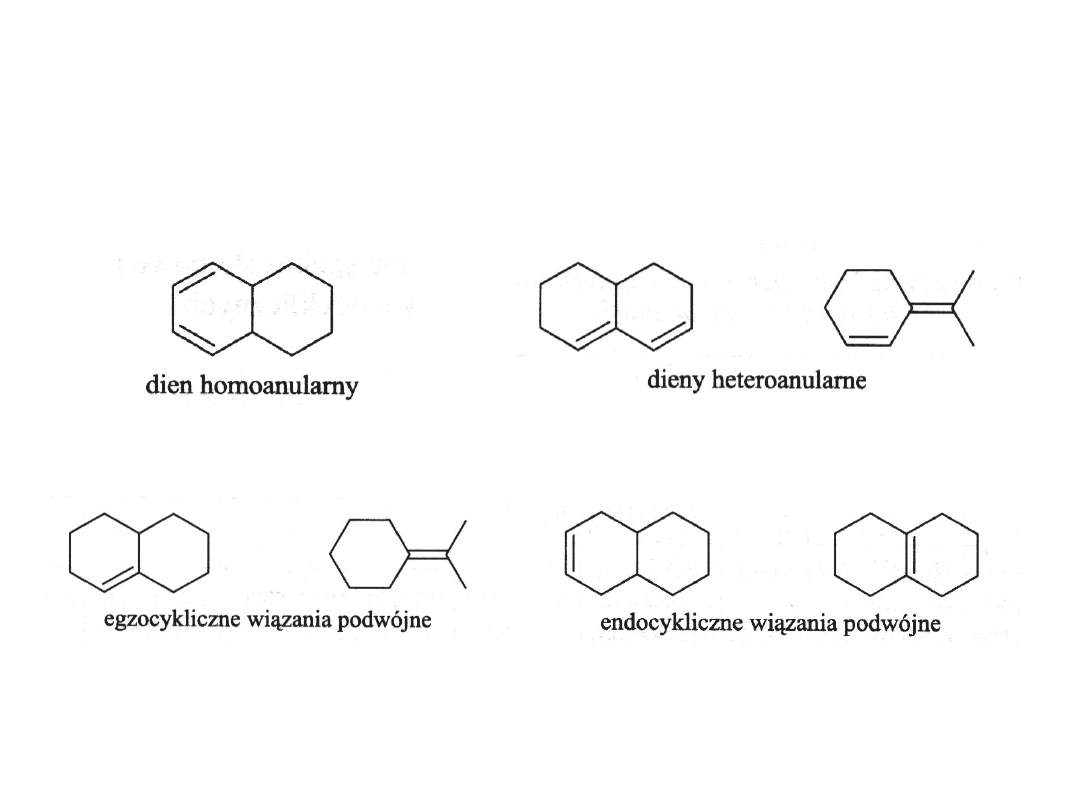
cisoid,
s-cis
transoid, s-
trans
Dieny cykliczne mają z konieczności
wymuszoną konformację s-cis lub s-trans
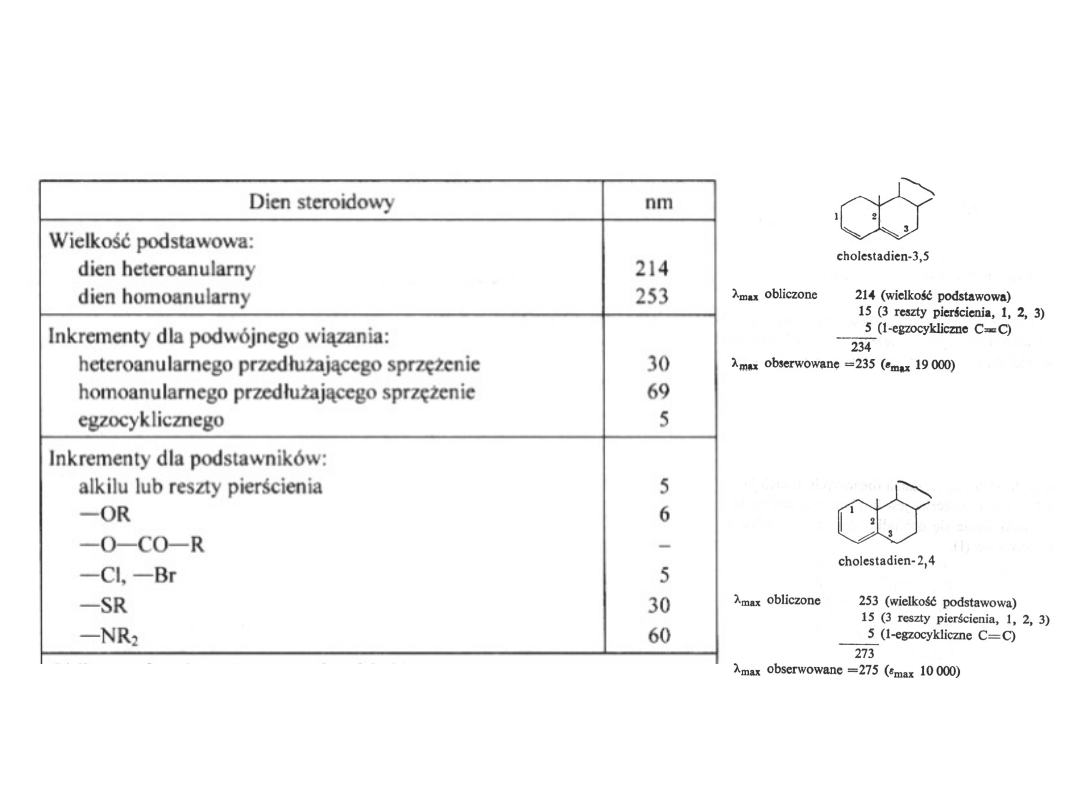
Empiryczne reguły addytywności dla dienów
(przejścia
*, K)
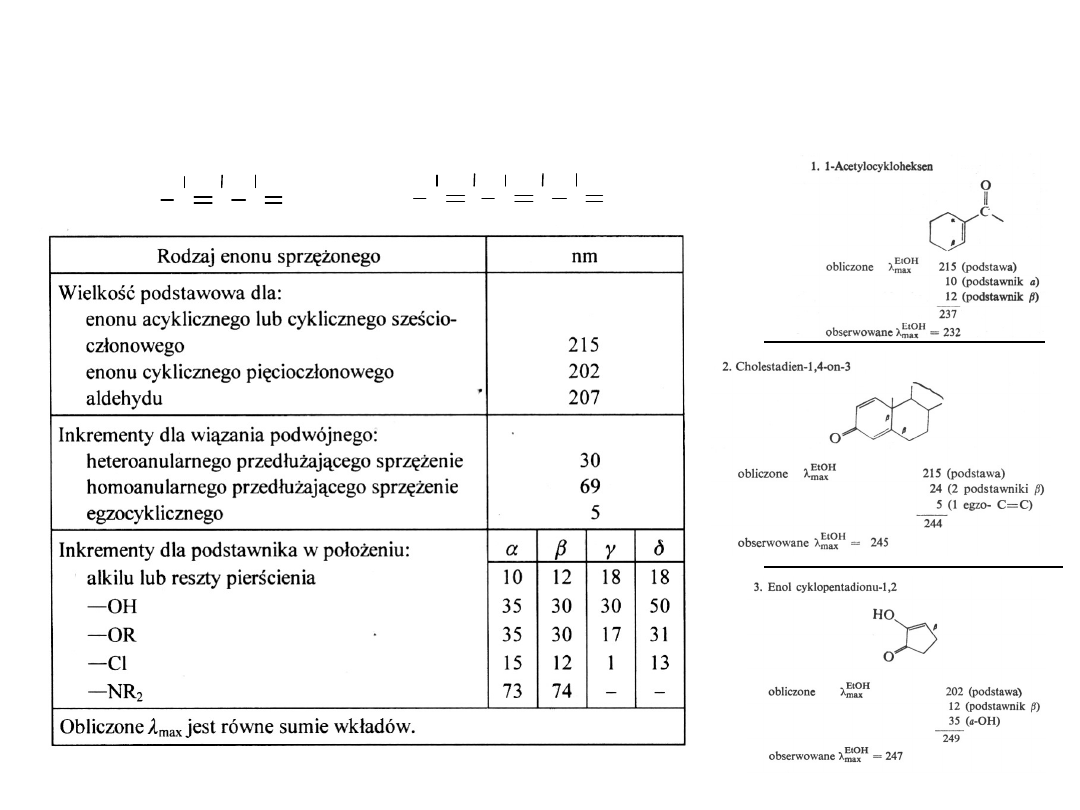
Na położenie i intensywność pasma * (K) enonów ma wpływ (i)
podstawienie przy wiązaniu nienasyconym, (ii) wydłużenie układu
sprzężonego i (iii) rozpuszczalnik
C C C O
C C C O
C C
REGUŁY ADDYTYWNOŚCI DLA ENONÓW
(wg.
Fiesera)

POPRAWKI NA
ROZPUSZCZALNIK
pasmo K
enonów
Rozpuszczal
nik
heksan
CHCl
3
H
2
O
* (
K
)
230 (12
600)
238
243 (10
000)
+13
n* (
R
)
329 (41)
314
305 (60)
-24
C C
C
O
H
H
3
C
H
3
C
CH
3
tlenek mezytylu
przesunięcie batochromowe
„red shift”
przesunięcie hipsochromowe
„blue shift”
Stan wzbudzony enonu
dla przejść * jest
bardziej polarny od stanu
podstawowego
Stan wzbudzony enonu
dla przejść n* jest
mniej polarny niż stan
podstawowy
Pasmo K
Przeniesienie etylenowego
elektronu do orbitali *
grupy karbonylowej (charge
transfer)

C C C O
C C
OH (OR)
Reguły addytywności nienasyconych kwasów
karboksylowych i ich estrów (przejścia
*)
(Nielson)
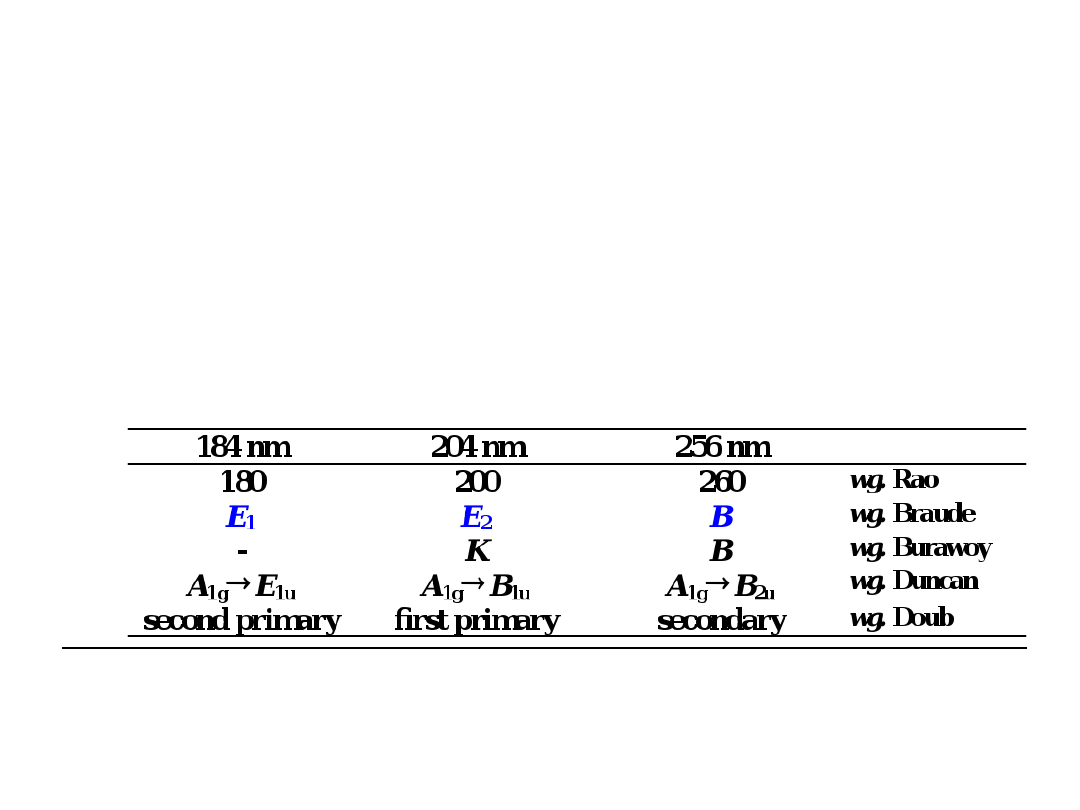
CHROMOFOR BENZENOWY
Benzen daje trzy pasma absorpcji w wyniku
przejść *:
ok. 184 nm (
max
= 60 000) – przejście
dozwolone
ok. 200 nm (
max
= 7 900)
ok. 256 nm (
max
= 200)
(charaktryzuje się strukturą
subtelną)
Oznaczenie pasm
benzenowych
Pasmo
B
(pasmo benzoidowe); Pasma
E
(pasma
etylenowe, E
1
i E
2
) –
W wielopierścieniowych związkach aromatycznych
pasmo E
2
ma strukturę subtelną
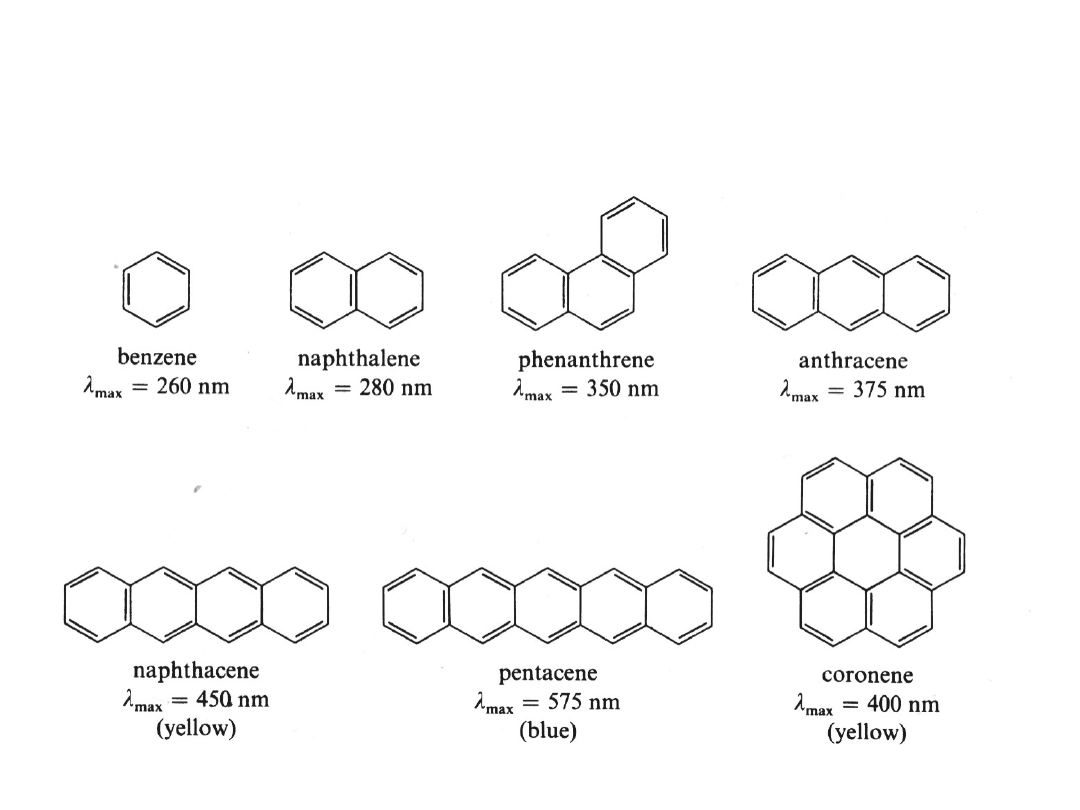
Wielopierścieniowe związki aromatyczne
(ACENY i FENENY)
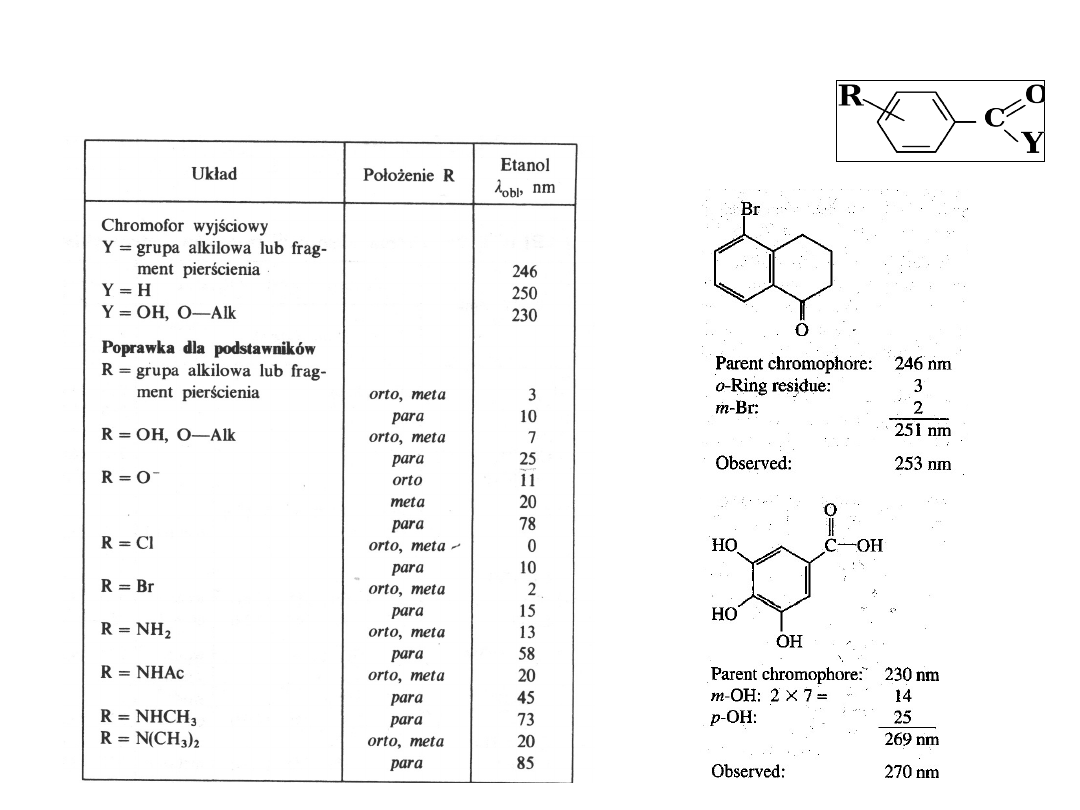
Reguły obliczania położenia pasm absorpcji
(primary absorption band)
POCHODNYCH BENZOILOWYCH
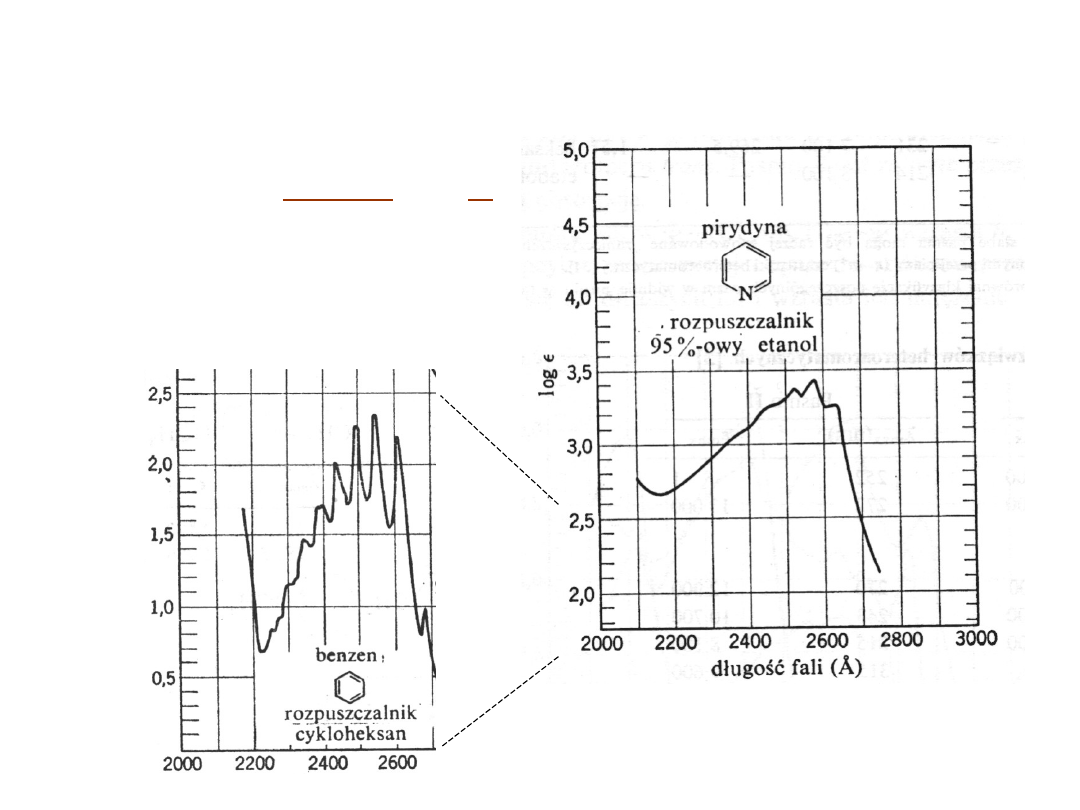
Widmo
pirydyny
jest
podobne
do
widma
benzenu.
Pasmo
B
pirydyny
jest
bardziej
intensywne
(asymetryczna
cząsteczka) i ma mniej
wyraźną
strukturę
subtelną niż benzen.
ZWIĄZKI
HETEROCYKLICZNE
ZAKRES DALEKIEGO
NADFIOLETU
< 200 nm
*, n * - pojedyncze wiązania C-C,
C-O, C-Cl
* - izolowane C=C, CC, CN
Grupa funkcyjna
max
nm
Alkany
< 150
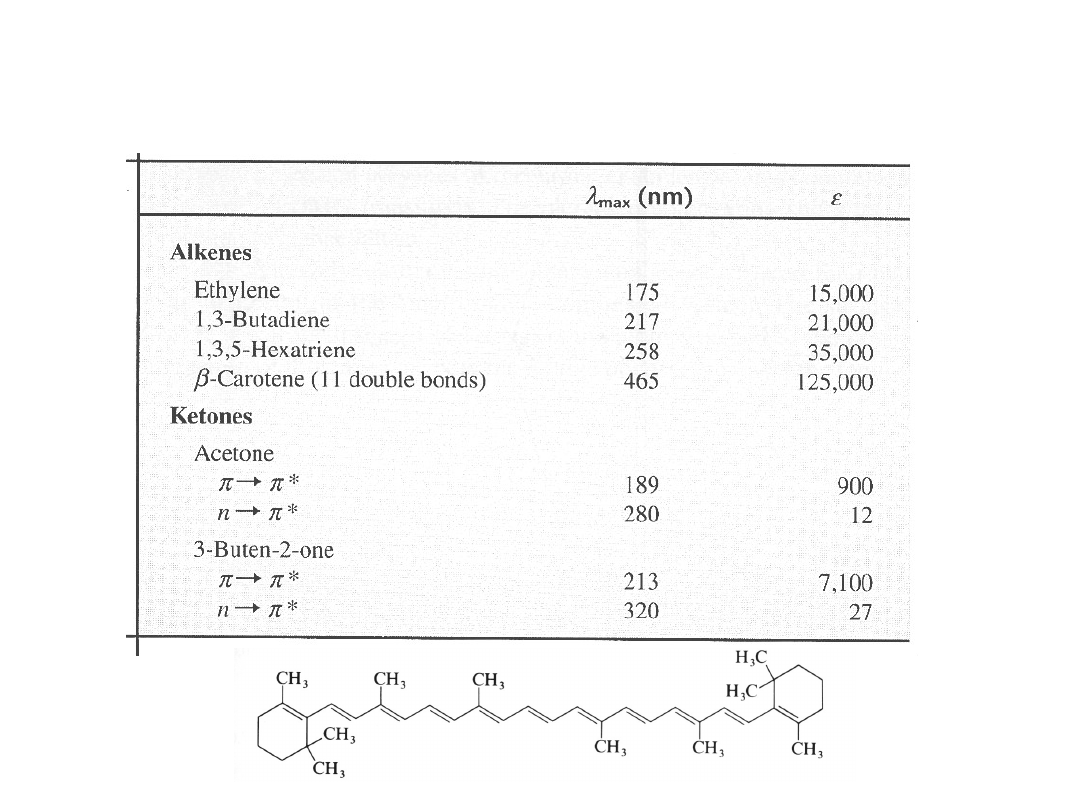
Alkeny
175
Alkiny
170
Nitryle
160
Etery
180
Alkohole
175-200
Chlorki alkilu
170
Brak absorpcji w zakresie bliskiego nadfioletu
wskazuje na obecność tego rodzaju związków
DLA JAKOŚCIOWEJ INTERPRETACJI WIDM UV
PRAKTYCZNĄ WARTOŚĆ MA ABSORPCJA
WYSTĘPUJĄCA
> 210 nm
ZAKRES BLISKIEGO
NADFIOLETU
200 – 400 nm
n * - pojedyncze C-N:, C-S, C-Br, C-I
n * - izolowane C=X:, N=N:, N=O
* - izolowane N=O, sprzężone C=C-C=X (X = O,
N), C=C-CC
Grupa funkcyjna
max
, nm
Bromki, jodki
alkilu
205, 250
Aminy I-rz.
190; 220
Tiole
210
Kwasy
karboksylowe
210
Estry
205
Amidy I-rz.
210
Aldehydy
190, 290
Ketony
180, 280
nitrozwiązki
201, 274
Azotany
271
Azo-związki
340
Absorpcja
końcowa
180 -
210 nm
Grupa funkcyjna
max
, nm
Dieny, Diyny
> 210
Enony
> 210,
>310
Areny
> 210,
>250
daleki
nadfiol
et
bliski
nadfiol
et
150 200 250
nm

Widzimy kolor uzupełniający do koloru
absorbowanego
Oko ludzkie
zmienia
fotony światła na
impulsy nerwowe
transformowane do
mózgu
Związki zawierające serię skoniugowanych grup
chromoforowych są dla oka ludzkiego barwne, jeżeli
absorbują światło o długości fali
> 400 nm
.
Komórki fotoreceptorowe w
siatkówce oka :
czopki
(ok. 3 mln) – rozróżnianie
barwy
pręciki
(ok. 1 mld) –widzenie
czarno–białe
(dolny próg detekcji - ok. 100
fotonów światła)
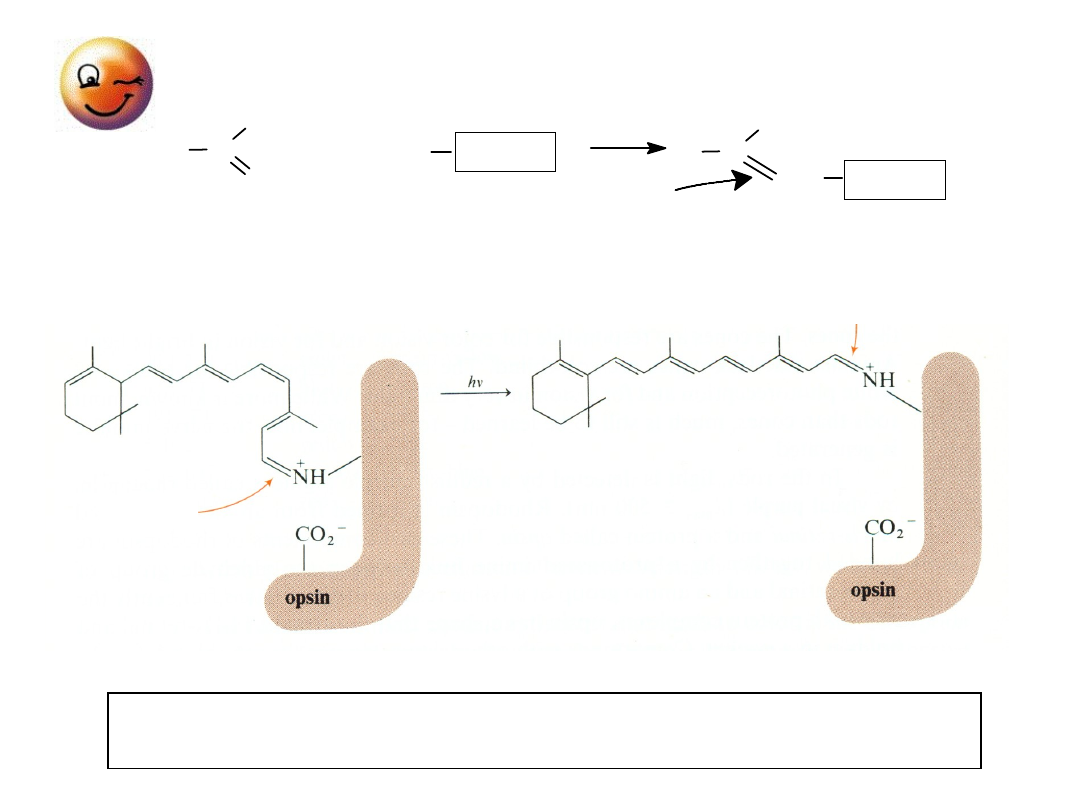
odsłonięte –
hydroliza
chronio
ne
MECHANIZM WIDZENIA
(pręciki)
C
O
H
+ H
2
N
..
opsyna
H
2
O
C
NH
H
opsyna
+
wiązanie iminowe
- protonowane
RODOPSYNA
czerwono-purpurowy
pigment
(
max
500 nm)
(zasada
Shiffa)
11-
cis
11-
trans
RETINAL
Hydroliza zmienia jonową przepuszczalność komórek
fotoreceptorowych (impuls elektryczny)
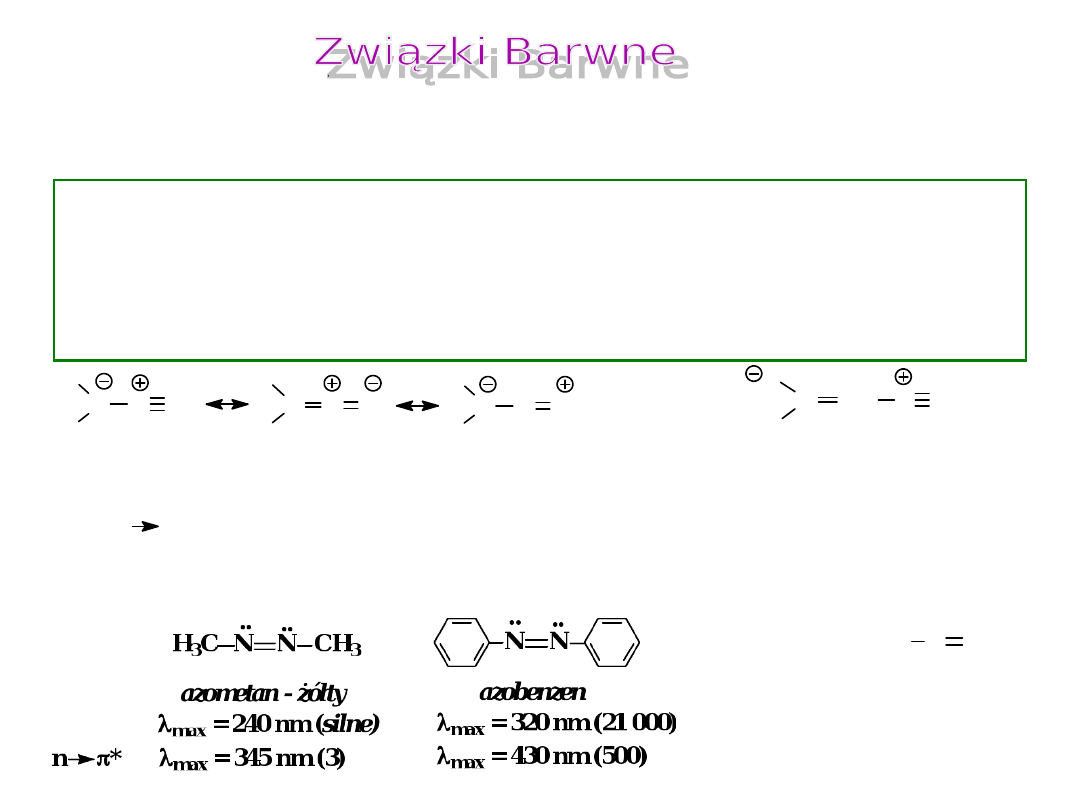
Związek barwny zawiera
nie mniej niż cztery
, a
zazwyczaj pięć lub więcej skoniugowanych grup
chromoforowych
Jedynymi wyjątkami są
:
związki
diazowe
: ( -N
2
) i
azowe
: (-N=N-)
nitrozowe
: (-N=O)
glioksal, -diketony, jodoform (CHI
3
)
C N N:
C N N:
..
C N N:
..
CH
2
N
2
- diazometan
- gaz barwy żółtej
n *
max
= 410 nm (3)
C
C
2
H
5
O
O
CH N N:
N
2
CHCOOC
2
H
5
- diazooctan etylu
max
= 249 nm (10 050)
max
= 378 nm (16)
CH
3
CH
2
CH
2
CH
2
N O:
.. ..
nitrozobutan- nieb.
max =
300 nm (100)
max
= 665 nm (20)
OH
-
H
+
ok.
525
nm
ok.
450
nm
OH
-
H
+
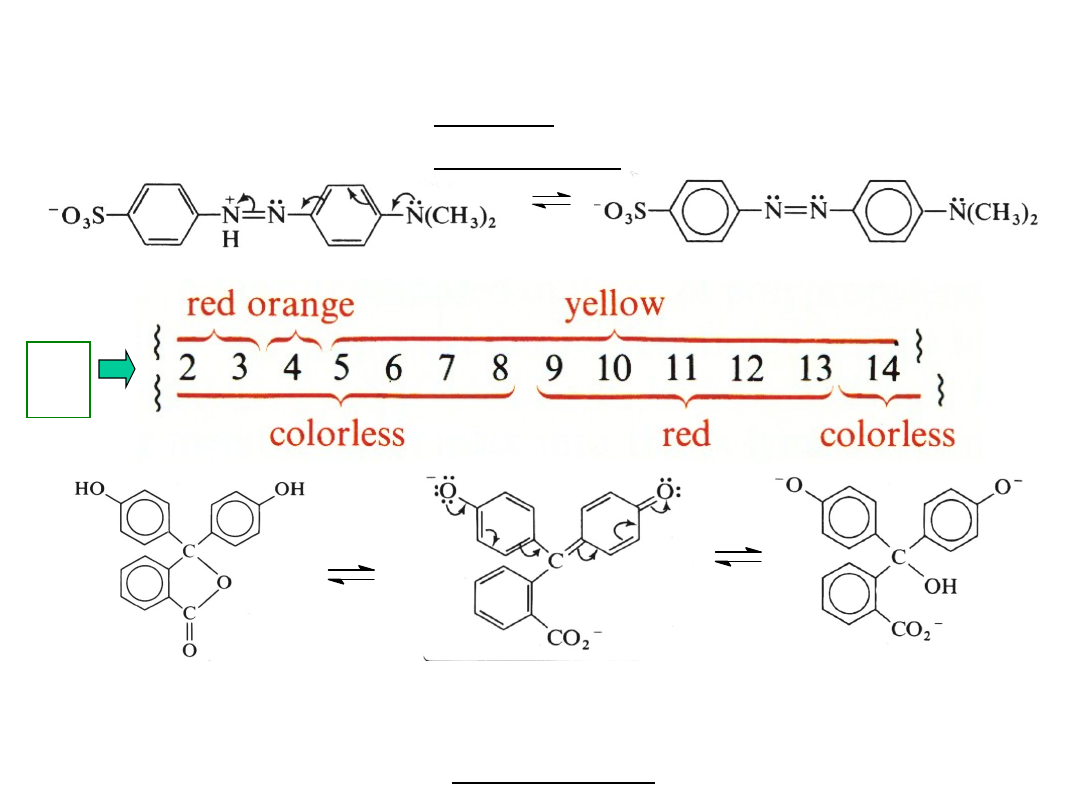
INDYKATORY KWASOWO-
ZASADOWE
Oranż
metylowy
Fenoloftal
eina
E
2
-
max
= 228 nm
(28 600)
B -
max
= 275 nm
(4 700)
max
=
587 nm
(32 500)
E
2,
B
p
H
OH
-
H
+
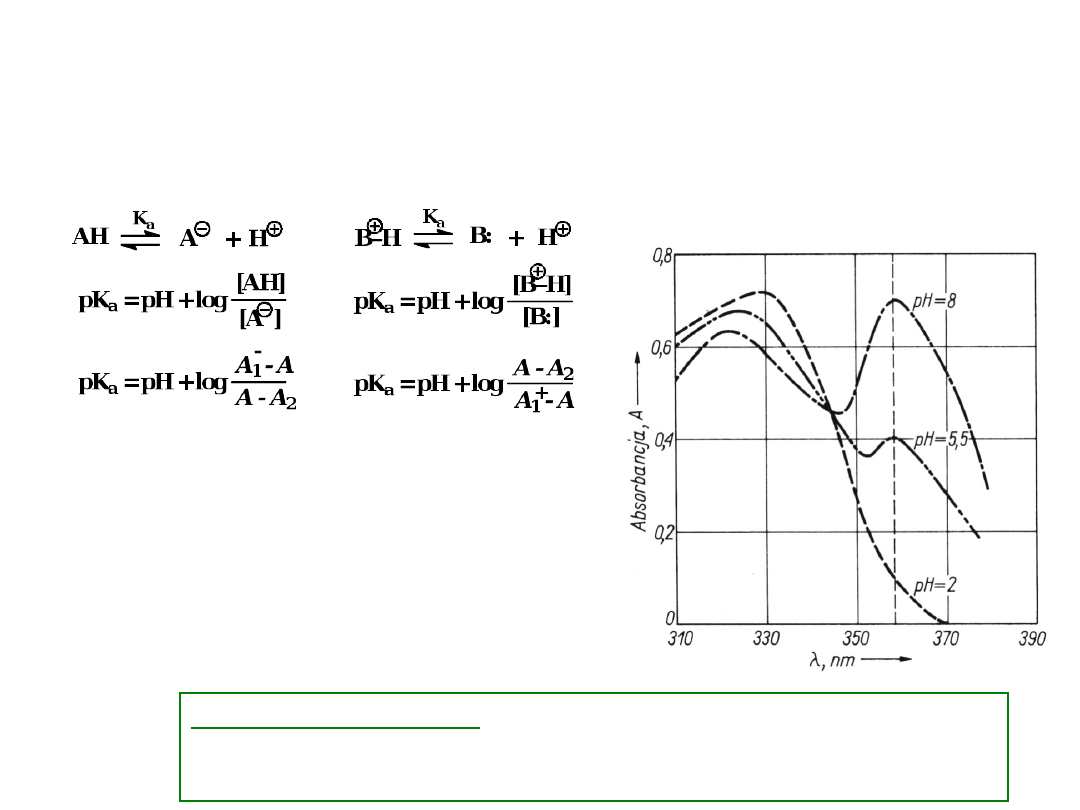
WYZNACZANIE STAŁYCH
pK
a
Widmo formy niezjonizownej (kwasu lub zasady) musi
różnić się od widma formy zjonizowanej
A
1
- absorbancja formy
całkowicie
zjonizowanej
A
2
– absorbancja formy
niezjonizowanej
A = (A
1
+ A
2
) – absorbancja
obserwowana
przy danym pH
Punkt izobestyczny
– punkt równowagowy, w którym
przecinają się krzywe absorpcji o różnym pH
roztworu
punkt
izobesty
czny
analitycz
na
długość
fali
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
materiały spektroskopia UV VIS
Spektrofotometria UV VIS Zastosowanie spektrofotometrii w Biochemii
Spektrofotometria UV
spektrometria UV VIS spektrofluorymetria
Spektroskopia wykład1a konspekt
Spektrofotometria UV, Biol UMCS, I semestr, Chemia nieorganiczna
Spektrofotometria UV-VIS 4
Wykresy zależności dla spektrofotometrii UV VIS
Spektrofotometria UV-VIS, Ochrona Środowiska, Sprawozdania z Chemii Analitycznej Środowiska
Spektroskopia UV-VIS kompleksów metali przejściowych-ćwiczenia, matury z chemii
Spektrofotometria UV VIS
spektroskopia uv vis, spektroskopia ir
materiały spektroskopia UV VIS
Spektroskopia UV
spektrometria UV VIS spektrofluorymetria
Spektroskopia UV 2
Instrukcja spektroskopia UV VIS
więcej podobnych podstron