
20. Model atomu wodoru według Bohra.
Wybór i opracowanie zadań – Jadwiga Mechlińska-Drewko.
Więcej zadań na ten temat znajdziesz w II części skryptu.
20.1.
Opierając się na teorii Bohra znaleźć:
a/
promień n-tej orbity elektronu w atomie wodoru,
b/
prędkość elektronu na tej orbicie,
c/
jego
całkowitą energię na n-tej orbicie.
20.2.
Wyznaczyć długość fali promieniowania emitowanego przez atom wodoru przy przejściu
elektronu z orbity n na orbitę k.
20.3.
Przejście elektronu z n-tej orbity na orbitę k=1 zachodzi z emisją fotonu o długości λ=1,026
10
-7
m. Znaleźć promień n-tej orbity.
20.4.
Znaleźć dla dwóch pierwszych orbit atomu wodoru wartość siły przyciągania
kulombowskiego między elektronem i jądrem oraz natężenie pola elektrycznego
wytworzonego przez jądro w odległości równej promieniowi pierwszej i drugiej orbity.
20.5.
Ile razy zwiększy się promień orbity elektronu w atomie wodoru będącego w stanie
podstawowym (n=1) przy wzbudzeniu go kwantem o energii E
ν
=12,09 eV ?
20.6.
W atomie wodoru elektron przeskakuje z drugiej orbity na pierwszą. Wyznaczyć zmianę
wartości pędu elektronu oraz zmianę jego energii kinetycznej przy tym przeskoku.
20.7.
Seria linii wodorowych z zakresu światła widzialnego (tzw. seria Balmera) powstaje przy
przejściu elektronu z wyższych orbit na drugą. Znaleźć granice serii Balmera.
20.8.
Wykazać, że częstotliwość fali świetlnej emitowanej przez atom wodoru przy przejściu
elektronu z n+1 na n-tą orbitę dąży, przy dużych n, do częstotliwości obiegu elektronu na
n-tej orbicie.
20.9.
Obliczyć minimalne liniowe rozmiary pozytonium oraz jego energię jonizacji. Pozytonium
jest układem złożonym z pozytonu i elektronu krążących wokół wspólnego środka masy.
20.10.
Obliczyć wartość orbitalnego momentu magnetycznego elektronu w atomie wodoru w stanie
podstawowym.

Rozwiązania:
20.1.R.
Korzystając z równań:
2
2
0
2
4
1
2
n
n
n
n
n
r
e
r
mV
i
h
n
r
V
m
πε
π
=
=
,
gdzie:
m- masa elektronu,
r
n
- promień n-tej orbity,
V
n
- prędkość elektronu na n-tej orbicie,
h- stała Plancka,
e- ładunek elektronu,
ε
0
- przenikalność elektryczna próżni,
wyznaczamy:
n
h
e
V
i
n
e
m
h
r
n
n
1
2
0
2
2
2
2
0
ε
π
ε
=
=
.
Całkowita energia elektronu jest sumą energii kinetycznej
2
2
n
kn
mV
E
=
i energii potencjalnej oddziaływania elektronu z jądrem
n
pn
r
e
E
2
0
4
1
πε
−
=
czyli
.
10
09
,
1
8
,
1
8
1
7
3
2
0
4
2
2
2
2
0
4
−
⋅
=
=
−
=
−
=
+
=
m
c
h
me
R
gdzie
n
Rhc
n
h
me
E
E
E
pn
kn
n
πε
πε
R - stała Rydberga.
20.2.R.
2
2
k
Rhc
n
Rhc
E
E
c
h
h
k
n
+
−
=
−
=
=
λ
υ
.
−
=
+
−
=
2
2
2
2
1
1
1
1
1
n
k
R
k
n
R
λ
.
20.3.R.
Z poprzednich zadań mamy zależności:
(1)
−
=
2
2
1
1
1
n
k
R
λ
(2)
2
2
2
0
n
e
m
h
r
n
π
ε
=
.
Po wstawieniu n
2
wyznaczonego z równania (1) do równania (2) mamy:
.
10
75
,
4
)
(
10
2
2
2
2
0
m
k
R
e
m
k
R
h
r
n
−
⋅
=
−
=
λ
π
λ
ε
.
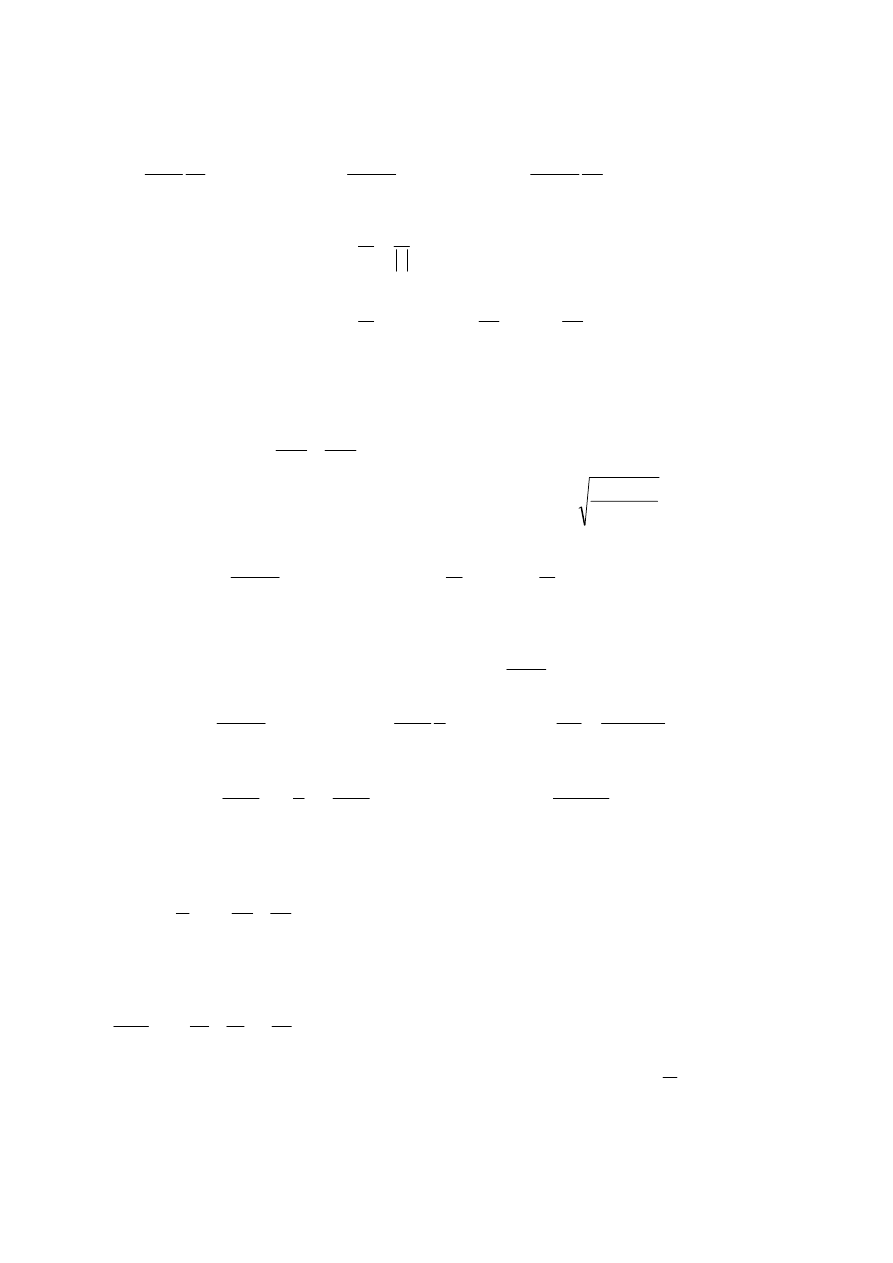
20.4.R.
Ponieważ
2
2
0
4
1
n
n
r
e
F
πε
=
oraz
2
2
2
0
n
e
m
h
r
n
π
ε
=
to
4
3
0
4
6
2
1
4
n
h
e
m
F
n
ε
π
=
.
Natężenie pola elektrycznego
e
F
q
F
E
=
=
.
Wynik obliczeń:
4
1
2
4
1
2
11
1
8
1
2
,
2
10
13
,
5
,
10
22
,
8
E
E
F
F
oraz
m
V
E
N
F
=
=
⋅
=
⋅
=
−
.
20.5.R.
W wodorze, przy przejściu elektronu z orbity n-tej na pierwszą orbitę następuje emisja
kwantu o energii:
2
2
1
1
Rhc
n
Rhc
E
E
h
E
n
+
−
=
−
=
=
υ
υ
.
Znając wartość energii kwantu można wyznaczyć wartość n :
3
=
−
=
υ
E
Rhc
Rhc
n
.
Elektron w procesie opisanym w zadaniu został wzbudzony na poziom trzeci.
Ponieważ :
2
2
2
0
n
e
m
h
r
n
π
ε
=
i
r
to
2
1
n
r
n
=
9
3
2
1
3
2
1
=
=
=
r
r
i
n
r
r
n
.
20.6.R.
Z postulatu Bohra wynika:
n
n
n
n
r
nh
p
i
h
n
r
V
m
π
π
2
=
=
2
.
Ponieważ
2
2
2
0
n
e
m
h
r
n
π
ε
=
to
2
2
2
0
4
2
0
2
8
2
1
2
n
h
me
m
p
E
oraz
n
h
me
p
n
kn
n
ε
ε
=
=
=
.
Z powyższych zależności wynika, że:
2
2
0
4
2
1
0
2
0
2
2
1
32
3
4
2
1
1
2
h
me
E
E
E
oraz
h
me
h
me
p
p
p
ε
ε
ε
=
−
=
∆
=
−
=
−
=
∆
.
20.7.R.
Przy przejściu elektronu z n-tej orbity na
k-tą następuje emisja światła o długości spełniającej
równanie
−
=
2
2
1
1
1
n
k
R
λ
. Dla serii Balmera
k=2.
Przy przejściu z
n=3 na k=2 nastąpi emisja kwantu o najmniejszej energii (i największej
długości fali) w serii Balmera. Jest to długofalowa granica serii przy czym:
.
660
36
5
3
1
2
1
1
max
2
2
.
max
nm
czyli
R
R
=
=
−
=
λ
λ
Krótkofalowa granica odpowiada przejściu z
∞
=
n
na
k=2 i wynosi
nm
R
367
4
.
min
=
=
λ
.
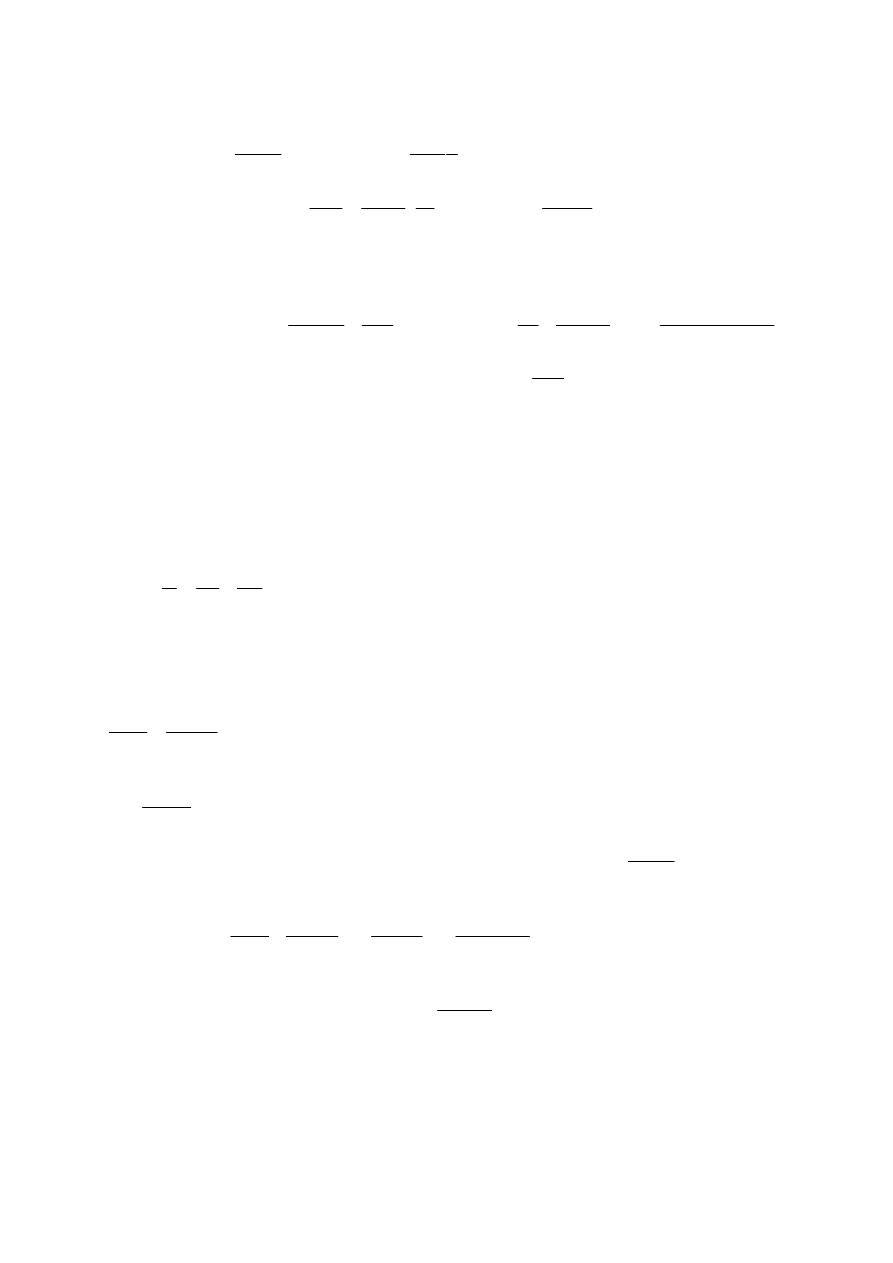
20.8.R.
Ponieważ
n
h
e
V
i
n
e
m
h
r
n
n
1
2
0
2
2
2
2
0
ε
π
ε
=
=
częstotliwość obiegu elektronu w atomie
wodoru jest równa:
3
3
2
0
4
1
4
2
n
h
me
r
V
n
n
n
⋅
=
=
ε
π
υ
.
8
3
2
0
4
c
h
me
R
ε
=
Przy przejściu elektronu z orbity
n+1 na orbitę n następuje emisja kwantu o energii:
(
)
(
)
2
2
2
2
2
2
2
2
1
1
1
2
1
1
1
)
1
(
n
n
n
n
n
Rc
n
n
Rc
czyli
n
Rhc
n
Rhc
E
E
h
E
n
n
+
−
+
+
=
+
−
=
+
+
−
=
−
=
=
+
υ
υ
υ
Dla n>>1 częstotliwość kwantu dąży do wartości
3
2
n
Rc
n
=
υ
co jest równe częstotliwości
obiegu elektronu.
20.9.R.
Pozyton jest cząstką o masie równej masie elektronu. Ładunek pozytonu jest równy co do
wartości bezwzględnej ładunkowi elektronu i wynosi 1,6
⋅10
-19
C.
Uwzględniając ruch elektronu i pozytonu wokół wspólnego środka masy wprowadzamy masę
zredukowaną
µ układu elektron-pozyton:
p
e
m
m
1
1
1
+
=
µ
gdzie
m
e
i
m
p
odpowiednio masy elektronu i pozytonu.
Korzystając z układu równań:
h
n
r
V
n
n
=
µ
π
2
i
2
0
2
2
4
n
n
n
r
e
r
V
πε
µ
=
,
przyjmując, że
m
e
=m
p
=m wyznaczamy
2
2
2
0
2
n
e
m
h
r
n
π
ε
=
.
Minimalne rozmiary pozytonium określa promień pierwszej orbity:
2
2
0
1
2
e
m
h
r
π
ε
=
.
Energia wiązania pozytonium wynosi:
2
2
2
0
4
0
2
0
2
2
16
8
4
2
n
h
me
r
e
r
e
V
E
E
E
n
n
n
p
k
w
ε
πε
πε
µ
−
=
−
=
−
=
+
=
Energia jonizacji z poziomu pierwszego
eV
h
me
E
j
8
,
6
16
2
2
0
4
=
=
ε
.

20.10.R.
Moment magnetyczny obwodu z prądem
IS
=
µ
I natężenie prądu jaki daje ruch elektronu po orbicie kołowej,
S powierzchnia obejmowaną przez ten obwód z prądem.
n
T
e
I
=
T
n
–okres obiegu elektronu na
n-tej orbicie
2
2
n
n
n
n
r
S
V
r
T
π
π
=
=
n
n
m
eh
r
eV
r
r
eV
B
n
n
n
n
n
n
n
n
µ
π
µ
µ
π
π
µ
=
=
=
=
4
2
2
2
µ
B
=0,93
⋅10
-23
J/T -magneton Bohra.
Wyszukiwarka
Podobne podstrony:
model atomu wedlug Bohra2, Akademia Morska Szczecin, SEMESTR II, Fizyka, sciaga fiza
F-2 Model atomu wodoru według Bohra
33 Model atomu Bohra
MK02 Model atomu Bohra
Model atomu Bohra
33 Model atomu Bohra (10)
model atomu bohra na fizyke
MODEL ATOMU BOHRA, Liceum, testy
Model atomu Bohra, Nauka
33 model atomu Bohra
wektorowy model atomu bohra ORVFAHZM2YPG65Y77GLPVUHBQLQ6EKWCYESD4BY
33 Model atomu Bohra
9Efekt Comptona i model budowy atomu wg bohra
efekt fotoelektryczny, model atomu Bohra
Model atomu Bohra
Model atomu Bohra energia?lkowitA
33 Model atomu Bohra
MK02 Model atomu Bohra
więcej podobnych podstron