W tym temacie
rak żołądka
,
chirurgia onkologiczna
,
HER
,
kinaza tyrozynowa
,
wskaźnik Maruyamy
Chirurgia raka żołądka zorientowana
molekularnie - Prof. dr hab. n. med.
Wojciech P. Polkowski
Opublikowane: 2009-11-10 w lekarzonkolog.pl
Słowa kluczowe:
rak żołądka
chirurgia onkologiczna
HER
kinaza tyrozynowa
wskaźnik Maruyamy
Dziedzina :
chirurgia
onkologia
rak żołądka
,
chirurgia onkologiczna
,
HER
,
kinaza tyrozynowa
,
wskaźnik Maruyamy
Pomimo spadku zachorowalności na raka żołądka na świecie,
Polska pozostaje wciąż krajem o wysokiej zapadalności.
Ostatnio w Polsce wykrywanych jest ponad 5000 nowych
zachorowań na ten nowotwór rocznie. W odróżnieniu od krajów
Dalekiego Wschodu, gdzie dominuje wczesne wykrycie dzięki
upowszechnieniu badania endoskopowego, a odsetek przeżyć 5-letnich wynosi 52%, w Europie odsetek
przeżyć 5-letnich pozostaje na niższym poziomie i wynosi 24% [1].
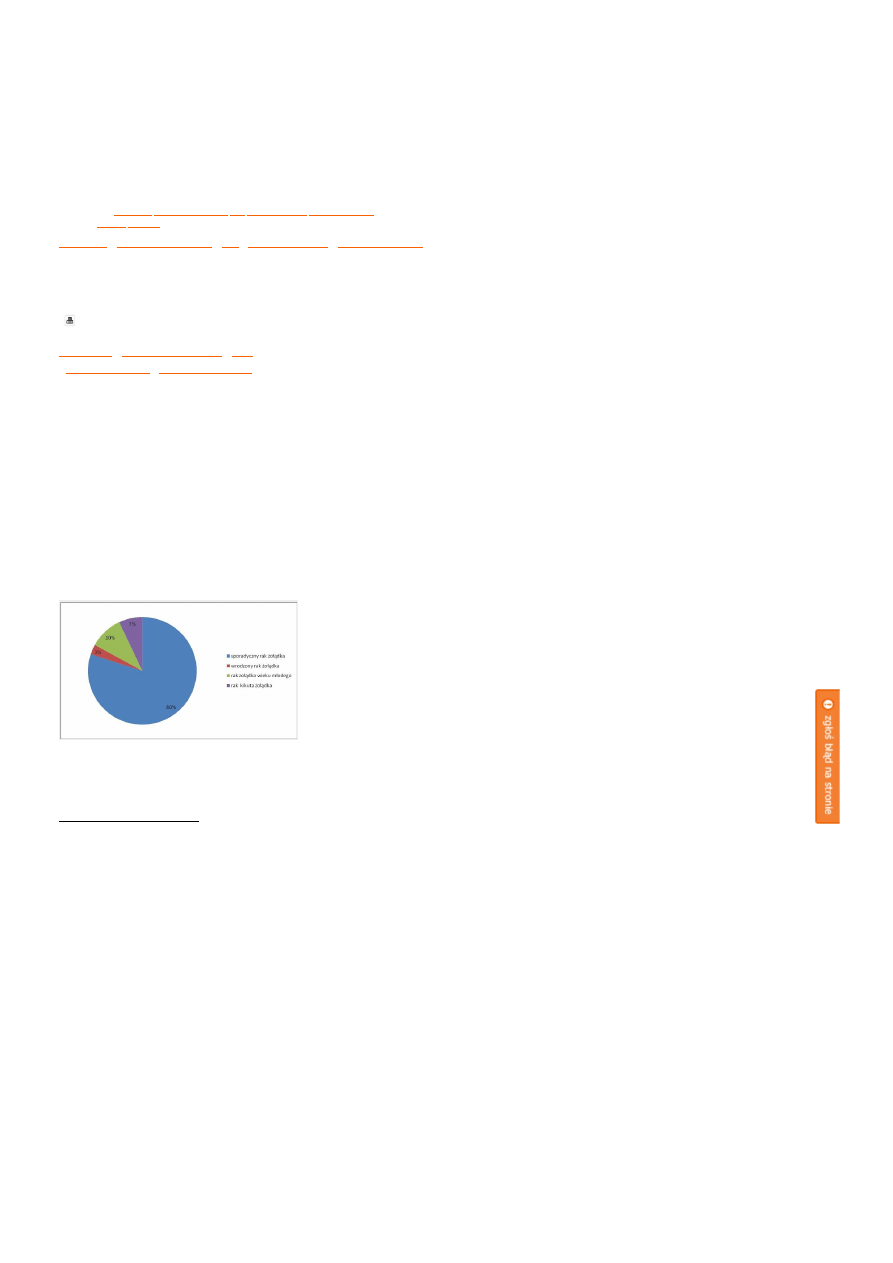
Z punktu widzenia patogenetycznego raka żołądka podzielić można na: sporadycznego, wrodzonego, wieku
młodego i kikuta żołądka, których częstość występowania przedstawiono na Rycinie 1. Pomimo pewnych
różnic patogenetycznych oraz metod leczenia chirurgicznego, ze względu na podobieństwo pod względem
wrażliwości na leczenie systemowe do tej grupy nowotworów dołączyć można także gruczolakoraka dalszego
odcinka przełyku i wpustu, tzw. raka połączenia przełykowo-żołądkowego.
Rycina 1.
Częstość występowania poszczególnych rodzajów raka żołądka.
kliknij obrazek aby powiększyć
Do rozwoju raka żołądka dochodzi w wyniku współdziałania czynników środowiskowych i nagromadzenia
specyficznych zmian genetycznych, odpowiedzialnych za rozwój wrodzonego raka żołądka. W przypadku
sporadycznego raka żołądka (>45 roku życia) czynniki środowiskowe odgrywają większą rolę, niż w
przypadku raka żołądka wieku młodego (≤45 roku życia), gdzie czynniki genetyczne odgrywają rolę kluczową,
wobec krótszego czasu ekspozycji na czynniki środowiskowe. Rak może również powstać w kikucie żołądka,
wiele lat po resekcji tego narządu najczęściej z powodu choroby wrzodowej (w latach 60-70. XX wieku), a
jego leczenie chirurgiczne jest najczęściej niemożliwe z powodu spóźnionego rozpoznania choroby w jej
nieoperacyjnym stadium.
W 1965 r. Laurén przedstawił klasyfikację raka żołądka opartą na charakterze struktury komórkowej i
sposobie naciekania. Klasyfikacja wyróżnia dwa podstawowe typy raka: 1) typ jelitowy (ponad 50%
przypadków), 2) typ rozlany (ponad 30% przypadków). Typ jelitowy cechuje morfologiczne podobieństwo do
błony śluzowej jelita. W jego strukturze przeważa budowa gruczołowa z komórkami przypominającymi
cylindryczne komórki jelitowe oraz obecność komórek kubkowych produkujących kwaśne mukopolisacharydy.
Towarzyszy mu zwykle zanikowe zapalenie błony śluzowej wraz z metaplazją jelitową. Charakteryzuje się
rozprężającym sposobem naciekania. Typ rozlany charakteryzuje się obecnością pojedynczych komórek lub
małych gniazd raka o małej kohezji, szeroko rozrasta się z daleko rozproszonymi komórkami nowotworowymi
śródściennie w żołądku, nie tworząc wyraźnych granic. Ze względu na gorsze rokowanie należy go traktować
jako nowotwór o szczególnie wysokim stopniu złośliwości. Guzy, które tworzą mieszaninę obydwu typów
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
1 z 6
2010-04-19 12:25
histologicznych, charakteryzują się naciekaniem bardziej zbliżonym do typu rozlanego niż jelitowego. Histo-
kliniczna klasyfikacja Lauréna ma duże znaczenie praktyczne dla podejmowania decyzji klinicznych, m.in. co do
zakresu resekcji żołądka. Klasyfikacja Lauréna jest przydatnym czynnikiem rokowniczym. Guzy typu jelitowego
charakteryzują się lepszym rokowaniem. Spadkowa tendencja zachorowalności na raka żołądka jest
obserwowana w świecie już od kilku dekad i dotyczy głównie raka żołądka typu jelitowego.
Receptorowe kinazy tyrozynowe z rodziny EGF
Rodzina receptorów czynnika wzrostu naskórka (EGFR; ang. epidermal growth factor receptor) obejmuje
receptory błonowe typu I o aktywności kinazy tyrozynowej, kodowane przez geny erbB (ang.
erythroblastosis). Do rodziny tej należą: EGFR (HER1, c-erbB-1), HER2 (c-erbB2), HER3 (c-erbB3) i HER4
(c-erbB4). Nadekspresja onkogenu HER2, spowodowana amplifikacją (zwielokrotnieniem kopii) onkogenu
c-erbB2 pojawia się w wielu gruczolakorakach u ludzi. Nadekspresja HER2 uważana jest za wartościowy
czynniki prognostyczny u chorych na raka piersi, raka gruczołowego przełyku i żołądka. W raku żołądka
nadekspresja HER2 jest głównie spotykana w guzach typu jelitowego. Rokowanie u chorych z guzami
HER2-pozytywnymi jest istotnie gorsze niż u chorych z guzami HER2-negatywnymi. Nadekspresja HER2
charakteryzuje szczególnie agresywne postaci raków.
W gruczolakoraku połączenia przełykowo-żołądkowego, nadekspresję HER2 stwierdzono jedynie w guzach
typu jelitowego, podczas gdy guzy rozlane nie wykazywały ekspresji HER2. Guzy typu jelitowego i rozlanego
różnią się więc nie tylko morfologicznie i biologicznie (prognostycznie), ale również onkogenetycznie.
Nadekspresja HER2 pojawia się na “późnym” etapie progresji typu jelitowego tego nowotworu [2]. Z
klinicznego punktu widzenia należy podkreślić, że nadekspresję HER2 można określić w materiale z biopsji
przedoperacyjnej.
Leczenie chirurgiczne
Podstawowym sposobem terapii raka żołądka jest leczenie chirurgiczne, wobec stwierdzanej jego
ograniczonej chemio- i radiowrażliwości. Pomimo poprawy wczesnej wykrywalności raka żołądka, odsetek
chorych, u których możliwe jest wykonanie radykalnej operacji z zamiarem wyleczenia, pozostaje wciąż
niezadowalająco niski. W przeszłości anegdotyczną pozostawała reguła „50%”: tylko połowa chorych z
rozpoznanym rakiem żołądka jest operacyjna ze względu na zły stan ogólny i wyniszczenie nowotworowe; u
25% chorych możliwe jest wykonanie resekcji (resekcyjność – 25%); a tylko u pozostałych chorych możliwe
jest wykonanie radykalnej resekcji narządu wraz z regionalnym układem chłonnym (czasem w bloku z
narządami sąsiednimi) dla uzyskania wyleczenia. Nawet w wyselekcjonowanej grupie chorych
hospitalizowanych w wyspecjalizowanym ośrodku z zamiarem dokonania operacji radykalnej, resekcyjność nie
przekraczała 75% [3].
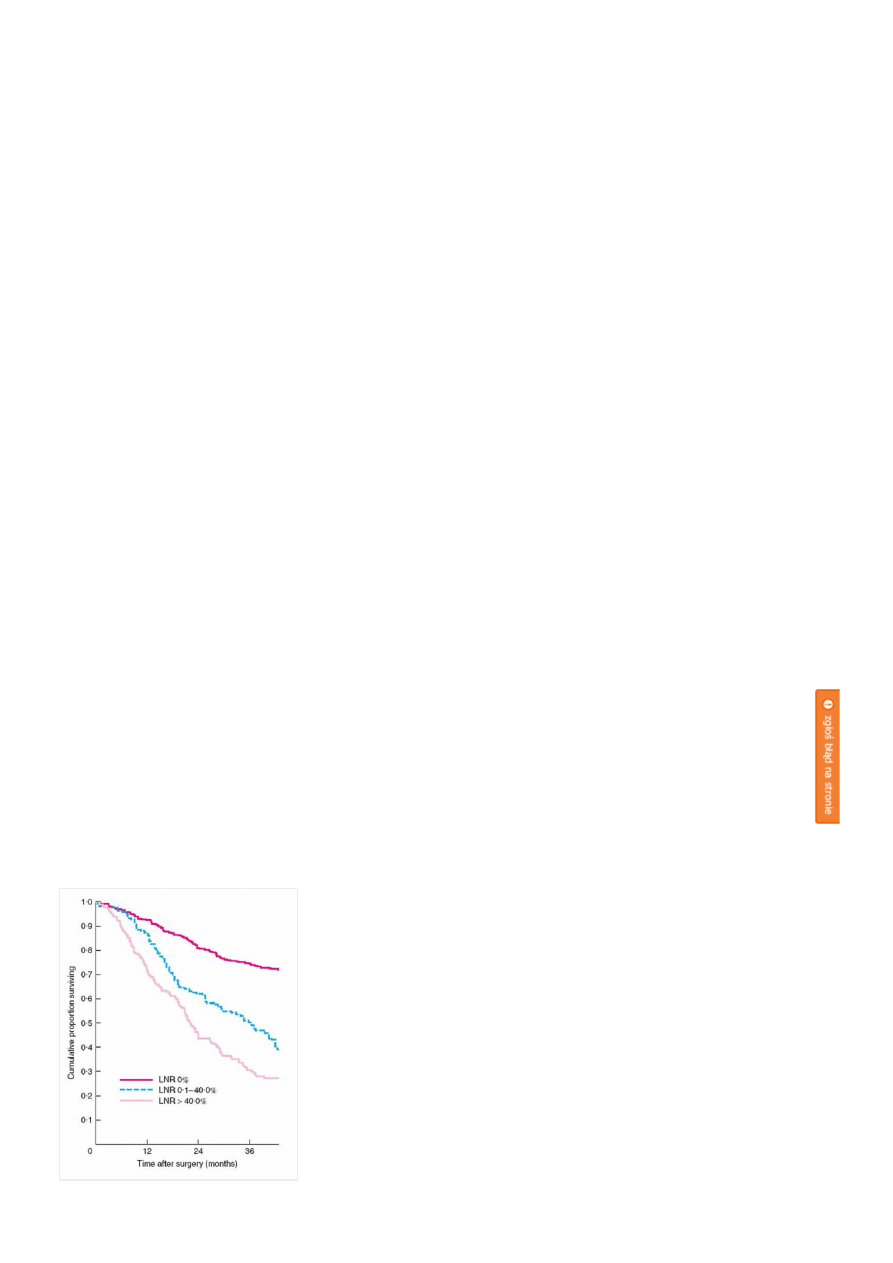
Rokowanie u chorych na raka żołądka po leczeniu chirurgicznym jest złe i w głównej mierze uzależnione od
stopnia zajęcia regionalnego układu chłonnego, co odzwierciedla tzw. wskaźnik węzłów chłonnych (LNR; ang.
lymph node ratio; stosunek liczby węzłów chłonnych z przerzutami do liczby wszystkich usuniętych i zbadanych
histo-patologicznie węzłów chłonnych; Rycina 2) [4].
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
2 z 6
2010-04-19 12:25
Rycina 2.
Znaczenie rokownicze wskaźnika węzłów chłonnych (LNR; ang. lymph node ratio).
kliknij obrazek aby powiększyć
Zakres operacji
Resekcja co najmniej 2/3 żołądka z limfadenektomią D2 jest standardem leczenia chirurgicznego
zaawansowanego raka żołądka (T1N1M0 – T3N2M0) [5].
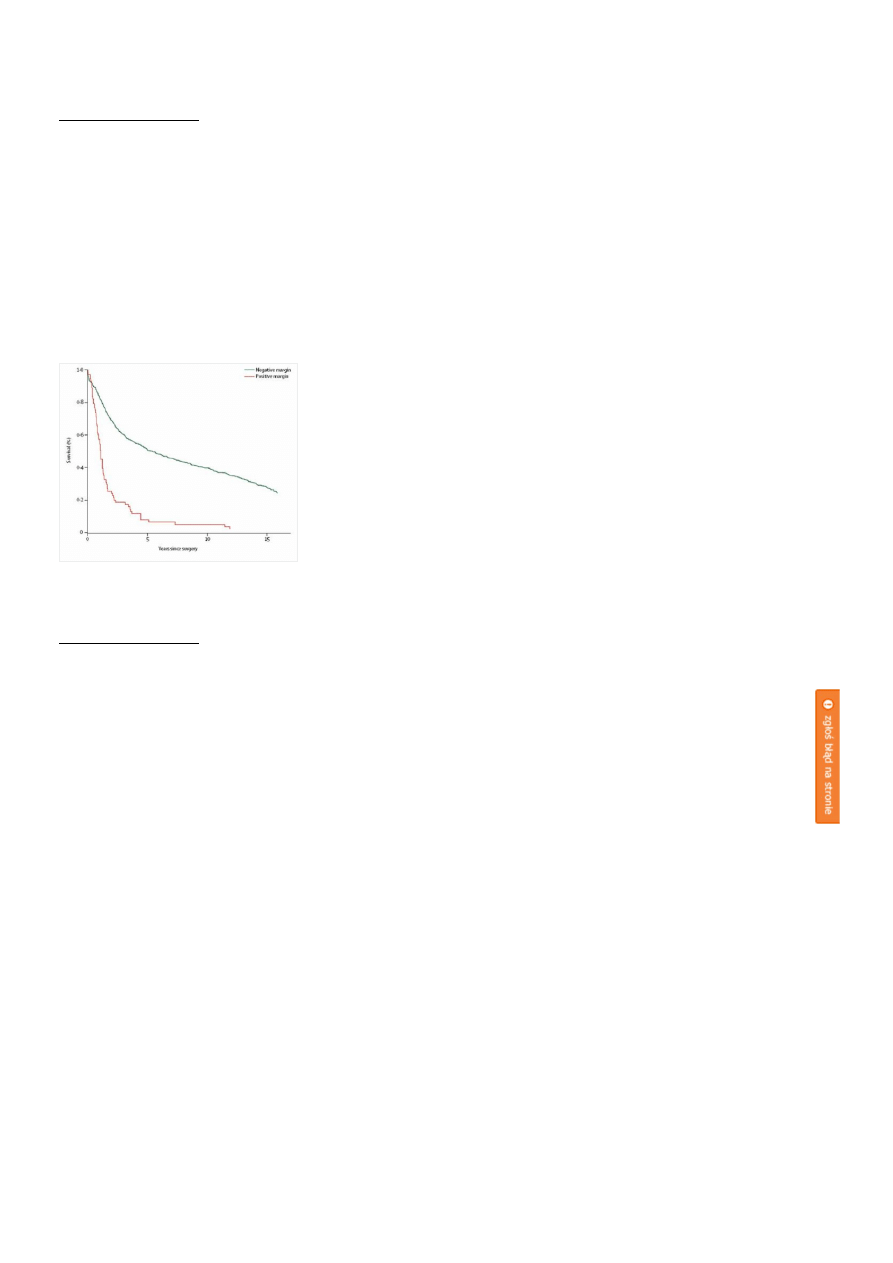
Celem dwóch badań klinicznych z losowym doborem chorych było zbadanie czy subtotalna resekcja żołądka
jest wystarczająca do leczenia raka dalszej części żołądka.[6, 7] Nie stwierdzono różnic w śmiertelności, ani
przeżyciach. Natomiast stwierdzenie utkania nowotworowego w marginesie resekcji znacznie pogarsza
rokowanie (Rycina A).[8, 9]
Rycina A.
Przeżycia u chorych z pozytywnymi i negatywnymi marginesami resekcji.
kliknij obrazek aby powiększyć
Mikroskopowo zajęty margines resekcji (R1; ang. residual disease) w istotny sposób pogarsza przeżycia
szczególnie u chorych bez przerzutów do węzłów chłonnych lub gdy nie jest ich więcej niż 5.[8] Śródoperacyjne
badanie histo-patologiczne marginesów resekcji oraz docięcie mikroskopowo zmienionego odcinka
spowodować może istotną poprawę przeżycia u chorych z ograniczonym zajęciem układu chłonnego, ale nie u
chorych z zaawansowaniem regionalnym (powyżej 5 węzłów chłonnych z przerzutami). W praktyce ocena
marginesów resekcji oznacza w czasie operacji całkowitego wycięcia żołądka, badanie pierścienia
zespoleniowego przełyku (margines bliższy) oraz dwunastnicy (margines dalszy). Rzadziej w czasie
(częściowej) resekcji żołądka, badana jest linia cięcia samego żołądka. Margines bliższy jest zwykle zagrożony
gdy nowotwór zlokalizowany jest w górnej części żołądka lub w ok. połączenia przełykowo-żołądkowego.
Natomiast margines dalszy może być zajęty gdy guz wychodzi z dalszej części żołądka. Proksymalna
lokalizacja nowotworu wiąże się zwykle z typem rozlanym raka oraz podstępnym, niewidocznym endoskopowo
ani niewyczuwalnym palpacyjnie, śródściennym sposobem naciekania. Histologiczna infiltracja przełykowego
marginesu resekcji niekorzystnie wpływa na przeżycia 5-letnie. Dlatego u chorych na gruczolakoraka
połączenia przełykowo-żołądkowego, u których planuje się radykalną operację z zamiarem wyleczenia,
proponuje się przecięcie przełyku aż 8 cm powyżej guza z dostępu piersiowo-brzusznego [10]. Stwierdzono
jednak, że w rakach połączenia przełykowo-żołądkowego (typu II wg klasyfikacji Siewerta, tj. wpustu żołądka)
o nieprawidłowo niskiej ekspresji E-kadheryny, najczęściej typu rozlanego, istnieje szczególne wysokie ryzyko
mikroskopowego naciekania przełykowego marginesu resekcji (Rycina B) [11]. Dlatego poznanie jeszcze
przed operacją zarówno typu histologicznego wg klasyfikacji Lauréna, jak i znajomość charakterystyki
molekularnej (ekspresji E-kadheryny) raka żołądka jest istotna dla osiągnięcia optymalnego marginesu resekcji
oraz indywidualizacji leczenia chirurgicznego.
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
3 z 6
2010-04-19 12:25

Rycina B.
Barwienie immunohistochemiczne na E-kadherynę raka wpustu żołądka typu rozlanego wg klasyfikacji
Lauréna.
kliknij obrazek aby powiększyć
Zakres usuwania węzłów chłonnych został określony przez wytyczne Japońskiego Stowarzyszenia Raka
Żołądka (Japanese Gastric Cancer Association; JCGC), w których zidentyfikowano 16 różnych stacji węzłów
chłonnych otaczających żołądek.[5] Węzły chłonne okołożołądkowe wzdłuż krzywizny mniejszej (stacje 1, 3 i 5)
i większej (stacje 2, 4 i 6) zgrupowano w kategorię N1. Natomiast węzły wzdłuż tętnicy żołądkowej lewej
(stacja 7), wątrobowej wspólnej (stacja 8), pnia trzewnego (stacja 9) i tętnicy śledzionowej (stacje 10 i 11)
zgrupowano w kategorię N2. Do stacji 12 należą węzły chłonne więzadła wątrobowo-dwuanstniczego, 13 – do
tyłu od głowy trzustki, 14 – u nasady krezki, 15 – w krezce okrężnicy poprzecznej, 16 – para-aortalne.
Resekcja dotkniętej chorobą części lub całości żołądka oraz sieci większej i mniejszej z zakresem
limfadenektomii D1 oznacza usunięcie węzłów chłonnych N1. Resekcja żołądka lub gastrektomia z zakresem
limfadenektomii D2 oznacza, że są również usuwane węzły chłonne N2. Jeżeli usuwane są węzły chłonne ze
stacji 12-15 oznacza to zakres limfadenektomii D3, a gdy dodatkowo ze stacji 16 – D4.
Wycięcie całego żołądka z guzem nowotworowym, wraz z regionalnym układem chłonnym (czasem w bloku z
narządami sąsiednimi), teoretycznie zwiększa szanse na wyleczenie. Wykonanie takiej operacji może być
jednak nieuzasadnione, gdy mamy do czynienia albo z chorobą we wczesnej fazie bez zajęcia węzłów
chłonnych, albo gdy przeciwnie nowotwór jest już rozsiany (przerzuty odległe), albo gdy wykonanie takiej
operacji wiąże się z dużym ryzykiem powikłań i śmiertelności pooperacyjnej ze względu na wiek i/lub choroby
współistniejące. Wyniki dotychczas opublikowanych badań klinicznych z losowym doborem chorych oraz
meta-analizy dotyczące porównania resekcji D1 oraz D2, wykazały znaczne zwiększenie śmiertelności
pooperacyjnej w wyniku resekcji D2, bez istotnego wpływu na wyniki odległe – przeżycia.[12-16, 17] Jeżeli
jednak resekcję D2 (a nawet D3) można wykonać bez zwiększania powikłań i śmiertelności pooperacyjnej, tj.
przez doświadczonego i dobrze wyszkolonego chirurga w wyspecjalizowanym ośrodku, to w sposób istotny
korzystnie odbija się to na wynikach odległyc16]. Dalsze jednak zwiększanie radykalności limfadenektomii o
grupę para-aortalnych węzłów chłonnych (D4) nie poprawia przeżyć[18]. Wycięcie (częściowe) trzustki lub
śledziony w czasie gastrektomii usprawiedliwione jest tylko w przypadku bezpośredniego naciekania guza tych
narządów, gdyż takie rozszerzenie zabiegu znacznie podwyższa odsetek powikłań, bez istotnej poprawy
przeżyć[19-24]. U chorych o zaawansowaniu T3/T4 konieczna jest staranna analiza przedoperacyjnych badań
obrazowych dla zminimalizowania niepotrzebnego poszerzania gastrektomii o narządy sąsiednie [25]. Chociaż
resekcja poszerzona o narządy sąsiednie może być wykonana u chorych z klinicznie oszacowanym rakiem T4
z niskim odsetkiem powikłań i zgonów pooperacyjnych, to jednak należy sobie zdać sprawę, że większość z
nich będzie miało de facto chorobę mniej zaawansowaną - pT3.
Wskaźnik Maruyamy „nie usuniętej choroby” (ang. Maruyama index of unresected disease)
W późnych latach 80. Keiichi Maruyama wraz ze współpracownikami z National Cancer Center Hospital w
Tokio stworzył program komputerowy, który wykorzystywał bazę danych wyników badań histo-patologicznych
od 3843 chorych na raka żołądka po resekcji z limfadenektomią co najmniej D2, w każdej ze zdefiniowanych
wcześniej 16 stacji węzłów chłonnych.[26] Program ma na celu oszacowanie prawdopodobieństwa
wystąpienia przerzutów w każdej z nie usuniętych przez chirurga stacji regionalnych węzłów chłonnych oraz
prognozowanie przeżycia. Siedem wejściowych zmiennych (wiek i płeć chorego, typ wg Borrmann, rozmiar,
lokalizacja, pozycja i histologia nowotworu) można określić przed lub w czasie operacji. Wskaźnik Maruyamy
jest procentową sumą prawdopodobieństwa przerzutów do regionalnych węzłów chłonnych w każdej ze stacji
(1-12), które nie zostały usunięte przez chirurga. Umożliwia on racjonalnie planowanie zakresu limfadenektomii
dla danego chorego. Wskaźnik Maruyamy <5 wiąże się z istotnym wydłużeniem przeżycia oraz mniejszym
ryzykiem nawrotu choroby w porównaniu do chorych, u których wskaźnik ten wyniósł ≥5 (Rycina C).[27]
Wskaźnik ten okazał się niezależnym czynnikiem rokowniczym u chorych na raka żołądka leczonych
chirurgicznie, nawet w skojarzeniu z radio-chemioterapią, która w tej analizie mogła być czynnikiem
maskującym efekt jakości leczenia chirurgicznego.[28]
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
4 z 6
2010-04-19 12:25
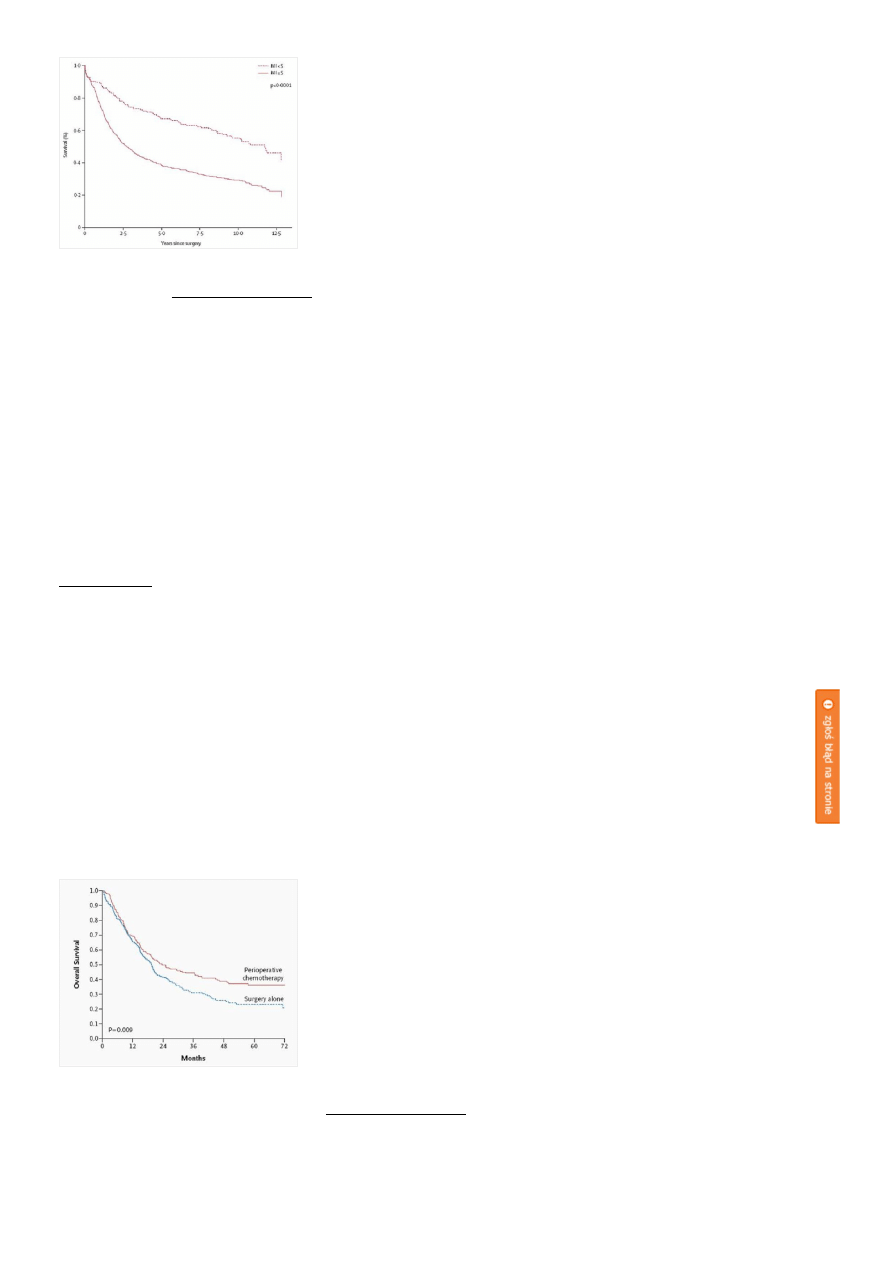
Rycina C. Przeżycia w oparciu o analizę wskaźnika Maruyamy u chorych w holenderskim badaniu klinicznym
porównującym D1 z D2. kliknij obrazek aby powiększyć
Przerzuty odległe u chorych na raka żołądka występują z częstością niezależną od wskaźnika Maruyamy.
Jednak wznowy regionalne, którym mogą towarzyszyć przerzuty odległe, pojawiają się zdecydowanie częściej
u chorych ze wskaźnikiem Maruyamy ≥5 [29]. Tak więc uzyskanie niskiego wskaźnika Maruyamy gwarantuje
zwiększenie miejscowo-regionalnej kontroli nad chorobą oraz poprawę przeżycia. Ponadto wskaźnik ten,
podobnie jak liczba usuniętych węzłów chłonnych, jest wyznacznikiem jakości leczenia chirurgicznego raka
żołądka [30]. Obydwa wskaźniki powinny być wykorzystywane do identyfikacji chorych z wysokim ryzykiem
nawrotu choroby, u których leczenie uzupełniające (adiuwantowa chemio-/radioterapia) może być korzystne.
Izolowana wznowa miejscowo-regionalna dotyczy ok. ¼ chorych po operacji doszczętnego wycięcia raka
żołądka [31]. Złe wyniki leczenia, po części można tłumaczyć uchybieniami w standaryzacji leczenia
chirurgicznego raka żołądka, co skutkuje suboptymalnym leczeniem operacyjnym wielu chorych [27]. W tej
grupie chorych łatwiej jest wykazać korzystny wpływ uzupełniającej chemio-radioterapii [28, 32].
Rozwiązaniem może być skoncentrowanie uwagi chirurgów na osiąganiu w każdym przypadku radykalnej
operacji raka żołądka niskiego (< 5) wskaźnika Maruyamy, który ilościowo określa czy zakres limfadenektomii
jest dostateczny, a można go obliczyć przed lub w czasie operacji za pomocą łatwo dostępnego
oprogramowania komputerowego [33].
Leczenie skojarzone
Po analizie wyników 4 dużych, kontrolowanych badań klinicznych z losowym doborem, obejmujących łącznie
1775 chorych, okazało się, że chemioterapia oparta na pochodnych fluoropirymidyny i platyny daje podobne
wyniki pod względem przeżycia (9.5 - 8.7 mies.), wskaźnika odpowiedzi (44 - 36%) i toksyczności (46%) w
gruczolakorakach górnego odcinka przewodu pokarmowego, niezależnie od lokalizacji w przełyku, połączeniu
przełykowo-żołądkowym lub żołądku [34]. XXI wiek przyniósł pewne zmiany w taktyce leczenia skojarzonego
gruczolakoraka żołądka i połączenia przełykowo-żołądkowego (Rycina 3) [35]. Po ogłoszeniu wyników badania
MAGIC stało się jasne, że możliwe jest podwyższenie odsetka przeżyć 5-letnich o 13%, co odpowiada 25%
zmniejszeniu ryzyka zgonu, poprzez zastosowanie 3 cykli chemioterapii ECF zarówno przed, jak i po operacji.
Kolejnym efektem tego badania było stwierdzenie zmniejszenia guza (mediana = 3 cm) oraz obniżenia stopnia
zaawansowania (więcej guzów T1/2; mniej N2) pod wpływem przedoperacyjnej chemioterapii. Nie przełożyło
się to na zwiększenia odsetka operacji (mikroskopowo) radykalnych, ale z drugiej strony przedoperacyjna
chemioterapia nie spowodowała też istotnego zwiększenia powikłań, śmiertelności pooperacyjnej, ani nie
wydłużyła czasu pooperacyjnej hospitalizacji. Resekcja wydawała się dla operującego chirurga radykalna
(wykonana z zamiarem wyleczenia) o 9% częściej u chorych po przedoperacyjnej chemioterapii.
Rycina 3. Przeżycia u chorych w badaniu MAGIC, leczonych przed- i pooperacyjną chemioterapią ECF w
porównaniu do chorych leczonych wyłącznie chirurgicznie. kliknij obrazek aby powiększyć
Włączenie nowych leków (docetaxel) przyczyniło się do zwiększenia skuteczności dotychczas stosowanych
schematów chemioterapii chorych na zaawansowanego raka żołądka, zwiększając odsetek odpowiedzi do
37% [36]. Stało się realne zastosowanie chemioterapii indukcyjnej do przypadków pierwotnie nieresekcyjnych,
z zamiarem wykonania kolejnej operacji (tzw. second-look) po uzyskaniu odpowiedzi umożliwiającej wykonanie
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
5 z 6
2010-04-19 12:25

W tym temacie
rak żołądka
,
chirurgia onkologiczna
,
HER
,
kinaza
tyrozynowa
,
wskaźnik Maruyamy
radykalnej resekcji [37]. Ostatni postęp to zastosowanie epirubicyny i oxaliplatyny z kapecytabiną (schemat
EOX) u chorych na przerzutowego i miejscowo zaawansowanego raka żołądka i przełyku, co pozwoliło na
dalsze zwiększenie odpowiedzi do 48% [38]. Jeżeli współczesna chemioterapia umożliwia uzyskanie
obiektywnej odpowiedzi (całkowita lub częściowa regresja guza i/lub zmian węzłowych) u co drugiego chorego
na zaawansowanego raka żołądka i połączenia przełykowo-żołądkowego, to praktycznym wymogiem chwili dla
chirurgów staje się za wszelką cenę unikanie zbędnych laparotomii zwiadowczych, tylko po to, aby na własne
oczy przekonać się, że zaawansowanie choroby jest zbyt duże, aby można było wykonać radykalną operację.
Nowoczesne obrazowanie (tomografia komputerowa, ultrasonografia endoskopowa, pozytronowa tomografia
emisyjna) pozwala dzisiaj na precyzyjne określenie zaawansowania choroby oraz udokumentowanie naciekania
uniemożliwiającego pierwotnie radykalną operację. Wykonywanie operacji, a nawet resekcji bez uprzedniej
znajomości histo-patologii nowotworu oraz jego zaawansowania określane jest w chirurgii onkologicznej
mianem operacji „łapu-capu” (ang. whoop’s operation) [39]. Co więcej, rozsądny chirurg-onkolog chce przed
operacją poznać także inne cechy morfologiczne i molekularne, aby możliwie jak najwięcej wiedzieć o
narządowej biopatologii nowotworu, z którym ma do czynienia. Jest to jedna z zasad chirurgii onkologicznej
propagowana przez Profesora T. Koszarowskiego. W praktyce klinicznej raka żołądka oznacza to konieczność
poznania typu histologicznego wg klasyfikacji Lauréna dla wyboru zakresu resekcji w guzach zlokalizowanych
w dalszej części żołądka. Innym przykładem jest znajomość ekspresji E-kadheryny w rakach połączenia
przełykowo-żołądkowego dla osiągnięcia optymalnego marginesu resekcji [11]. Stwierdzenie inaktywującej
mutacji w genie E-kadeheryny (CDH1) u członka rodziny, w której występuje wrodzony (rozlany) rak żołądka,
jest warunkiem rozważania profilaktycznej gastrektomii [40]. U 77% chorych z takich rodzin, u których
wykonano profilaktyczną gastrektomię, preparat operacyjny żołądka zawierał ukryte (niedostępne badaniu
endoskopowemu) ogniska rozlanego raka [41]. Standardowa chemioterapia w raku żołądka stosowana jest
niejako „na ślepo”. Pewien przełom przyniosło ogłoszenie wyników badania ToGA w czasie kongresu American
Society of Clinical Oncology (ASCO) w 2009 r. [42]. Trastuzumab okazał się pierwszym biologicznym lekiem,
który w połączeniu z chemioterapią poprawił przeżycia w zaawansowanym HER2-pozytywnym raku żołądka.
Prawdopodobnie można ten przełom porównać do wprowadzenia imatinibu w leczeniu nieresekcyjnych (a
ostatnio również uzupełniająco po resekcji) guzów stromalnych przewodu pokarmowego (ang. gastro-intestinal
stromal tumour; GIST). Nasza wiedza o możliwościach leczenia celowanego raka żołądka będzie bogatsza po
ogłoszeniu wyników trwających jeszcze prospektywnych badań klinicznych III fazy [43]. Jakie może mieć to
znaczenie praktyczne? Podobnie jak w GIST warunkiem zastosowania nowej, bardziej skutecznej kombinacji
leków jest sprawdzenie profilu molekularnego nowotworu żołądka przed rozpoczęciem leczenia. Istotnym
wydaje się potwierdzenie nadekspresji HER2 w badaniu immunohistochemicznym (IHC) wycinków z biopsji
endoskopowej, która pozwala na rozpoznanie raka żołądka. Zabezpieczenie materiału tkankowego jest
warunkiem przeprowadzenia badania cytogenetycznego FISH w przypadku niepewnego wyniku badania IHC
(++). Leczenie raka żołądka powinno wyglądać dokładnie tak samo jak ma to miejsce przy planowaniu
leczenia (operacyjnego) raka piersi, gdzie trastuzumab znalazł już swoje miejsce w leczeniu bardziej
agresywnych postaci raka piersi. Istotną rolę odgrywa nie tylko chirurg, ale również gastroenterolog
wykonujący badanie endoskopowe, na którego spada obowiązek zabezpieczenia odpowiedniego materiału
tkankowego nie tylko do postawienia rozpoznania histo-patologicznego, ale także do badań
immunohistochemicznych lub FISH. Chirurg powinien również uzmysłowić sobie, że w przypadkach kiedy
zaawansowanie miejscowe raka żołądka nie pozwala mu na wykonanie radykalnej resekcji, najistotniejsze jest
pozyskanie materiału tkankowego do badań molekularnych. Już teraz ma to miejsce w leczeniu przerzutów
raka jelita grubego do wątroby, gdzie trzeba uzyskać tkankę przerzutów do badań ekspresji EGFR i mutacji
K-ras dla oceny możliwości zastosowania celowanego leczenia cetuximabem w nadziei zwiększenia
resekcyjności przerzutów. Być może w przyszłości leczenie indukcyjne nawet pierwotnie nieresekcyjnego raka
żołądka (typu jelitowego) będzie polegało na zastosowaniu chemioterapii w połączeniu z trastuzumabem dla
uzyskania możliwości radykalnej resekcji po zakończeniu wstępnego leczenia systemowego. Wskaźnik
resekcyjności bowiem, staje się coraz bardziej atrakcyjnym punktem końcowym oceny nowych terapii
systemowych, wypierając takie chociażby parametry jak czas do progresji. Im większy postęp dokona się w
terapii systemowej nowotworów, tym większe zainteresowanie budzić będzie możliwość radykalnej resekcji
nowotworu w nadziei na trwałe wyleczenie.
Autor: Prof. dr hab. n. med. Wojcie ch P. Polkowski Klinika Chirurgii Onkologiczne j
Uniwe rsyte tu Me dyczne go w Lublinie
Opublikowany: 2009-11-10
Szukaj takze wg haseł:
rak żołądka
,
chirurgia onkologiczna
,
HER
,
kinaza tyrozynowa
,
wskaźnik Maruyamy
Chirurgia raka żołądka zorientowana molekularnie - Prof. dr hab. n. me...
http://www.lekarzonkolog.pl/mod/archiwum/8242/drukuj/
6 z 6
2010-04-19 12:25
Wyszukiwarka
Podobne podstrony:
chirurgia 2009
chirurgia 2009
chirurgia, Giełda chirurgia 2009
pyt+chirurgia+2009, Uczelnia, giełda chirurgia, gielda, gieda
Wersja A Zerówka z chirurgii 2009, Stomatologia, III rok, chirurgia ogólna
pyt+chirurgia+2009, medycyna, giełdy, chirurgia, chir2, Giełda Chirurgia
chirurgia, pyt+chirurgia+2009
TESTcałościowy z chirurgii 2008-2009, ratownicto 2012 2013, ratownictwo medyczne, Testy
III rok, chirurgia1 termin 2009, 1
III rok, chirurgia1 termin 2009, 1
16.03.2009 chirurgia, medycyna, giełdy, chirurgia, chirurgia
Chirurgia urazowa - postępy 2009, MEDYCYNA, RATOWNICTWO MEDYCZNE, BTLS+chirurgia
TEST- końcowy z chirurgii dla ucznia 2008-2009, ratownicto 2012 2013, ratownictwo medyczne, Testy
więcej podobnych podstron