
CHEMIA
Prowadz
ą
cy
Dr Małgorzata Wojtkowska
WI
Ś
p. 406

ZAKRES MATERIAŁU
- Podstawowe prawa i poj
ę
cia chemiczne
- Modele budowy atomu. Struktura elektronowa
atomu. Poziomy energetyczne i widmo atomu
wodoru wg Bobra. Dualizm korpuskularno-
falowy.
- Budowa atomu w uj
ę
ciu kwantowym. Liczby
kwantowe. Orbitale atomowe-energia i symetria.
Konfiguracje elektronowe, zakaz Pauliego,
Reguła Hunda.

Zmiany własno
ś
ci pierwiastków w obr
ę
bie grupy i
okresu (energia jonizacji, energia powinowactwa,
promienie atomowe i jonowe,
- Elektroujemno
ść
, własno
ś
ci kwasowo-zasadowe
pierwiastków, tlenków i wodorotlenków,
- Warto
ś
ciowo
ść
, metaliczno
ść
i niemetaliczno
ść
,
amfoteryczno
ść
).
- Zwi
ą
zek budowy atomu z układem okresowym.
- Zwi
ą
zek budowy atomu z układem okresowym.
- Cz
ą
steczki i wi
ą
zania chemiczne. Reguła oktetu.
- Rodzaje wi
ą
za
ń
. Moment dipolowy wi
ą
zania i
cz
ą
steczki. Wi
ą
zania sigma i pi. Delokalizacja
wi
ą
za
ń
. Orbitale molekularne. Hybrydyzacja.
- Budowa wybranych cz
ą
steczek.
- Zwi
ą
zki kompleksowe. Budowa, nazewnictwo i
izomeria.

- Elementy kinetyki chemicznej. Energia aktywacji.
Równanie kinetyczne na szybko
ść
reakcji.
- Kataliza. Prawo działania mas – stan równowagi
chemicznej. Reguła przekory.
- Elementy termodynamiki chemicznej. Energia
wewn
ę
trzna. Entalpia. I zasada termodynamiki,
prawo Hessa. Warunki standardowe. Obliczanie
efektów cieplnych reakcji. II zasada termodynamiki.
Entropia. Entalpia swobodna. Warunki
samorzutno
ś
ci reakcji, zwi
ą
zek standardowej
samorzutno
ś
ci reakcji, zwi
ą
zek standardowej
entalpii swobodnej reakcji z warto
ś
ci
ą
jej stałej
równowagi.
- Równowaga chemiczna w roztworach elektrolitów.
Aktywno
ść
i współczynnik aktywno
ś
ci (obliczenia).
- Teorie kwasów i zasad. Iloczyn jonowy wody. Skala
pH. Obliczanie pH kwasów, zasad i soli.

- Wska
ź
niki. Reakcje jonowe. Reakcje
strachania osadów. Iloczyn rozpuszczalno
ś
ci.
Efekt solny, efekt wspólnego jonu.
- Utlenianie i redukcja. Stopi
ę
utlenienia.
Połówkowe, jonowe i cz
ą
steczkowe równania
reakcji redox. Bilansowanie reakcji redox.
Szereg napi
ę
ciowy metali i szereg
elektrochemiczny. Przewidywanie biegu
elektrochemiczny. Przewidywanie biegu
reakcji redox. Równowaga reakcji redox.
- Ogniwa galwaniczne. Rodzaje elektrod. Wzór
Nernsta.
- Procesy elektrolizy wodnych roztworów i
stopionych elektrolitów. Prawa Faradaya.

Zasady ZALICZENIA WYKŁADU
• EGZAMIN
• TRZY CZ
ĘŚ
CIOWA FORMA ZDANIA
EGZAMINU W TZW. TERMINIE
ZEROWYM:
ZEROWYM:
• Po serii 5 wykładów – sprawdzian
• Zaliczenie trzech sprawdzianów zwalnia z
EGZAMINU

Podstawowe poj
ę
cia
• Reakcje chemiczne s
ą
to przemiany w
czasie, których z jednych substancji
powstaj
ą
inne o odmiennych
wła
ś
ciwo
ś
ciach.
• Reagenty s
ą
to substraty i produkty
• Reagenty s
ą
to substraty i produkty
ł
ą
cznie.
• Substraty –substancje wzi
ę
te do reakcji
• Produkty – substancje otrzymane w
wyniku reakcji

Prawa chemiczne
• Prawo zachowania masy: Masa
substratów równa si
ę
masie produktów
reakcji
• Prawo stało
ś
ci składu: Stosunek
pierwiastków w ka
ż
dym zwi
ą
zku
chemicznym jest stały i charakterystyczny
dla danego zwi
ą
zku.

• Prawo stosunków stałych - Prusta (1799) –
ka
ż
dy zw. chemiczny ma stały skład ilo
ś
ciowy:
np. dwa atomy A i B o masie mA i mB tworz
ą
zw. AB , to stosunek mas tych pierwiastków jest
stały w tym zwi
ą
zku: mA/mB= const.
• Prawo stosunków wielokrotnych: je
ż
eli dwa
pierwiastki ł
ą
cz
ą
si
ę
ze sob
ą
tworz
ą
c dwa lub
pierwiastki ł
ą
cz
ą
si
ę
ze sob
ą
tworz
ą
c dwa lub
wi
ę
cej zw. chemicznych, to ilo
ś
ci wagowe
jednego pierwiastka przypadaj
ą
ca na stał
ą
ilo
ść
drugiego pierwiastka pozostaj
ą
do siebie w
stosunku prostych liczb całkowitych: np. tlenki
azotu.

• Prawo stosunków obj
ę
to
ś
ciowych Gay-
Lussaca (1808) – prosta zale
ż
no
ść
liczbowa
obj
ę
to
ś
ci ł
ą
cz
ą
cych si
ę
ró
ż
nych gazów – musi
istnie
ć
zwi
ą
zek mi
ę
dzy liczbami reaguj
ą
cych
cz
ą
stek a zajmowan
ą
obj
ę
to
ś
ci
ą
.
W tej samej temperaturze i pod tym samym
ci
ś
nieniem jednakowe obj
ę
to
ś
ci ró
ż
nych gazów
musz
ą
zawiera
ć
jednakow
ą
liczb
ę
cz
ą
stek – to
zauwa
ż
ył Dalton co było sprzeczne z jego teori
ą
zauwa
ż
ył Dalton co było sprzeczne z jego teori
ą
atomistyczn
ą
:
• 1V N + 1V O = 2 V NO
• zatem x V N + xV N = 2x V NO
• a wi
ę
c 1/2V N + 1/2V O = 1 V NO (nie zgodne z
teori
ą
Daltona o niepodzielno
ś
ci atomów).

•
Prawo zachowania materii
•
Reakcje chemiczne przeprowadzane w układzie zamkni
ę
tym (nie
wymieniaj
ą
cym z otoczeniem masy i energii) przebiegaj
ą
bez
zmiany ł
ą
cznej masy reaguj
ą
cych substancji.
•
Masa całkowita układu reaguj
ą
cego jest taka sama przed jak i
po reakcji
•
ΣΣΣΣ
m = const
•
Einstein wykazał równowa
ż
no
ść
masy i energii:
E = mc2
•
W reakcjach rozszczepienia czy syntezy j
ą
der atomów znaczna
•
W reakcjach rozszczepienia czy syntezy j
ą
der atomów znaczna
cz
ęść
masy przechodzi w energi
ę
promienist
ą
i słuszne jest prawo
ogólniejsze – prawo zachowania materii : suma masy i energii w
układzie zamkni
ę
tym jest stała i nie zale
ż
y od zmian zachodz
ą
cych
w układzie:
•
ΣΣΣΣ
(m +E/c2) = const
•
Mo
ż
na obliczy
ć
,
ż
e rozszczepienie 1000 g 235U wyzwala energi
ę
8.23x1013J, co po przeliczeniu daje mas
ę
0.915 g uranu – co
stanowi 0.1% masy pocz
ą
tkowej.

Prawo Avogadra (sformułowane przez
Amadeo Avogadro)
W tych samych warunkach fizycznych tj. w
takiej samej temperaturze i pod takim samym
ci
ś
nieniem, w równych obj
ę
to
ś
ciach ró
ż
nych
ci
ś
nieniem, w równych obj
ę
to
ś
ciach ró
ż
nych
gazów znajduje si
ę
taka sama liczba
cz
ą
steczek".
1mol gazu – 22,2 dm3

• Atom jest to najmniejsza cz
ęść
pierwiastka
chemicznego zachowuj
ą
ca jeszcze jego
charakterystyczne wła
ś
ciwo
ś
ci
• Cz
ą
steczka składa si
ę
z co najmniej 2 atomów.
Cz
ą
steczka pierwiastka składa si
ę
z atomów tego
samego pierwiastka Cz
ą
steczka zwi
ą
zku chemicznego
składa si
ę
z atomów ró
ż
nych pierwiastków
• Masa atomowa m
at
jest to masa atomu wyra
ż
ona w
jednostkach masy atomowej u
• Masa czasteczkowa m
cz
jest to masa atomu wyra
ż
ona w
jednostkach masy atomowej u
• Jednostk
ą
masy atomowej jest 1/12 masy atomu
w
ę
gla 12C u = 1/12 izotopu(12C) = 0,166 * 10(-23)g
• Liczba atomowa (Z) mówi o ilo
ś
ci protonów i elektronów
liczba masowa (A) mówi o ilo
ś
ci nukleonów w j
ą
drze. A
- Z = liczba neutronów
• Nukleony = protony + neutrony

Atom
Nazwa
Promie
ń
(m)
Masa
Atom
ok. 10-10
ró
ż
na w zale
ż
no
ś
ci
od pierwiastka
J
ą
dro
ok. 10-15
ok. 99,9% masy
atomu
Elektron
tworz
ą
chmur
ę
o
promieniu
równym promieniowi
atomu
ok. 0,1% masy atomu

Atom c.d.
•
Ka
ż
dy atom składa si
ę
z j
ą
dra i elektronów przebywaj
ą
cych w
przestrzeni pozaj
ą
drowej.
•
J
ą
dro składa si
ę
z protonów i neutronów, tzw. nukleonów
(wyj
ą
tkiem jest izotop wodoru w j
ą
drze którego jest tylko proton).
•
Liczb
ę
protonów w j
ą
drze podaje tzw. liczba atomowa Z, natomiast
liczb
ę
nukleonów – tzw. liczba masowa A.
•
Proton - ci
ęż
ka cz
ą
stka elementarna, o masie 1,6726*10-27kg;
około 1 u. Proton ma ładunek +1 składnik j
ą
dra atomowego.
•
Neutron - ci
ęż
ka, elektrycznie oboj
ę
tna cz
ą
stka elementarna o
masie 1,6748*10-27kg; równie
ż
około 1 u. składnik j
ą
dra
atomowego; swobodny - nietrwały, rozpada si
ę
na proton z emisj
ą
negatonu i antyneutrina.
•
Elektron ma ładunek -1 i mas
ę
0,00055 u.
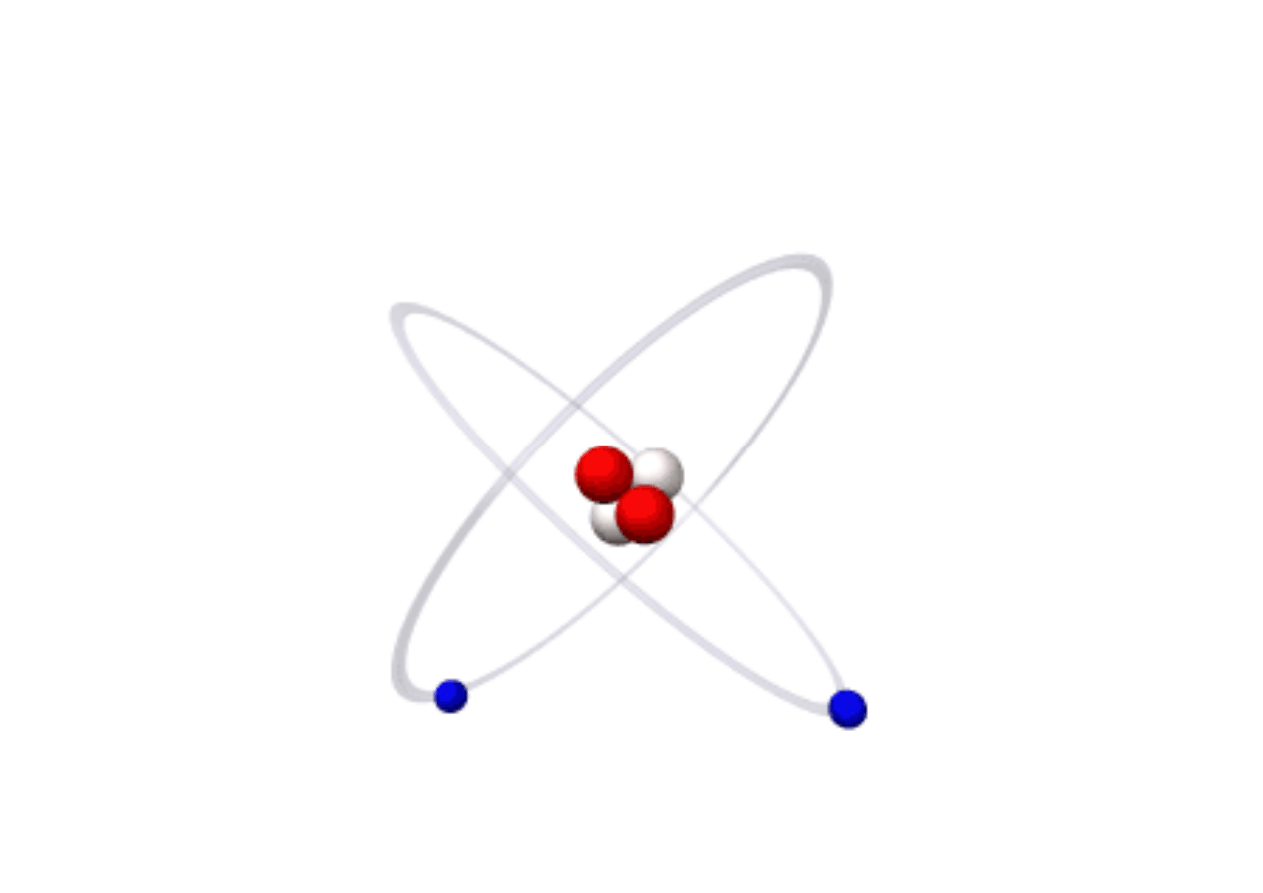
Atom Helu

Budowa j
ą
dra atomowego
• J
ą
dro ma zawsze mniejsz
ą
mas
ę
, ni
ż
wynikałoby to z
sumowania mas składników tego j
ą
dra.
• Ró
ż
nica pomi
ę
dzy sum
ą
mas nukleonów tworz
ą
cych
j
ą
dro danego atomu a rzeczywist
ą
mas
ą
tego j
ą
dra to
tzw. defekt masy.
• Ró
ż
nica ta odniesiona do jednostki masy atomowej
• Ró
ż
nica ta odniesiona do jednostki masy atomowej
stanowi tzw. wzgl
ę
dny defekt masy i jest miar
ą
energii
wi
ą
zania elementów składowych j
ą
dra.
• Nuklid jest to zbiór atomów o tej samej liczbie atomowej i
tej samej liczbie masowej, np.
• 238 U
92

•
Deficyt masy (niedobór masy, defekt masy) - ró
ż
nica
∆
m mi
ę
dzy
sum
ą
mas nukleonów wchodz
ą
cych w skład j
ą
dra atomowego, a mas
ą
j
ą
dra. Iloczyn niedoboru masy i kwadratu pr
ę
dko
ś
ci
ś
wiatła w pró
ż
ni jest
równy energii wi
ą
zania w j
ą
drze,
∆
E.
∆
E =
∆
mc2
•
∆
m= xm
p
+ ym
n
– m
e(p,n)
•
gdzie:
– nuklid zawieraj
ą
cy y neutronów i x protonów (N + Z = A)
– mp = 1,00727 - masa protonu w j.m.a.
– mn = 1,00866 - masa neutronu w j.m.a
– mE - masa j
ą
dra nuklidu
– c = 3·108 m/s - pr
ę
dko
ść
ś
wiatła w pró
ż
ni
– c = 3·108 m/s - pr
ę
dko
ść
ś
wiatła w pró
ż
ni
– 1 kg masy to równowa
ż
no
ść
energii
∆
m·c2 = 9·1016 J
– 1 g masy to równowa
ż
no
ść
energii 9·10(13)J
– jednostce masy atomowej (1 u = 1,66053873(13)·10-27 kg) odpowiada
energia 931 MeV
Przykład
ró
ż
nica pomi
ę
dzy mas
ą
j
ą
dra atomowego, a sum
ą
mas nuklidów składowych:
Dla j
ą
dra 4He o masie 4,00150 zawieraj
ą
cego 2 protony (mp = 1,00727) i 2
neutrony (mn = 1,00866) suma mas nukleonów wynosi 4,03186, a wi
ę
c
deficyt masy
∆
m = 2mp + 2 mn - mHe = 0,03036 u, co odpowiada
2,73·109 kJ/mol.

Izotopy
– atomy tego samego pierwiastka o ró
ż
nej liczbie masowej, np.
Izotony
– atomy ró
ż
nych pierwiastków o takiej samej liczbie neutronów,
lecz ró
ż
nej liczbie masowej, np.
Izobary
– atomy ró
ż
nych pierwiastków o tej samej liczbie masowej, np.

Masa atomowa i masa cz
ą
steczkowa
•
Masa atomowa (A) to masa atomu, wyra
ż
ona w atomowych jednostkach
masy [u], która stanowi
ś
redni
ą
wa
ż
on
ą
mas izotopów danego pierwiastka
wyst
ę
puj
ą
cych w przyrodzie:
•
gdzie:
•
%n – zawarto
ść
procentowa danego izotopu,
•
%n – zawarto
ść
procentowa danego izotopu,
An – masa tego izotopu (upraszczaj
ą
c, mo
ż
emy wstawi
ć
do wzoru liczb
ę
masow
ą
tego izotopu).
Atomowa jednostka masy [u] to masa1/12 masy atomu izotopu w
ę
gla C-12
•
Masa cz
ą
steczkowa (Mr) jest sum
ą
mas atomów wchodz
ą
cych w skład
cz
ą
steczki i te
ż
jest wyra
ż
ona w atomowych jednostkach masy [u].

Mol i masa molowa
Mol – jednostka liczno
ś
ci materii.
1mol = 6,02214179±0,00000030 · 10(23) cz
ą
stek
Masa molowa – masa pojedynczego atomu wyra
ż
ona w atomowych
jednostkach masy.
Masa cz
ą
steczkowa – masa pojedynczej cz
ą
steczki wyra
ż
ona w
atomowych jednostkach masy.
Atomowa jednostka masy – odpowiada 1/12 masy izotopu w
ę
gla.
Liczba Avogadra - okre
ś
la liczb
ę
atomów stanowi
ą
cych 1 mol.
N
A
= 6,022137·10(23) mol-1
Jednostk
ą
masy molowej jest mol [mol].

Masa atomowa
• Masa atomowa - liczba okre
ś
laj
ą
ca ile razy masa
jednego reprezentatywnego atomu danego pierwiastka
jest wi
ę
ksza od masy 1/12 izotopu 12C, (atom o
ś
redniej
masie wyliczonej proporcjonalnie ze wszystkich
stabilnych izotopów w danego pierwiastka, ze wzgl
ę
du
na ich rozpowszechnienie na Ziemi. Masa atomowa jest
wyra
ż
ana w jednostkach masy atomowej [u].
wyra
ż
ana w jednostkach masy atomowej [u].
• MA - masa atomowa
mA - bezwzgl
ę
dna masa atomu
0,166·10-23 - 1/12 masy w
ę
gla
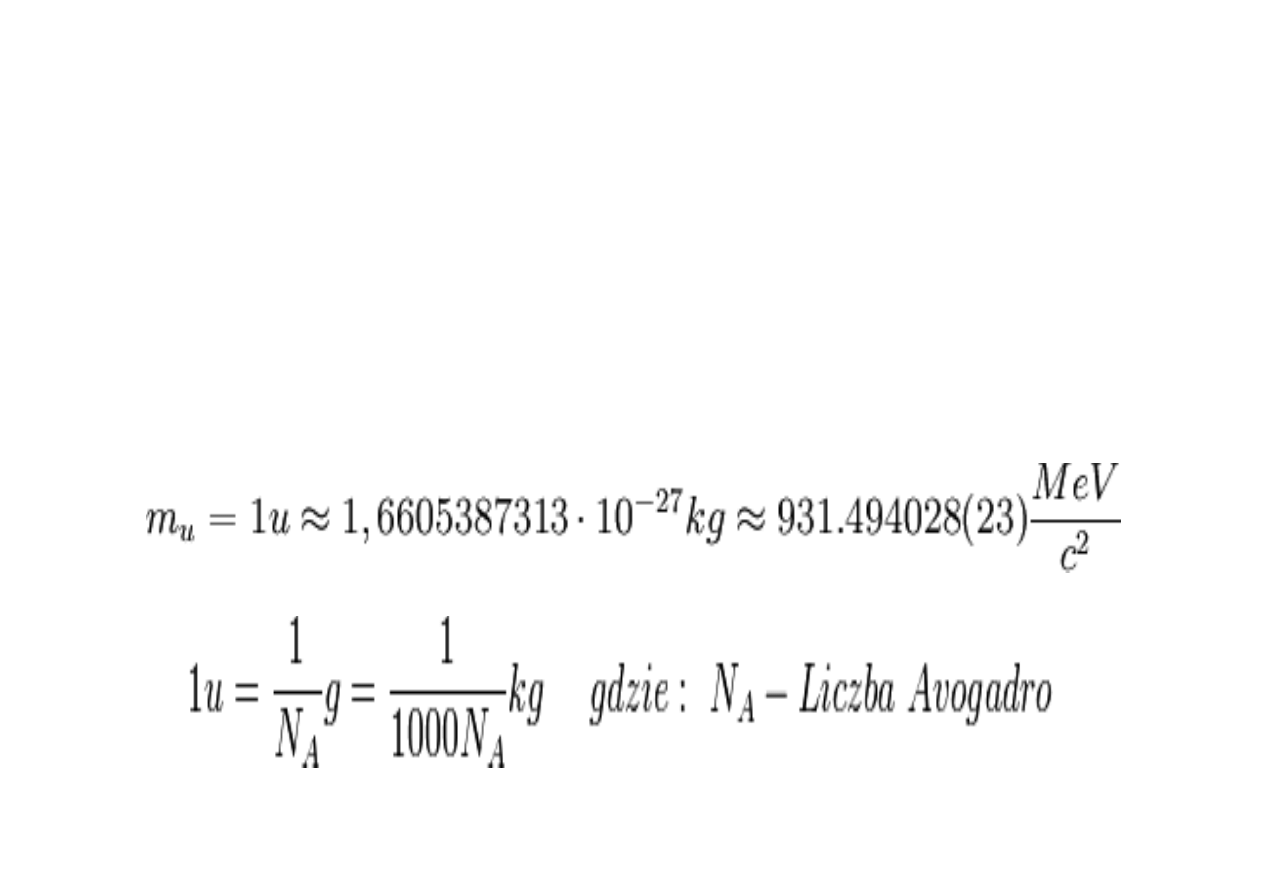
Jednostka masy atomowej
• u, oznaczana tak
ż
e jako u (z ang. atomic
mass unit) – jednostka masy, która w
przybli
ż
eniu jest równa masie atomu wodoru,
została zdefiniowana jako 1/12 masy atomu
w
ę
gla 12C.
w
ę
gla 12C.

Liczba Avogadra - okre
ś
la liczb
ę
atomów
stanowi
ą
cych 1 mol.
N
A
Obj
ę
to
ść
molowa - obj
ę
to
ść
1 mola gazu wyra
ż
ona
w dm3.
• Mol dowolnego gazu zajmuje obj
ę
to
ść
ok.
22,4 dm3 w tzw. warunkach normalnych
(0°C czyli 273K, 1 atm, czyli 101325 Pa),.
• 1mol - 6,022137·10(23)at. – 22,4 dm3

przykład
Dla :
• masy atomowe wodoru i tlenu, to odpowiednio,
1 j. m. at. i 16 j. m. at.;
• masy cz
ą
steczkowe
wodoru H
2
- 2 j. m. at,
tlenu O
2
- 32 j
wody H
2
O - 18 j. m. at.
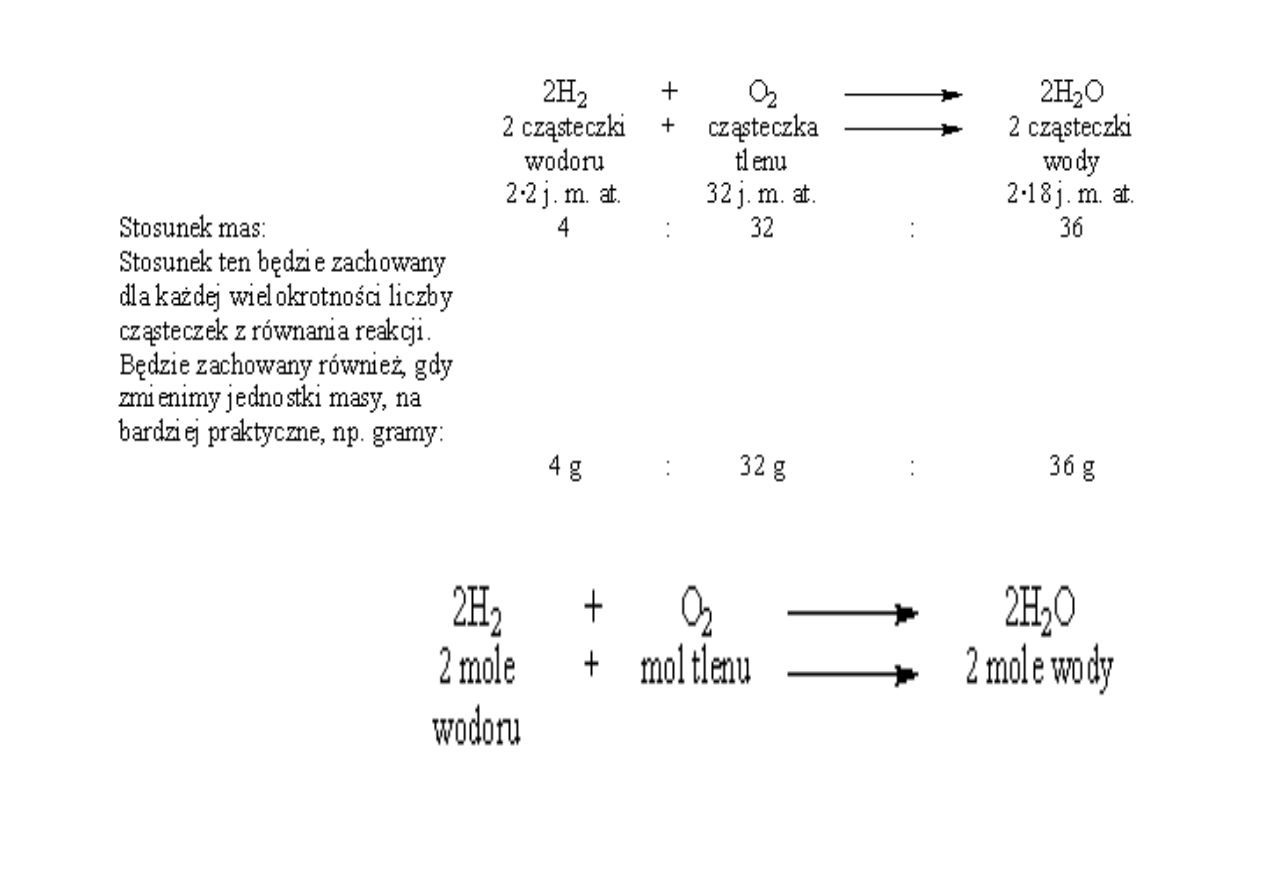
•Równanie reakcji z przykładu zinterpretujemy zatem:

Postulaty teorii Daltona
John Dalton, angielski uczony, opracował w 1804r. tez
ę
atomistyczno -
cz
ą
steczkow
ą
budowy materii. We współczesnej formie jest ona aktualna do
dzisiaj.
• Pierwiastek chemiczny zło
ż
ony jest z bardzo małych cz
ą
stek,
które nazwano atomami.
•
• Wszystkie atomy danego pierwiastka wykazuj
ą
identyczne
wła
ś
ciwo
ś
ci chemiczne.
wła
ś
ciwo
ś
ci chemiczne.
•
• Atomy nale
żą
ce do ró
ż
nych pierwiastków cechuj
ą
si
ę
odr
ę
bnymi własno
ś
ciami fizycznymi oraz chemicznymi. W
przyrodzie jest tyle atomów ile pierwiastków.
•
• Atom okre
ś
lonego pierwiastka nie ulega przekształceniu w
innego rodzaju atom (który charakteryzuje inny pierwiastek) w
wyniku standardowej reakcji chemicznej
.
•

Postulaty teorii Daltona c.d.
• Tworzenie zwi
ą
zków chemicznych przez pierwiastki
jest zwi
ą
zane z ł
ą
czeniem ró
ż
nych atomów
(nale
żą
cych do ró
ż
nych pierwiastków) w wyniku czego
powstaj
ą
cz
ą
steczki.
•
• Zwi
ą
zek chemiczny składa si
ę
cz
ą
steczek.
Cz
ą
steczki, wchodz
ą
ce w skład zwi
ą
zku
Cz
ą
steczki, wchodz
ą
ce w skład zwi
ą
zku
chemicznego, s
ą
identyczne pod wzgl
ę
dem budowy i
wła
ś
ciwo
ś
ci.
•
• Rozkład zwi
ą
zku chemicznego nast
ę
puje w wyniku
rozpadu cz
ą
steczek na atomy pierwiastków.
• Atomy nale
żą
ce do tego samego pierwiastka równie
ż
mog
ą
tworzy
ć
cz
ą
steczki.

• Odkrycie elektronu
• Joseph Thomson w 1896r podczas
do
ś
wiadcze
ń
z
ż
yciem rozrzedzonych
gazów odkrył elektron. Jest to cz
ą
stka
elementarna, składowa atomu, oznaczana
symbolem e-. Charakterystyk
ę
elektronu
symbolem e-. Charakterystyk
ę
elektronu
zestawiono poni
ż
szej
• Masa 0,00055u - 9,11 x 10-31kg
• Ładunek 1,6 x 10-19 C

POSTULATY BUDOWY ATOMU BOHRA
Bohr (1913) teori
ę
sw
ą
oparł na twierdzeniach , zwanych postulatami Bohra.
1. Elektron w atomie mo
ż
e przebywa
ć
tylko w okre
ś
lonych stanach, o okre
ś
lonej
energii, zwanych stacjonarnymi
2.
Elektron w stanie stacjonarnym nie promieniuje (nie traci energii).
•
εεεε
= E1 + E2 =
νννν
h – warto
ść
emitowanej energii podczas przej
ś
cia do stanu o
wy
ż
szej energii
.
3.
Dozwolone stany dla ruchu elektronu odpowiadaj
ą
tylko pewnym
dozwolonym warto
ś
ciom (kwantom) orbitalnego momentowi p
ę
du
b
ę
d
ą
cego wielokrotno
ś
ci
ą
liczby h/2
π
: mvr =n(h/2
ππππ
)
4.
W ka
ż
dym z tych stanów elektron porusza si
ę
wokół j
ą
dra po
orbicie kołowej.
Tylko takie orbity s
ą
dozwolone, dla których iloczyn długo
ś
ci orbity
i p
ę
du elektronu jest równy całkowitej wielokrotno
ś
ci stałej
Plancka.
2 rmv=nh ; n=1,2,3.......

• Dwa pierwsze postulaty s
ą
poprawne i
zachowane w teorii kwantowej.
• Trzeci jest słuszny cz
ęś
ciowo – moment
p
ę
du elektronu jest wielko
ś
ci
ą
stał
ą
.
• Czwarty jest całkowicie niesłuszny –
elektron porusza si
ę
po orbicie kulistej.
elektron porusza si
ę
po orbicie kulistej.
• Bohr nie wyja
ś
nił dlaczego moment
p
ę
du jest kwantowany – zało
ż
enie to
dawało zgodno
ść
mi
ę
dzy
przewidywaniami a obserwacj
ą
.

• Dopiero w 1924 de Broglie podał wyja
ś
nienie –
ka
ż
da poruszaj
ą
ca si
ę
cz
ą
stka ma falow
ą
natur
ę
(jak
ś
wiatło)
•
λλλλ
= h/mv – długo
ść
faly jest b. mała w
porównaniu z wymiarami cz
ą
stki
• Dualizm korposkularny – cz
ą
stka posiada
mas
ę
i długo
ść
fali
mas
ę
i długo
ść
fali
• Zasada nieoznaczono
ś
ci Heisenberga –
niemo
ż
liwo
ść
jednoczesnego, dokładnego
pomiaru poło
ż
enia i p
ę
du cz
ą
stki.
• Wyprowadził on wzór ł
ą
cz
ą
cy mas
ę
cz
ą
stki
(m), pr
ę
dko
ść
(v) oraz energie kinetyczn
ą
(E):
E = mv2 / 2

• Mimo pozornej poprawno
ś
ci modelu zrezygnowano z
niego, poniewa
ż
zgodnie z elektrodynamik
ą
klasyczn
ą
poruszaj
ą
cy si
ę
po okr
ę
gu (lub elipsie), a wi
ę
c
przyspieszany, elektron powinien, w sposób ci
ą
gły,
wypromieniowywa
ć
energi
ę
i w efekcie "spadłby" na
j
ą
dro ju
ż
po czasie rz
ę
du 10-6 sekundy.
• Fakt,
ż
e tak si
ę
nie dzieje, nie dawał si
ę
wytłumaczy
ć
na gruncie fizyki klasycznej.
• Model Bohra został ostatecznie odrzucony równie
ż
ze
wzgl
ę
du na to,
ż
e:
- nie dawało go si
ę
zaadaptowa
ć
do atomów
posiadaj
ą
cych wi
ę
cej ni
ż
dwa elektrony
- nie mo
ż
na było za jego pomoc
ą
stworzy
ć
przekonuj
ą
cej, zgodnej ze znanymi faktami
eksperymentalnymi teorii powstawania wi
ą
za
ń
chemicznych
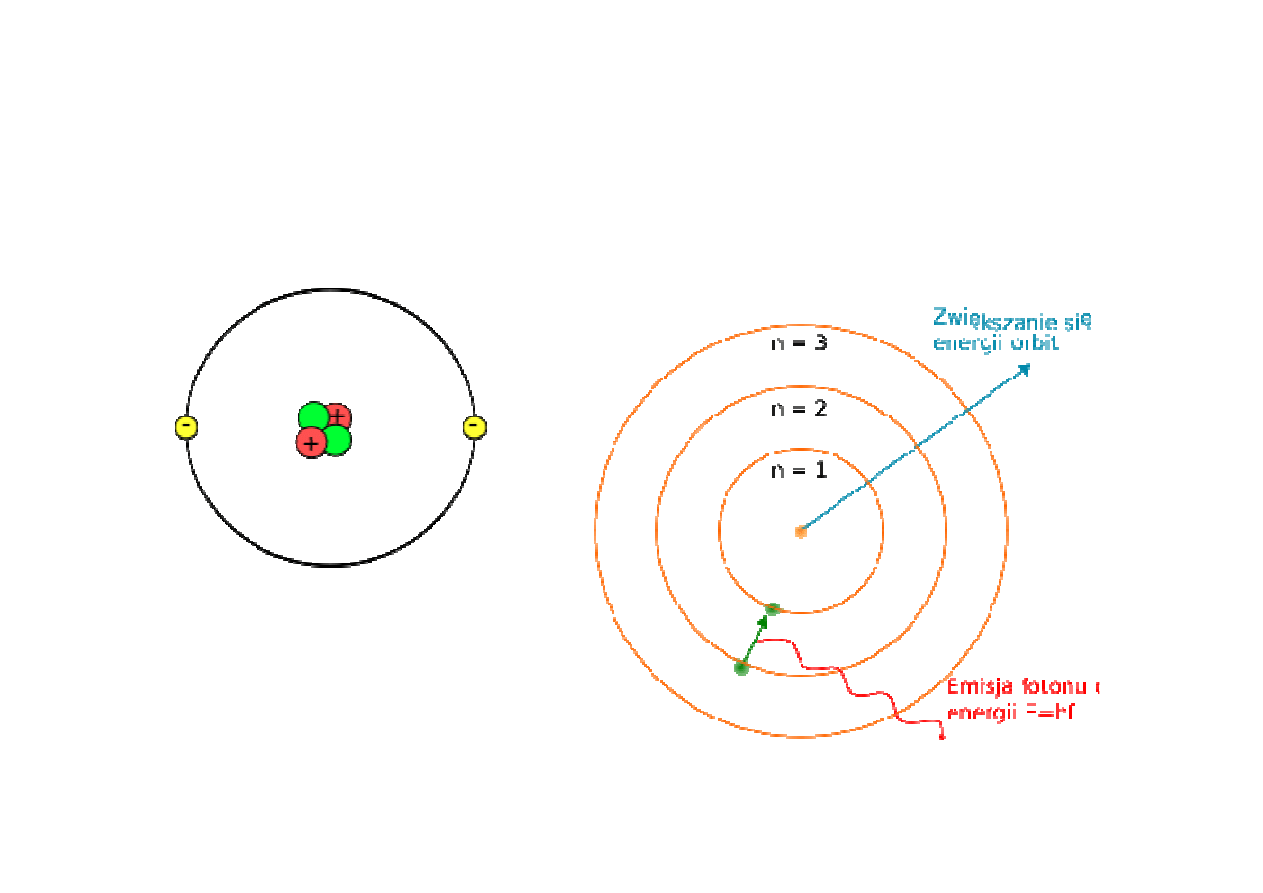
Orbitalny model atomu helu i model
budowy atomu Bohra

Model falowy
Teoria ta korzysta z praw mechaniki kwantowej.
Nie ma tu elektronu, jako korpuskuły, bo nie mo
ż
na go
dostrzec w okre
ś
lonym punkcie, a jedynie mówi
ć
o
prawdopodobie
ń
stwie jego wyst
ę
powania w
okre
ś
lonej przestrzeni.
Zło
ż
one wyra
ż
enia matematyczne ustalaj
ą
rozkład
Zło
ż
one wyra
ż
enia matematyczne ustalaj
ą
rozkład
g
ę
sto
ś
ci elektronowej.
Stany energetyczne w atomie s
ą
okre
ś
lone, podobnie
jak w modelu Bohra, przez liczby kwantowe.
Teoria falowa w precyzyjniejszy ni
ż
wcze
ś
niej sposób,
opisuje zachowanie si
ę
atomów wieloelektronowych.
Pomimo wielu niedokładno
ś
ci w modelu Bohra,
czasem okazuje si
ę
on by
ć
przydatny przy
wyja
ś
nianiu prostych zało
ż
e
ń
chemicznych.

• W centralnej cz
ęś
ci atomu znajduje si
ę
dodatnio
naładowane j
ą
dro, w którym znajduj
ą
si
ę
protony i
neutrony.
• Za zwart
ą
struktur
ę
j
ą
dra atomowego odpowiadaj
ą
siły
j
ą
drowe.
• Natura tych sił nie została do dzisiaj poznana.
• Wokół j
ą
dra, w bardzo znacznej od niego odleglo
ś
ci
(bior
ą
c pod uwag
ę
rozmiar samego j
ą
dra), bezustannie i
z ogromn
ą
pr
ę
dko
ś
ci
ą
kr
ążą
po eliptycznych torach
elektrony.
• Mi
ę
dzy j
ą
drem a elektronami istnieje wolna przestrze
ń
.
• Mi
ę
dzy j
ą
drem a elektronami istnieje wolna przestrze
ń
.
• T
ę
pozornie pust
ą
przestrze
ń
wypełnia chmura
elektronowa i ich pole elektromagnetyczne.
• Elektrony kr
ążą
z ogromn
ą
pr
ę
dko
ś
ci
ą
i wykonuj
ą
około
6 mld okr
ąż
e
ń
na mikrosekund
ę
.
• Bardzo trudno jest jednoznacznie powiedzie
ć
w którym
konkretnie miejscu, znajduje si
ę
elektron w danej chwili.
• Elektron znajduje si
ę
wsz
ę
dzie dokoła jadra i tworzy co
ś
w rodzaju chmury. Elektrony kr
ążą
ce w tej samej
odległo
ś
ci od j
ą
dra tworz
ą
tzw. powłok
ę
elektronow
ą
.

Kwarki
•
Fizycy odkryli,
ż
e protony i neutrony s
ą
zbudowane z jeszcze
mniejszych cz
ą
stek, zwanych kwarkami.
•
Według naszej dotychczasowej wiedzy kwarki s
ą
jak punkty w
geometrii. Nie s
ą
one zbudowane z niczego innego.
W chwili obecnej, po wielu do
ś
wiadczeniach sprawdzaj
ą
cych t
ę
teori
ę
, naukowcy podejrzewaj
ą
,
ż
e kwarki i elektron s
ą
elementarne.
•
Istnieje sze
ść
rodzajów kwarków. Trzy z nich maj
ą
ładunek +2/3e, a
•
Istnieje sze
ść
rodzajów kwarków. Trzy z nich maj
ą
ładunek +2/3e, a
pozostałe ładunek -1/3e. Nazwy kwarków pochodz
ą
od pierwszej
litery angielskich nazw
•
Proton składa si
ę
z 3 kwarków: 2 kwarków u i jednego d, a neutron
tak
ż
e z 3 kwarków, tyle
ż
e 2 kwarków d i jednego u.
Dzi
ę
ki ułamkowym warto
ś
ciom ładunku kwarków, cz
ą
stki
elementarne z nich zbudowane maj
ą
ładunek całkowity.
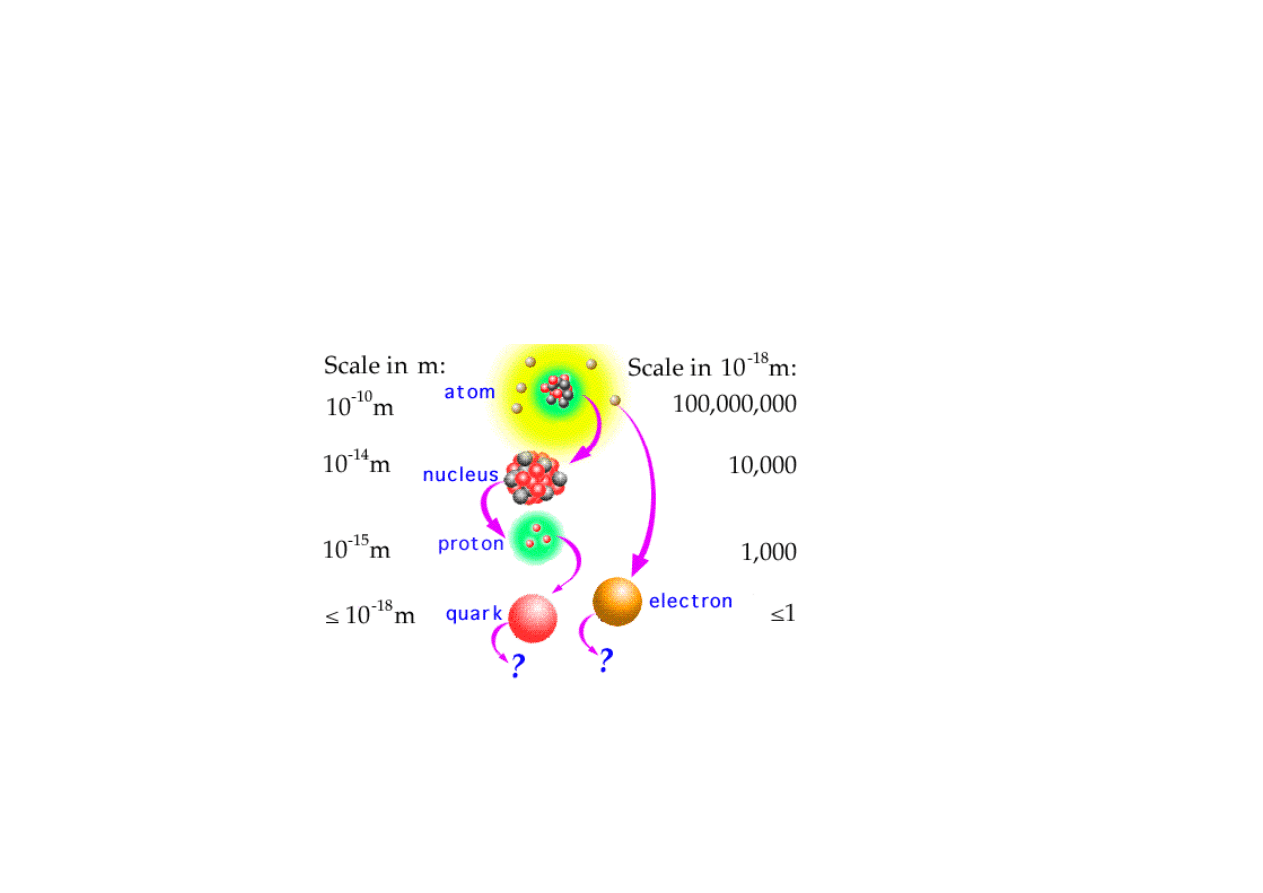
Kwarki
kwarki i elektrony s
ą
mniejsze ni
ż
10 do pot
ę
gi -18 metra, jest wiec mo
ż
liwe ze
nie maja one w ogóle
ż
adnego rozmiaru. Jest tez mo
ż
liwe, ze kwarki i
elektrony nie s
ą
cz
ą
stkami elementarnymi, ale zbudowane s
ą
z jeszcze
mniejszych cz
ą
steczek.
atomy s
ą
zbudowane z protonowa, neutronowa i elektronowa.
Protony i neutrony s
ą
zbudowane z kwarków, które by
ć
mo
ż
e s
ą
zbudowane z jeszcze bardziej podstawowych cz
ą
stek...

Trwało
ść
j
ą
dra
• Trwało
ść
j
ą
dra jest utrzymywana dzi
ę
ki siłom
j
ą
drowym. Maj
ą
one bardzo niewielki zasi
ę
g
działania z powodu bardzo małego promienia
j
ą
dra atomowego, którego
ś
rednica jest równa
ok. 10(-15) – 10(-14) m.
• Za trwało
ść
j
ą
dra odpowiadaj
ą
siły j
ą
drowe
• Za trwało
ść
j
ą
dra odpowiadaj
ą
siły j
ą
drowe
działaj
ą
ce pomi
ę
dzy nukleonami, charakteryzuj
ą
si
ę
bardzo małym zasi
ę
giem (rz
ę
du 10-13 cm)
oraz brakiem zwi
ą
zku z ładunkiem. Neutrony
oraz protony mog
ą
wymienia
ć
ładunek mi
ę
dzy
sob
ą
na wskutek zderze
ń
. Energia zwi
ą
zana z
oddziaływaniami mi
ę
dzy składnikami j
ą
dra
została okre
ś
lona jako energia wi
ą
zania j
ą
dra.

• Neutrony oraz protony mog
ą
wymienia
ć
ładunek
mi
ę
dzy sob
ą
na wskutek zderze
ń
. Energia
zwi
ą
zana z oddziaływaniami mi
ę
dzy składnikami
j
ą
dra została okre
ś
lona jako energia wi
ą
zania
j
ą
dra.
• Energi
ę
wylicza si
ę
z równania Einsteina:
E = mc2
• Jej warto
ść
wskazuje na to jaka energia musi
by
ć
dostarczona, by rozbi
ć
j
ą
dro albo jaka ilo
ść
jest wydzielona podczas jego tworzenia. Wzrost
energii wi
ą
zania oraz defektu masy czyni j
ą
dro
bardziej trwałe stabilne.

J
ą
dra trwałe to takie, które:
• Posiadaj
ą
równe ilo
ś
ci protonów i
neutronów
• Posiadaj
ą
parzyste ilo
ś
ci protonów oraz
neutronów
• Stosunek protonów do neutronów wynosi
2 : 3
2 : 3
W pozostałych przypadkach nast
ę
puje
samorzutny rozpad.
Suma protonów oraz neutronów w zasadzie
jest równa masie j
ą
dra w jednostkach mas
atomowych u.
Wyszukiwarka
Podobne podstrony:
CHEMIA I Podstawowe pojecia id Nieznany
CHEMIA I Podstawowe pojęcia
0 Bazy danych podstawowe pojeci Nieznany
1 Podstawowe pojeciaid 9565 Nieznany (2)
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
Pojecia Podstawowe SVG2WZAEW2JI Nieznany
P1 podstawowe pojecia id 344421 Nieznany
Podstawowe pojecia pedagogiczne Nieznany
Chemia organiczna podstawy wykl Nieznany
Podstawowe pojęcia i prawa chemiczne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
1 Podstawowe pojeciaid 8624 Nieznany (2)
1 Wprowadzenie – podstawowe pojęcia, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
Podstawowe pojęcia i prawa chemiczne, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
Podstawowe pojęcia chemiczne, CHEM, Chemia Ogólna
Podstawowe pojecia spoiwa id 36 Nieznany
Chemia organiczna podstawy wykl Nieznany (2)
więcej podobnych podstron