1
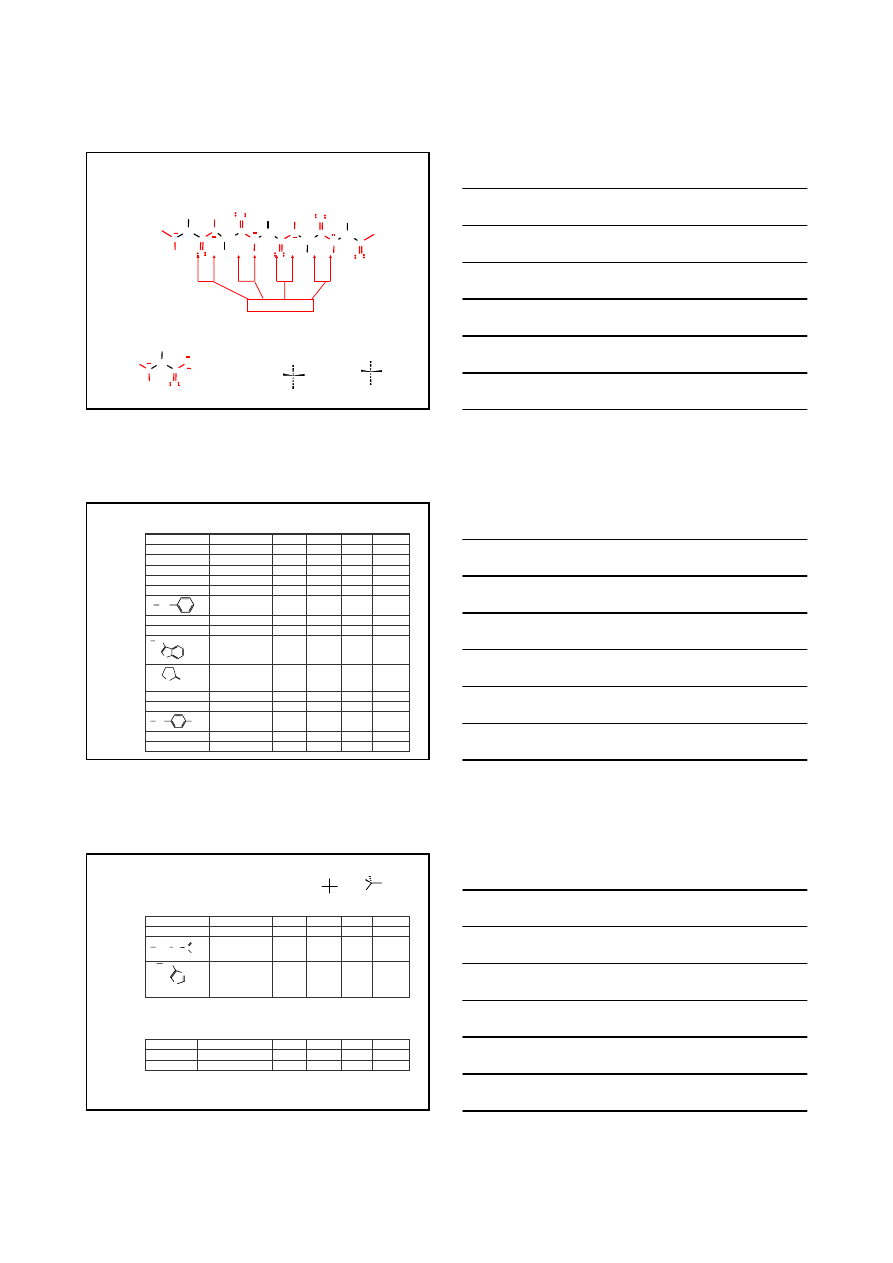
AMINOKWASY, PEPTYDY I BIAŁKA
N
H
O
C
CH
R
H
OH
α-aminokwas
R
R
O
C
CH
N
H
C
O
H
N
CH
R
R
H
N
H
O
C
CH
R
N
O
O
C
CH
C
N
H
CH
1
2
3
4
fragment białka
CO
2
H
H
2
N
H
R
L
−
α-aminokwas
aldehyd L
−
glicerynowy
CHO
HO
H
CH
2
OH
(S)
wiązanie amidowe
L-
AMINOKWASY
9.2
2.3
Met/M
METIONIA
–CH
2
SCH
3
10.8
1.7
Cys/C
CYSTEINA
–CH
2
SH
9.1
2.2
Tyr/Y
TYROZYNA
10.4
2.6
Thr/T
TREONINA
–CH(OH)CH
3
9.2
2.2
Ser/S
SERYNA
–CH
2
OH
10.6
2.0
Pro/P
PROLINA
9.4
2.4
Trp/W
TRYPTOFAN
9.1
2.2
Gln/Q
GLUTAMINA
–CH
2
CH
2
CONH
2
8.8
2.0
Asn/N
ASPARAGINA
–CH
2
CONH
2
9.1
1.8
Phe/F
FENYLOALANINA
9.7
2.4
Ile/I
IZOLEUCYNA
–CH(CH
3
)CH
2
CH
3
9.6
2.4
Leu/L
LEUCYNA
–CH
2
CH(CH
3
)
2
9.6
2.3
Val/V
WALINA
–CH
2
CH
3
9.7
2.3
Ala/A
ALANINA
–CH
3
9.6
2.3
Gly/G
GLICYNA
–H
p
K
a
p
K
a2
p
K
a1
SKRÓT
NAZWA
STRUKTURA R-
H
2
N
CO
2
H
R
H
CO
2
H
H
2
N
H
R
OBOJĘTNE
* Aminokwasy egzogenne
CH
2
N
H
CH
2
N
H
COOH
CH
2
OH
L-
AMINOKWASY
6.0
9.2
1.8
His/H
HISTYDYNA
12.5
9.0
2.2
Arg/R
ARGININA
10.5
9.0
2.2
Lys/K
LIZYNA
–CH
2
(CH
2
)
3
NH
2
p
K
a
p
K
a2
p
K
a1
SKRÓT
NAZWA
STRUKTURA R-
ZASADOWE
Aminokwasy egzogenne – organizm zwierzęcy nie potrafi ich
syntezować z innych składników zawartych w pokarmie
C
NH
2
NH
(CH
2
)
3
NH
N
N
H
CH
2
4.3
9.7
2.2
Glu/E
KWAS GLUTAMINOWY
–CH
2
CH
2
COOH
3.9
9.8
2.1
Asp/D
KWAS ASPARAGINOWY
–CH
2
COOH
p
K
a
p
K
a2
p
K
a1
SKRÓT
NAZWA
STRUKTURA R-
KWASOWE
H
2
N
CO
2
H
R
H
CO
2
H
H
2
N
H
R
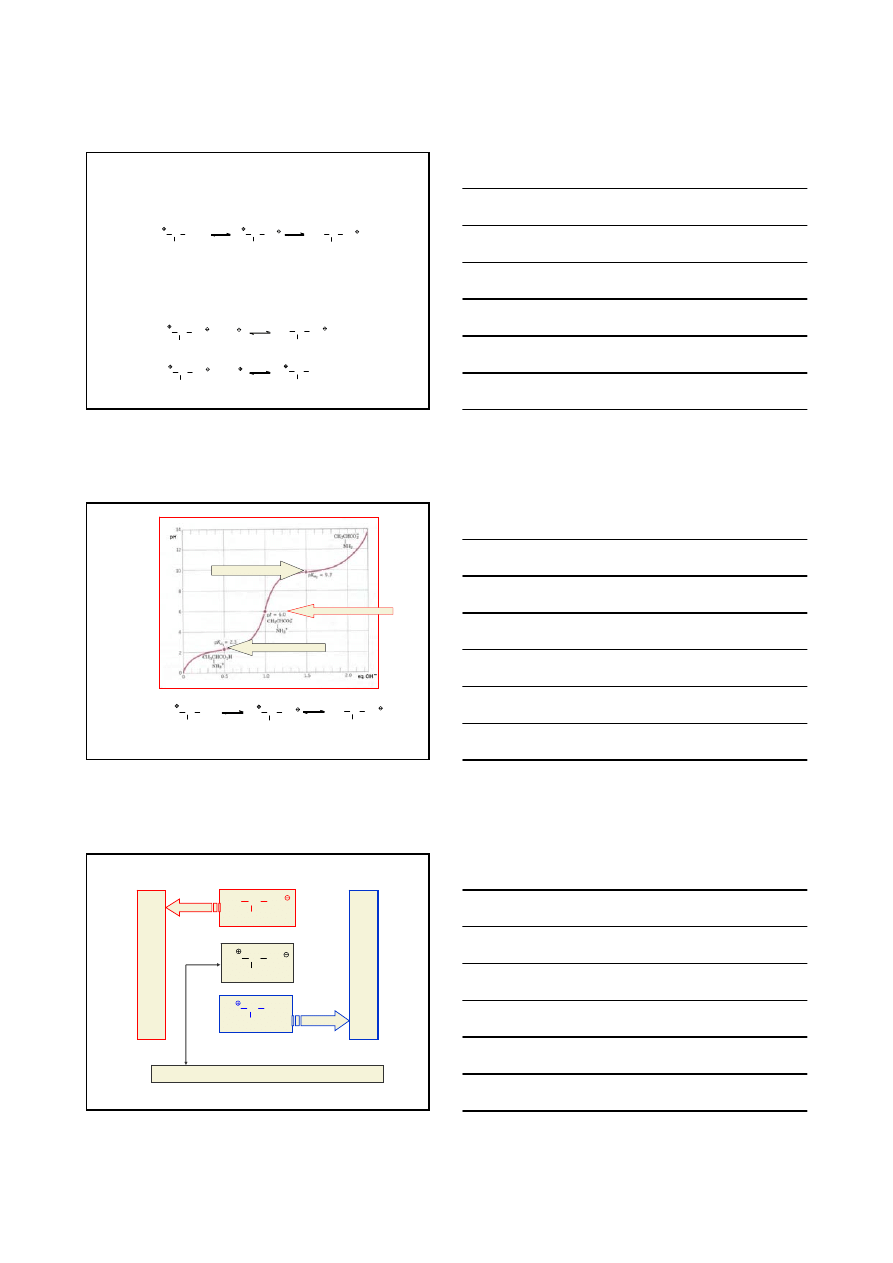
2
L-
AMINOKWASY
WŁAŚCIWOŚCI:
krystaliczne, nielotne, substancje stałe topiące się z rozkładem w wysokich temperaturach
nierozpuszczalne w niepolarnych rozpuszczalnikach, np. benzenie, eterze etylowym czy
naftowym; najczęściej rozpuszczalne w wodzie
substancje amfoteryczne
H
3
N CH
R
COO
OH
-
H
+
H
+
OH
-
H
2
N CH
R
COO
H
3
N CH
R
COOH
jon dipolarny
(obojnaczy)
postać aminokwasu
w niskich pH
postać aminokwasu
w wysokich pH
H
3
N CH
R
COO
H
2
N CH
R
COO
+ OH
+ H
2
O
+ H
2
O
+ H
3
O
H
3
N CH
R
COOH
H
3
N CH
R
COO
KWAS
KWAS
ZASADA
ZASADA
SPRZĘŻONA ZASADA
SPRZĘŻONA ZASADA
SPRZĘŻONY KWAS
SPRZĘŻONY KWAS
L-
AMINOKWASY
KRZYWA MIARECZKOWANIA ALANINY
H
3
N CH
CH
3
COO
H
3
N CH
CH
3
COOH
H
2
N CH
CH
3
COO
OH
-
H
+
H
+
OH
-
jon dipolarny ll
pK
a2
= 6.0
forma kationowa l
pK
a1
= 2.3
forma anionowa lll
pK
a2
= 9.7
JON DIPOLARNY II
FORMA KATIONOWA I
FORMA ANIONOWA III
L-
AMINOKWASY
PUNKT IZOELEKTRYCZNY – stężenie jonów hydroniowych, przy którym dany
aminokwas nie ulega migracji pod wpływem pola elektryczngo
H
2
N CH
CH
3
COO
III
H
3
N CH
CH
3
COO
II
H
3
N CH
CH
3
COOH
I
+
_
NISKIE pH
WYSOKIE pH
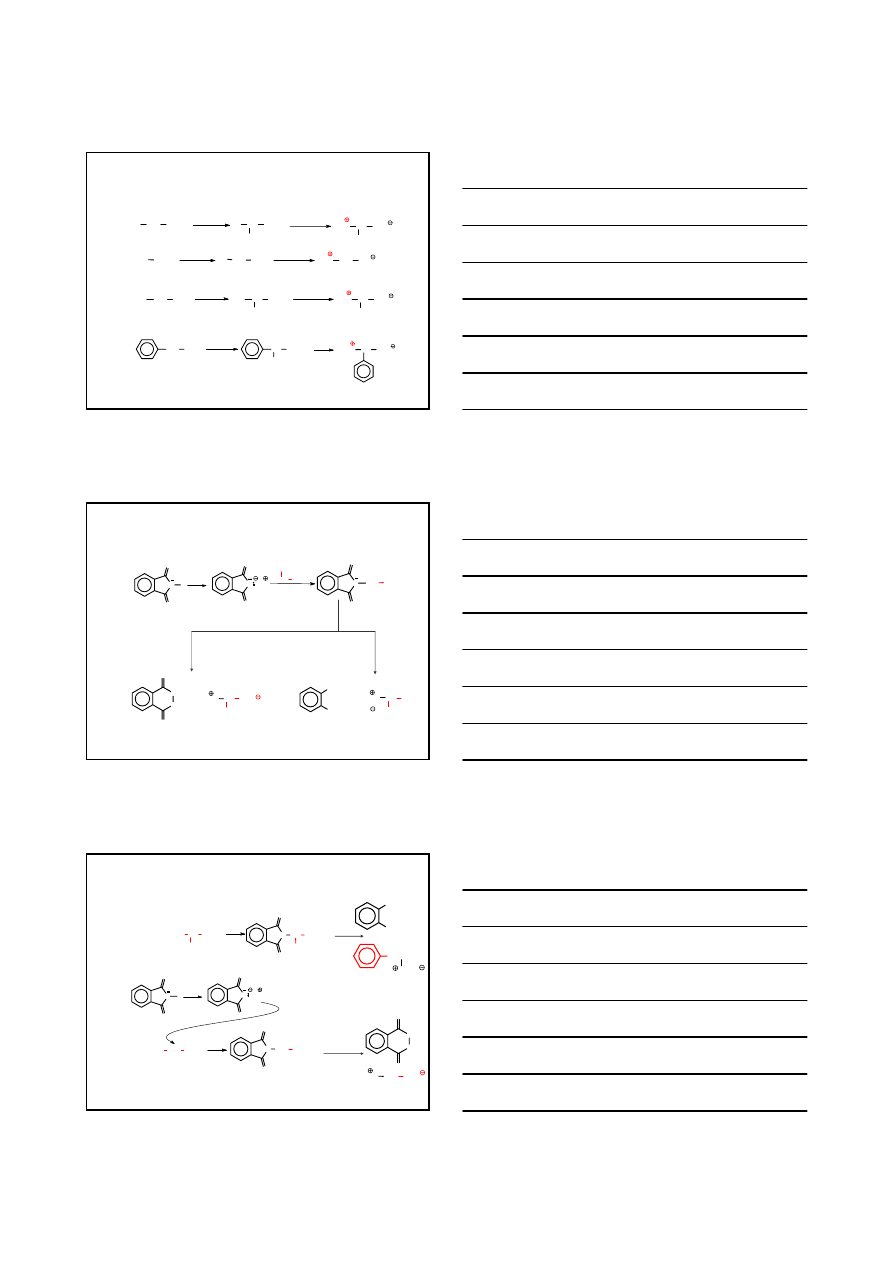
3
L-
AMINOKWASY
OTRZYMYWANIE
AMONOLIZA KWASÓW
α−HALOGENOKARBOKSYLOWYCH
R CH
2
COOH
1.
Br
2
, Pcz
2. H
2
O
R CH
Br
COOH
H
3
N
CH
R
COO
nadmiar
NH
3
+
NH
4
Br
PRZYKŁADY
+
NH
4
Br
nadmiar
NH
3
H
3
N
CH
2
COO
CH
2
Br
COOH
1.
Br
2
, Pcz
2. H
2
O
CH
3
COOH
64%
GLICYNA
DL
-ALANNA
+
NH
4
Br
NH
3
H
3
N
CH COO
CH
Br
COOH
1.
Br
2
, Pcz
2. H
2
O
CH
2
COOH
DL
-FENYLOGLICYNA
+
NH
4
Br
nadmiar
NH
3
H
3
N
CH
CH
3
COO
CH
3
CH
Br
COOH
1.
Br
2
, Pcz
2. H
2
O
CH
3
CH
2
COOH
70%
L-
AMINOKWASY
OTRZYMYWANIE
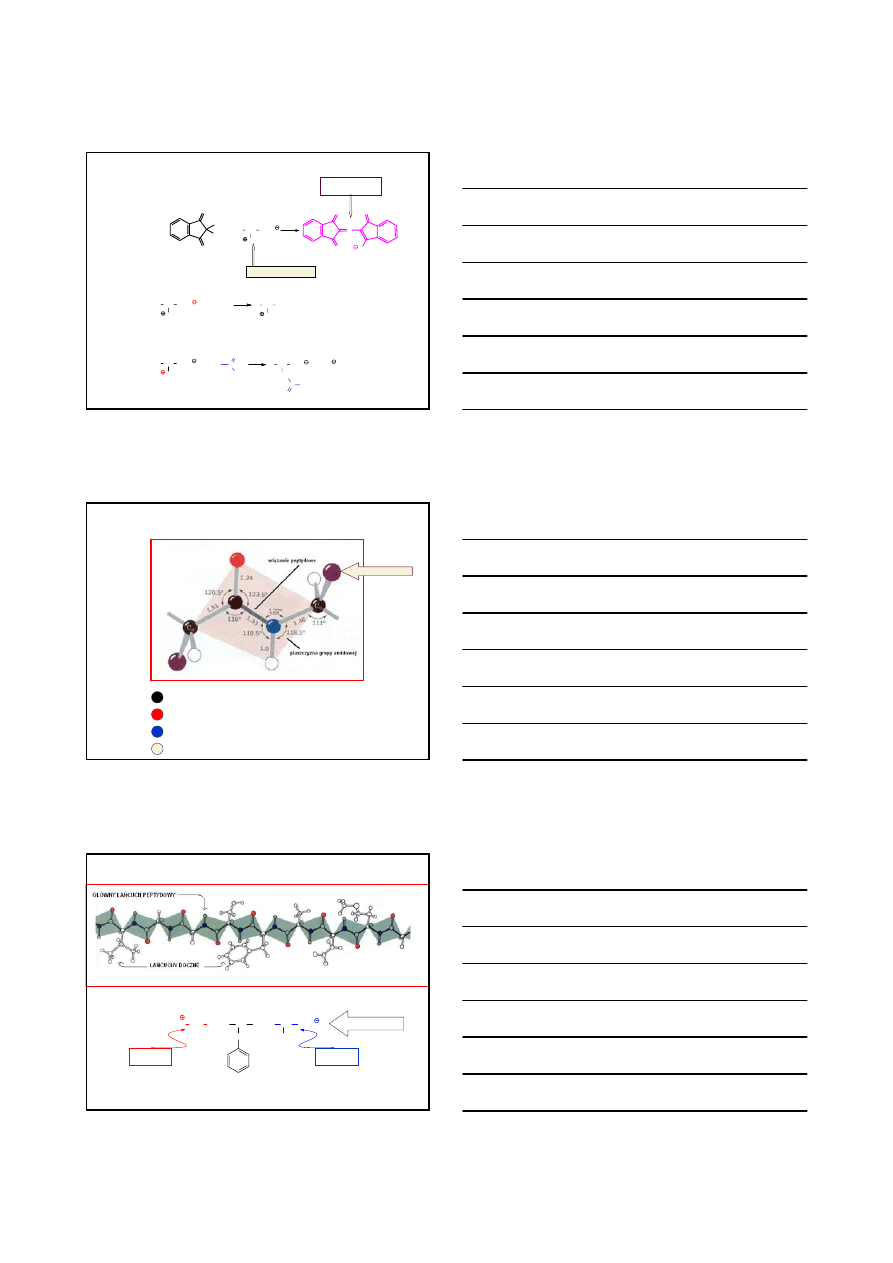
Z WYKORZYSTANIEM FTALIMIDKU POTASU
N
O
O
H
KOH
N
O
O
K
RCH CO
2
Me
X
N
O
O
CHR COOMe
(-KX)
NH
2
NH
2
, EtOH
∆
HCl/H
2
O
+
CH
H
3
N
COO
R
NH
NH
O
O
FTALHYDRAZYD
nierozpuszczalny w etanolu
COOH
COOH
+
CH
H
3
N
COOH
R
Cl
L-
AMINOKWASY
OTRZYMYWANIE
Z WYKORZYSTANIEM FTALIMIDKU POTASU
PRZYKŁADY
N
O
O
H KOH
N
O
O
K
CHLOROWODOREK
DL
-FENYLOALANINY
C
6
H
5
CH
2
CH
Br
COOEt
- KBr
N
O
O
CH
CO
2
Et
CH
2
C
6
H
5
+
COOH
COOH
+
CH
2
CHCO
2
H
NH
3
Cl
HCl/H
2
O
3-FENYLOPROPIONIAN ETYLU
NH
2
NH
2
, EtOH
∆, 89%
+
CH
2
H
3
N
COO
NH
NH
O
O
GLICYNA
Br CH
2
COOEt
N
O
O
CH
2
COOEt
- KBr
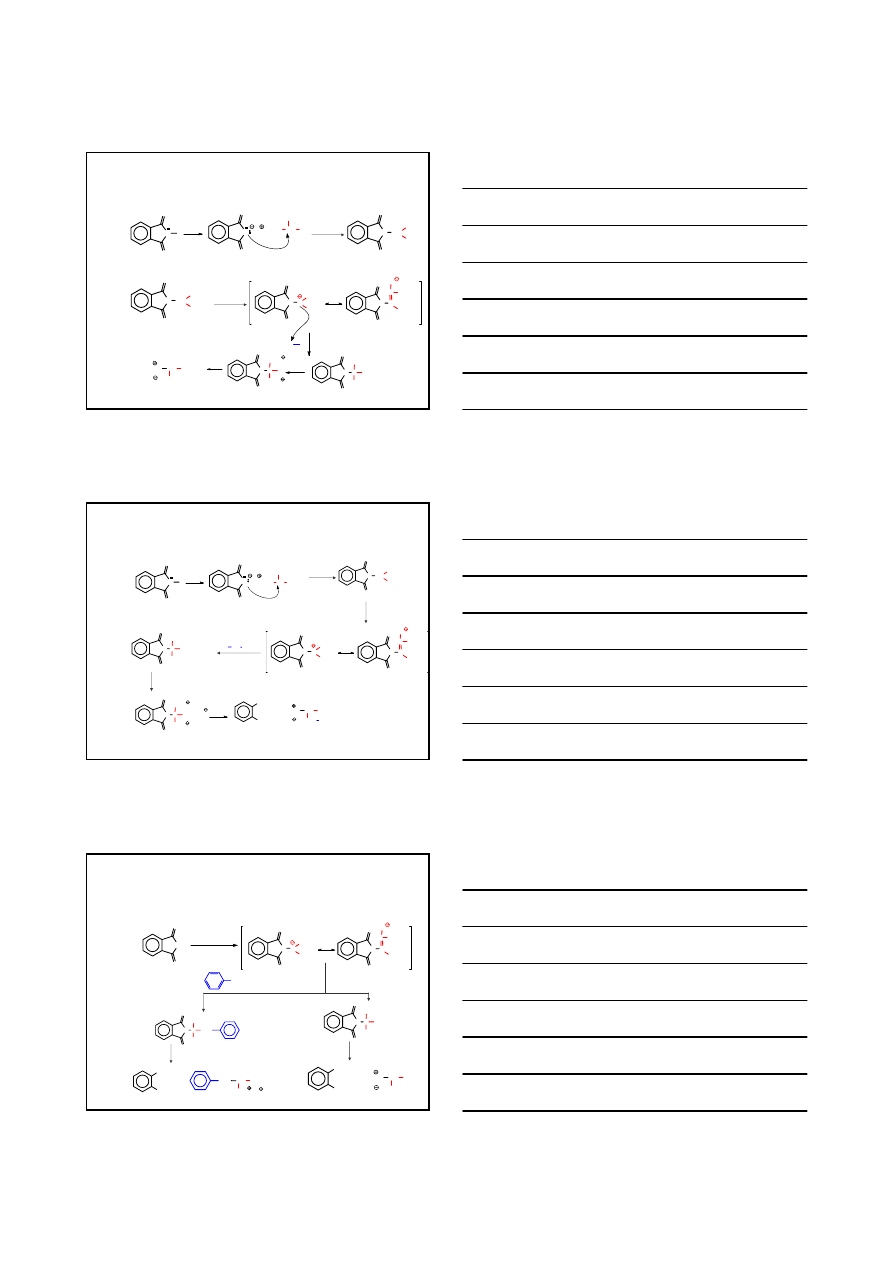
4
L-
AMINOKWASY
OTRZYMYWANIE
Z WYKORZYSTANIEM FTALIMIDKU POTASU I BROMOMALONIANU
N
O
O
H
KOH
N
O
O
K
Br CH COOEt
COOEt
N
O
O
CH
CO
2
Et
CO
2
Et
82-85%
BROMOMALONIAN
DIETYLOWY
N
O
O
CH
CO
2
Et
CO
2
Et
EtO
-
Na
+
N
O
O
C
CO
2
Et
CO
2
Et
N
O
O
C
CO
2
Et
C
O
OEt
R
Cl
N
O
O
C
COOEt
COOEt
R
NaOH
N
O
O
C
CO
O
CO
O
R
COOH
COOH
+
CH
H
3
N
COOH
R
Cl
HCl
L-
AMINOKWASY
OTRZYMYWANIE
Z WYKORZYSTANIEM FTALIMIDKU POTASU I BROMOMALONIANU
N
O
O
H
KOH
N
O
O
K
Br CH COOEt
COOEt
N
O
O
CH
CO
2
Et
CO
2
Et
82-
85%
BROMOMALONIAN
DIETYLOWY
N
O
O
C
CO
2
Et
CO
2
Et
N
O
O
C
CO
2
Et
C
O
OEt
EtO
-
Na
+
PRZYKŁADY
N
O
O
C
COOEt
COOEt
CH
2
COOEt
Br CH
2
COOEt
HCl
N
O
O
C
CO
O
CO
O
CH
2
COO
COOH
COOH
+
CH
H
3
N
COOH
CH
2
COOH
Cl
NaOH
CHLOROWODOREK KWASU
DL
-ASPARAGINOWEGO
L-
AMINOKWASY
OTRZYMYWANIE
PRZYKŁADY
Z WYKORZYSTANIEM FTALIMIDKU POTASU I BROMOMALONIANU
NH
O
O
N
O
O
C
CO
2
Et
CO
2
Et
N
O
O
C
CO
2
Et
C
O
OEt
1. KOH
2.
BrCH(CO
2
Et)
2
3. EtO
-
Na
+
(CH
3
)
2
CH–Br
1. NaOH
2. HCl
COOH
COOH
+
CH
H
3
N
COOH
CH(CH
3
)
2
Cl
CHLOROWODOREK DL-WALINY
CH
2
Cl
N
O
O
C
COOEt
COOEt
CH
2
1. NaOH
2. HCl
COOH
COOH
+
CH
CH
2
COOH
NH
3
Cl
CHLOROWODOREK DL-FENYLOANILINY
N
O
O
C
COOEt
COOEt
CH(CH
3
)
2
5
L-
AMINOKWASY
REAKCJE
REAKCJE Z NINHYDRYNĄ
OH
O
O
OH
2
+
N
O
O
O
O
R CH
NH
3
COO
+ RCHO + CO
2
+ 3H
2
O + H
+
REAKCJE Z ALKOHOLAMI
R CH
NH
3
COO
+
R'OH
H
+
∆
+ H
2
O
R CH
NH
3
COO
R'
REAKCJE Z CZYNNIKAMI ACYUJĄCYMI
R CH
NH
COO
O
C R'
+ Cl
TEA
+
R CH
NH
3
COO
R'
C
O
Cl
lub
OH
-
1° GRPA AMINOWA
ANION O BARWIE
FIOLETOWEJ
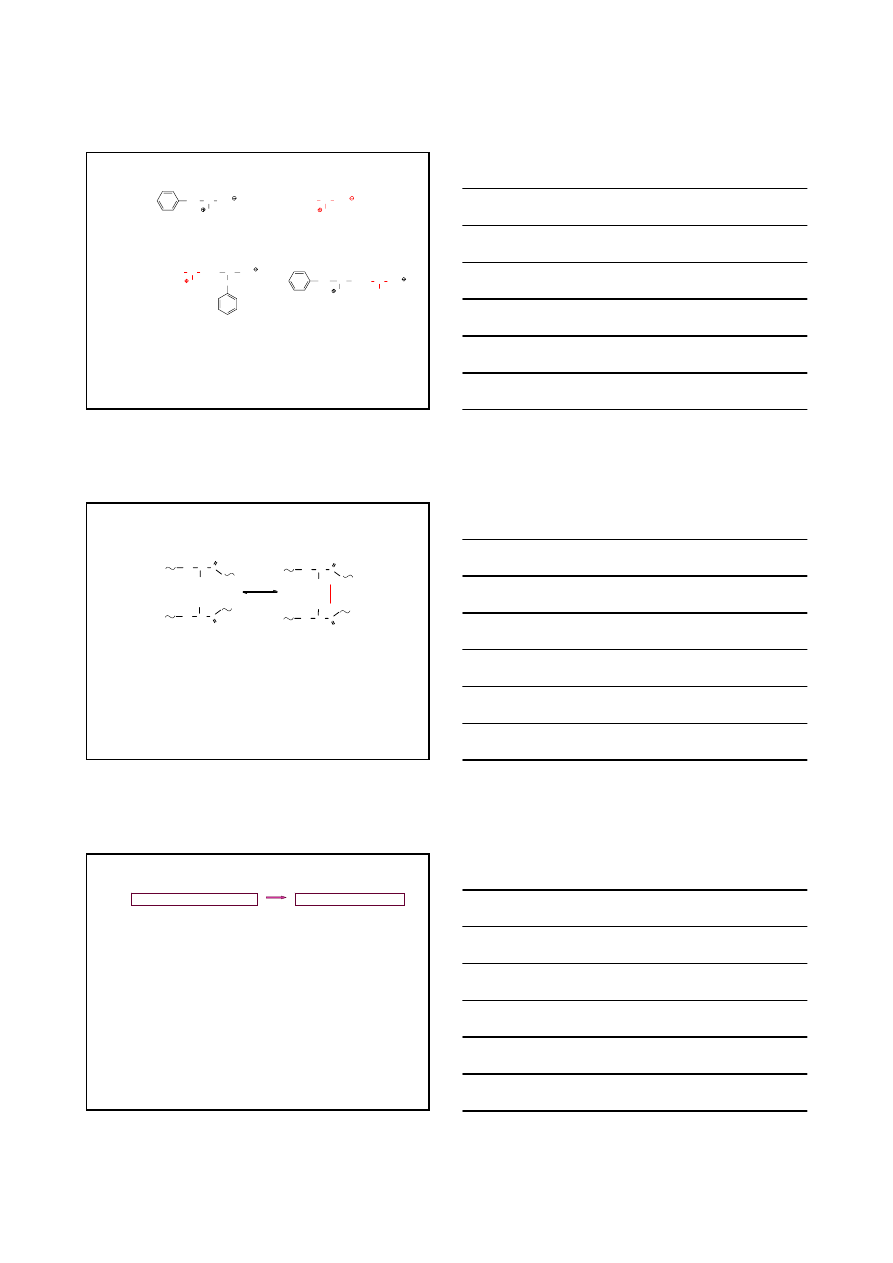
PEPTYDY
– atom węgla
– atom tlenu
– atom azotu
– atom wodoru
ŁAŃCUCH BOCZNY
PEPTYDY
H
3
N CH
2
CO
NH CH CO
NH CH
CH
2
CH
3
COO
GLICYLO
FENYLOALANYLO
ALANINA
TRIPEPTYD
aminokawas
C-terminalny
aminokawas
N-terminalny
Gly
Phe
Ala
6
PEPTYDY
CH
2
CH
NH
3
COO
(CH
3
)
2
CH CH
NH
3
COO
CO
NH CH
CH(CH
3
)
2
COO
CH
CH
2
NH
3
(CH
3
)
2
CH CH
NH
3
CO
NH CH COO
CH
2
FENYLOALANINA
WALINA
WALILO
FENYLOALANINA
FENYLOALANYLO
WALINA
DLA DWÓCH AMINOKWASÓW ISTNIEJĄ DWIE MOŻLIWE STRUKTURY DIPEPTYDU:
PEPTYDY
O
C
CH
NH
CH
2
SH
O
C
CH
NH
CH
2
SH
UTLENIANIE
REDUKCJA
O
C
CH
NH
CH
2
S
CH
2
S
NH CH C
O
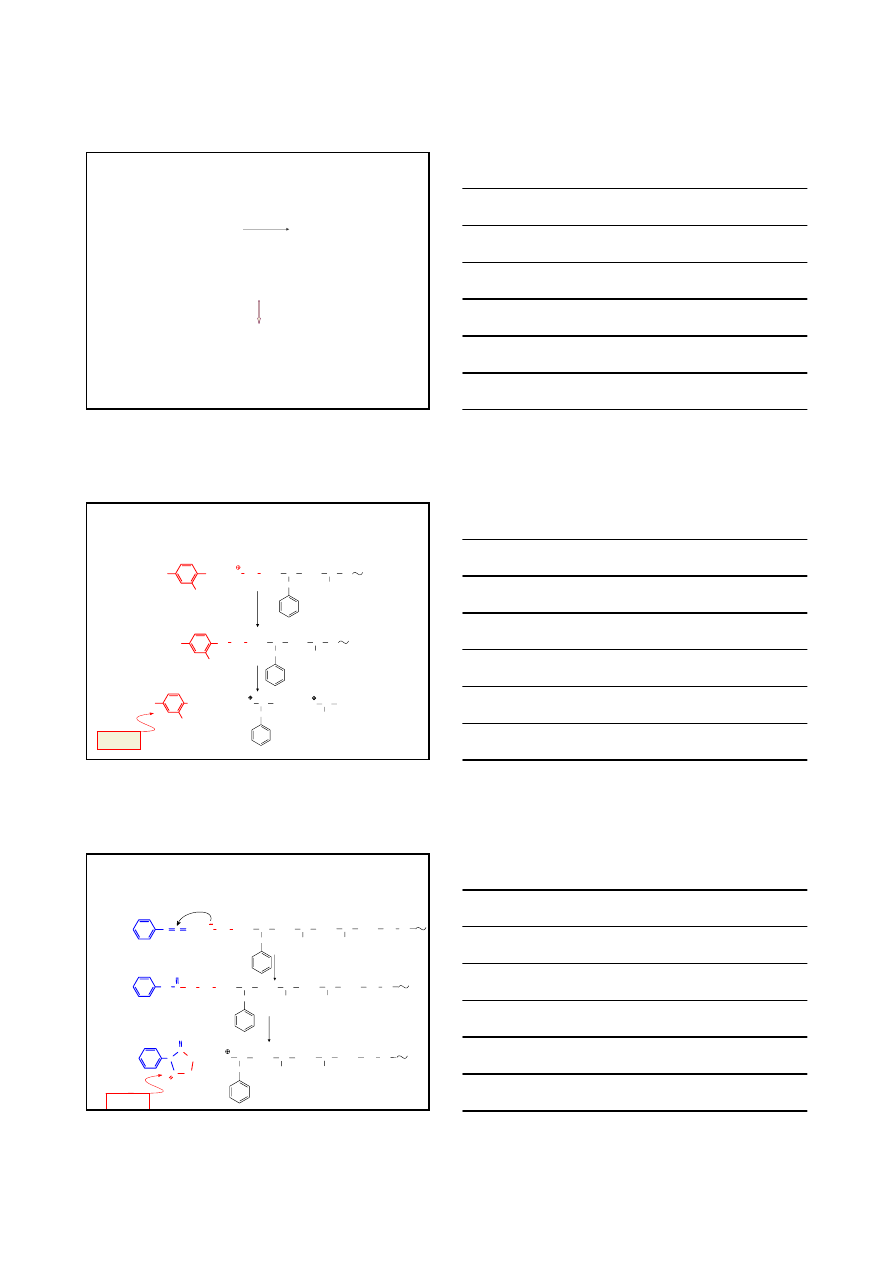
ANALIZA STRUKTURY PEPTYDÓW I BIAŁEK
STRUKTURA PIERWSZORZĘDOWA
SEKWENCJA AMINOKWASÓW
jakie aminokwasy wchodzą w skład badanej cząsteczki peptydu
jaki jest wzajemny stosunek reszt aminokwasowych
w jakiej kolejności występują reszty aminokwasowe w łańcuchu
7
ANALIZA STRUKTURY PEPTYDÓW I BIAŁEK
1.
HYDROLIZA CAŁKOWITA W WARUNKACH KATALIZY KWASOWEJ
GlyLeuAlaValAlaPheGlyAla
2 Gly + Leu + 3 Ala + Val + Phe
HCl
∆
oktapeptyd
2.
HYDROLIZA CZĘŚCIOWA W WARUNKACH KATALIZY KWASOWEJ
Glu – Cys + Cys – Gly + Gly + Glu + Cys
tripeptyd
Glu – Cys – Gly
ANALIZA STRUKTURY PEPTYDÓW I BIAŁEK
3.
USTALANIE
N-TERMINALNEGO
AMINOKWASU W PEPTYDZIE – METODA SANGERA
H
3
N CH
2
CO
NH CH CONH CH
CH
2
CH
3
CO
F
NO
2
O
2
N
+
1-FLUORO-2,4-DINITROBENZEN
POLIPEPTYD
NaHCO
3
HN CH
2
CO
NH CH CONH CH
CH
2
CH
3
CO
NO
2
O
2
N
HCl/
∆
H
3
N CH COOH
CH
2
NHCH
2
COOH
NO
2
O
2
N
H
3
N CH
CH
3
COOH
+
+
+ ......
aminokawas
N-terminalny
Metoda opracowana – 1945r.
Nagroda Nobla – 1958r.
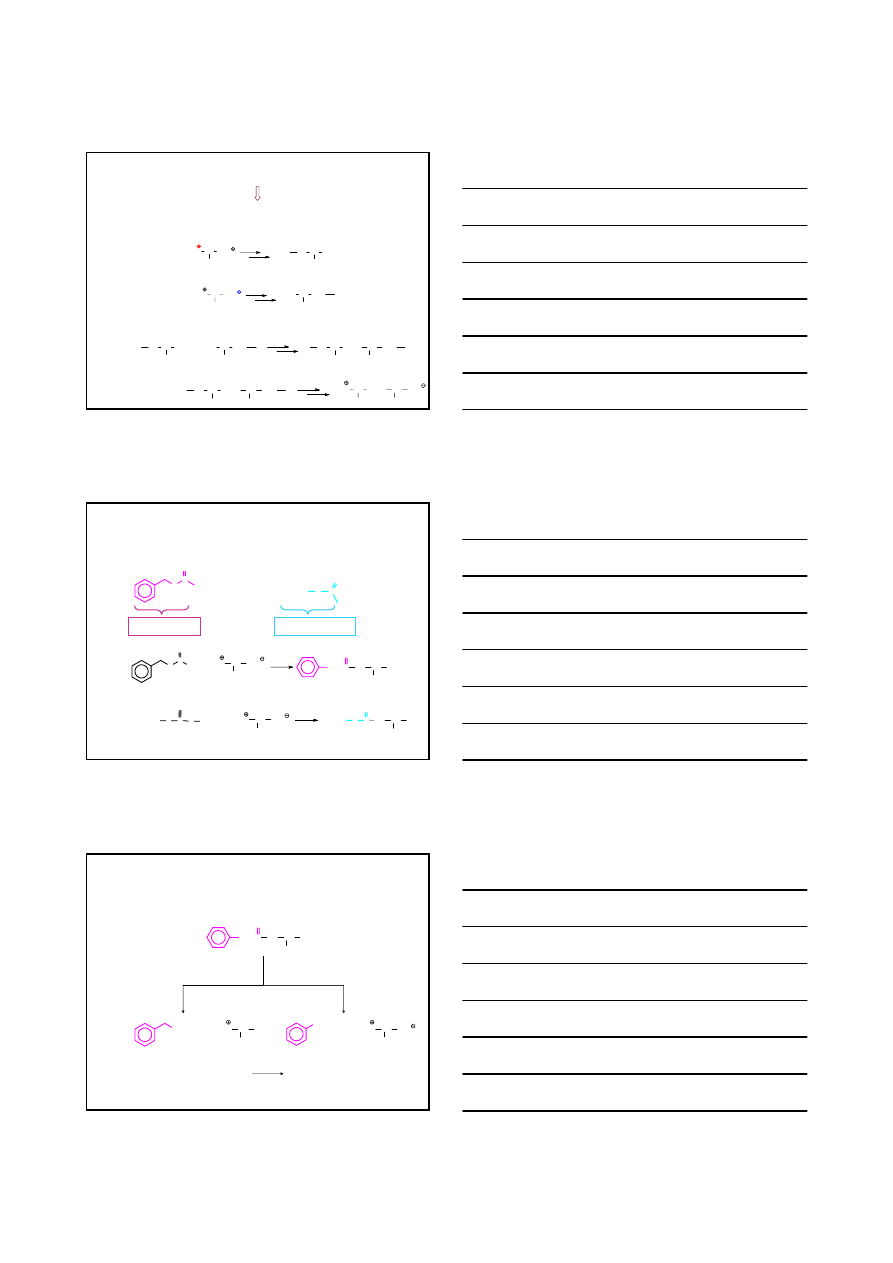
ANALIZA STRUKTURY PEPTYDÓW I BIAŁEK
4.
USTALANIE
N-TERMINALNEGO
AMINOKWASU W PEPTYDZIE
– METODA DEGRADACYJNA EDMANA
N C S
H
2
N CH
2
CO
NH CH CONH CH
CH
2
CH
3
CONH CH
CH(CH
3
)
2
CONH CH
2
CO
+
OH
-
, pH 9
NH C
S
CO
CH
2
CONH
CH(CH
3
)
2
CH
CONH
CH
3
CH
2
CH
CONH
CH
CO
NH
CH
2
NH
H
+
N
C
S
NH
CH
2
C
O
CO
CH
2
CONH
CH(CH
3
)
2
CH
CONH
CH
3
CH
2
CH
CONH
CH
H
3
N
+
TIOIZOCYJANIAN FENYLU
POLIPEPTYD
aminokawas
N-terminalny
POLIPEPTYD KRÓTSZY O JEDEN
AMINOKWAS
8
SYNTEZA PEPTYDÓW
Ala
Gly
AlaAla
AlaGly
GlyAla
GlyGly
1.
ZABEZPIECZENIE GRUPY AMINOWEJ
–NH
2
AMINOKWASU N-TERMINALNEGO
2.
ZABEZPIECZENIE GRUPY KARBOKSYLOWEJ
–CO
2
H
AMINOKWASU C-TERMINALNEGO
3.
AKTYWACJA GRUPY KARBOKSYLOWEJ –CO
2
H AMINOKWASU N-TERMINALNEGO –
TWORZENIE WIĄZANIA PEPTYDOWEGO
4.
USUNIĘCIE GRUP BLOKUJĄCYCH
STRATEGIA SYNTEZY PEPTYDÓW
H
3
N
CH
R
COO
HN
CH
R
COOH
B
1
H
2
N CH
R
COO
B
2
H
3
N CH
R
COO
H
2
N CH
R
COO
B
2
HN
CH
R
COOH
B
1
HN
CH
R
CONH
B
1
CH
COO
R
B
2
+
HN
CH
R
CONH
B
1
CH
COO
R
B
2
H
3
N
CH
R
CONH CH
COO
R
STRATEGIA SYNTEZY PEPTYDÓW
1.
ZABEZPIECZENIE GRUPY AMINOWEJ
–NH
2
AMINOKWASU N-TERMINALNEGO
GRUPY BLOKUJĄCE TYPU URETANOWEGO
CHLOROMRÓWCZAN
BENZYLU
GRUPA BENZYLOKSY-
KARBONYLOWA, Z–
O
C
O
GRUPA tert-BUTYLOKSY-
KARBONYLOWA, Boc–
(CH
3
)
3
C O C
O
O
Cl
C
O
+ H
3
N CH COO
CH
3
OH
-
NH CH COOH
CH
3
CH
2
OC
O
N
– BENZYLOKSY-
KARBONYLOALANINA
(CH
3
)
3
C O C
O
O C(CH
3
)
3
H
3
N CH COO
CH(CH
3
)
2
+
(CH
3
)
3
C O C
O
CH(CH
3
)
2
COOH
CH
NH
WĘGLAN DI- tert-BUTYLU
N
–tert- BUTYLOKSY-
KARBONYLOWALINA
STRATEGIA SYNTEZY PEPTYDÓW
1.
ZABEZPIECZENIE GRUPY AMINOWEJ
–NH
2
AMINOKWASU N-TERMINALNEGO
USUWANIE GRUP BLOKUJĄYCH TYPU URETANOWEGO – BENZYLOKSYKARBONYLOWEJ
NH CH COOH
R
CH
2
OC
O
HBr/AcOH
H
2
, Pd/C
Br +
CO
2
+ H
3
N CH COOH
CH
3
CZYLI
Z – Ala + H
2
PhCH
3
+ CO
2
+ Ala
Pd/C
Z
– Ala
CH
3
+
CO
2
+ H
3
N CH COO
CH
3
9
STRATEGIA SYNTEZY PEPTYDÓW
1.
ZABEZPIECZENIE GRUPY AMINOWEJ
–NH
2
AMINOKWASU N-TERMINALNEGO
USUWANIE GRUP BLOKUJĄYCH TYPU URETANOWEGO – tert-BUTYLOKSYKARBONYLOWEJ
(CH
3
)
3
C O C
O
CH(CH
3
)
2
COOH
CH
NH
Boc
–Val
HCl/eter
lub
CF
3
COOH
+
CO
2
+
CH(CH
3
)
2
COOH
CH
H
3
N
CZYLI
Boc – Val + CF
3
COOH (CH
3
)
2
C=CH
2
+ CO
2
+ Val
2.
ZABEZPIECZENIE GRUPY KARBOKSYLOWEJ
–CO
2
H
AMINOKWASU
C-TERMINALNEGO
STRATEGIA SYNTEZY PEPTYDÓW
H
3
N CH
COO
R
+
CH
3
OH
SOCl
2
Cl H
3
N CH
COOCH
3
R
INNE ESTRY:
BENZYLOWE, ETYLOWE, tert-BUTYLOWE
USUWANIE ESTRÓW:
H
3
N CH
COO
CH
2
Ph
+
CH
3
OH
SOCl
2
Cl H
3
N CH
COOCH
3
CH
2
Ph
1. NaOH
2. H
+
Cl H
3
N CH
COOH
CH
2
Ph
H
3
N CH COOC(CH
3
)
3
CH(CH
3
)
2
CF
3
COOH
CF
3
COO H
3
N CH COOH
CH(CH
3
)
2
H
2
, Pd/C
H
2
N CH COOCH
2
CH
2
CH(CH
3
)
2
H
3
N CH COO
CH
2
CH(CH
3
)
2
+
CH
3
HCl
× Phe
OMe
HCl
× Val
OtBu
LeuOBzl
ACYDOLIZA
WODOROLIZA
3.
AKTYWACJA GRUPY KARBOKSYLOWEJ –CO
2
H AMINOKWASU
N-TERMINALNEGO – TWORZENIE WIĄZANIA PEPTYDOWEGO
STRATEGIA SYNTEZY PEPTYDÓW
RODZAJE AKTYWACJI GRUPY KARBOKSYLOWEJ:
CHLORKI KWASOWE
MIESZANE BEZWODNIKI
ESTRY AKTYWNE
METODA DICYKLOHEKSYLOKARBODIIMIDOWA (DCCI)
DCCI
Z – Ala
+ H
2
N CH COOCH
2
CH
2
CH(CH
3
)
2
NH CH COOH
CH
3
CH
2
OC
O
LeuOBzl
Z – AlaLeuOBzl
NH CH CONH
CH
3
CH
2
OC
O
CH
2
CH(CH
3
)
2
COOCH
2
CH
10
4.
USUNIĘCIE GRUP BLOKUJĄCYCH
STRATEGIA SYNTEZY PEPTYDÓW
Z – AlaLeuOBzl
NH CH CONH
CH
3
CH
2
OC
O
CH
2
CH(CH
3
)
2
COOCH
2
CH
H
2
,
Pd/C
H
3
N CH CONH
CH
3
CH
2
CH(CH
3
)
2
COO
CH
AlaLeu
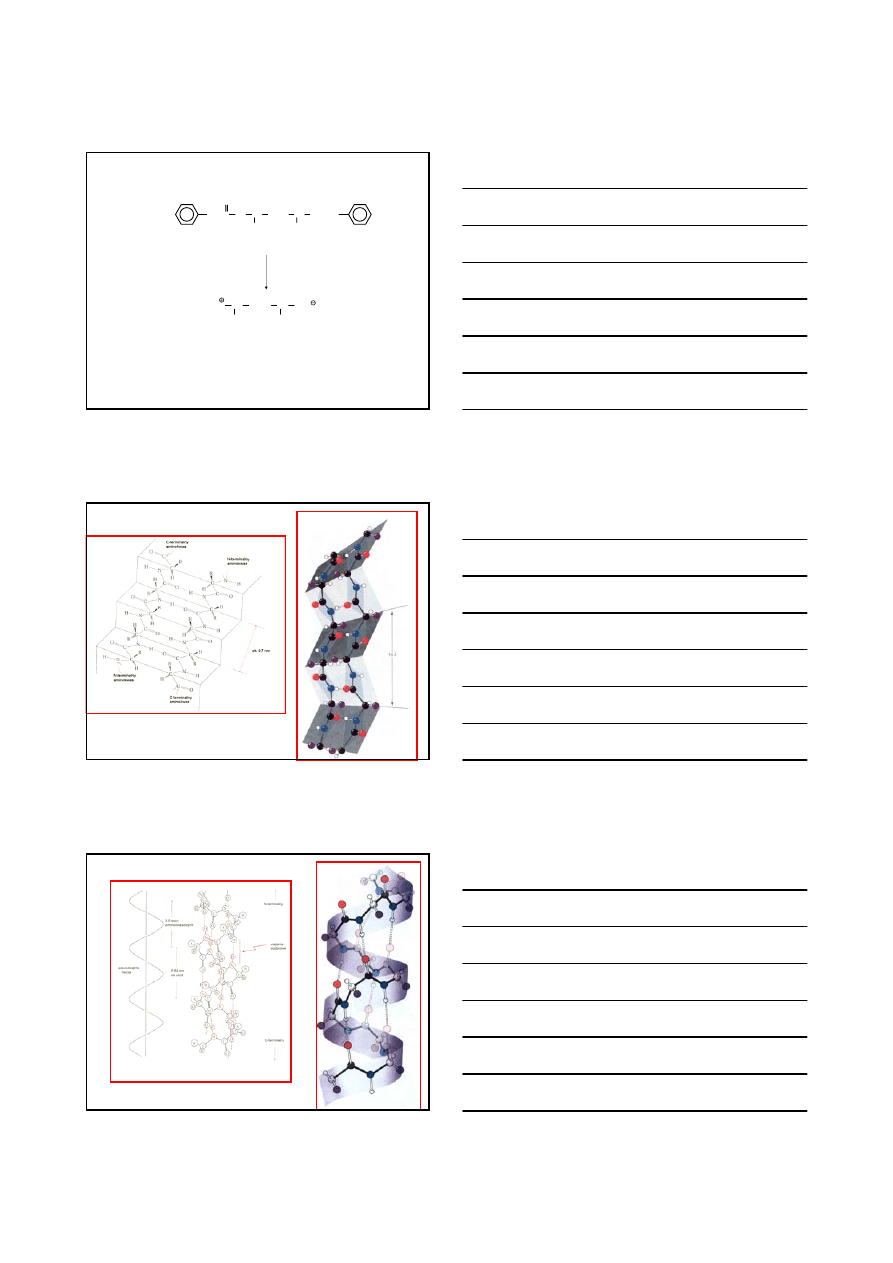
BIAŁKA
Struktura harmonijkowa (struktura
β)
proponowana przez L. Paulinga dla fibroiny jedwabiu
BIAŁKA
Struktura
α-helisy
zaproponowana przez L. Paulinga dla
α-keratyny
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykl Nieznany (2)
Chemia organiczna W 8 id 112721 Nieznany
Chemia organiczna podstawy wykład1
chemia organiczna id 112638 Nieznany
Chemia organiczna podstawy wykład5
Chemia organiczna Biotech 2013 Nieznany
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna 2 id 112634 Nieznany
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
chemia organiczna(1) id 112729 Nieznany
więcej podobnych podstron