1
ROPA NAFTOWA
gaz ziemny
≤ 20°C
C
1
– C
4
benzyna lekka
30 - 200
°C
C
5
– C
11
nafta
200 - 300
°C
C
12
– C
15
olej napędowy
300 - 400
°C
C
15
– C
25
pozostałość o temp. wrzenia > 400°C
DESTYLACJA POD ZMNIEJSZONYM CIŚNIENIEM
OLEJE SMAROWE
WOSKI
ASFALT
RAFINACJA – kolumnowa destylacja frakcyjna prowadzona do temperatury 400
°C
LICZBA OKTANOWA – miara jakości paliwa
CH
3
C
CH
3
CH
3
CH
2
CH CH
3
CH
3
CH
3
(CH
2
)
5
CH
3
(n-heptan)
L.O. = 0
2.2.4-trimetylopentan
L.O. = 100
L.O. = 95
Paliwo o takich właściwościach przeciwstukowych
jak mieszanina składająca się z
5% n-heptanu
oraz
95% 2.2.4-trimetylopentanu
OGÓLNIE
węglowodory o łańcuchach prostych – niskie L.O.
węglowodory o łańcuchach rozgałęzionych – wyższe L.O.
KRAKING KATALITYCZNY – rozpad cząsteczek większych alkanów na dwie
mniejsze cząsteczki (najczęściej alkanu i alkenu) pod działaniem temperatury 400 -
500
°C w obecności katalizatora
ROPA NAFTOWA
NAFTA, CIĘŻKIE OLEJE, MAZUT
C
10
H
22
C
5
H
12
+
C
5
H
10
C
3
H
8
+
C
4
H
8
+
C
3
H
6
C
4
H
10
+
C
6
H
12
C
2
H
6
+
C
4
H
8
+
C
4
H
8
alkan
alken
WĘGLOWODORY C
3
– C
5
KATALIZATORY: SiO2 + Al2O3
lub krzemiany Al, Mg, Zr
2
WĘGLOWODORY C
3
– C
5
ROPA NAFTOWA
KATALITYCZNE REKOMBINOWANIE
IZOMERYZACJA
C
4
H
10
+
C
4
H
8
C
2
H
6
+
C
4
H
8
C
8
H
18
C
6
H
14
kat.
kat.
CH
3
CH
2
CH
2
CH
3
AlCl
3
, HCl
Al
2
O
3
CH
3
CH CH
3
CH
3
REFORMING KATALITYCZNY – tzw. aromatyzacja; polega na cyklizacji n-alkanów, a
następnie odwodornieniu do arenów w obecności katalizatora
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
CH
3
-H
2
, Pt
-3H
2
, Pt
CH
3
n
-heptan
metylocykloheksan
toluen
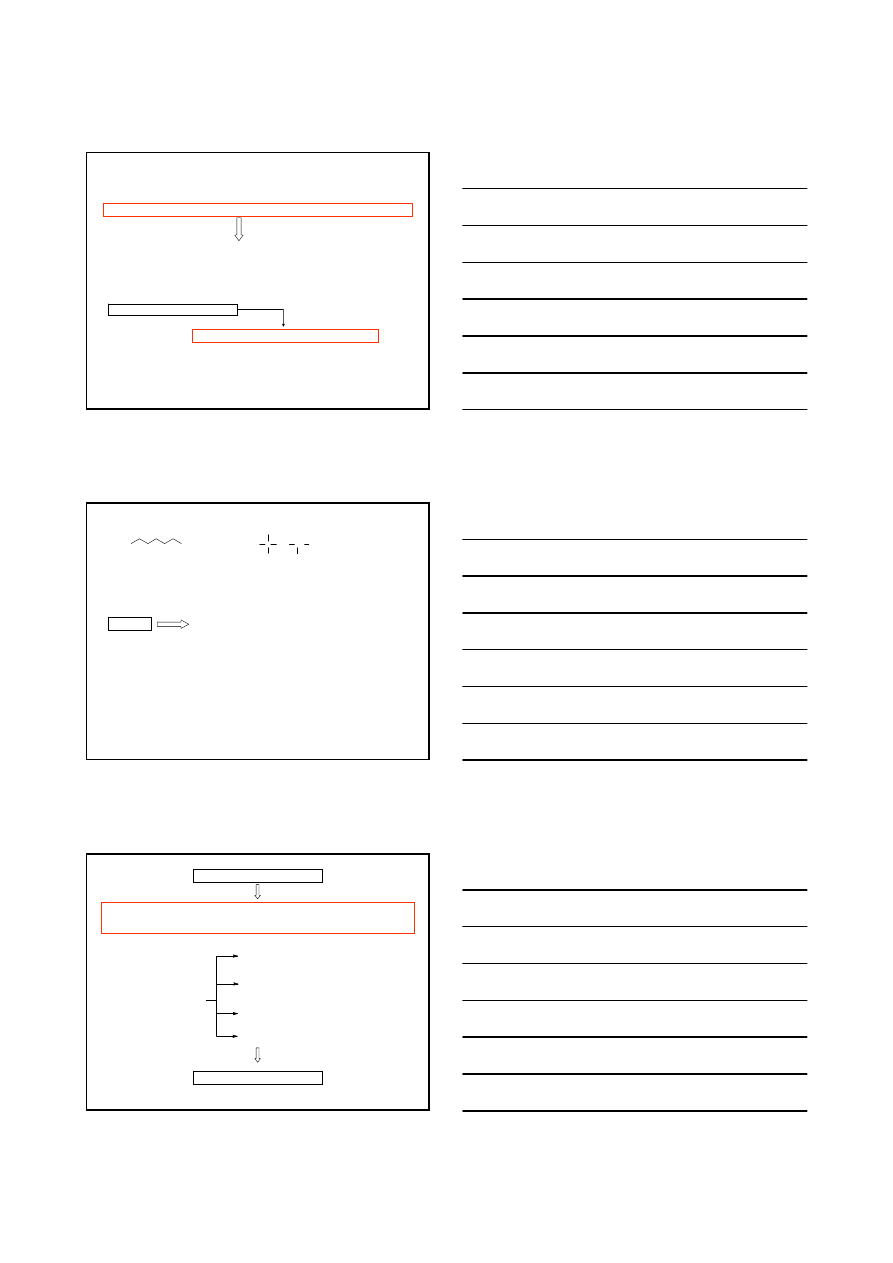
IZOMERIA – IZOMERY KONSTYTUCYJNE I STEREOIZOMERY
C
4
H
10
C
3
H
7
Cl
C
2
H
6
O
CH
3
CH
2
CH
2
CH
3
BUTAN
CH
3
CHCH
3
CH
3
METYLO
PROPAN
CH
3
CH
2
CH
2
Cl
1-
CHLORO
PROPAN
CH
3
CHCH
3
Cl
2-
CHLORO
PROPAN
CH
3
CH
2
OH
ETAN
OL
ETER
DIMETYLOWY
CH
3
O
CH
3
IZOMERY KONSTYTUCYJNE
IZOMERIA – IZOMERY KONSTYTUCYJNE I STEREOIZOMERY
C
2
H
2
Cl
2
C
7
H
14
STEREOIZOMERY
C C
H
Cl
Cl
H
E
-1,2-DI
CHLORO
ETEN
Z
-1,2-DI
CHLORO
ETEN
C C
H
Cl
Cl
H
H
3
C
H
H
CH
3
trans
-1,3-DI
METYLO
CYKLOPENTAN
cis
-1,3-DI
METYLO
CYKLOPENTAN
H
3
C
H
H
CH
3
IZOMERY GEOMETRYCZNE
3
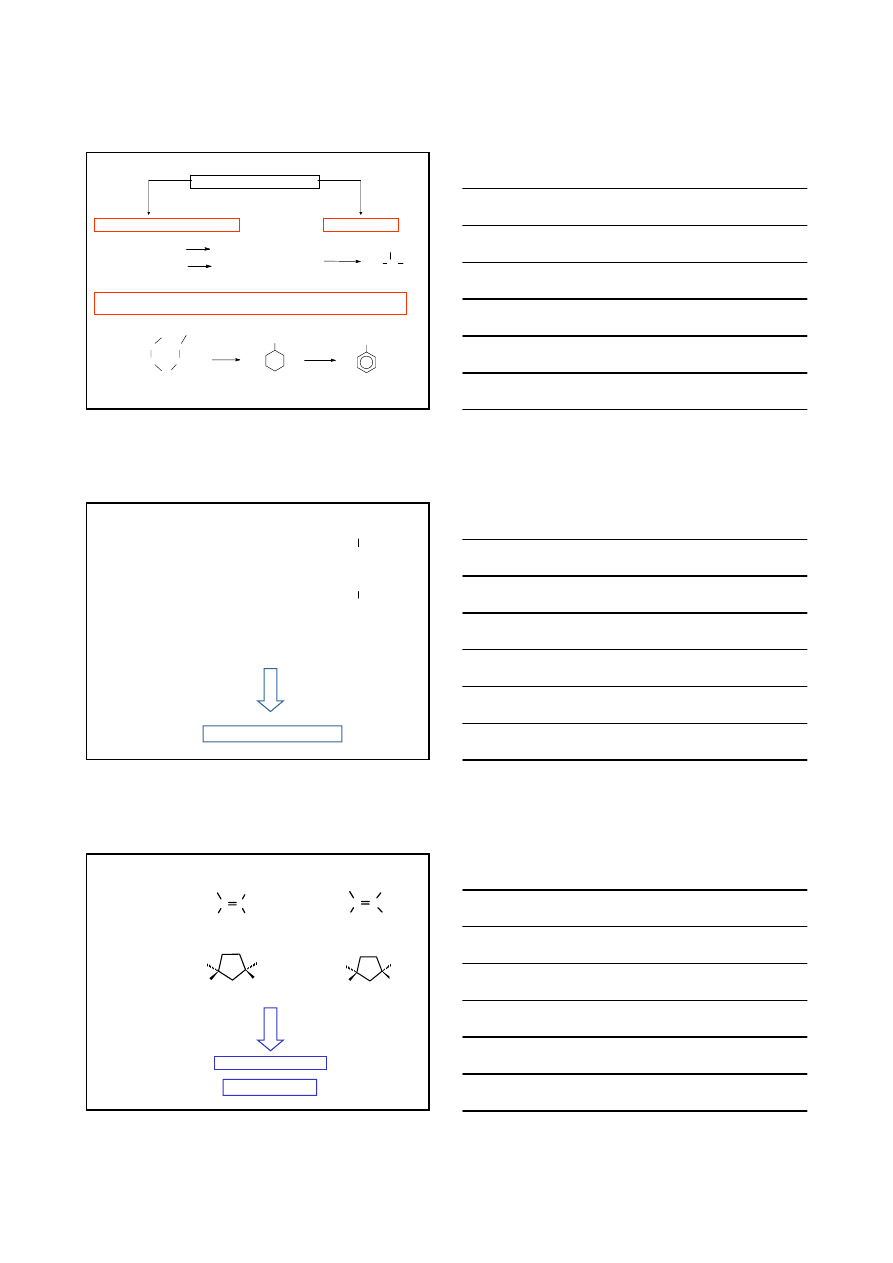
IZOMERY
związki o takim samym
wzorze sumarycznym
IZOMERY KONSTYTUCYJNE
izomery różniące się sposobem
połączenia atomów ze sobą
STEREOIZOMERY
związki o takiej samej konstytucji; różnią się
rozmieszczeniem atomów w przestrzeni
DIASTEREOIZOMERY
stereoizomery nie będące
enancjomerami
ENANCJOMERY
stereoizomery, między którymi
zachodzi relacja przedmiot – jego
odbicie lustrzane
DIASTEREOIZOMERY
stereoizomery nie będące
enancjomerami
ENANCJOMERY
stereoizomery, między którymi
zachodzi relacja przedmiot – jego
odbicie lustrzane
Z-
i E-2-buten
HO
OH
HO
OH
cis-
i trans-1,4-cykloheksanodiol
Cl
Br
F
H
Cl
F
H
Br
IZOMERIA OPTYCZNA
Cl
H
H
H
C
3
Oś symetrii – obrót o kąt n wokół osi n-
krotnej powoduje przekształcenie
cząsteczki w cząsteczkę identyczną
Płaszczyzna symetrii – płaszczyzna, która
przecina przedmiot lub cząsteczkę w ten
sposób, że jedna połowa jest odbiciem
lustrzanym drugiej połowy.
Cl
Br
H
H
σ
Cl
H
H
H
Cl
Br
H
H
4
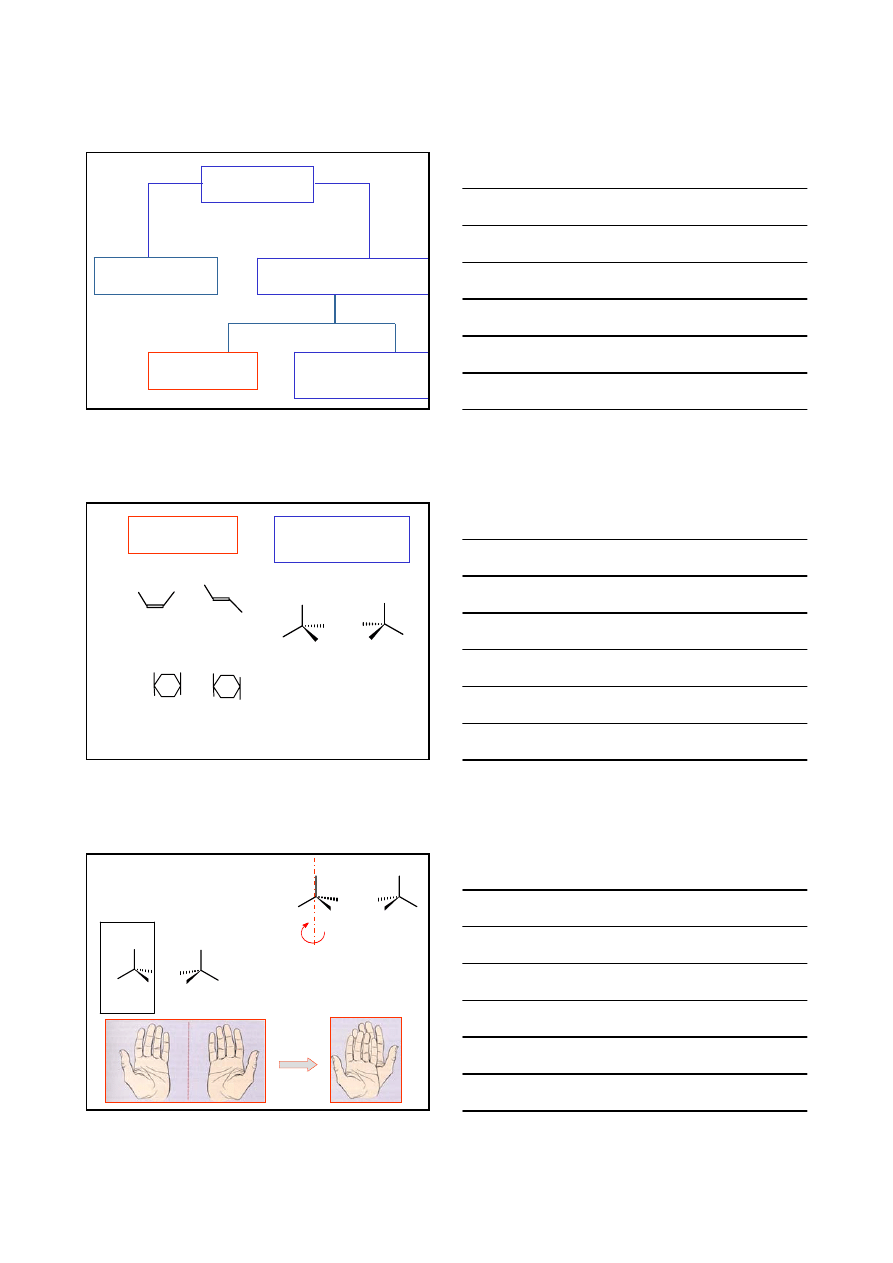
IZOMERIA OPTYCZNA
Cl
Br
I
H
Cl
Br
I
H
lustro
CZĄSTECZKI NIE SĄ IDENTYCZNE
ENANCJOMERY
stereoizomery, między którymi
zachodzi relacja przedmiot – jego
odbicie lustrzane
taki sam wzór sumaryczny
taka sama konstytucja
różne rozmieszczenie atomów przestrzeni
STEREOIZOMERY
CZĄSTECZKI CHIRALNE
IZOMERIA OPTYCZNA
CZĄSTECZKA JEST CHIRALNA WTEDY, GDY NIE POSIADA INWERSYJNEJ OSI
SYMETRII, tzw. NIEWŁAŚCIWEJ
PRZYCZYNY CHIRALNOŚCI CZĄSTECZEK:
* CENTRUM STEREOGENNE dawniej ASYMETRII
* OŚ CHIRALNA
* PŁASZCZYZNA CHIRALNA
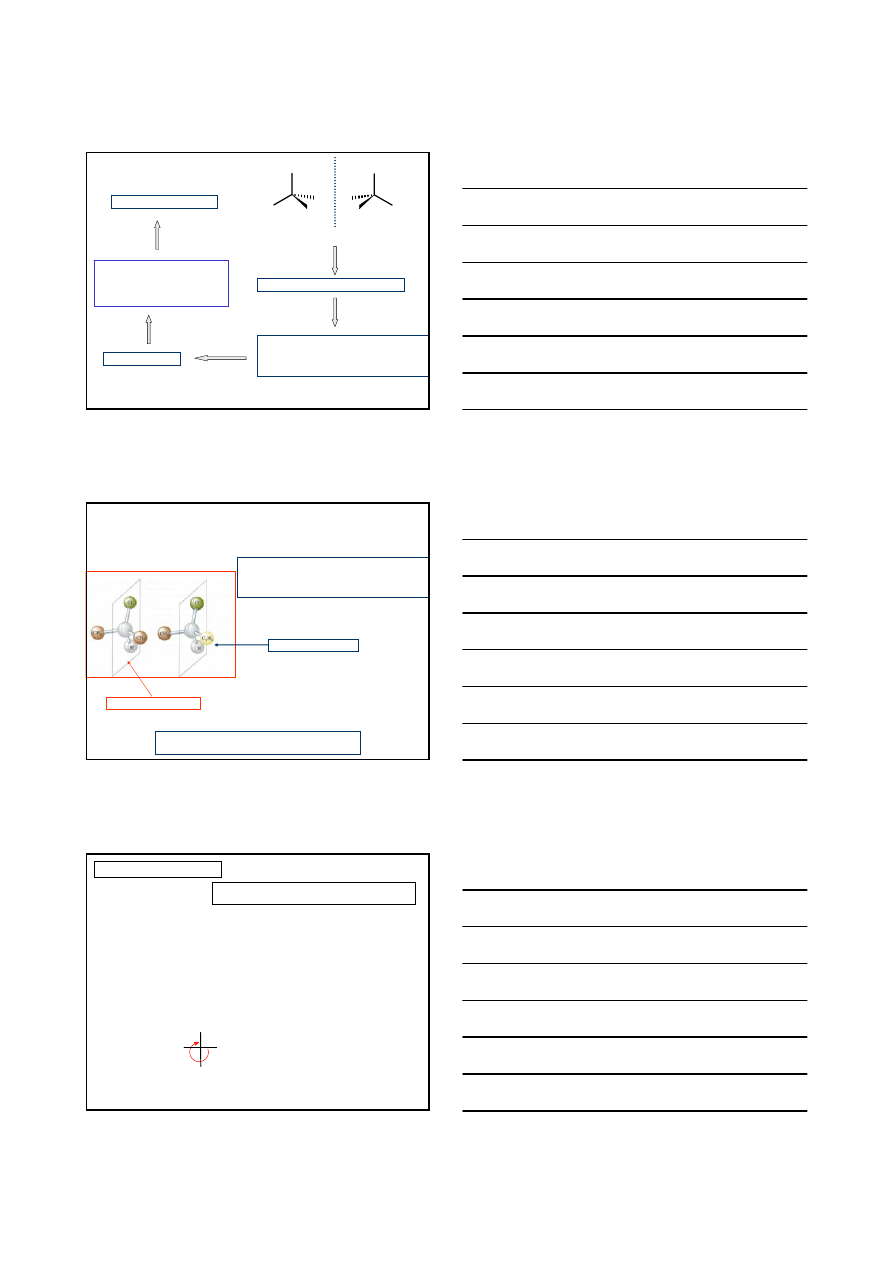
KONFIGURACJA – charakterystyczne dla danego
stereoizomeru rozmieszczenie atomów w przestrzeni
CZĄSTECZKA ACHIRALNA
CZĄSTECZKA CHIRALNA
1960r. Cahn, Ingold i Prelog
uniwersalna metoda przypisywania konfiguracji R/S
każdemu związkowi organicznemu
Reguły pierwszeństwa podstawników:
I
> Br > Cl > OH > CH
3
CH
2
> CH
3
> D > H > :
2.
Jeżeli nie można ustalić pierwszeństwa podstawników w oparciu o regułę 1, to należy w
analogiczny sposób rozpatrywać następne atomy, np. chlorek sec-butylu
1.
Jeżeli cztery atomy połączone z centrum stereogennym są różne, to pierwszeństwo
zależy od liczby masowej atomu połączonego z centrum stereogennym; im większa
liczba masowa, tym starszy podstawnik, np.:
4
3
2
1
Cl >
CH
3
CH
2
> CH
3
> H
C(H,H,H) <
C(C,H,H)
Cl > CH
3
,
CH
3
CH
2
> H
CH
2
CH
3
H
Cl
H
3
C
chlorek (S)-2-butylu
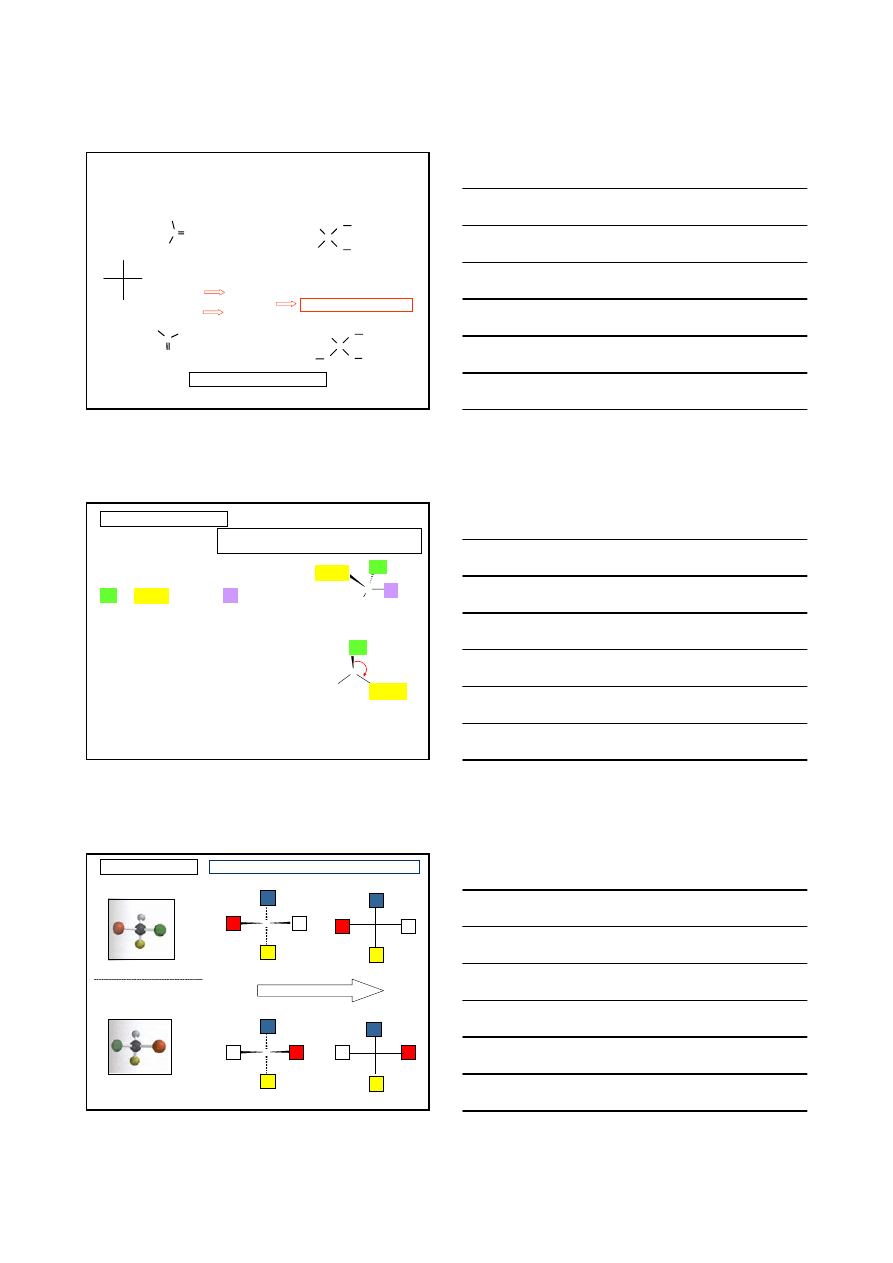
5
Reguły pierwszeństwa podstawników:
3.
W przypadku podstawników z wiązaniami wielokrotnymi, atomy połączone takim
wiązaniem rozpatruje się jako podwojone lub potrojone
C O
rozpatrujemy jako
HO >
CHO, CH
2
OH
> H
CHO
CH
2
OH
OH
H
CHO C(O,O,H)
CH
2
OH C(O,H,H)
HO >
CHO
>
CH
2
OH
> H
C
O
OH
rozpatrujemy jako
C
O
O
O C
C
H
C
O
O C
C
COOH > CHO > CH
2
OH
1960r. Cahn, Ingold i Prelog
uniwersalna metoda przypisywania konfiguracji
R/S
każdemu związkowi organicznemu
uporządkowanie podstawników powiązanych z
centrum stereogenicznym zgodnie ze starszeństwem
zorientowanie cząsteczki tak, aby podstawnik najmłodszy był
najbardziej oddalony od obserwatora
zatoczyć łuk od podstawnika najstarszego poprzez
średni do młodszego
±
łuk zgodny z ruchem wskazówek zegara – konfiguracja
R
±
łuk niezgodny z ruchem wskazówek zegara – konfiguracja
S
C
CH
3
CH
2
OH
H
H
3
C
H
CH
3
CH
2
H
3
C
OH
HO
CH
3
CH
2
CH
3
H
>
>
>
C
H
3
C
OH
CH
2
CH
3
R
C
H
F
Cl
Br
F
H
Br
Cl
C
H
F
Cl
Br
F
H
Br
Cl
F
H
Br
Cl
F
H
Br
Cl
1902r. Emil Fischer
RZUTOWANIE NA PŁASZCZYZNĘ
projekcja asymetrycznego atomu węgla na płaszczyźnie
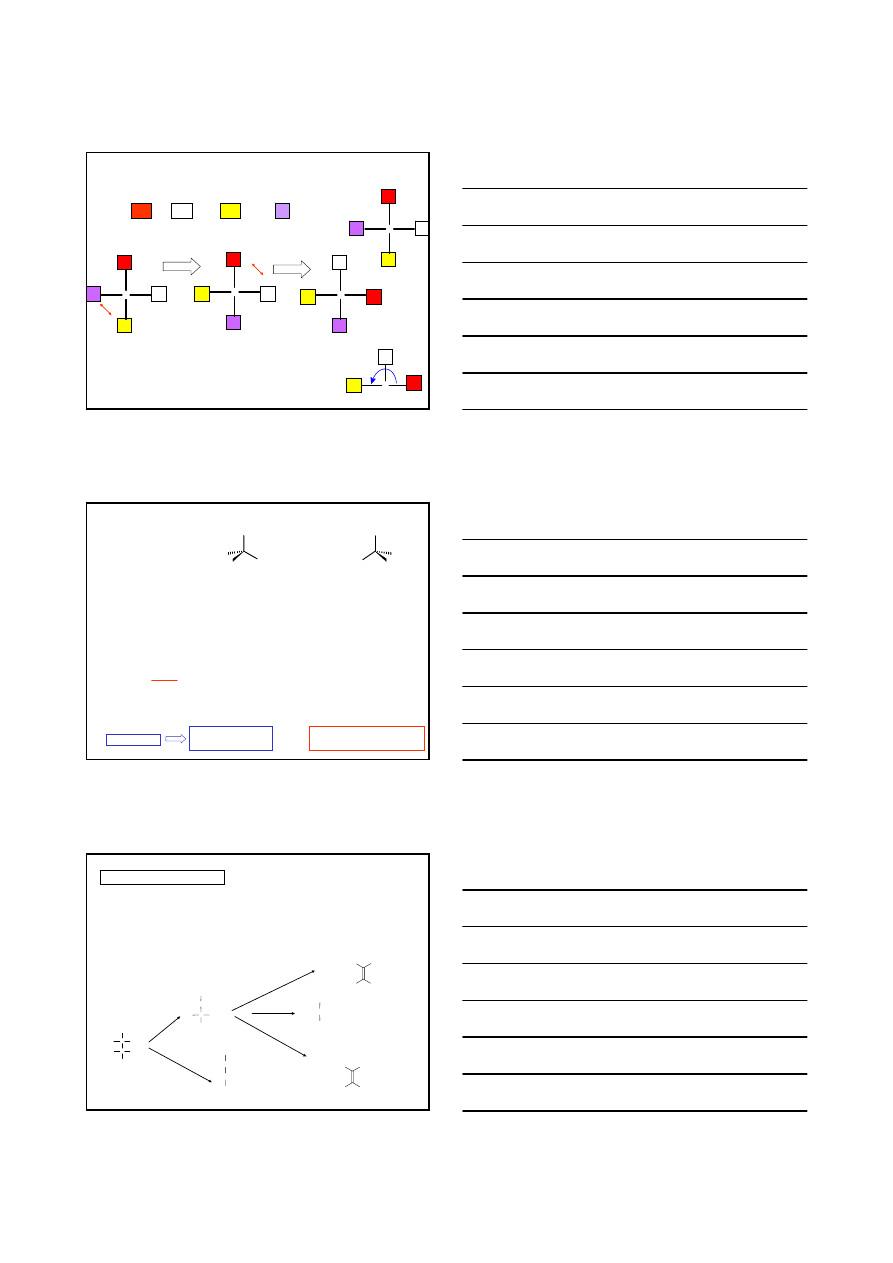
6
uporządkowanie podstawników powiązanych z centrum stereogenicznym zgodnie
ze starszeństwem
parzysta liczba zmian podstawników tak, aby podstawnik
najmłodszy zajmował pozycję w dole wzoru
zatoczyć łuk od podstawnika najstarszego poprzez średni do młodszego
±
łuk zgodny z ruchem wskazówek zegara – konfiguracja
R
±
łuk niezgodny z ruchem wskazówek zegara – konfiguracja
S
H
>
>
>
Br
Cl
F
F
H
Br
Cl
C
F
H
Br
Cl
C
F
H
Br
Cl
C
F
H
Br
Cl
C
1 ZMIANA
2 ZMIANA
C
F
Br
Cl
S
S
IZOMERIA OPTYCZNA – ENANCJOMERY
OH
CH
2
CH
3
H
3
C
H
(R)-2-BUTANOL
(S)-2-BUTANOL
OH
CH
3
H
CH
3
CH
2
TEMP. WRZENIA
99.5°C
99.5°C
GĘSTOŚĆ [g/ml]
0.808
0.808
WSPÓŁ. ZAŁ.
1.397
1.397
SKRĘCALNOŚĆ WŁ.
- 13.52
+ 13.52
[ α ] = α
c
×
l
D
20°C
Gdzie:
α – skręcalność obserwowana
c
– stężenie roztworu badanego [g/ml]
l
– długość drogi światła [dm]
ENANCJOMERY
IDENTYCZNE
WŁAŚCIWOŚCI FIZYCZNE I
CHEMICZNE
RÓŻNE KIERUNKI SKRĘCANIA
PŁASZCYZNY ŚWIATŁA
SPOLARYZOWANEGO KOŁOWO
ALE
Jakub van’t Hoff postulował:
1.
Związki węgla, posiadające asymetryczny atom węgla są chiralne
2.
Pochodne chiralnych związków węgla tracą zdolność skręcania płaszczyzny światła
spolaryzowanego wtedy, gdy zanika asymetria wszystkich atomów węgla
COOH
C
HO
H
C
H
OH
COOH
COOH
CH
2
CH
2
COOH
COOH
CH
2
C
H
OH
COOH
COOH
CH
2
COOH
H
HOOC
H
COOH
COOH
H
H
COOH
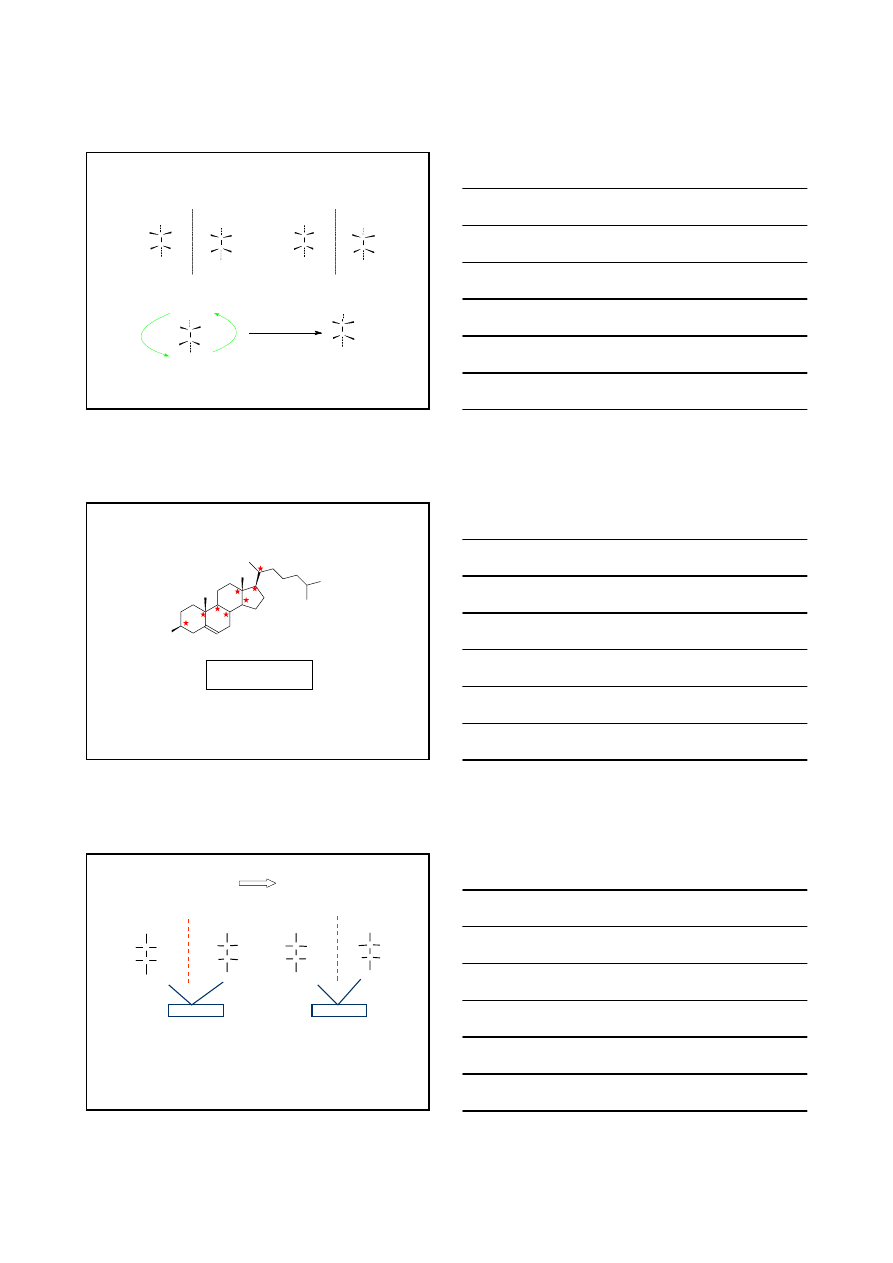
7
3.
Związki posiadające asymetryczne atomy węgla nie muszą być chiralne
COOH
C
HO
H
C
H
OH
COOH
COOH
C
HO
C
H
HO
COOH
H
COOH
C
OH
H
C
H
HO
COOH
COOH
C
OH
C
H
OH
COOH
H
COOH
C
HO
C
H
HO
COOH
H
COOH
C
OH
C
H
OH
COOH
H
obrot o 180°
optycznie czynne
identyczne struktury
forma mezo
n centrów stereogenicznych
2 stereoizomerów
n
cholesterol
2
8
= 256 stereoizomerów
H
3
C
HO
H
3
C
IZOMERIA OPTYCZNA
CH
3
C
H
Br
C
H
Br
CH
2
CH
3
CH
3
C
H
Br
C
H
Br
CH
2
CH
3
S
R
S
CH
3
C
H
Br
C
H
Br
CH
2
CH
3
CH
3
C
H
Br
C
H
Br
CH
2
CH
3
R
S
S
ENANCJOMERY
ENANCJOMERY
IZOMERIA OPTYCZNA
n
– liczba centrów stereogennych
2
n
– maksymalna liczba stereoizomerów
R
R
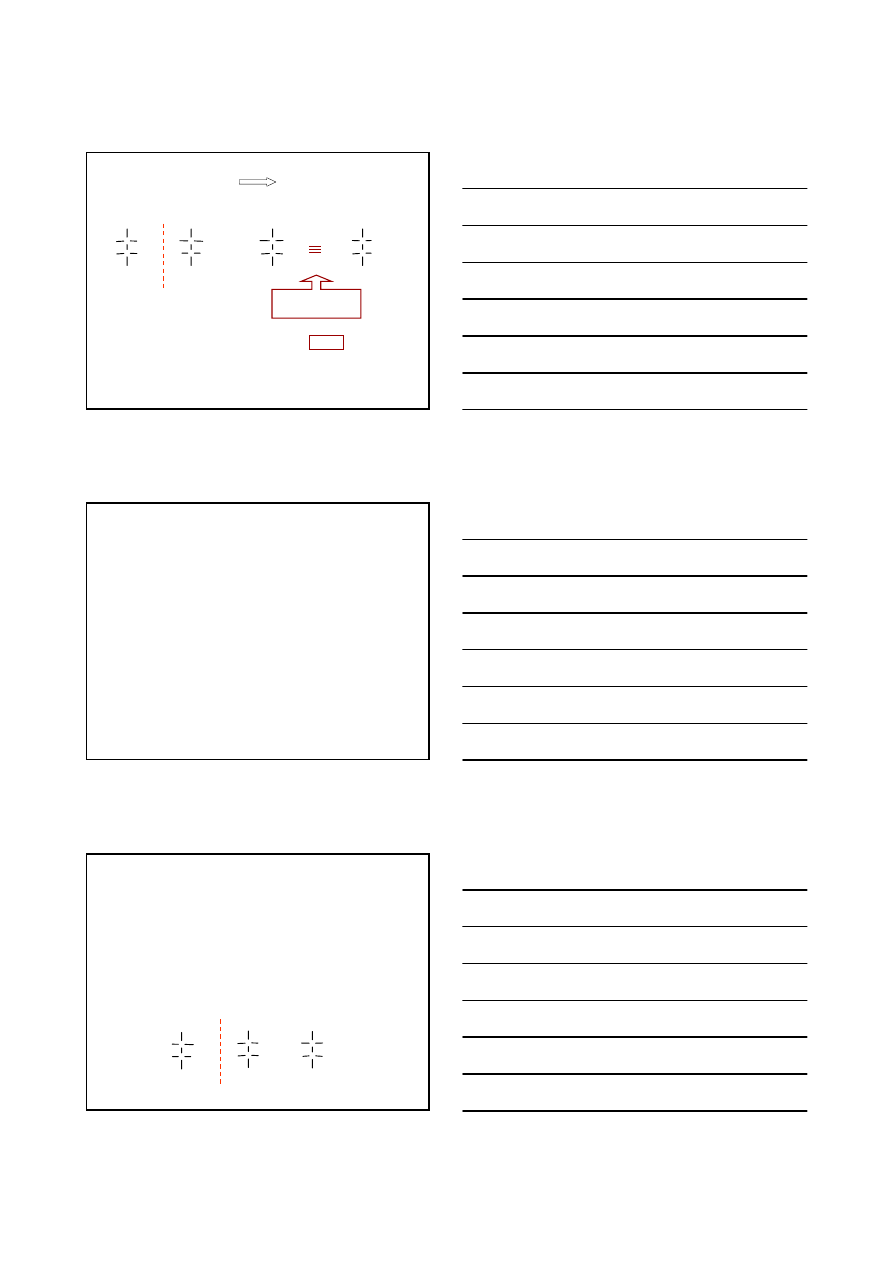
8
IZOMERIA OPTYCZNA
n
– liczba centrów stereogennych
2
n
– maksymalna liczba stereoizomerów
S
R
S
R
STRUKTURY SĄ IDENTYCZNE
PO OBROCIE O 180°
R
R
S
S
mezo-
achiralna
CH
3
C
H
Cl
C
H
Cl
CH
3
CH
3
C
H
Cl
C
H
Cl
CH
3
CH
3
C
H
C
H
CH
3
Cl
Cl
CH
3
C
H
Cl
C
H
Cl
CH
3
IZOMERIA OPTYCZNA
MIESZANINA RACEMICZNA – składa się z jednakowych ilości cząsteczek każdego z
enancjomerów; jest achiralna
powstaje na skutek:
mechanicznego zmieszania czystych enancjomerów
reakcji, np. przyłączanie do wiązań podwójnych halogenowodoru
racemizacji enancjomeru
RACEMAT – związek racemiczny różni się właściwościami fizycznymi od enancjomerów;
siatka krystaliczna racematu składa się z cząsteczek obu enancjomerów
IZOMERIA OPTYCZNA
WŁAŚCIWOŚCI FIZYCZNE KWASÓW WINOWYCH
KWAS
WINOWY
[ α ]
D
20
temp. top.
[°C]
CIĘŻAR WŁ.
ROZPUSZCZALNOŚĆ
w H
2
O [g/100ml]
mezo-
–
140 1
666
120
(–)
- 11.98
170 1
760
147
(+)
+11.98
170 1
760
147
(±)
–
205 1
687
25
COOH
C
H
OH
C
H
HO
COOH
COOH
C
H
HO
C
H
HO
COOH
COOH
C
H
HO
C
H
OH
COOH
mezo-
9
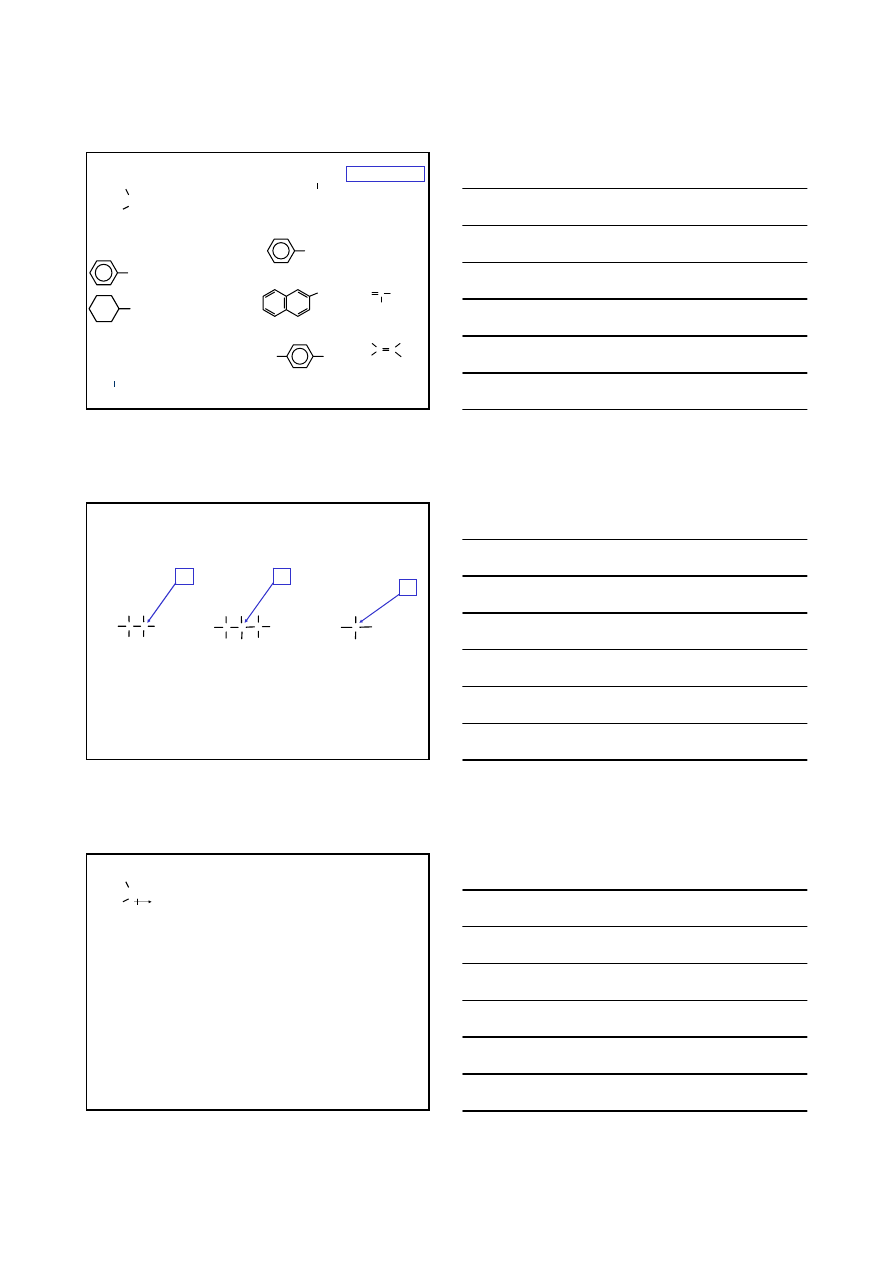
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
HALOGENKI ALKILOWE
HALOGENKI
ARYLOWE
WINYLOWE
– C – X
sp
3
= C – X
sp
2
H
3
C –
I
jodo
metan;
jodek
metylu
bromek
benzylu
CH
2
Br
Cl
chloro
cykloheksan;
chlorek
cykloheksylu
H
2
C=CHCH
2
–
Cl
3-
chloro
-1-propen;
chlorek
allilu
H
3
C–CHCH
2
–
Br
CH
3
1-
bromo
-2-metylopropan
Br
Cl
F
H
3
C
bromo
benzen
p
- fluoro
toluen
2- chloro
naftalen
H
2
C=CH–
Cl
chloro
eten;
chlorek
winylu
CH
3
CH C CH
2
CH
3
Br
3-bromo
-2-penten
C C
CH
3
Cl
H
3
C
H
(E)
-2-chloro
-2-buten
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
H C
H
H
C
H
H
Cl
1°
chlorek 1°
chlorek
etylu
H C
H
H
C
H
C
Cl
H
H
H
2°
chlorek 2°
2-chloro
propan
H
3
C
C
CH
3
Cl
CH
3
3°
chlorek 3°
chlorek
tert-
butylu
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
– C –– X
sp
3
+δ
−δ
DŁUGOŚĆ WIĄZANIA WĘGIEL – HALOGEN
CH
3
– F
1.39 Å
CH
3
– Cl
1.78 Å
CH
3
– Br
1.93 Å
CH
3
– I
2.14 Å
10
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
WŁAŚCIWOŚCI FIZYCZNE:
stan skupienia w temp. pokojowej – ciecze; z wyjątkiem CH
3
Cl i CH
3
Br, które są gazami
temp. wrzenia: CH
3
l > CH
3
Br > CH
3
Cl > CH
3
F
wrażliwe na światło – pod wpływem światła często ulegają rozkładowi
nie rozpuszczają się w wodzie:
chloroalkany – lżejsze od wody
bromo– i jodoalkany – cięższe od wody
lotne halogenoalkany są lakrymatorami
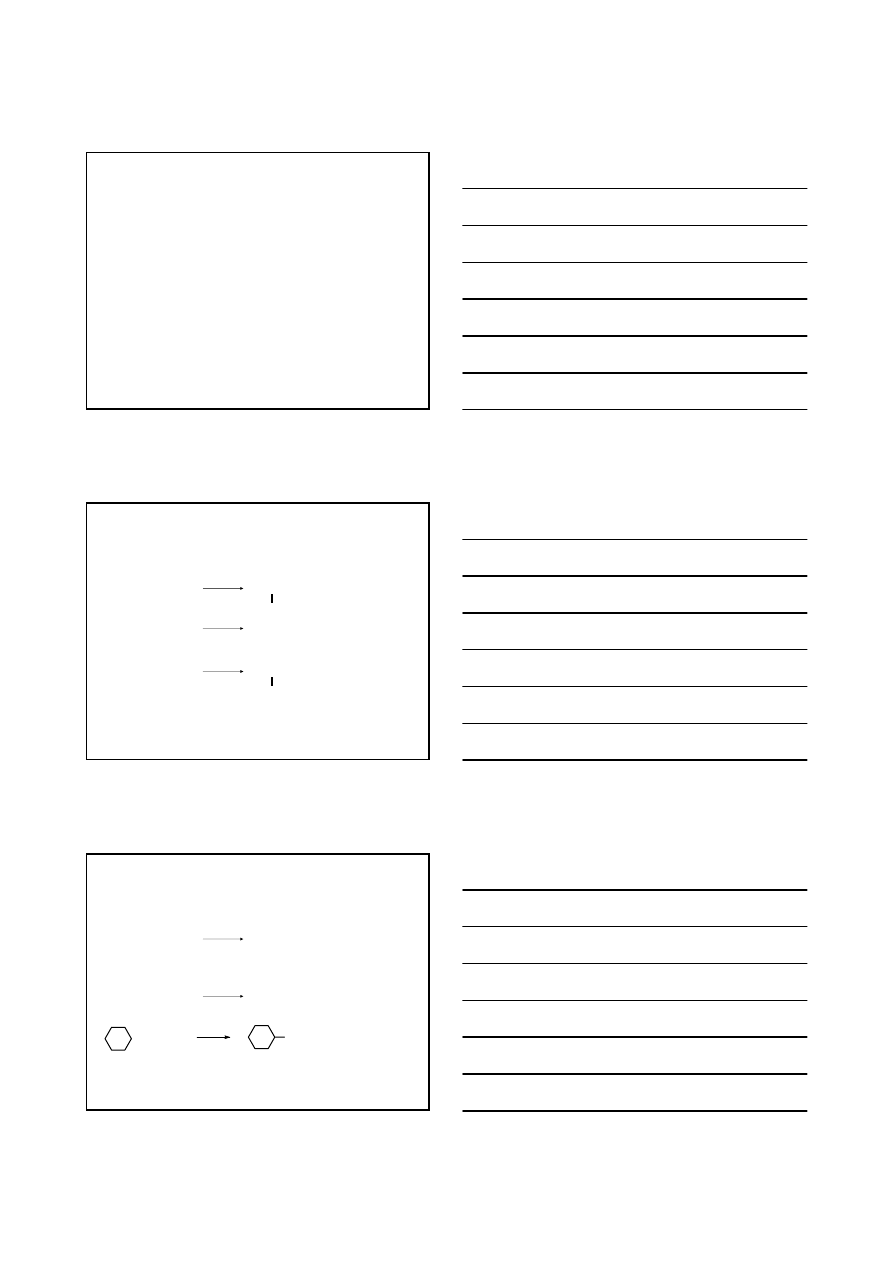
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
OTRZYMYWANIE
REAKCJE PRZYŁĄCZENIA
CHLOROWCA
LUB
CHLOROWCO
WODORU DO ALKENÓW
R – CH = CH
2
+ H –
X
R – CH – CH
3
X
A
E
R – CH = CH
2
+ H –
Br
R – CH – CH
2
Br
A
R
R – CH = CH
2
+
X
2
R – CH – CH
2
X
X
A
E
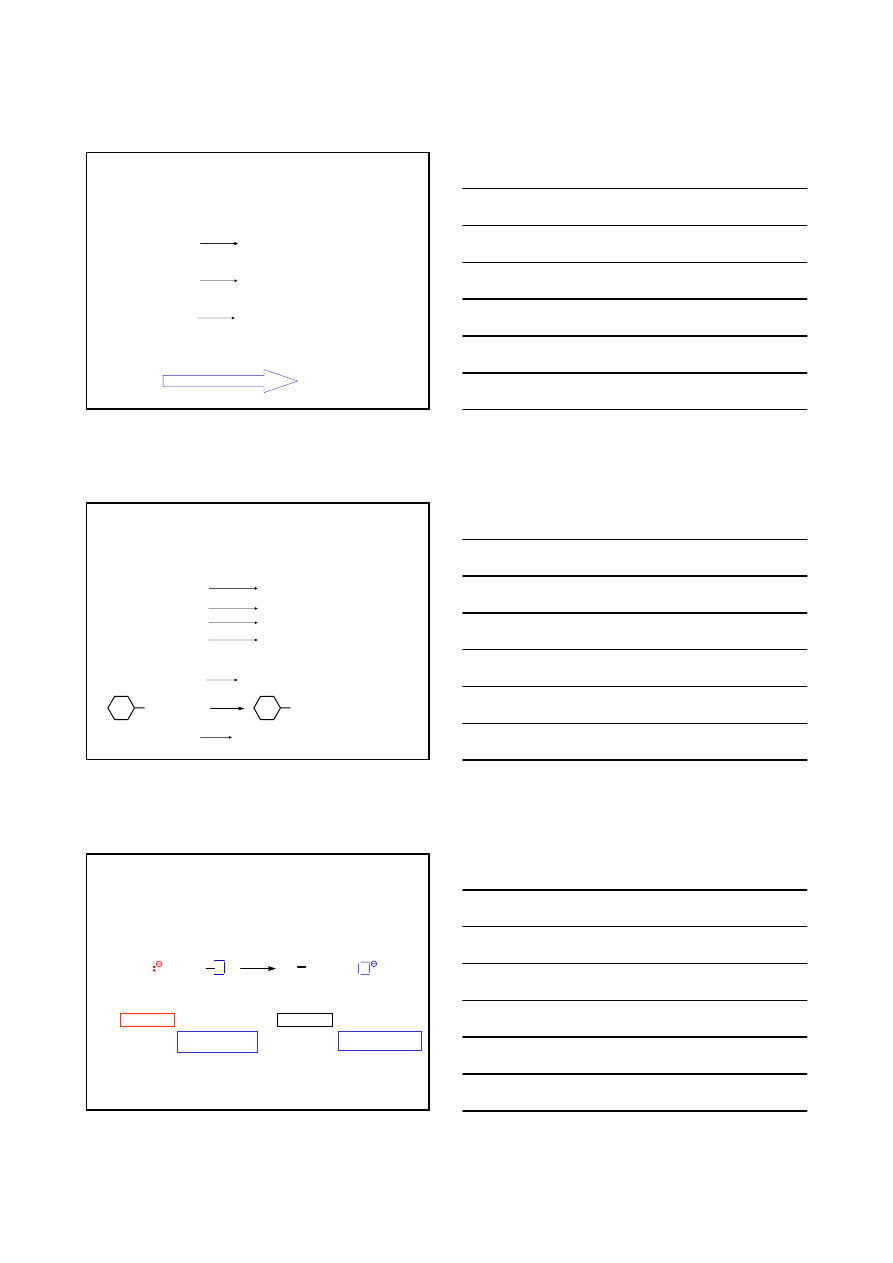
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
OTRZYMYWANIE
REAKCJE PODSTAWIENIA
CHLOROWCEM
ATOMU WODORU W ALKANACH
R – H +
X
2
R –
X
+ H –
X
S
R
h
ν
PRZYKŁADY
CH
4
+
Cl
2
CH
3
–
Cl
+ H –
Cl
S
R
h
ν
+
Br
2
S
R
h
ν
Br
+ H
Br
11
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
OTRZYMYWANIE
REAKCJE WYMIANY
CHLOROWCA
R –
Cl
+ K
Br
R –
Br
+ K
Cl
aceton
∆
R –
Cl
+ K
I
R –
I
+ K
Cl
aceton
∆
R –
Cl
+ K
Br
R –
Br
+ K
Cl
aceton
∆
R –
Br
+ K
I
R –
I
+ K
Br
aceton
∆
Cl Br
I
KIERUNEK WYMIANY
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
OTRZYMYWANIE
REAKCJE PODSTAWIENIA
GRUPY HYDROKSYLOWEJ
W ALKOHOLACH
PRZYKŁADY
R –
OH
+ H –
X
R –
X
+ H
2
O
R –
OH
+ SO
Cl
2
R –
Cl
+ H
Cl
+ SO
2
R –
OH
+ P
Cl
5
R –
Cl
+ HCl
+ PO
Cl
3
R –
OH
+ P
Br
3
R –
Br
+ H
3
PO
3
CH
3
CH
2
–
OH
+ SO
Cl
2
CH
3
CH
2
–
Cl
+ H –
Cl
+ SO
2
OH
+
PBr
3
Br
+ H
3
PO
3
(CH
3
)
3
C –
OH
+ H
Cl
(CH
3
)
3
C –
Cl
+ H
2
O
1.
REAKCJE Z ODCZYNNIKAMI NUKLEOFILOWYMI
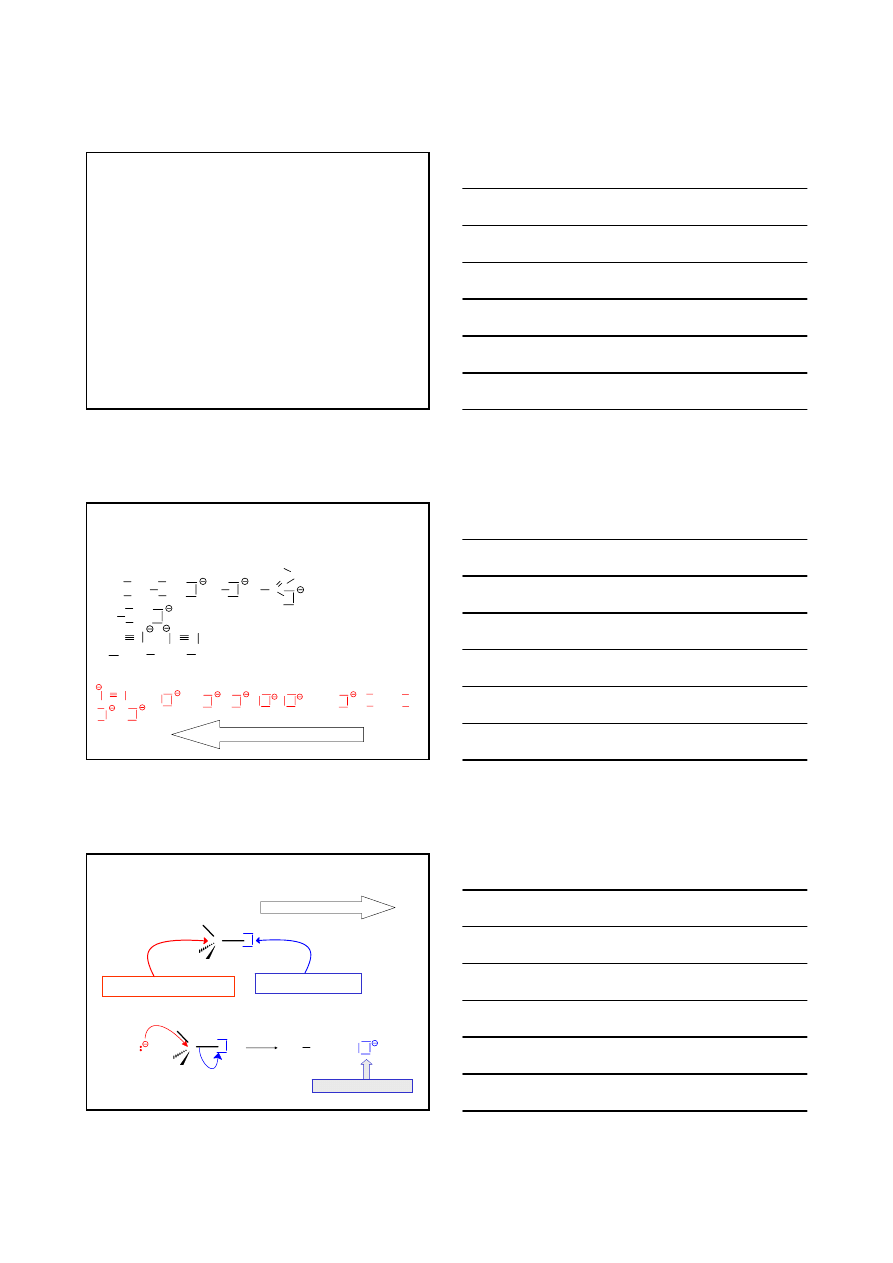
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
REAKCJE
Nu
+
R
X
R
Nu
+
X
NUKLEOFIL
SUBSTRAT
HALOGENEK ALKILU
PRODUKT
GRUPA ODCHODZĄCA
JON HALOGENKOWY
12
SUBSTYTUCJA NUKLEOFILOWA
SZYBKOŚĆ I MECHANIZM SUBSTYTUCJI NUKLEOFILOWEJ ZALEŻĄ OD:
RODZAJU I STĘŻENIA NUKLEOFILA
BUDOWY I STĘŻENIA SUBSTRATU – HALOGENKU ALKILOWEGO
INNYCH CZYNNIKÓW – ROZPUSZCZALNIKA, TEMPERATURY, ITP.
NUKLEOFILE – cząstki obojętne lub naładowane ujemnie z
niewiążącą parą elektronów zdolną do utworzenia wiązania
H
2
O , R OH, HO , R O , R C
O
O
SUBSTYTUCJA NUKLEOFILOWA
R SH, HS
HC C , C N
NH
3
, RNH
2
, R
2
NH
C N
RS , HS
I RO HO Br Cl CH
3
COO ROH H
2
O
NUKLEOFILOWOŚĆ
SUBSTYTUCJA NUKLEOFILOWA
GRUPY ODCHODZĄCE
C
X
δ+
δ−
Atom węgla z cząstkowym ładunkiem
dodatnim – miejsce ataku nukleofila
elektroujemny atom halogenu
polaryzuje wiązanie C – X
Nu
C
X
δ+
δ−
R
Nu
+
X
GRUPY ODCHODZĄCA
Cl Br
I
LEPSZA GRUPA ODCHODZĄCA
13
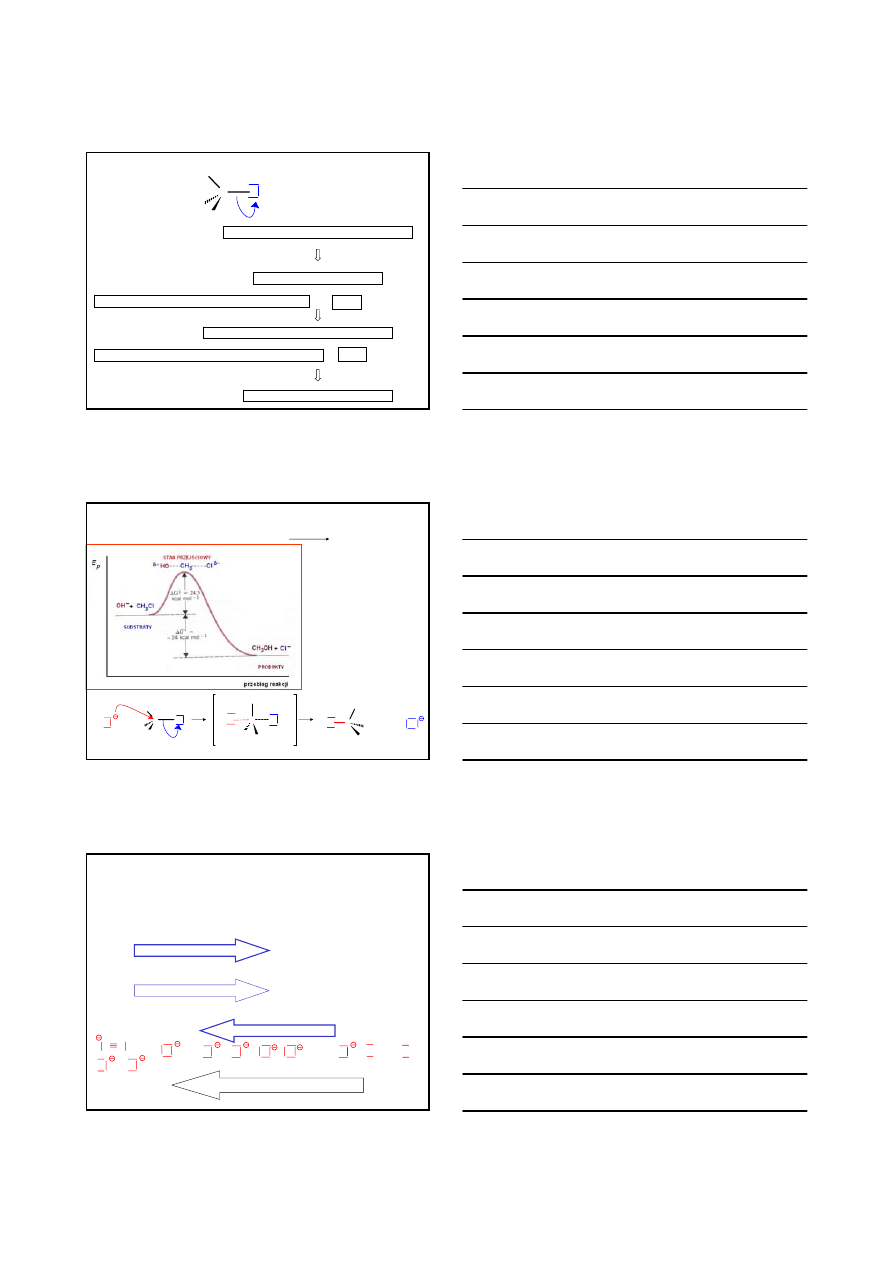
SUBSTYTUCJA NUKLEOFILOWA
C
X
δ+
δ−
elektroujemny atom halogenu polaryzuje wiązanie C – X
heterolityczny rozpad wiązanie C – X
równoczesne pękanie wiązania C – X i tworzenia wiązania C – Nu
elektroujemny atom halogenu polaryzuje wiązanie C – X
S
N
2
pękanie wiązania C – X i tworzenia wiązania C – Nu zachodzi kolejno
S
N
1
proces synchroniczny, jednoetapowy, dwucząsteczkowy
proces dwuetapowy, jednocząsteczkowy
SUBSTYTUCJA NUKLEOFILOWA
JEDNOETAPOWA, DWUCZĄSTECZKOWA
S
N
2
CH
3
–
Cl
+
OH
-
CH
3
–
OH
+
Cl
-
60°, H
2
O
MECHANIZM
δ+
δ−
H
C
Cl
H
H
HO
δ−
δ−
HO
H
H
Cl
C
H
HO
H
H
C
H
+
Cl
KINETYKA – reakcja II rzędu
v = k [R
X
] [
Nu
]
SUBSTYTUCJA NUKLEOFILOWA
JEDNOETAPOWA, DWUCZĄSTECZKOWA
S
N
2
SZYBKOŚĆ REAKCJI
S
N
2
zależy od:
rodzaju grupy odchodzącej
R – Cl R – Br
R – I
LEPSZA GRUPA ODCHODZĄCA
rodzaju nukleofila
C N
RS , HS
I RO HO Br Cl CH
3
COO ROH H
2
O
NUKLEOFILOWOŚĆ
SZYBKOŚĆ REAKCJI
S
N
2
SZYBKOŚĆ REAKCJI
S
N
2
14
SUBSTYTUCJA NUKLEOFILOWA
JEDNOETAPOWA, DWUCZĄSTECZKOWA
S
N
2
SZYBKOŚĆ REAKCJI
S
N
2
zależy od:
budowy reszty alkilowej substratu
– CH
3
> – CH
2
–
> CH –
>> – C –
1°
2°
3°
SZYBKOŚĆ REAKCJI
S
N
2
reakcję spowalniają także wszelkie rozgałęzienia na atomie węgla C
β
rozpuszczalnika
ROZPUSZCZALNIKI PROTONOWE
alkohole, woda
ROZPUSZCZALNIKI APROTONOWE
DMSO, DMF, acetonitryl
zmniejsza charakter
nukleofilowy reagenta
KORZYSTNIEJSZY DLA REAKCJI
S
N
2
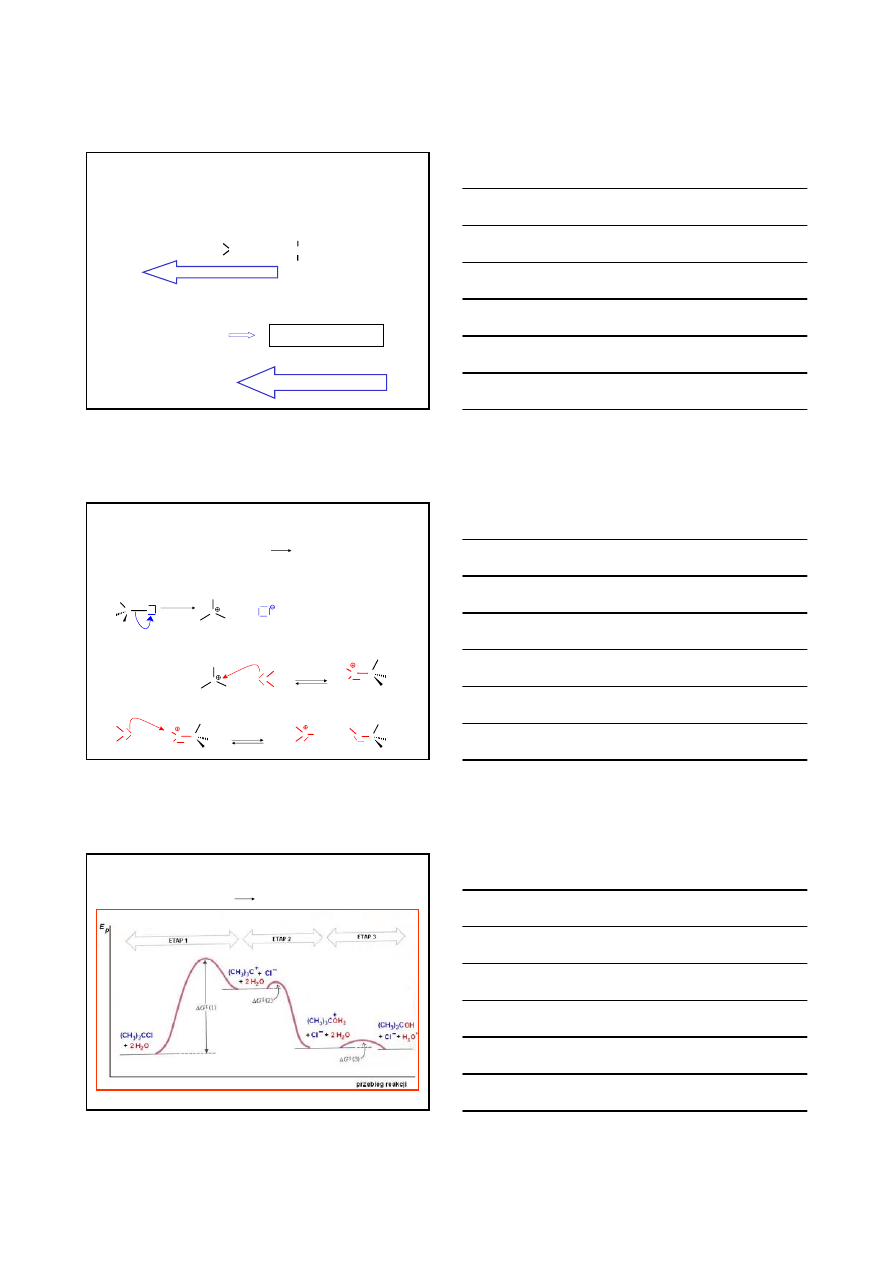
(CH
3
)
3
C –
Cl
+ 2
H
2
O
(CH
3
)
3
C –
OH
+ H
3
O
+
+
Cl
-
MECHANIZM
H
3
C
C
Cl
H
3
C
H
3
C
δ−
δ+
H
3
C
C
CH
3
CH
3
+
Cl
wolno
H
2
O
ETAP 1
ETAP 2
H
3
C
C
CH
3
CH
3
O
H
H
szybko
O
CH
3
CH
3
C
H
H
CH
3
ETAP 3
O
CH
3
CH
3
C
H
H
CH
3
O
H
H
szybko
O
CH
3
CH
3
C
H
CH
3
O
H
H
H
+
SUBSTYTUCJA NUKLEOFILOWA
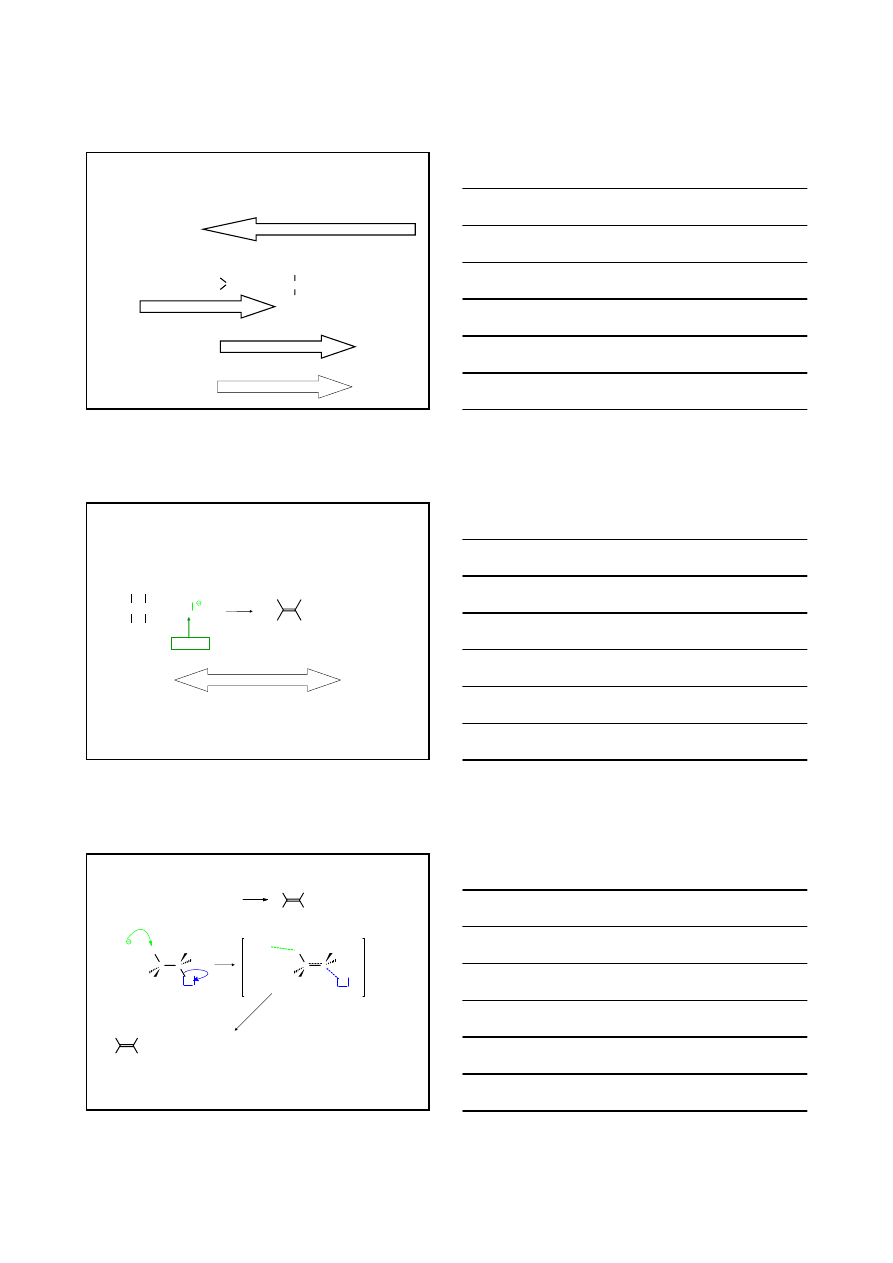
DWUETAPOWA, JEDNOCZĄSTECZKOWA
S
N
1
(CH
3
)
3
C –
Cl
+ 2
H
2
O
(CH
3
)
3
C –
OH
+ H
3
O
+
+
Cl
-
SUBSTYTUCJA NUKLEOFILOWA
DWUETAPOWA, JEDNOCZĄSTECZKOWA
S
N
1
15
KINETYKA – reakcja I rzędu
v = k [R
X
]
SZYBKOŚĆ REAKCJI S
N
1 NIE ZALEŻY OD STĘŻENIA
Nu
SZYBKOŚĆ
S
N
1
zależy od:
budowy reszty alkilowej substratu
– CH
3
< – CH
2
–
< CH –
< – C –
1°
2°
3°
SZYBKOŚĆ REAKCJI
S
N
1
Do reakcji biegnących mechanizmem
S
N
1
należą procesy solwolizy
rodzaju grupy odchodzącej
R – Cl R – Br
R – I
LEPSZA GRUPA ODCHODZĄCA
SZYBKOŚĆ REAKCJI
S
N
1
SUBSTYTUCJA NUKLEOFILOWA
DWUETAPOWA, JEDNOCZĄSTECZKOWA
S
N
1
2.
REAKCJE Z ZASADAMI
HALOGENOPOCHODNE WĘGLOWODORÓW
F–;
Cl
–; Br–; I–
REAKCJE
DEHYDROHALOGENOWANIE
ZASADA
– C – C –
+
+
H
– B
+
X
H
X
B
ELIMINACJA E2
proces synchroniczny, jednoetapowy, dwucząsteczkowy
KINETYKA – reakcja II rzędu
v = k [R
X
] [
B
]
MECHANIZM
C
2
H
5
O
-
+ CH
3
CH
Br
CH
3
H
CH
3
H
H
+
C
2
H
5
O
H +
Br
-
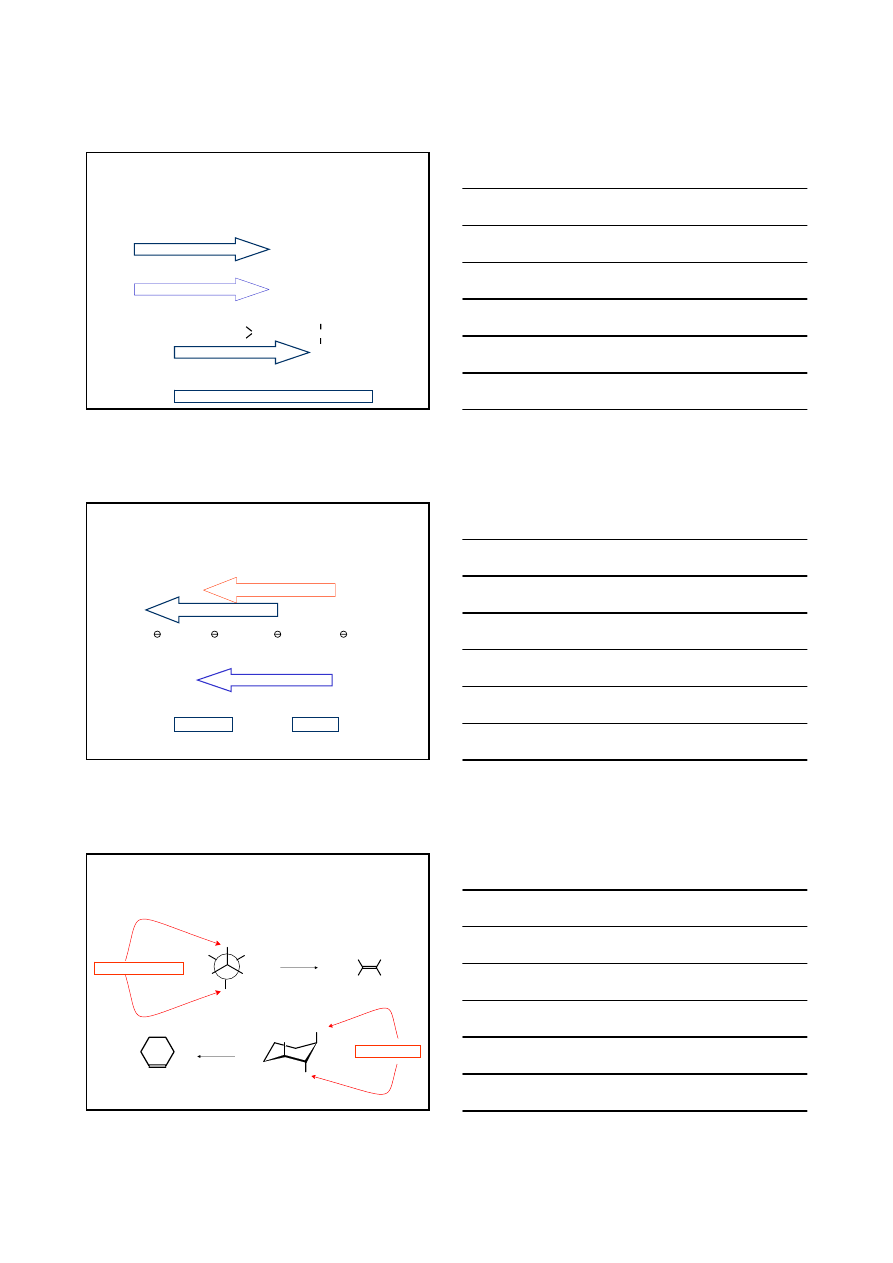
REAKCJA
H
C
C
H
H
H
CH
3
Br
C
2
H
5
O
α
β
δ−
δ−
C
2
H
5
O
Br
CH
3
H
H
H
C
C
H
H
CH
3
H
H
+
C
2
H
5
O
H +
Br
-
16
SZYBKOŚĆ REAKCJI
E
2
zależy od:
rodzaju grupy odchodzącej
R – Cl R – Br
R – I
LEPSZA GRUPA ODCHODZĄCA
SZYBKOŚĆ REAKCJI
E
2
ELIMINACJA E2
stężenia zasady oraz R – X
budowy reszty alkilowej substratu
– CH
3
< – CH
2
–
< CH –
< – C –
1°
2°
3°
SZYBKOŚĆ REAKCJI
E2
temperatury
szybkość reakcji E rośnie ze wzrostem temperatury
mocy zasady
NUKLEOFILOWOŚĆ
SZYBKOŚĆ REAKCJI
E
2
SZYBKOŚĆ REAKCJI
E
2
zależy od:
ELIMINACJA E2
ZASADOWOŚĆ
rodzaj zasady
(CH
3
)
3
CO
-
K
+
CH
3
O
-
Na
+
>
NH
2
> RO > HO > RCOO
> H
2
O
ELIMINACJA E2
Wymagania steryczne
E
2
atomy eliminowane wodoru oraz chlorowca muszą
leżeć w jednej płaszczyźnie – tzn. anti względem siebie
H
H
R
H
Br
R
–
HBr
E2
H
R
R
H
H i Br
– antiperiplanarne
–
HBr
E2
Br
H
H
H i Br
– diaksjalne
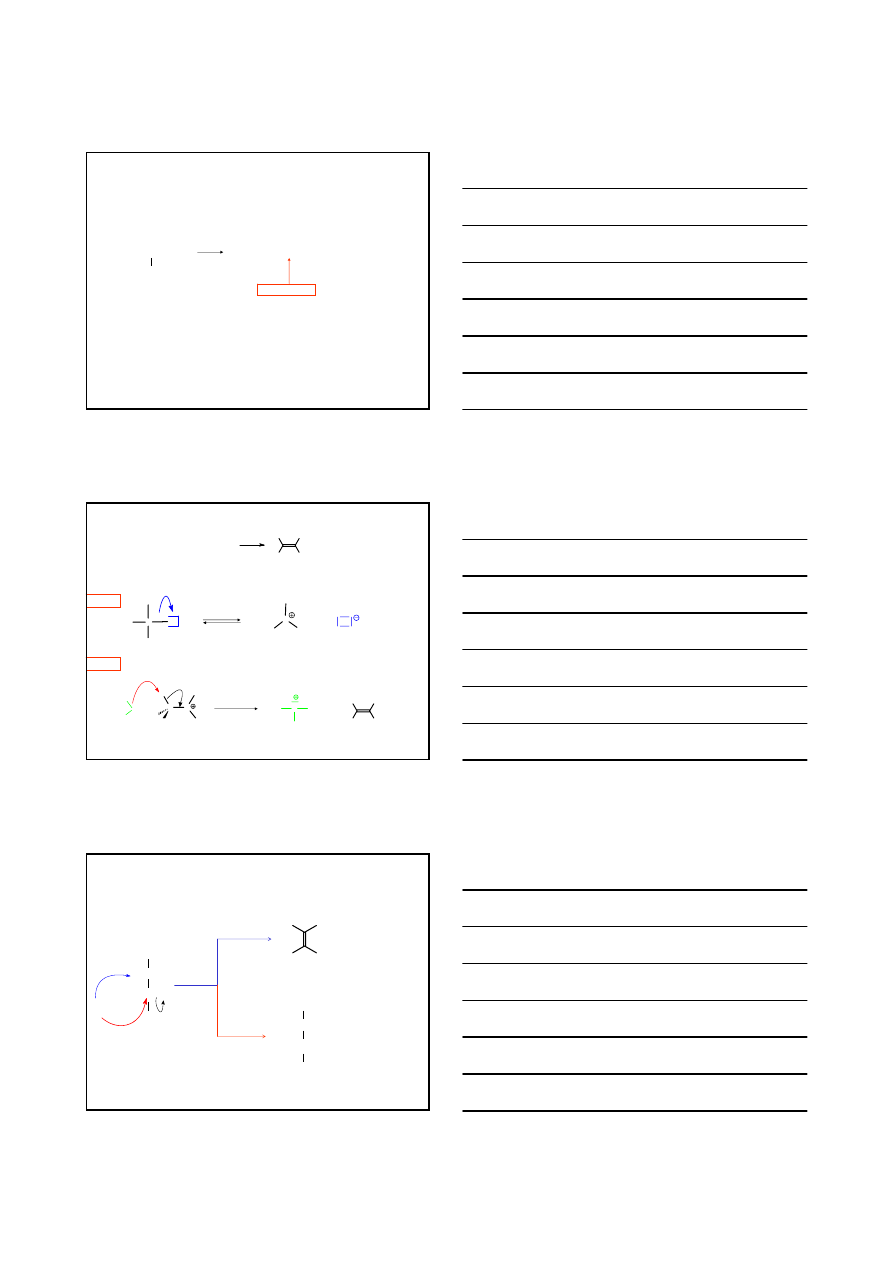
17
ELIMINACJA
REGUŁA ZAJCEWA
w reakcji eliminacji halogenowodoru proton odszczepiany jest w ten
sposób, aby powstał bardziej stabilny alken (czyli odrywa się od
tego atomu węgla
β, który powiązany jest z mniejszą liczbą atomów
wodoru)
CH
3
– CH
2
– CH – CH
3
CH
3
–CH = CH–CH
3
+ CH
2
= CH –CH
2
–CH
3
|B
-
Br
2-buten
1-buten
główny produkt
ELIMINACJA E1
proces dwuetapowy, jednocząsteczkowy
KINETYKA – reakcja I rzędu
v = k [R
X
]
MECHANIZM
REAKCJA
H
2
O
+ (CH
3
)
3
C
Cl
H
CH
3
H
CH
3
+
H
3
O
+
+
Cl
-
CH
3
C
H
3
C
CH
3
Cl
H
2
O
wolno
CH
3
C
H
3
C
CH
3
+
Cl
ETAP 1
ETAP 2
CH
3
CH
3
H
H
C
C
H
H
2
O
szybko
α
β
H
CH
3
H
CH
3
+
H
O
H
H
S
N
2 czy E2
H – C –
– C
– X
:Nu
-
S
N
2
E2
H – C –
Nu
– C –
+
X:
-
+
Nu –
H +
X:
-
α
β
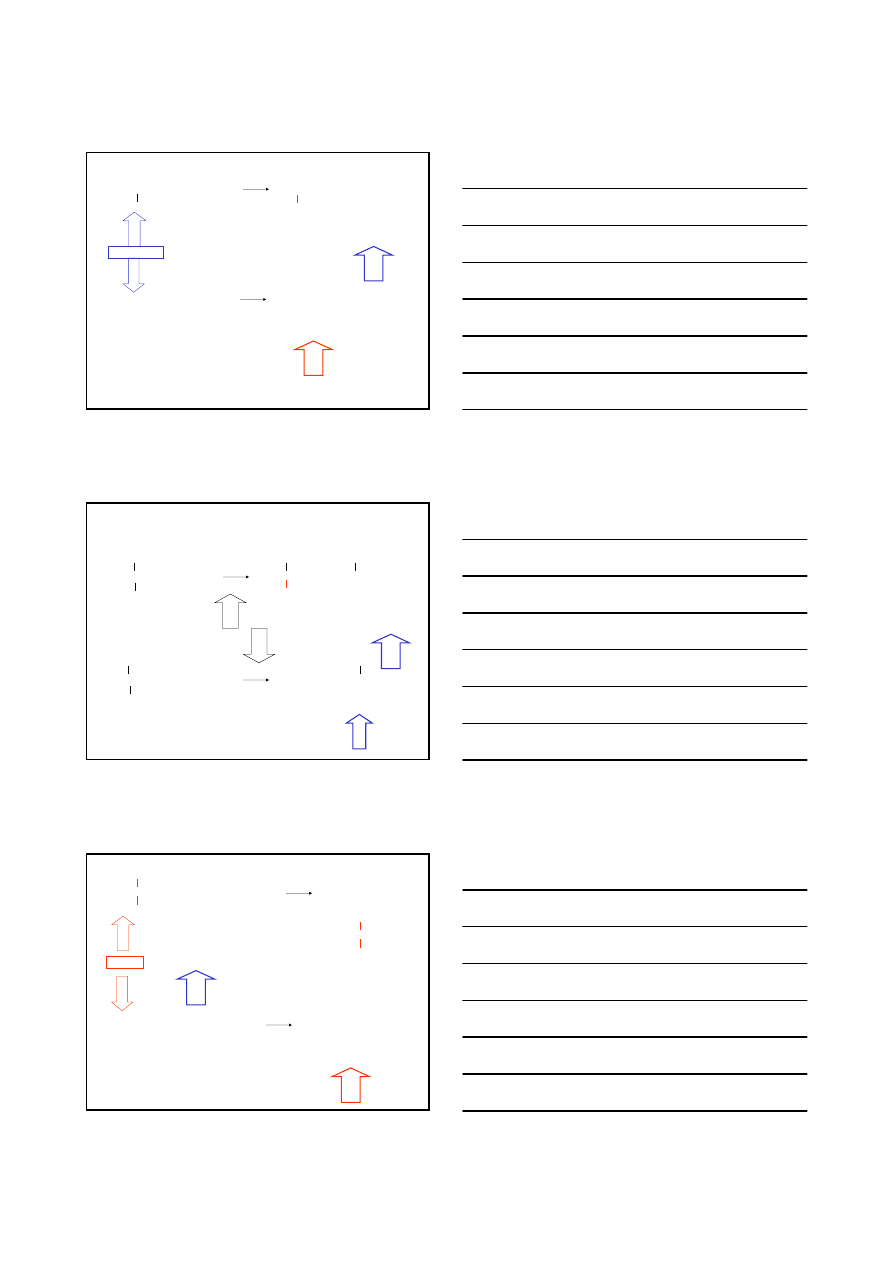
18
S
N
2 czy E2
S
N
2
21%
E2
79%
CH
3
– CH – CH
3
+
C
2
H
5
O
-
Na
+
CH
3
–CH–CH
3
+ CH
2
= CH –CH
3
Br
O – C
2
H
5
C
2
H
5
OH
55°C
(-NaBr)
S
N
2
90%
E2
10%
CH
3
– CH
2
Br
+
C
2
H
5
O
-
Na
+
CH
3
–CH
2
– O–C
2
H
5
+ CH
2
= CH
2
C
2
H
5
OH
55°C
(-NaBr)
2°
1°
S
N
2
E2
HALOGENEK
S
N
2
czy E2
E2 + E1
100%
CH
3
– C– CH
3
+
C
2
H
5
O
-
Na
+
CH
3
–C–CH
3
+ CH
2
= C –CH
3
CH
3
O – C
2
H
5
C
2
H
5
OH
25°C
(-NaBr)
Br
CH
3
CH
3
CH
3
– C– CH
3
+
C
2
H
5
O
-
Na
+
C
2
H
5
OH
+ CH
2
= C –CH
3
CH
3
C
2
H
5
OH
55°C
(-NaBr)
Br
CH
3
S
N
2
9%
E2
91%
T
↓
T
↑
E2
E
S
N
2
czy E2
CH
3
– C– CH
3
+ CH
3
(CH
2
)
15
CH
2
CH
2
– Br
CH
3
(CH
3
)
3
COH
40°C
(-KBr)
O
-
S
N
2
15%
E2
85
%
CH
3
(CH
2
)
15
CH = CH
2
+ CH
3
(CH
2
)
15
CH
2
CH
2
– O – C – CH
3
CH
3
CH
3
CH
3
– O
-
+ CH
3
(CH
2
)
15
CH
2
CH
2
– Br
CH
3
OH
65°C
(-NaBr)
CH
3
(CH
2
)
15
CH = CH
2
+ CH
3
(CH
2
)
15
CH
2
CH
2
– O –CH
3
S
N
2
99%
E2
1
%
E2
S
N
2
3°
1°
ZASADA
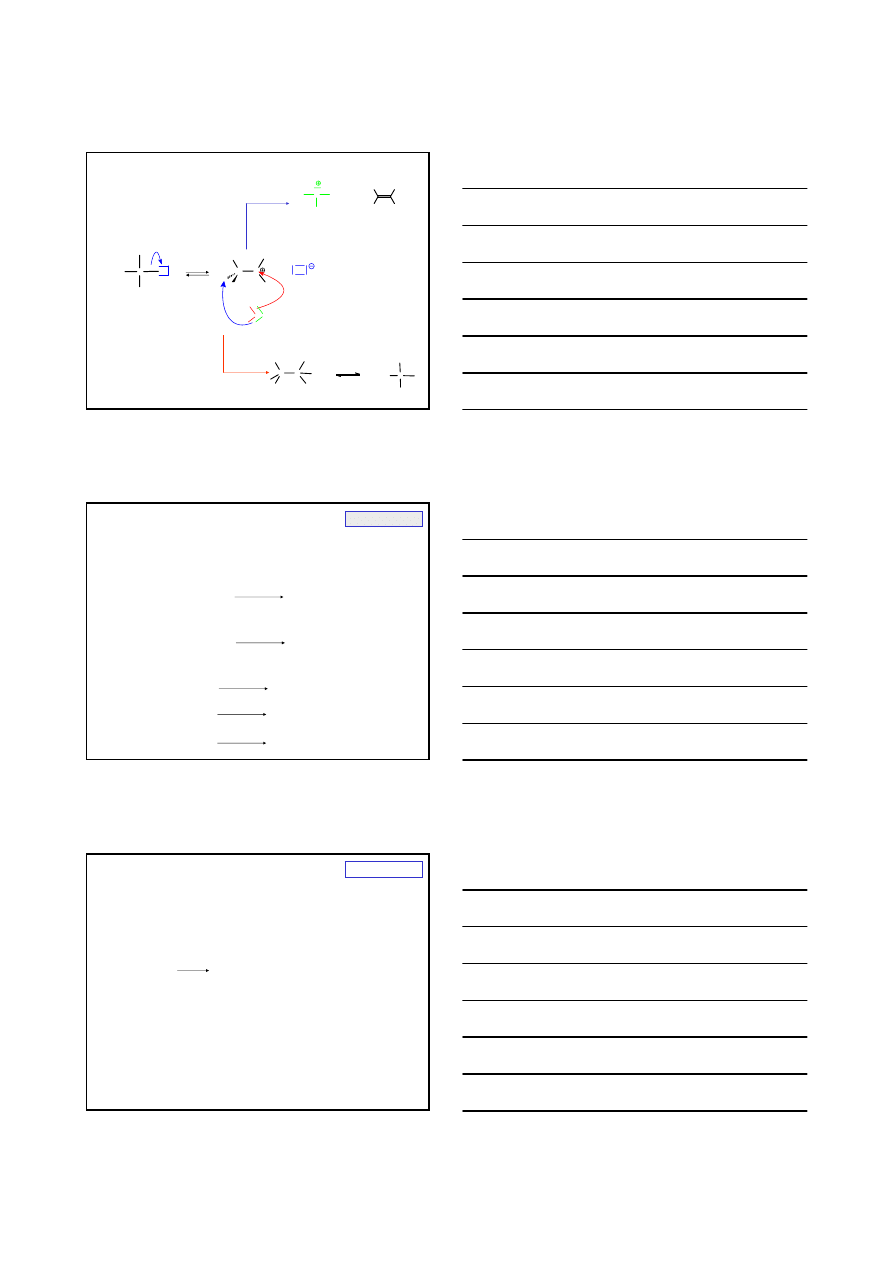
19
S
N
1
czy E1
R
C
H
3
C
R
X
wolno
+
X
R
R
H
H
C
C
H
H
2
O
α
S
N
1
β
H
2
O
E1
H
R
H
R
+
H
O
H
H
R
R
H
H
C
C
H
OH
2
+
R
R
C
H
3
C
OH
-H
+
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
REAKCJE
3.
REAKCJE Z AKTYWNYMI METALAMI
REAKCJA WÜRTZ’A
2 RCH
2
– X + 2
Na
RCH
2
CH
2
R + 2
Na
X
REAKCJA GRIGNARD’A
RCH
2
– X +
Mg
RCH
2
Mg
X
SYNTEZA COREY’A
R – X + 2
Li
R
Li
+
Li
X
2 R
Li
+
CuI
R
2
Cu
Li
+
Li
I
R
2
Cu
Li
+
R’X R’
– R + R
Cu
+
Li
X
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
REAKCJE
4.
REAKCJE REDUKCJI
R – X +
H
2
R –
H
+
H
X
Ni
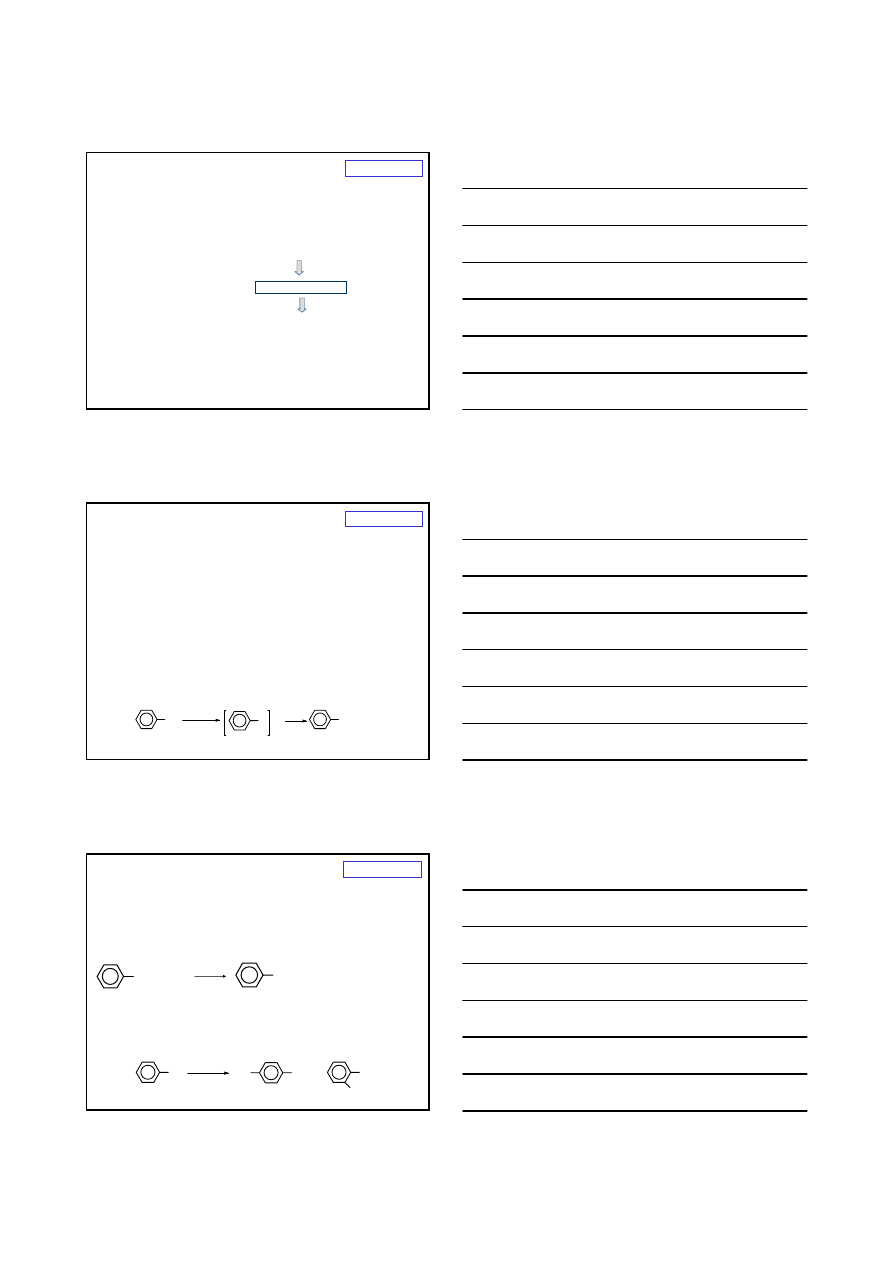
20
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
HALOGENKI AROMATYCZNE
= C –– X
sp
2
mniejszej różnicy elektroujemności pomiędzy atomami C
sp
2
i X
sprzężenia wolnej pary elektronów atomu halogenu z pierścieniem
WZMOCNIENIE WIĄZANIA C – X WYNIKA Z :
NIERUCHLIWY HALOGEN
mała reaktywność aromatycznych halogenków w reakcjach
S
N
oraz
E
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
HALOGENKI AROMATYCZNE
= C –– X
sp
2
Własności fizyczne
bezbarwne, słabo polarne ciecze
nierozpuszczalne w wodzie; zazwyczaj o większej gęstości od wody
Otrzymywanie
S
Earom
reakcja Sandmeyer’a
NH
2
HNO
2
/HCl
Cl
N
2
+
CuCl
Cl
-
HALOGENOPOCHODNE WĘGLOWODORÓW
F–; Cl–; Br–; I–
HALOGENKI AROMATYCZNE
= C –– X
sp
2
Własności chemiczne
reakcja z metalami
S
Earom
-I
mniejsza reaktywność pierścienia
+M
kieruje podstawniki w pozycje o- i p-
+
Mg
eter
Br
MgBr
Br
HNO
3
/H
2
SO
4
Br
NO
2
Br
O
2
N
+
21
HERBICYDY I INSEKTYCYDY
+
H
2
O
H
+
Cl
2
CCl
3
C
O
H
+
Cl
Cl
CCl
3
d
ichloro
d
ifenylo
t
richloroetan
DDT
HERBICYDY
OCH
2
COOH
Cl
Cl
Cl
OCH
2
COOH
Cl
Cl
KWAS 2,4-DICHLOROFENOKSYOCTOWY
KWAS 2,4,5-TRICHLOROFENOKSYOCTOWY
Cl
Cl
O
O
Cl
Cl
2,3,6,7-TETRACHLORODIBENZODIOKSYNA
HERBICYDY
N
N
N
N
N
Cl
H
H
atrazyna
kukurydza, trzcina cukrowa, ananasy
CF
3
N
O
N
H
fluorometuron
bawełna, trzcina cukrowa
N
O
2
N
NO
2
CF
3
trifluralin
pomidory, buraki
cukrowe, fasola, bawełna
SO
2
NH
Cl
O
NH
N
N
N
OCH
3
OCH
3
chlorosulfuron
zboża
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron