1
C
n
H
2n+2
ALK
AN
336 319
ejkoz
an
CH
3
(CH
2
)
18
CH
3
C
20
H
42
72
dek
an
CH
3
(CH
2
)
8
CH
3
C
10
H
22
35
non
an
CH
3
(CH
2
)
7
CH
3
C
9
H
20
18
okt
an
CH
3
(CH
2
)
6
CH
3
C
8
H
18
9
hept
an
CH
3
(CH
2
)
5
CH
3
C
7
H
16
5
heks
an
CH
3
(CH
2
)
4
CH
3
C
6
H
14
ciecze
3
pent
an
CH
3
(CH
2
)
3
CH
3
C
5
H
12
2
but
an
CH
3
(CH
2
)
2
CH
3
C
4
H
10
1
prop
an
CH
3
CH
2
CH
3
C
3
H
8
1
et
an
CH
3
CH
3
C
2
H
6
gazy
1
met
an
CH
4
CH
4
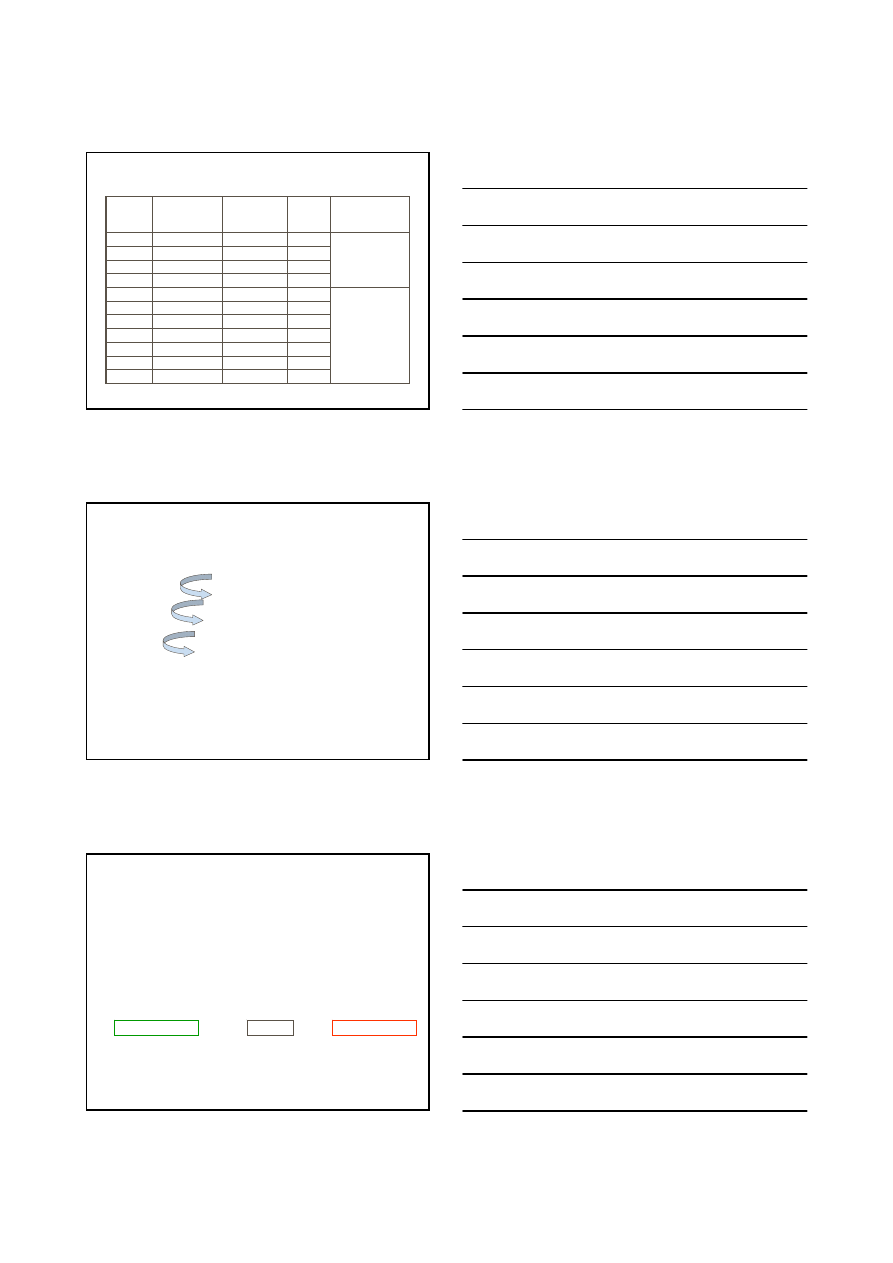
Stan skupienia
Liczba
izomerów
konsty-
tucyjnych
Nazwa alkanu
prostego
Wzór strukturalny
Wzór
sumaryczny
CH
3
CH
2
CH
2
CH
3
CH
3
CH
3
CH
3
CH
2
CH
3
CH
3
CH
2
CH
2
CH
2
CH
3
HOMOLOGI
HOMOLOGI
HOMOLOGI
NOMENKLATURA ZWIĄZKÓW ORGANICZNYCH
nazewnictwo zwyczajowe
nazewnictwo systematyczne
PRZEDROSTEK
określa miejsce i
rodzaj podstawnika
RDZEŃ
określa liczbę
atomów węgla
PRZYROSTEK
określa rodzaj grupy
funkcyjnej
+
+
najczęściej związane ze źródłem izolacji
2
System IUPAC
(
I
nternational
U
nion of
P
ure
and
A
pplied
C
hemistry)
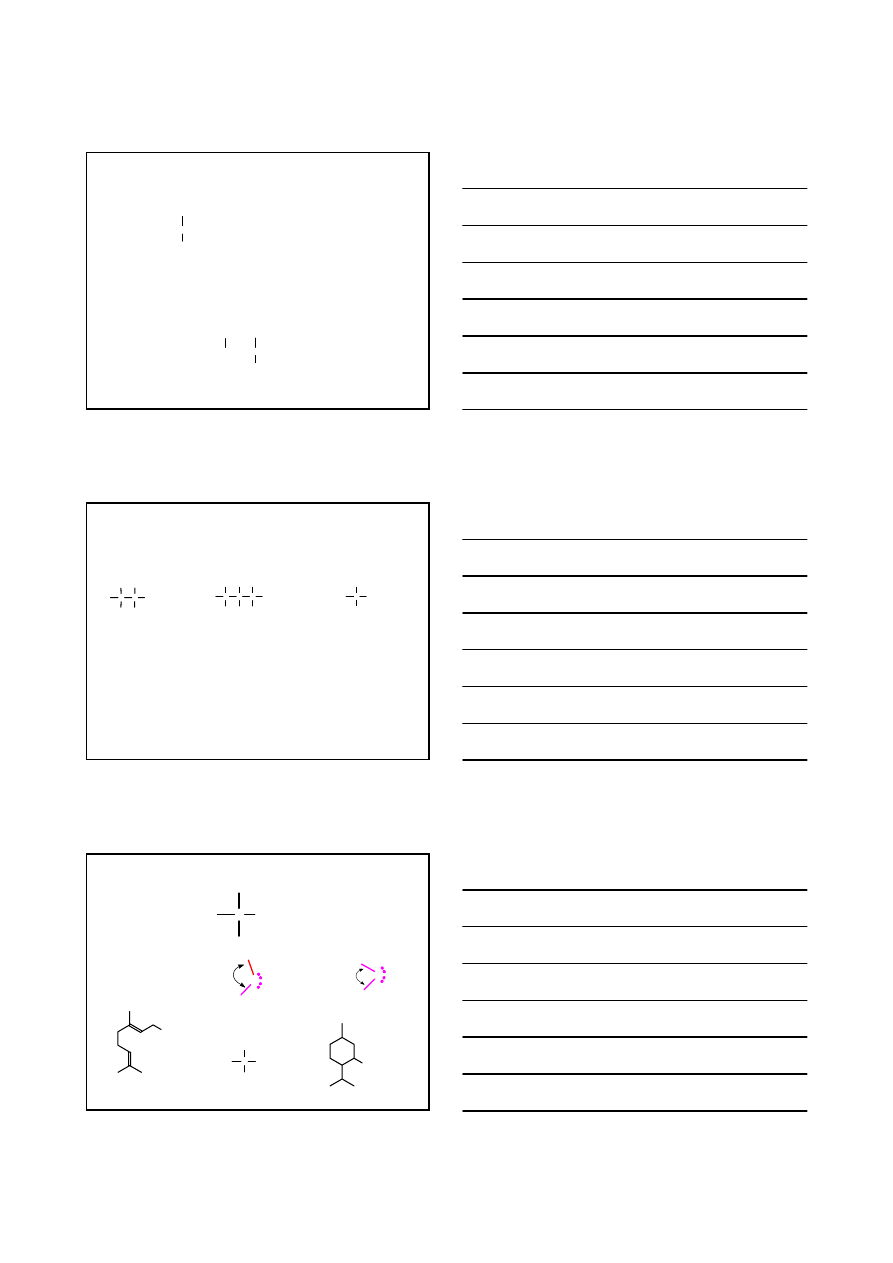
1. Lokalizacja najdłuższego łańcucha – decyduje o rdzeniu nazwy
pochodzącej od macierzystego alkanu
non
an
oktan
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CHCH
2
CH
3
CH
3
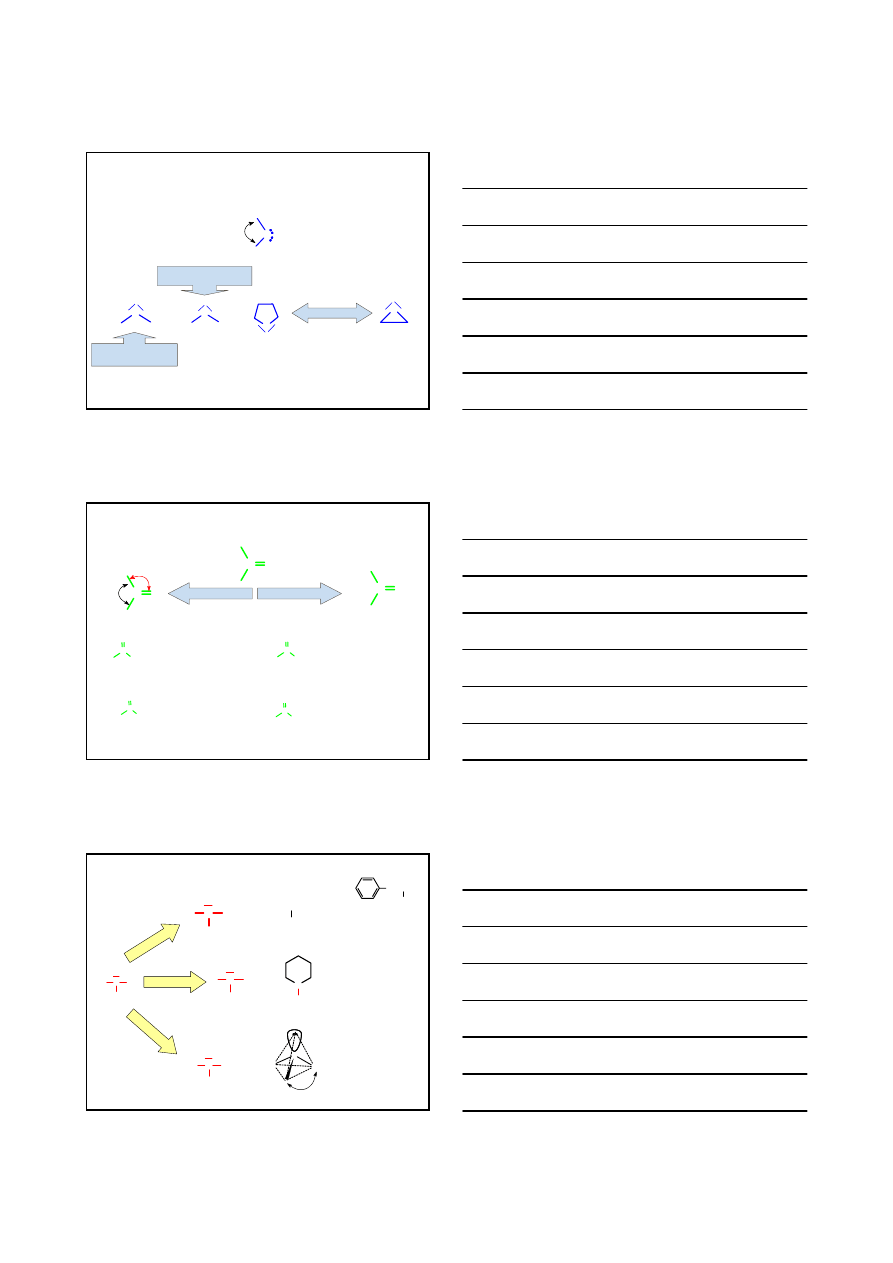
2. Tworzenie nazwy łańcucha bocznego
Podstawnik o wzorze C
n
H
2n+1
utworzony przez formalne odjęcie atomu
wodoru nazywa się poprzez zmianę końcówki na
–yl
w nazwie
macierzystego alkanu
C
n
H
2n+1
ALK
IL
3
°
(CH
3
)
3
C–
1
°
(CH
3
)
2
CHCH
2
–
CH
3
CHCH
2
CH
3
CH
3
CH
2
CH
2
CH
2
–
CH
3
CHCH
3
CH
3
CH
2
CH
2
–
CH
3
CH
2
–
CH
3
–
Alkil
2,2-dimetyloet
yl
(tert-but
yl
)
2-metyloprop
yl
(izobut
yl
)
1-metyloprop
yl
(sec-but
yl
)
but
yl
butan
CH
3
(CH
2
)
2
CH
3
1-metyloet
yl
prop
yl
propan
CH
3
CH
2
CH
3
et
yl
etan
CH
3
CH
3
met
yl
metan
CH
4
Nazwa alkilu
Nazwa alkanu
prostego
Wzór strukturalny
2
°
2
°
4. Jeżeli w łańcuchu głównym występują dwa lub więcej podstawników, to
każdy atom węgla, z którym są połączone musi mieć przyporządkowany
lokant; w ten sposób, aby suma lokantów (atomów węgla z
podstawnikami) była jak najmniejsza; podstawniki wymienia się w
kolejności alfabetycznej
3. Jeżeli jest to koniecznym, wyznacza się lokant atomu węgla, z którym
połączony jest podstawnik tak, aby w/w atom węgla posiadał jak
najniższą numerację
CH
3
CHCH
3
CH
3
metylo
prop
an
CH
3
CH
2
CHCH
2
CH
2
CH
3
CH
2
CH
3
1
2
3
4
5
6
7
7
6
5
4
3
2
1
3-
metylo
hept
an
CH
3
CHCH
3
CH
2
CH
3
CH
3
CH
2
CH
2
CHCH
2
7
6
5
4 3
2
1
1
2
3
4
5
6
7
6+7 >
2+4
4-
etylo-
2
-metylo
hept
an
3
5. Jeżeli dwa podstawniki są połączone z tym samym atomem węgla, to
muszą mieć przyporządkowany taki sam lokant
6. Jeżeli dwa lub więcej podstawniki w łąńcuchu głównym są
identycznymi, to po wymienieniu lokantów należy podać liczbę takich
samych grup przedrostkiem:
di–, tri –, tetra– , penta–
3-
etylo-
3
-metylo
heks
an
CH
2
CH
3
CH
3
CH
2
CH
2
CHCH
2
CH
3
CH
3
3
5
CH
3
CH
3
CHCH
2
CCH
2
CH
3
CH
3
CH
3
3
3,3,5
-
tri
metylo
heks
an
GRUPY FUNKCYJNE
HALOGENOALKANY
H C
H
H
C
H
H
Cl
H C
H
H
C
H
Cl
C
H
H
H
H
3
C C
CH
3
CH
3
Cl
1° CHLOREK ALKILU
2° CHLOREK ALKILU
3° CHLOREK ALKILU
CHLORO
ETAN
2-CHLORO
PROPAN
2-CHLORO
-2-METYLOPROPAN
GRUPY FUNKCYJNE
ALKOHOLE
C
OH
sp
3
CH
3
CH
3
H
O
H
105°
CH
3
CH
2
H
O
109°
ETAN
OL
OH
gerani
ol
H
3
C C
CH
3
CH
3
OH
tert-butan
ol
OH
ment
ol
4
GRUPY FUNKCYJNE
ETERY
R
R
O
R
R'
O
O
O
H
3
C
O
H
3
C
110°
ETER
DIMETYLOWY
ETER SYMETRYCZNY
ETER CYKLICZNY
ETER NIESYMETRYCZNY
GRUPY FUNKCYJNE
ZWIĄZKI KARBONYLOWE
C O
R
H
C O
R
C O
R
KET
ON
AL
DEHYD
H
H
C
O
METAN
AL
H
3
C
H
C
O
ETAN
AL
H
3
C
CH
3
C
O
PROPAN
ON
H
3
C
CH
2
CH
3
C
O
2
-BUTAN
ON
FORMALDEHYD
ALDEHYD MRÓWKOWY
ALDEHYD OCTOWY
ACETON
KETON
ETYLOWOMETYLOWY
118°
121°
GRUPY FUNKCYJNE
AMINY
H N
H
H
H N
H
R
R
N
H
R
R
N
R
R
1°
3°
2
°
CH
2
CHCH
3
NH
2
CH
3
CHCH
3
NH
2
izopropylo
amina
N
H
piperydyna
N
H
3
C
H
3
C
CH
3
121°
trimetylo
amina
5
GRUPY FUNKCYJNE
KWASY KARBOKSYLOWE
R
C
O
O H
RCOOH
RCO
2
H
CH
3
C
O
O H
H
C
O
O H
C
O
O H
kwas mrówkowy
kwas octowy
kwas benzoesowy
kwas
metan
owy
kwas
etan
owy
GRUPY FUNKCYJNE
AMIDY KWASÓW KARBOKSYLOWYCH
R
C
O
NH
2
R
C
O
NH
R'
R
C
O
N
R
2
CH
3
C
O
NH
2
CH
3
C
O
N
(CH
3
)
2
CH
3
C
O
NH
CH
3
acetamid
N-metylo
acetamid
N,N-
di
metylo
acetamid
GRUPY FUNKCYJNE
ESTRY KWASÓW KARBOKSYLOWYCH
R'
C
O
O R
R’
COOR
R’
CO
2
R
CH
3
C
O
O CH
2
CH
3
octan etylu
6
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
ENERGIA DYSOCJACJI WIĄZANIA – ilość energii wydzielona
podczas tworzenia wiązania chemicznego lub niezbędna do jego
tworzenia
I – I
151 kJmol
-1
H – F 569 kJmol
-1
MOC WIĄZANIA
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
ENERGIA WIĄZANIA – jest wartością średnią
CH
4
→ C + 4H•
∆H = 1662 kJmol
-1
E
C–H
= 1662 : 4 = 415 kJmol
-1
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
HETEROLIZA WIĄZANIA
zawierającego atom węgla prowadzi do do powstania dwóch jonów
atom węgla miał cząstkowy ładunek dodatni
C Z
δ+
δ−
C
+ Z
KARBOKATION
atom węgla miał cząstkowy ładunek ujemny
C
+ Z
C Z
δ+
δ−
KARBOANION
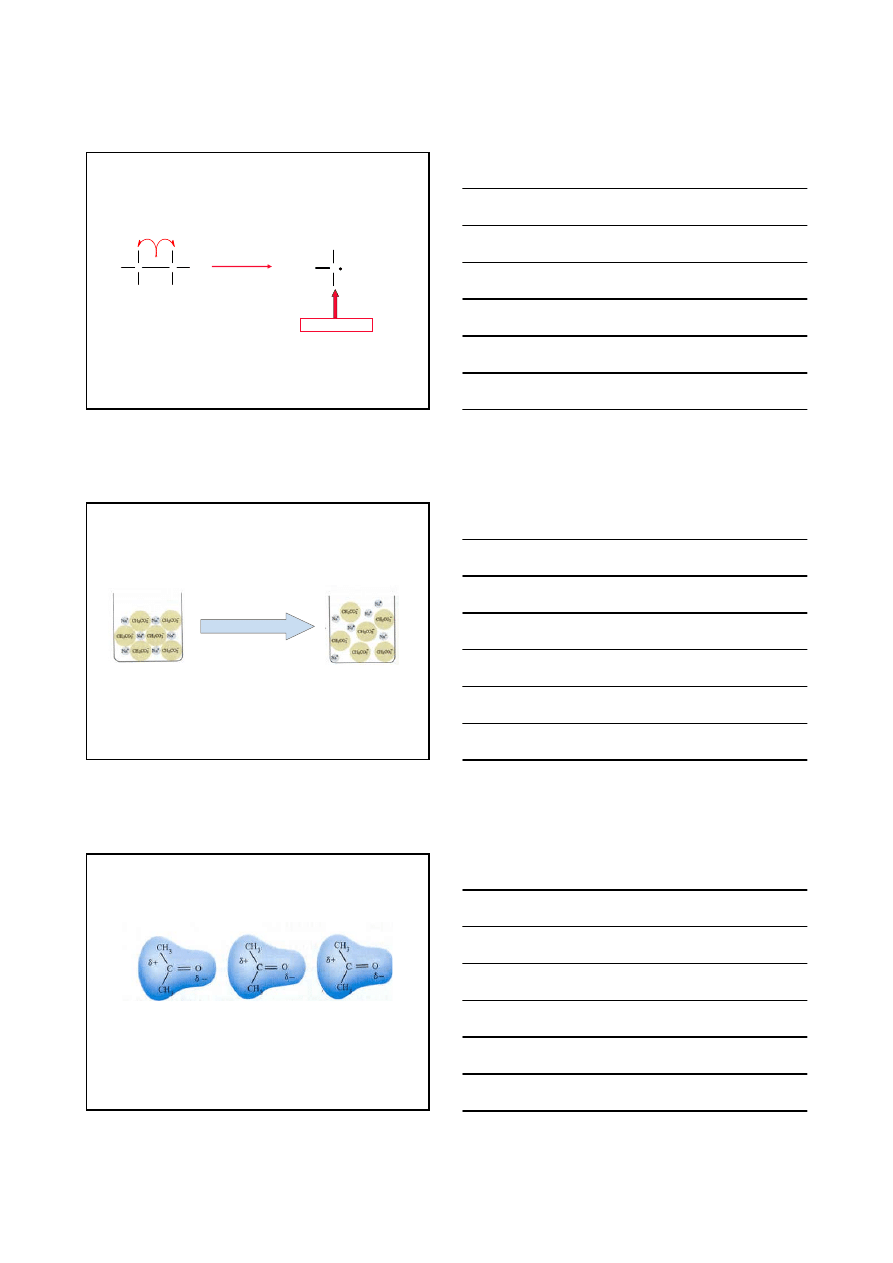
7
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
HOMOLIZA WIĄZANIA
C
C
C
2
KARBORODNIK
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
JON – JON
TOPNIENIE
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
DIPOL – DIPOL
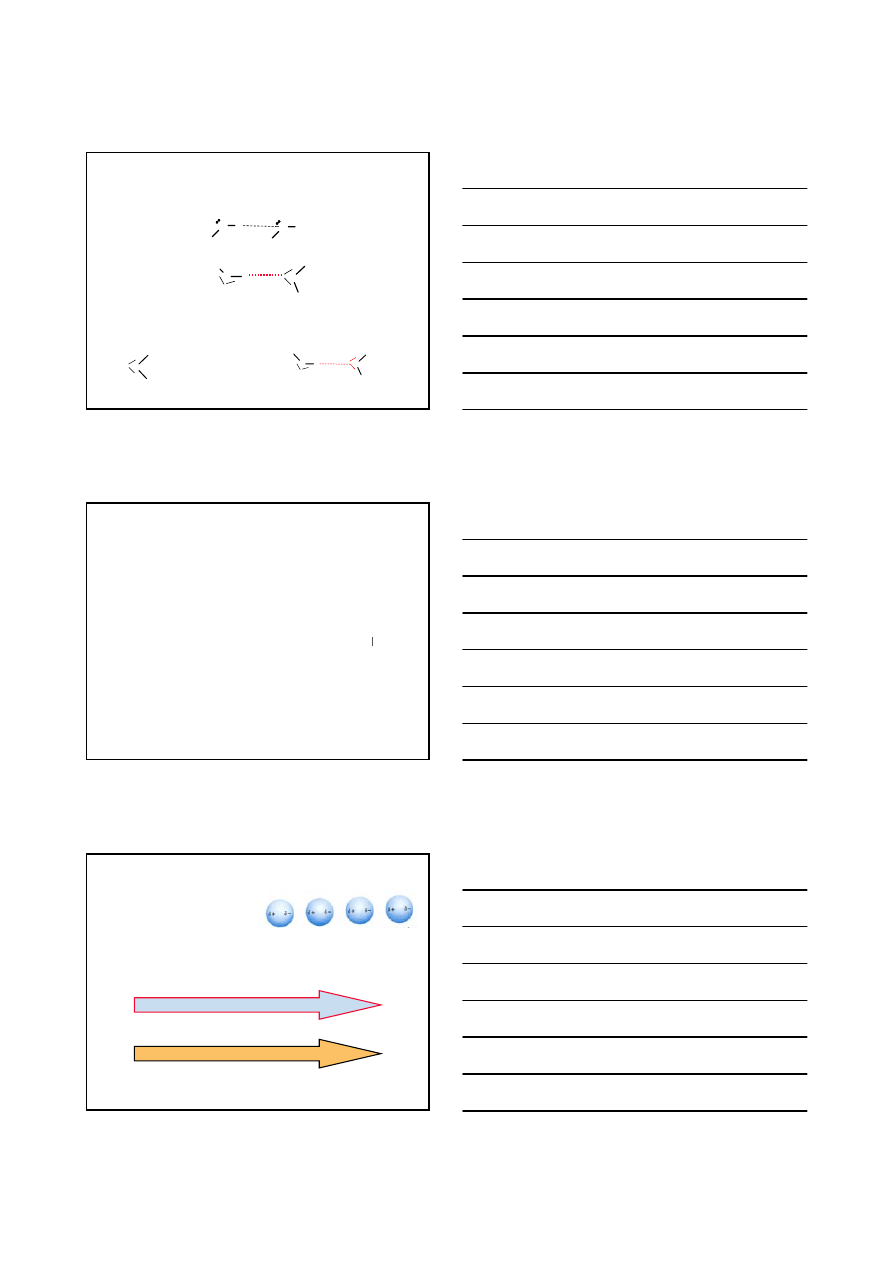
8
X H
H
X
δ+
δ−
δ−
δ+
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
WIĄZANIA WODOROWE
CH
3
CH
2
O H
O
H
CH
2
CH
3
WIĄZANIE WODOROWE – występuje, gdy atom wodoru znajdzie się
pomiędzy dwoma silnie elektroujemnymi atomami takimi, jak: tlen, fluor czy
azot
O
CH
3
CH
3
CH
3
CH
2
O
H
O
H
CH
2
CH
3
t
w
–24.9
°C
M
CZ
46
t
w
+78.5
°C
M
CZ
46
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
WIĄZANIA WODOROWE
(CH
3
)
3
C–OH
alkohol tert-butylowy
tt
+25°C
CH
3
CH
2
CH
2
CH
2
–OH
1-butanol
tt
-90°C
(CH
3
)
2
CHCH
2
–OH
izobutanol
tt
-108°C
tt
-114°C
CH
3
CH
2
CH
2
CH–OH
sec-butanol
CH
3
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
SIŁY
VAN DER
WAALSA
dipol – dipol indukowany
CH
4
METAN
t
w
-162°C
CH
3
CH
3
ETAN
t
W
-88.2°C
t
W
+174°C
CH
3
(CH
2
)
8
CH
3
DEKAN
siły van der Waalsa
M
CZ
oraz t
w
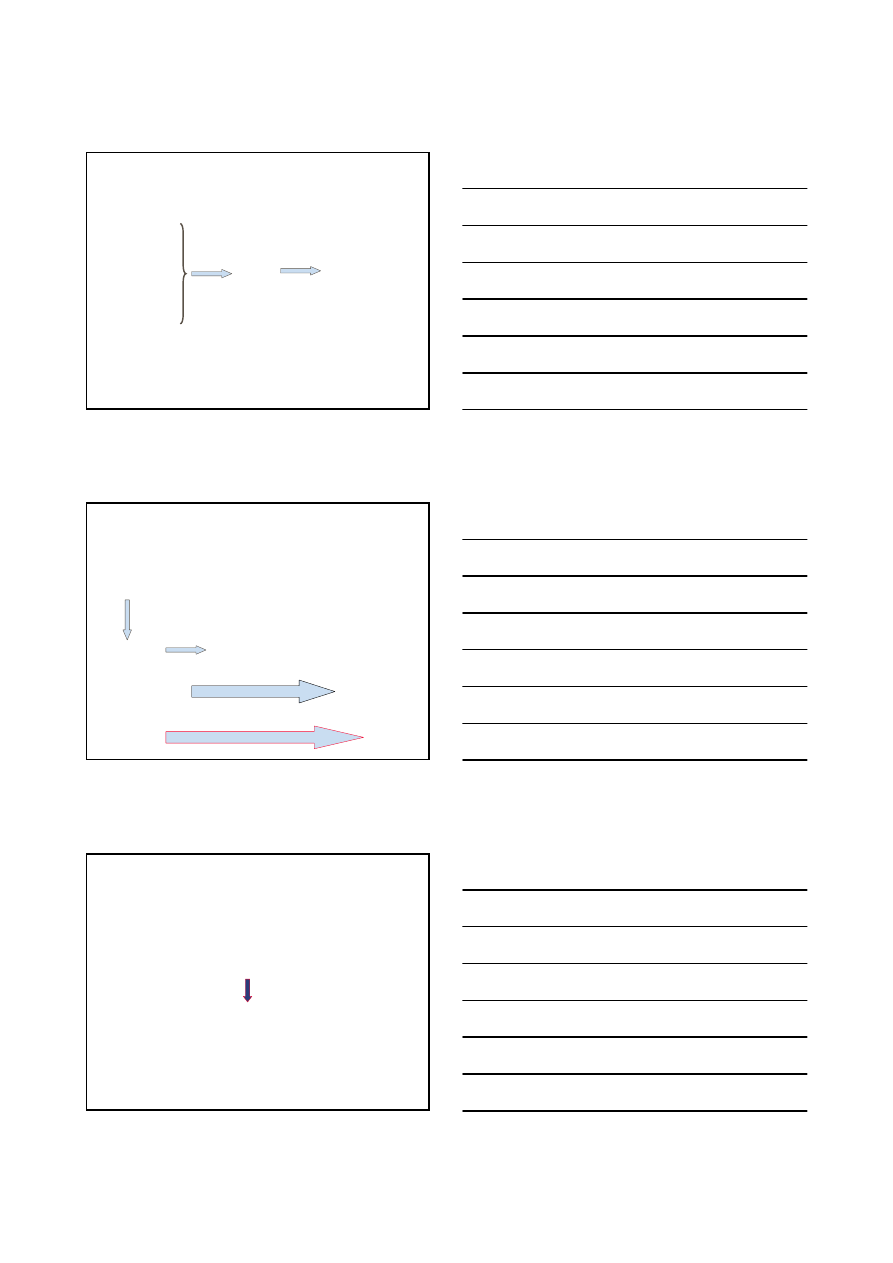
9
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
Temperatura wrzenia
ZWIĄZEK JONOWY
JONY
stan ciekły
stan stały
stan gazowy
wysoka temperatura
wrzenia
NaCl
t
w
1413°C
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
Temperatura wrzenia
ZWIĄZEK NIEJONOWY
CZĄSTECZKI
stan ciekły
oddziaływania
typu dipol – dipol
CH
4
t
w
– 161.5°C
siły van der Waalsa
H–Cl t
w
– 85°C
POLARNOŚĆ
TEMPERATURA WRZENIA
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
Temperatura wrzenia
ZWIĄZEK NIEJONOWY
CIECZE ZASOCJOWANE – cząsteczki połączone są wiązaniami
wodorowymi międzycząsteczkowymi
H–Cl t
w
– 85°C
H–F t
w
+ 15°C
H
2
S t
w
– 60°C
H
2
O t
w
+ 100°C
Dla porównania
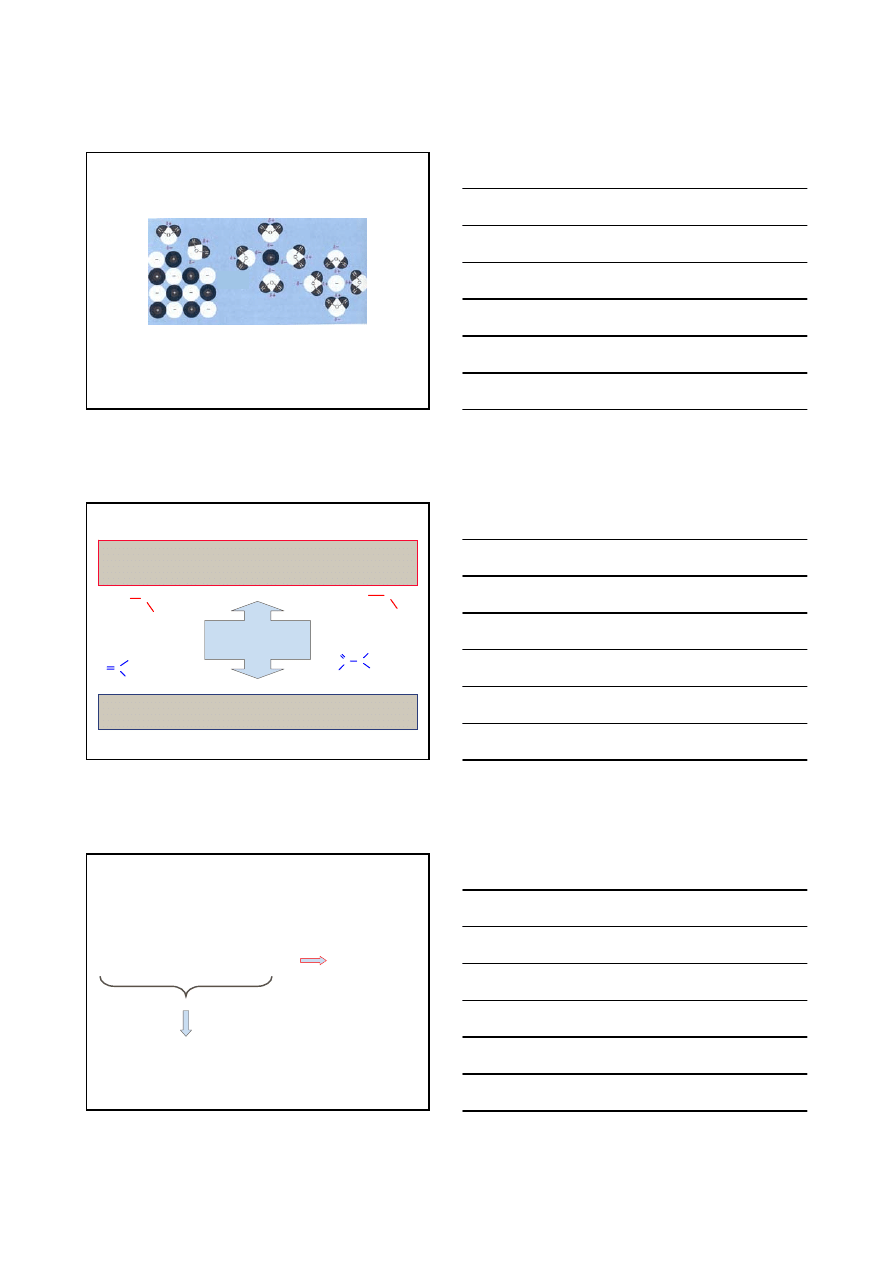
10
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
ROZPUSZCZALNOŚĆ
ZWIĄZEK JONOWY
JON SOLWATOWANY
ROZPUSZCZALNIKI
POLARNE
ROZPUSZCZALNIKI PROTONOWE – zawierają w swojej cząsteczce atom
wodoru połączony z atomem tlenu lub azotu, tzw. ‘protony ruchliwe’;
stabilizują aniony, lecz ograniczają ich reaktywność, np. zmniejszają ich
zasadowość czy nukleofilowość
ROZPUSZCZALNIKI APROTONOWE – nie zawierają w swojej cząsteczce
‘protonów ruchliwych’; silnie solwatują kationy, praktycznie nie oddziałują z
anionami – zwiększają ich zasadowość czy nukleofilowość
H
O
CH
3
H
O
H
S
O
CH
3
CH
3
DMSO
N
C
CH
3
CH
3
O
H
DMF
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
–
OH
DEKANOL
fragment hydrofobowy
fragment hydrofilowy
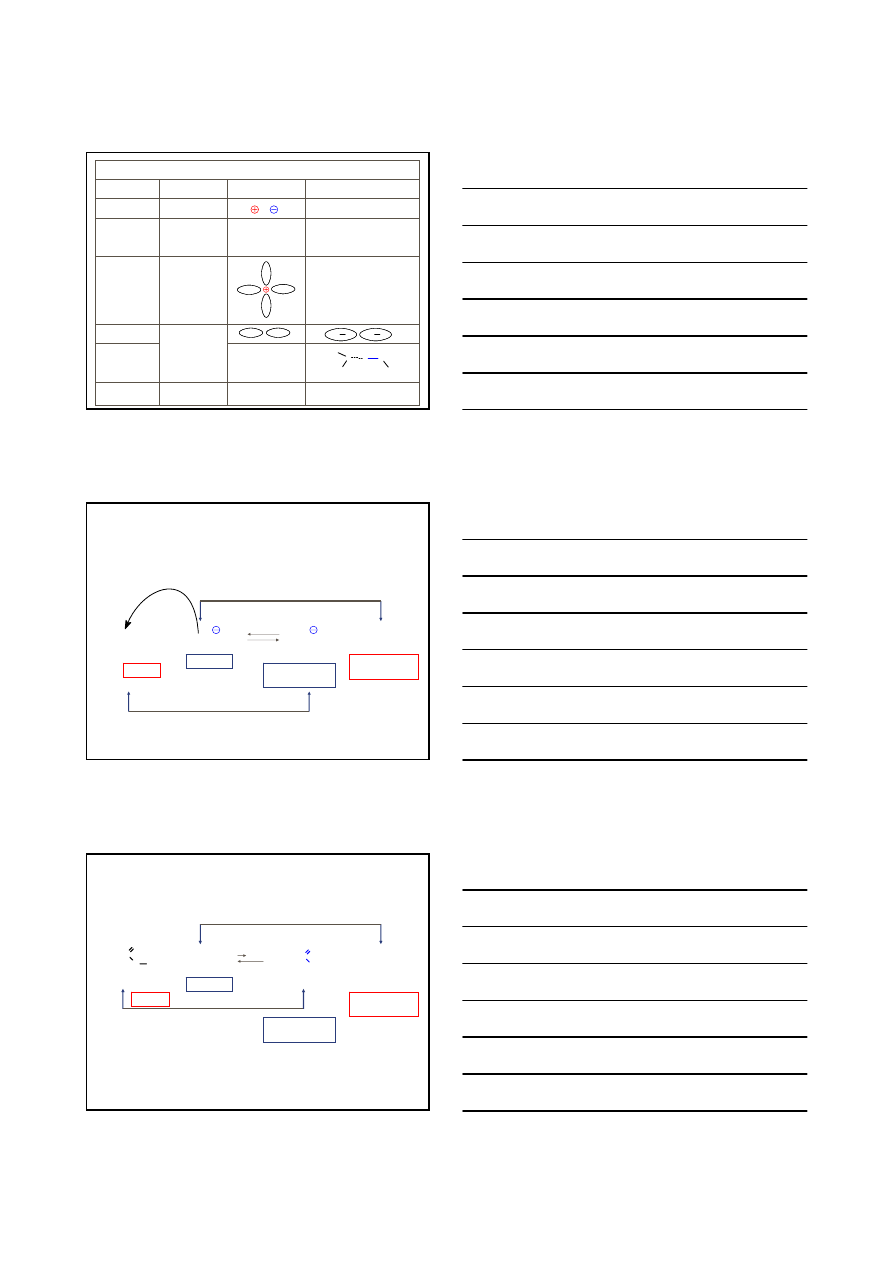
11
CH
4
·······CH
4
dipole chwilowe
słabe
siły van der
Waalsa
–X
⋅⋅⋅⋅ H–X–
wiązanie
wodorowe
średnie
→ słabe
(1–9 kcal/mol)
dipol - dipol
Na
+
w wodzie
średnie
jon – dipol
H – H 104 kcal/mol
CH
3
– CH
3
88 kcal/mol
I – I 36 kcal/mol
wiążąca para
elektronowa
mocne
(36–125 cal/mol)
wiązanie
kowalencyjne
sieć krystaliczna LiF
bardzo mocne
jon – jon
przykład
typ
moc
rodzaj
ODDZIAŁYWANIA
δ+
δ−
δ+
δ−
δ+
δ−
δ+
δ−
δ+
δ−
δ+
δ−
δ+
δ−
δ−
H
O
H
3
C
H
O
CH
3
CH
3
Cl
CH
3
Cl
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
KWASY
I
ZASADY
wg BRØNSTED – LOWRY’EGO
KWAS – donor protonu
ZASADA – akceptor protonu
+
+
SPRZĘŻONA PARA
SPRZĘŻONA PARA
SPRZĘŻONY
KWAS
ZASADA
KWAS
SPRZĘŻONA
ZASADA
H
– A
|A
|B
H
– B
+
H
2
O
+
CH
3
C
O
O
H
KWAS OCTOWY
CH
3
C
O
O
-
OCTAN
H
3
O
+
JON
HYDRONIOWY
SPRZĘŻONA PARA
SPRZĘŻONA PARA
SPRZĘŻONY
KWAS
ZASADA
KWAS
SPRZĘŻONA
ZASADA
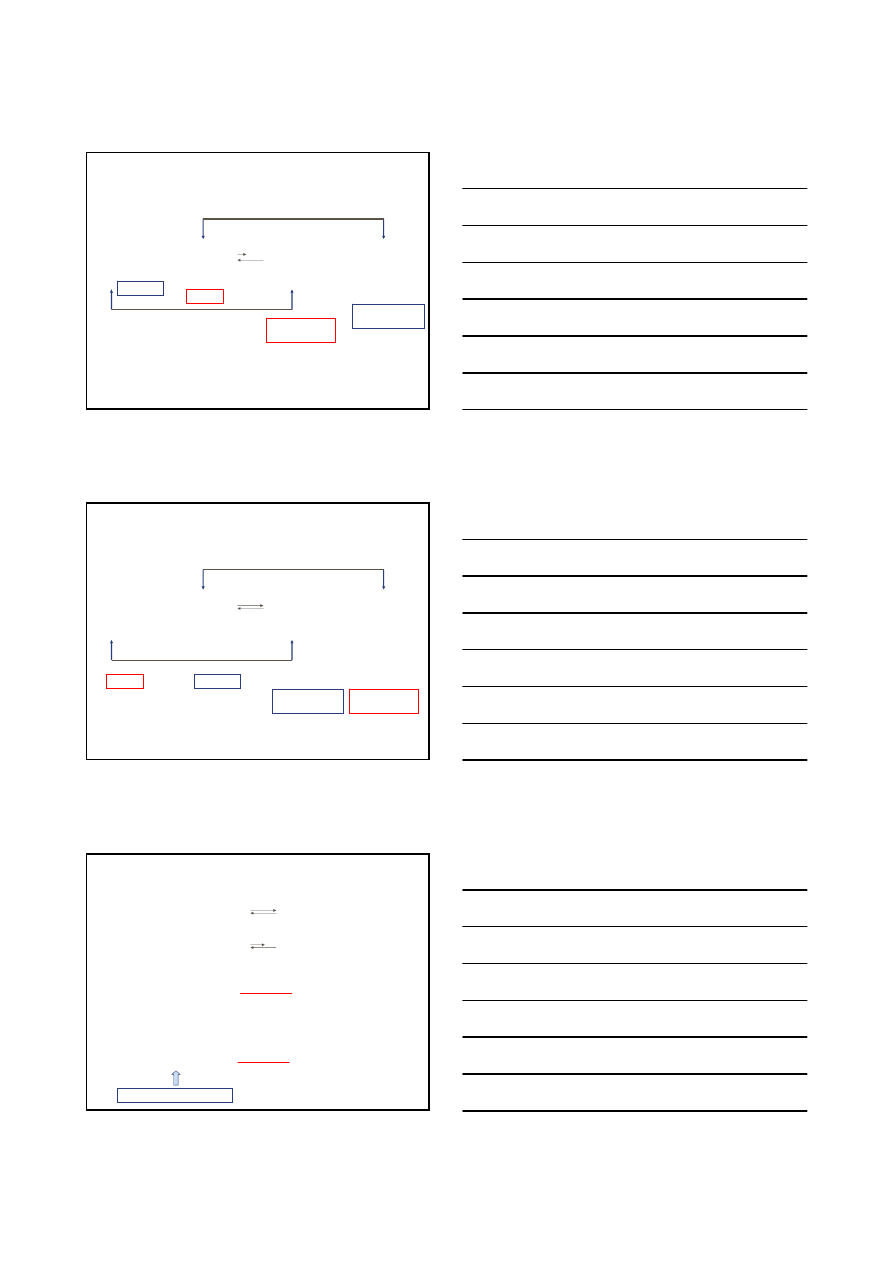
12
+
+
SPRZĘŻONA PARA
SPRZĘŻONA PARA
SPRZĘŻONY
KWAS
ZASADA
KWAS
SPRZĘŻONA
ZASADA
JON
HYDROKSYLOWY
OH
-
H
2
O
METYLONAMINA
CH
3
NH
2
JON
METYLOAMMONIOWY
CH
3
NH
3
+
+
+
SPRZĘŻONA PARA
SPRZĘŻONA PARA
SPRZĘŻONY
KWAS
ZASADA
KWAS
SPRZĘŻONA
ZASADA
JON
HYDROKSYLOWY
OH
-
H
2
O
H
3
O
+
JON
HYDRONIOWY
H
2
O
H – Cl + H
2
O Cl
-
+ H
3
O
+
H – A + H
2
O A
-
+ H
3
O
+
K
K =
[H
2
O][HA]
[H
3
O
+
][A
-
]
Jeżeli
[H
2
O] = const.
oraz
[H
2
O] = 55.6 mol/l
, to
K
a
= K [H
2
O] =
[HA]
[H
3
O
+
][A
-
]
STAŁA KWASOWOŚCI K
a
13
pK
a
= – log K
a
moc kwasu
Cl
-
-7.0
H
Cl
NO
3
-
-1.3
H
NO
3
F
-
3.45
H
F
CH
3
COO
-
4.76
CH
3
COO
H
CN
-
9.31
H
CN
HO
-
15.74
H
2
O
CH
3
CH
2
O
-
16.0
CH
3
CH
2
O
H
SPRZĘŻONA
ZASADA
pK
a
KWAS
SILNA
ZASADA
SŁABA
ZASADA
SŁABY
KWAS
MOCNY
KWAS
CH
3
COOH + OH
-
H
2
O + CH
3
COO
-
pK
a
= 4.76
pK
a
= 15.74
STRUKTURA I WŁAŚCIWOŚCI ZWIĄZKÓW ORGANICZNYCH
KWASY I
ZASADY
wg LEWISA
KWAS – akceptor pary elektronowej
ZASADA – donor pary elektronowej
F
B
F
F
KWAS LEWISA
+
O
CH
3
CH
3
F
B
F
F
CH
3
CH
3
O
ZASADA LEWISA
KOMPLEKS ETERU
DIMETYLOWEGO Z
TRIFLUOROBOREM
Cl H
δ−
δ+
H
CH
3
O
+
Zn
+2
KWAS LEWISA
ZASADA LEWISA
H
CH
3
O
Zn
2
O
H
H
+
+
Cl
-
ZASADA LEWISA
KWAS LEWISA
H
O
H
H
14
KWASY LEWISA:
donory protonów, np. H
2
O, HCl, H
2
SO
4
, RCOOH, PhOH, ROH
kationy, np. Li
+
, Mg
+2
, Br
+
związki metali
•
grupy IIIA BF
3
, AlCl
3
•
przejściowych, np. TiCl
4
, FeCl
3
, ZnCl
2
, SnCl
4
ZASADY LEWISA:
R – OH, R – O – R, R – C – H, R – C – R
O
O
R – C ,
O
Cl
R – C ,
O
OH
R – C ,
O
OR’
R – C ,
O
NH
2
R – S – R , R – NH
2
R – C
+
BF
3
R – C
O
H
O
H
BF
3
C
n
H
2n+2
ALKANY
336 319
ejkoz
an
CH
3
(CH
2
)
18
CH
3
C
20
H
42
72
dek
an
CH
3
(CH
2
)
8
CH
3
C
10
H
22
35
non
an
CH
3
(CH
2
)
7
CH
3
C
9
H
20
18
okt
an
CH
3
(CH
2
)
6
CH
3
C
8
H
18
9
hept
an
CH
3
(CH
2
)
5
CH
3
C
7
H
16
5
heks
an
CH
3
(CH
2
)
4
CH
3
C
6
H
14
ciecze
3
pent
an
CH
3
(CH
2
)
3
CH
3
C
5
H
12
2
but
an
CH
3
(CH
2
)
2
CH
3
C
4
H
10
1
prop
an
CH
3
CH
2
CH
3
C
3
H
8
1
et
an
CH
3
CH
3
C
2
H
6
gazy
1
met
an
CH
4
CH
4
Stan skupienia
Liczba
izomerów
konsty-
tucyjnych
Nazwa alkanu
prostego
Wzór strukturalny
Wzór
sumaryczny
15
WŁAŚCIWOŚCI CHEMICZNE ALKANÓW
NIE REAGUJĄ Z KWASMI I ZASADAMI
REAKCJA UTLENIANIA – SPALANIE W ATMOSFERZE TLENU
CIEPŁO SPALANIA
– ilość ciepła wydzielonego podczas spalania 1 mola
węglowodoru do dwutlenku węgla i wody
-892 kJmol
-1
CH
4
+ O
2
CO
2
+ H
2
O + Q
CH
2
X
2
CHX
3
+ HX
X
2
CHX
3
CX
4
+ HX
X
2
REAKCJA HALOGENOWANIA ALKANÓW
CH
4
CH
3
X + HX
X
2
CH
3
X CH
2
X
2
+ HX
X
2
X
2
: F
2
> Cl
2
> Br
2
> I
2
REAKTYWNOŚĆ CHLOROWCA
MECHANIZM REAKCJI HALOGENOWANIA ALKANÓW
1. ETAP – INICJACJA REAKCJI
Cl
2
Cl
Cl
2 Cl + Cl
h
ν
Cl
Cl
∆H
°
= E* = +58 kcalmol
-1
E
p
postęp reakcji
2 Cl
∆H° = +58 kcal/mol
16
MECHANIZM REAKCJI CHLOROWANIA ALKANÓW
2. ETAP
+
Cl
H CH
3
CH
3
+ HCl
3. ETAP
CH
3
Cl
Cl
Cl +
Cl
CH
3
+
∆H° = +1kcal/mol
∆H° = -25.5 kcal/mol
MECHANIZM REAKCJI CHLOROWANIA ALKANÓW
Br
2
E* = +18.6 kcalmol
-1
Cl
2
E* = +3.8 kcalmol
-1
2. ETAP
MECHANIZM REAKCJI CHLOROWANIA ALKANÓW
4. ETAP – REKOMBINACJA RODNIKÓW
CH
3
Cl
+
Cl
CH
3
CH
3
CH
3
CH
3
+
H
3
C
+
Cl
Cl
Cl
Cl
E
p
postęp reakcji
∆H° = -83.5 kcal/mol
∆H° = -58 kcal/mol
∆H° = -88 kcal/mol
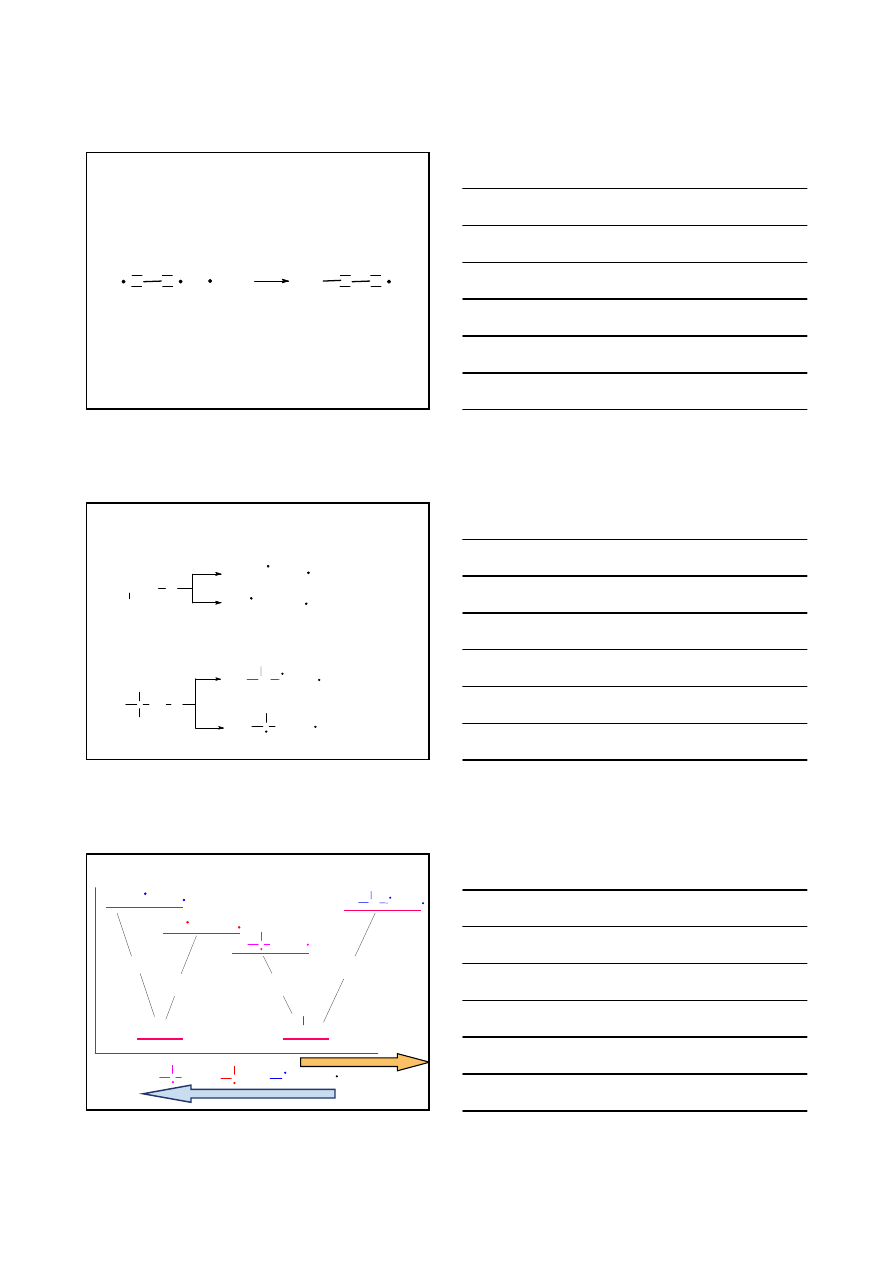
17
IHIBITORY REAKCJI RODNIKOWYCH
Substancje, które dodane do mieszaniny
reakcyjnej nawet w małych ilościach powodują
widoczne zmniejszenie szybkości procesu
CH
3
+
O
O
CH
3
O
O
CH
3
CHCH
2
H
H
CH
3
CH
2
CH
2
CH
3
CHCH
3
+
H
+
H
CH
3
C
H
3
C
CH
2
H
H
+
H
+
H
CH
3
CH
H
3
C
CH
2
CH
3
C
H
3
C
CH
3
CH
3
CH
2
CH
3
CH
3
CHCH
3
CH
3
CH
3
CH
2
CH
2
+
H
CH
3
CHCH
3
+
H
+
H
CH
3
C
H
3
C
CH
3
+
H
CH
3
CH
H
3
C
CH
2
∆H° = +98 kcal/mol
∆H° = +94 kcal/mol
∆H° = +98 kcal/mol
∆H° = +91 kcal/mol
C
C
C
C
C
CH
C
C CH
2
CH
3
>
>
>
STABINOŚĆ KARBORODNIKÓW
3°
2°
1°
ENERGIA DYSOCJACJI C – H
18
REASUMUJĄC – szybkość reakcji halogenowania alkanów zależy od:
1. rzędowości atomu węgla powiązanego z reagującym atomem wodoru
CH
3
CH
H
3
C
CH
3
CH
3
C
H
3
C
CH
3
Cl
CH
3
CH
H
3
C
CH
2
Cl
+
+
HCl
Cl
2
, h
ν
48%
29%
2-metylopropan
1-chloro-2-metylopropan
2-chloro-2-metylopropan
2. rodzaju halogenu
>99%
ślady
2-metylopropan
1-
bromo
-2-metylopropan
2-
bromo
-2-metylopropan
CH
3
CH
H
3
C
CH
3
CH
3
C
H
3
C
CH
3
Br
CH
3
CH
H
3
C
CH
2
Br
+
+
H
Br
Br
2
, h
ν
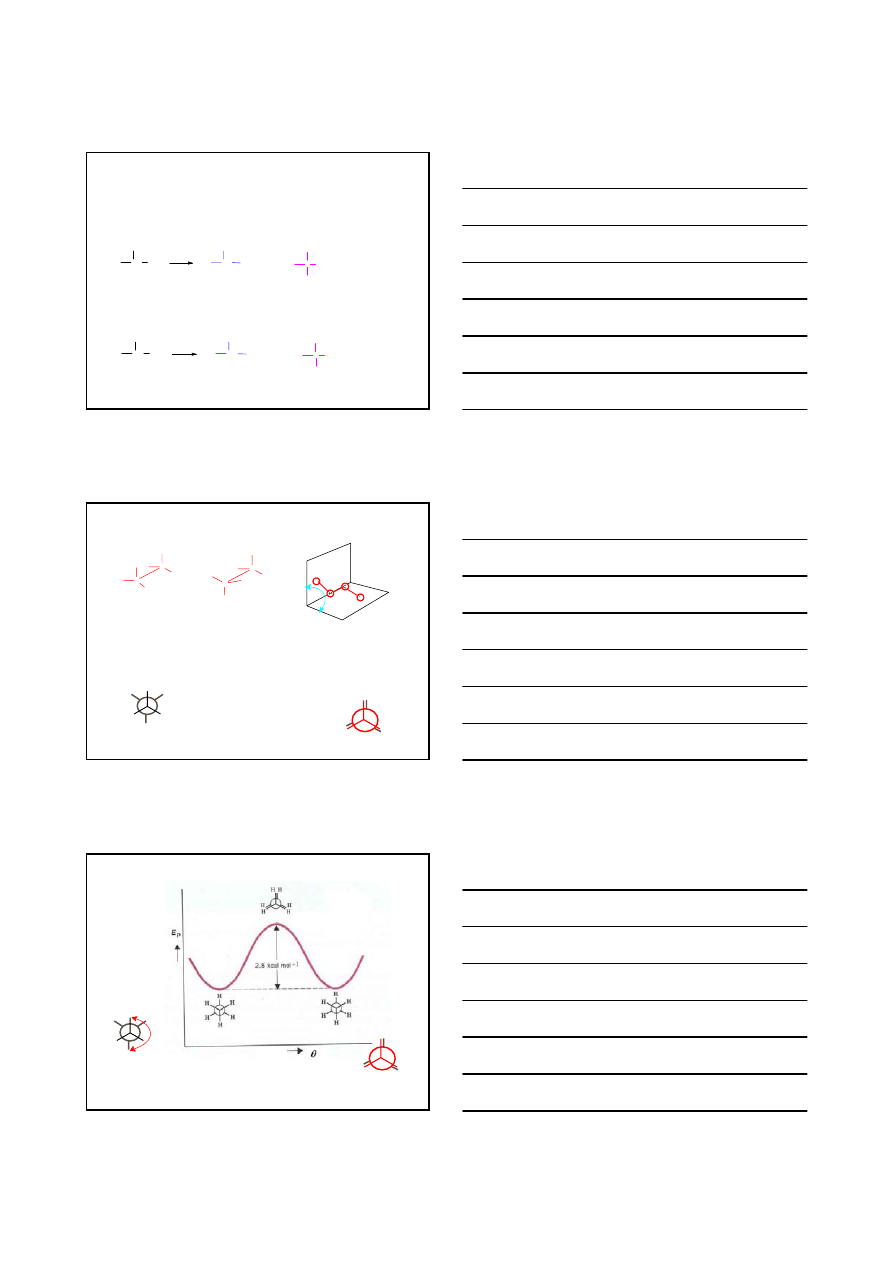
KONFORMACJE ALKANÓW
KONFORMACJE
– różne układy przestrzenne w cząsteczkach, które mogą się
wzajemnie w siebie przekształcać w wyniku swobodnego obrotu wokół wiązania
pojedynczego
θ
kąt torsyjny
C
C
H
H
H
H
H
H
C
C
H
H
H
H
H
H
θ = 0°
θ = 180°
NAPRZECIWLEGŁA
ANTIPERIPLANARNA
NAPRZEMIANLEGŁA
SYNPERIPLANARNA
KONFORMACJE ETANU
θ = 180°
ANTIPERIPLANARNA
NAPRZEMIANLEGŁA
θ = 0°
NAPRZECIWLEGŁA
SYNPERIPLANARNA
19
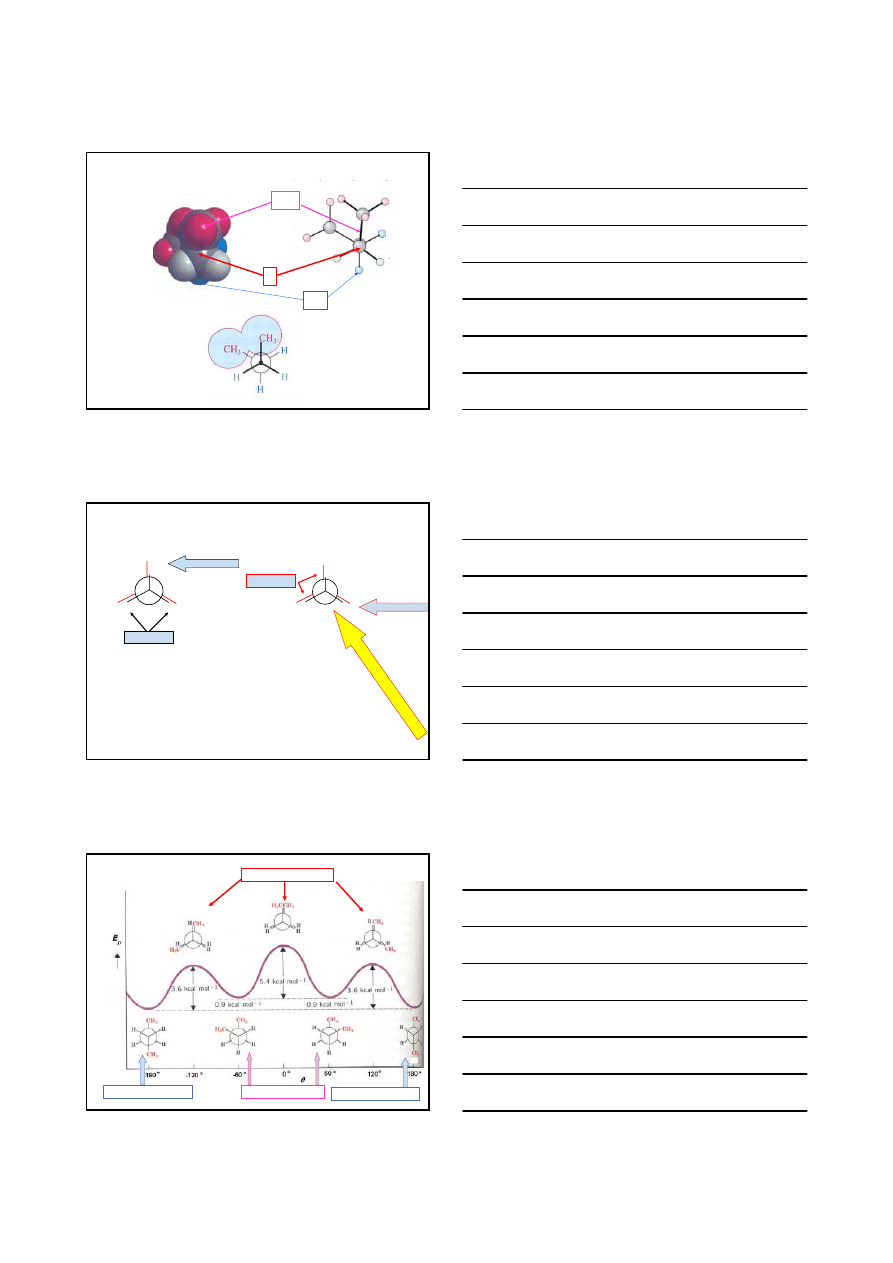
KONFORMACJE BUTANU
C
CH
3
H
CH
3
H
H
H
CH
3
H
11kJ/mol
2
× 4kJ/mol
CH
3
H
H
H
H
H
3
C
4kJ/mol
2
× 6kJ/mol
ST
A
B
IL
N
IE
JS
ZA
K
O
N
FIR
M
A
C
JA
KONFORMACJE BUTANU
KONFORMACJE BUTANU
ANTIPERIPLANARNA
ANTIPERIPLANARNA
SYNKLINALNA
typu Gauche
SYNPERIPLANARNA
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron