1
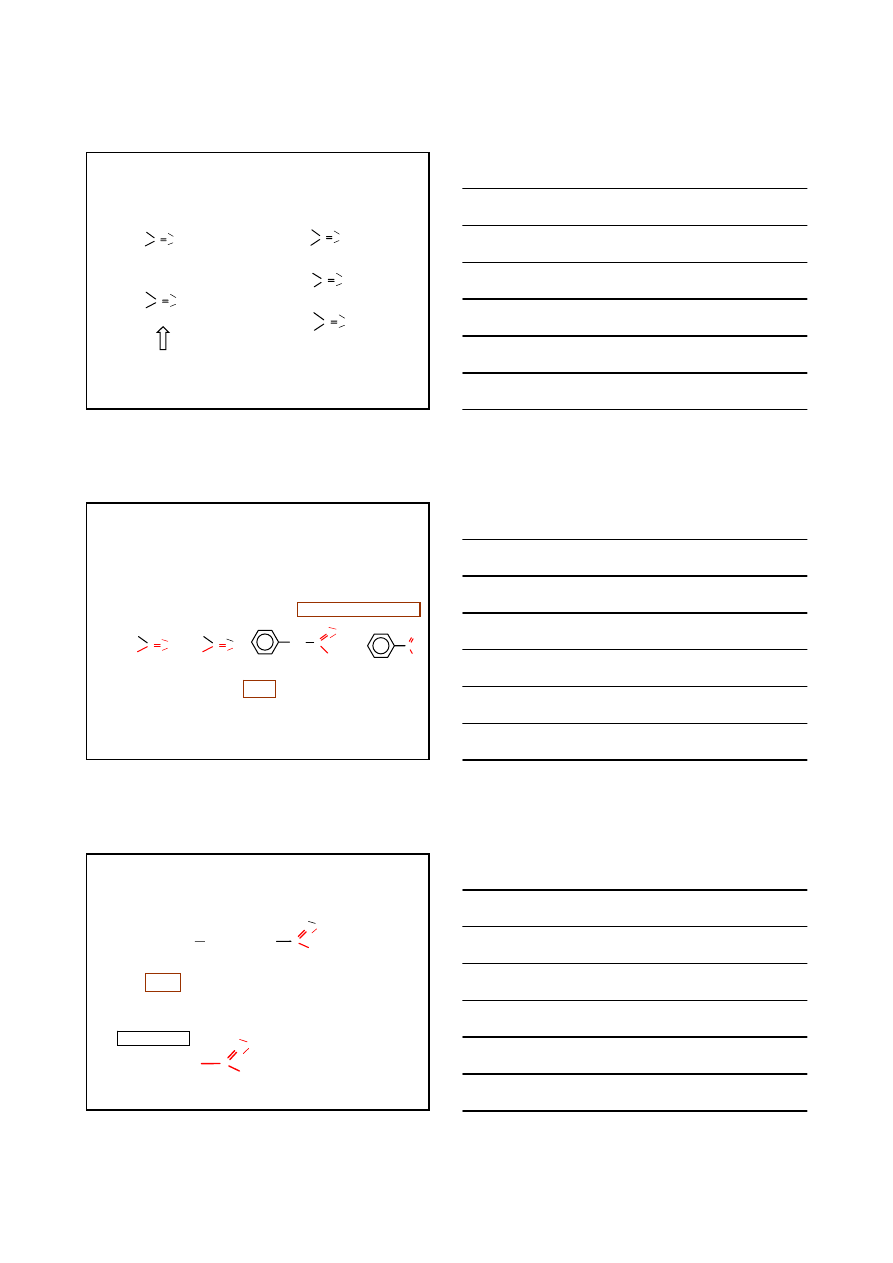
ZWIĄZKI KARBONYLOWE
C O
R
H
C O
Ar
H
ALDEHYD
KETON
C O
R
R'
C O
Ar
R
C O
Ar
Ar'
bardziej reaktywne niż ketony
łatwiej utleniają się niż ketony
ZWIĄZKI KARBONYLOWE – NOMENKLATURA
AL
DEHYD –
łac.
‘
ALcohol
DEHYDrogenatus’
(‘otrzymany przez odwodornienie alkoholu’)
NOMENKLATURA SYSTEMATYCZNA IUPAC
ALDEHYDÓW
1.
Najdłuższy łańcuch zawierający grupę –CHO decyduje o rdzeniu nazwy;
dodaje się końcówkę
-al
2.
Atom węgla grupy –CHO otrzymuje lokant
1
metan
al
etan
al
fenyloetan
al
C
H
O
C O
H
H
C O
H
3
C
H
C
O
CH
2
H
aldehyd
mrówkowy
aldehyd
octowy
aldehyd
fenylooctowy
aldehyd
benzoesowy
form
aldehyd
acet
aldehyd
benz
aldehyd
nie uwzględnia się go w nazwie
ALE
ZWIĄZKI KARBONYLOWE – NOMENKLATURA
NOMENKLATURA
ALDEHYDÓW
C
O
CH
2
CH
2
CH
2
CH
2
H
Cl
δ γ β α
5 4 3 2 1
5
-chloro
pentan
al
aldehyd
δ-chloro
walerianowy
ALE
PODSTAWNIK
C
O
H
FORMYL
2
ZWIĄZKI KARBONYLOWE – NOMENKLATURA
NOMENKLATURA SYSTEMATYCZNA IUPAC
KETONÓW
1.
Ustala się najdłuższy łańcuch zawierający grupę –CO–
2.
Do nazwy alkanu o takiej samej liczbie atomów węgla dodaje się końcówkę
-on
3.
Przed nazwą należy podać najniższy z możliwych lokant atomu węgla
karbonylowego (powiązanego z atomem tlenu)
C
O
CH
3
CH
3
C
O
CH
3
CH
2
CH
3
C
O
CH
3
CH
CH
3
CH
3
C
O
CH
3
CH
2
CH CH
2
propan
on
2-
butan
on
3-metylo-
2-
butan
on
4-penten-
2-on
a nie 1-penten-4-on
nie ma potrzeby
podawać lokantu
ZWIĄZKI KARBONYLOWE – NOMENKLATURA
NOMENKLATURA ZWYCZAJOWA
KETONÓW
Po słowie
KETON
podaje się w kolejności alfabetycznej nazwy w formie
przymiotnikowej podstawników na atomie karbonylowym węgla
C
O
CH
3
CH
3
C
O
CH
3
CH
2
CH
3
C
O
CH
3
CH
CH
3
CH
3
C
O
CH
3
CH
2
CH CH
2
keton
dimetylowy
keton
etylowometylowy
keton
allilowometylowy
keton
izopropylowometylowy
ZWIĄZKI KARBONYLOWE – NOMENKLATURA
NOMENKLATURA ZWYCZAJOWA
KETONÓW
ketony fenylowe – występuje w nazwie końcówka –
FENON
C CH
3
O
C CH
2
CH
3
O
C
O
benzo
fenon
propio
fenon
aceto
fenon
3
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI FIZYCZNE
C O
R'
R
+δ
−δ
∠CC(O)C ≈ 120°
µ
= 2.3 – 2.8 D
1.
Temperatura wrzenia
CH
3
CH
2
CH
2
CHO
BUTANAL
CH
3
COCH
2
CH
3
2-
BUTANON
M 72
tw
76°C
tw
80°C
CH
3
CH
2
CH
2
CH
2
CH
3
PENTAN
CH
3
CH
2
OCH
2
CH
3
ETER DIETYLOWY
M 72
M 74
tw
36°C
tw
37°C
CH
3
CH
2
CH
2
CH
2
OH
BUTANOL
CH
3
CH
2
CO
2
H
KWAS PROPANOWY
M 74
tw
118°C
tw
141°C
TEMPERATURA WRZENIA / POLARNOŚĆ
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI FIZYCZNE
2.
Rozpuszczalność w wodzie
Małe związki karbonylowe (C
≤ 5) – dobrze rozpuszczalne w H
2
O
C
O
H
H
formaldehyd, gaz tw -21°C
formalina – roztwór wodny
paraformaldehyd – polimery, ciała stałe
trioksan
CH
2
O
n
O
O
O
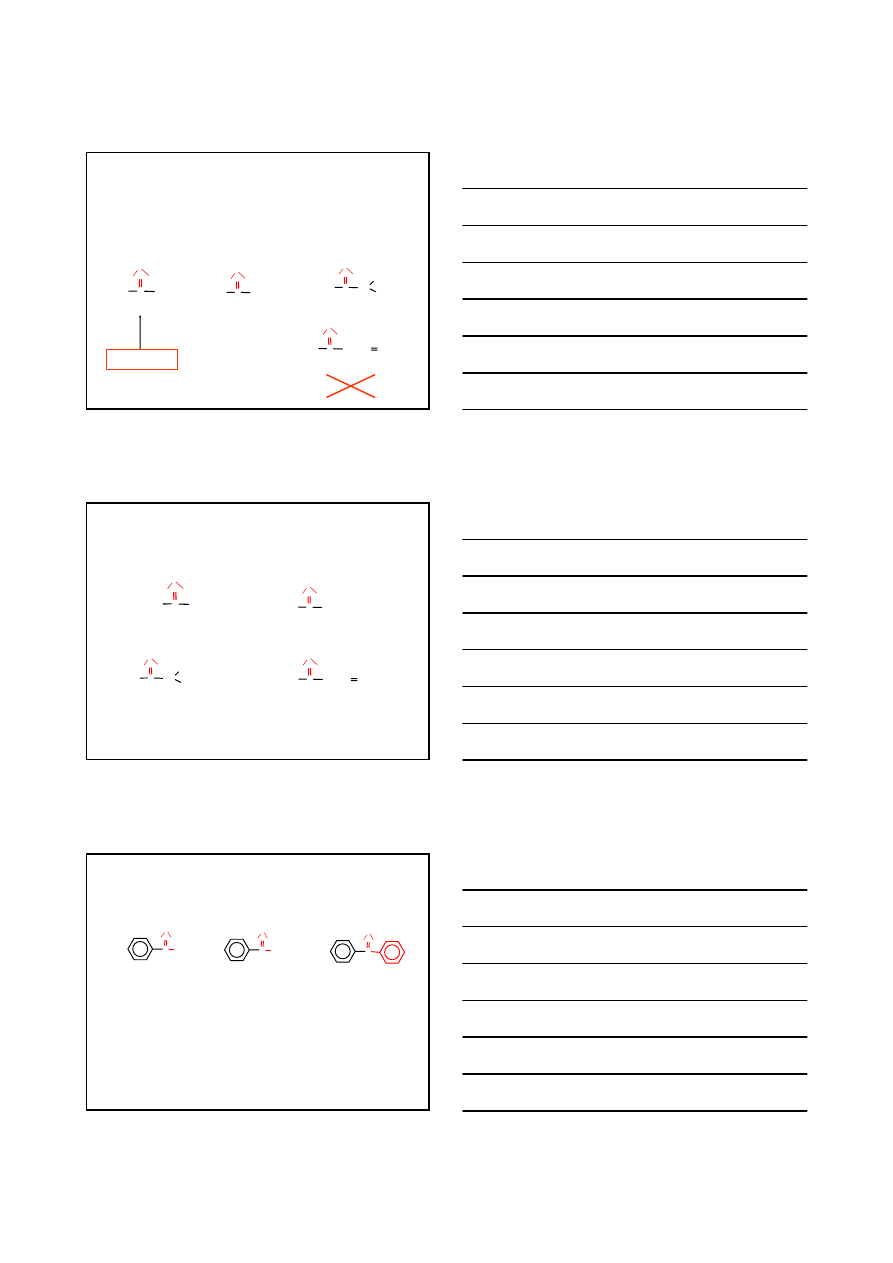
ZWIĄZKI KARBONYLOWE
OTRZYMYWANIE
1.
Reakcje utleniania
reakcje utleniania alkoholi 1° i 2°
[O]: Na
2
Cr
2
O
7
/H
2
SO
4
CrO
3
/CH
3
CO
2
H
CrO
3
×Pyr × HCl (PCC)
R
CH
2
OH
R
CHOH
R'
lub
[O]
lub
R
C
R'
O
R
C
O
H
[O]
R
C
O
OH
USUWANIE ALDEHYDU ZE
ŚRODOWISKA REAKCJI
R
C
O
H
R
CH
2
OH
PCC
4
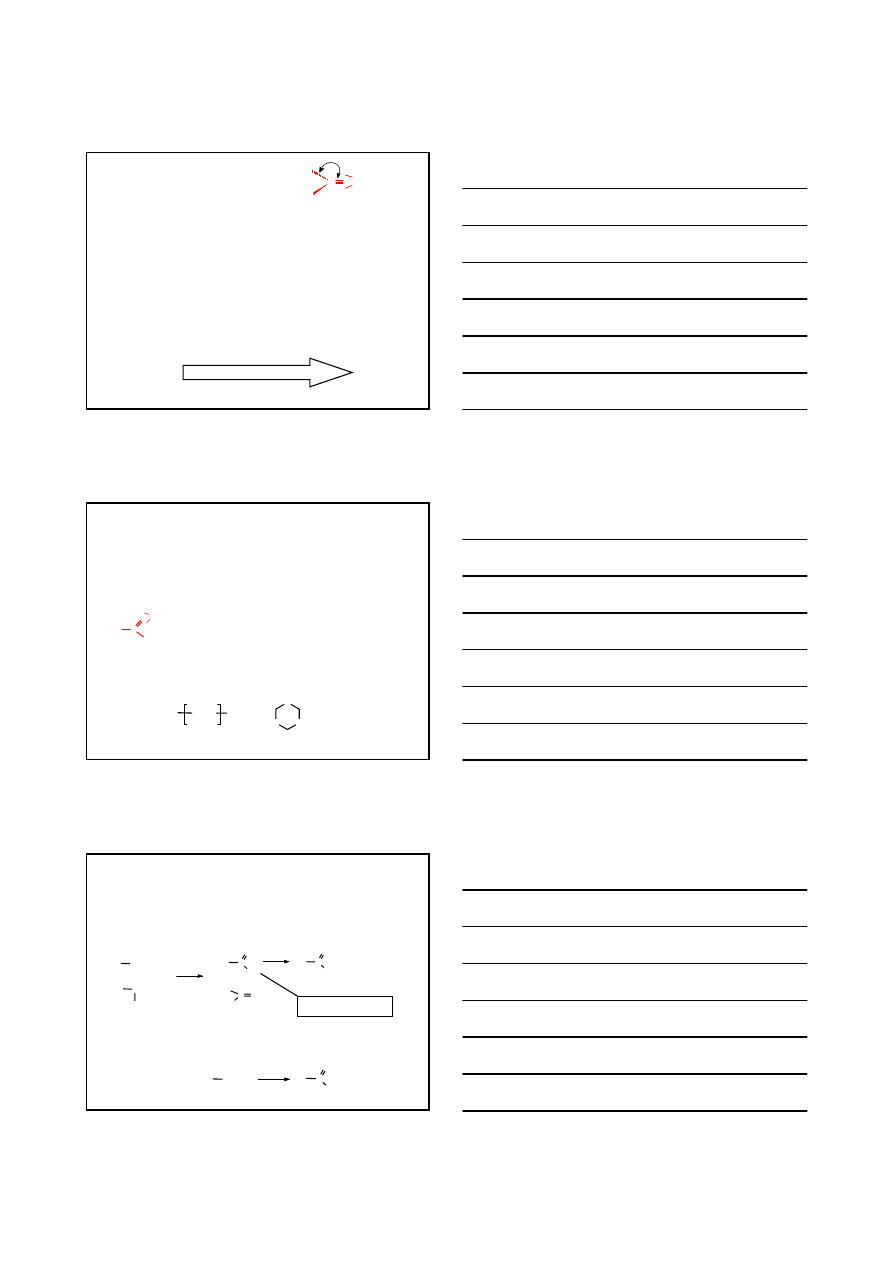
ZWIĄZKI KARBONYLOWE
OTRZYMYWANIE
1.
Reakcje utleniania
reakcje utleniania alkenów
R"
C
R'
O
H
R"
R
R'
1. O
3
2. H
2
O/Zn
R
C
O
H
+
PRZYKŁADY
1. O
3
2. H
2
O/Zn
CCH
2
CH
2
CH
2
CH
2
C
O
H
H
O
CH
3
CH CH
2
1. O
3
2. H
2
O/Zn
CH
3
CHO + H
2
C=O
reakcje utleniania vic-dioli
IO
4
-
t. pok. pH 7
H
C
R'
O
R
C
O
H
+
CH CH R
R'
OH OH
ZWIĄZKI KARBONYLOWE
OTRZYMYWANIE
2.
Reakcje acylowania – metoda Friedel – Craftsa
C R
O
AlCl
3
C R
O
Cl
+
AlCl
3
H
3
O
+
C R
O
3.
Metoda przemysłowa – reakcja addycji wody do alkinów
H
R
H
OH
H C C R
HgSO
4
, H
2
SO
4
H
2
O
R
C
O
CH
3
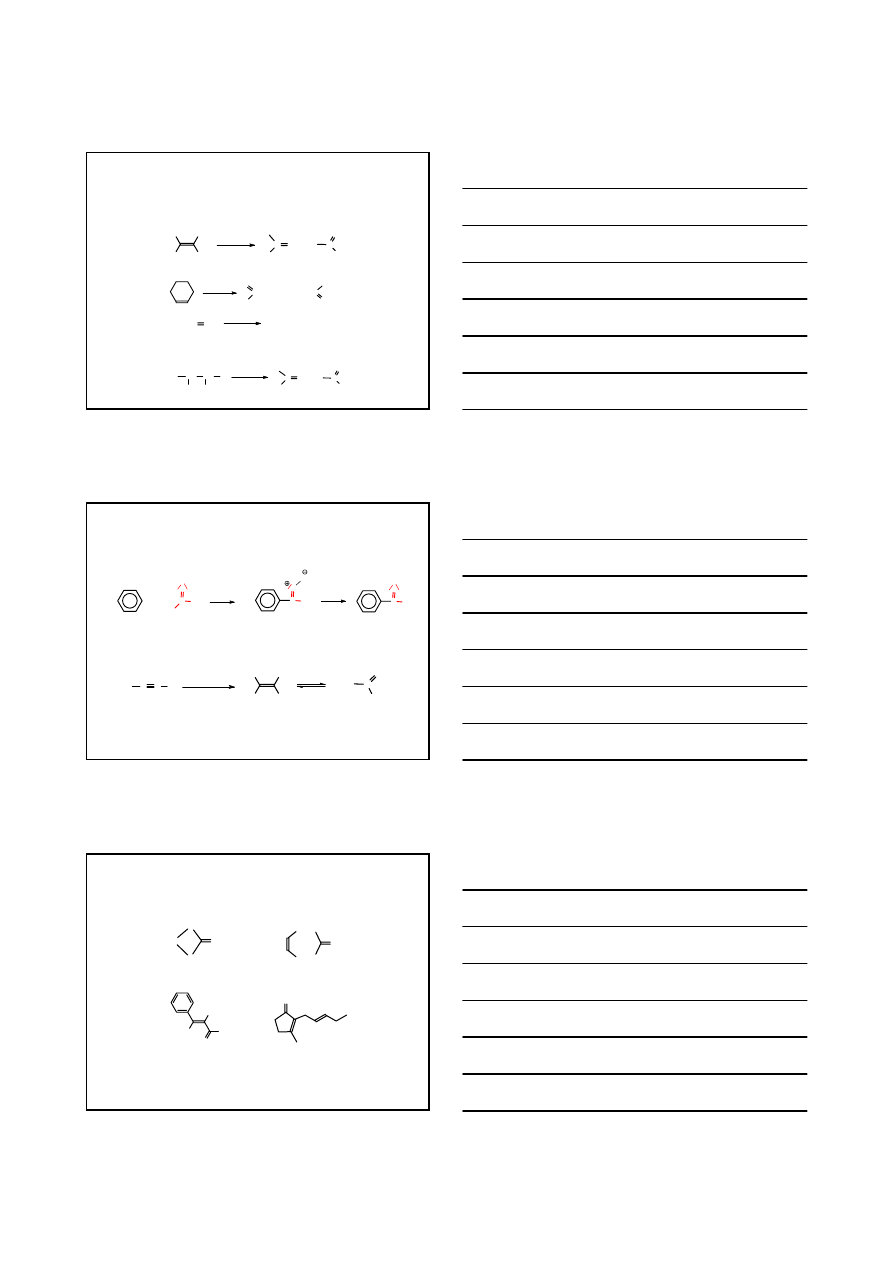
ZWIĄZKI KARBONYLOWE
OTRZYMYWANIE
4.
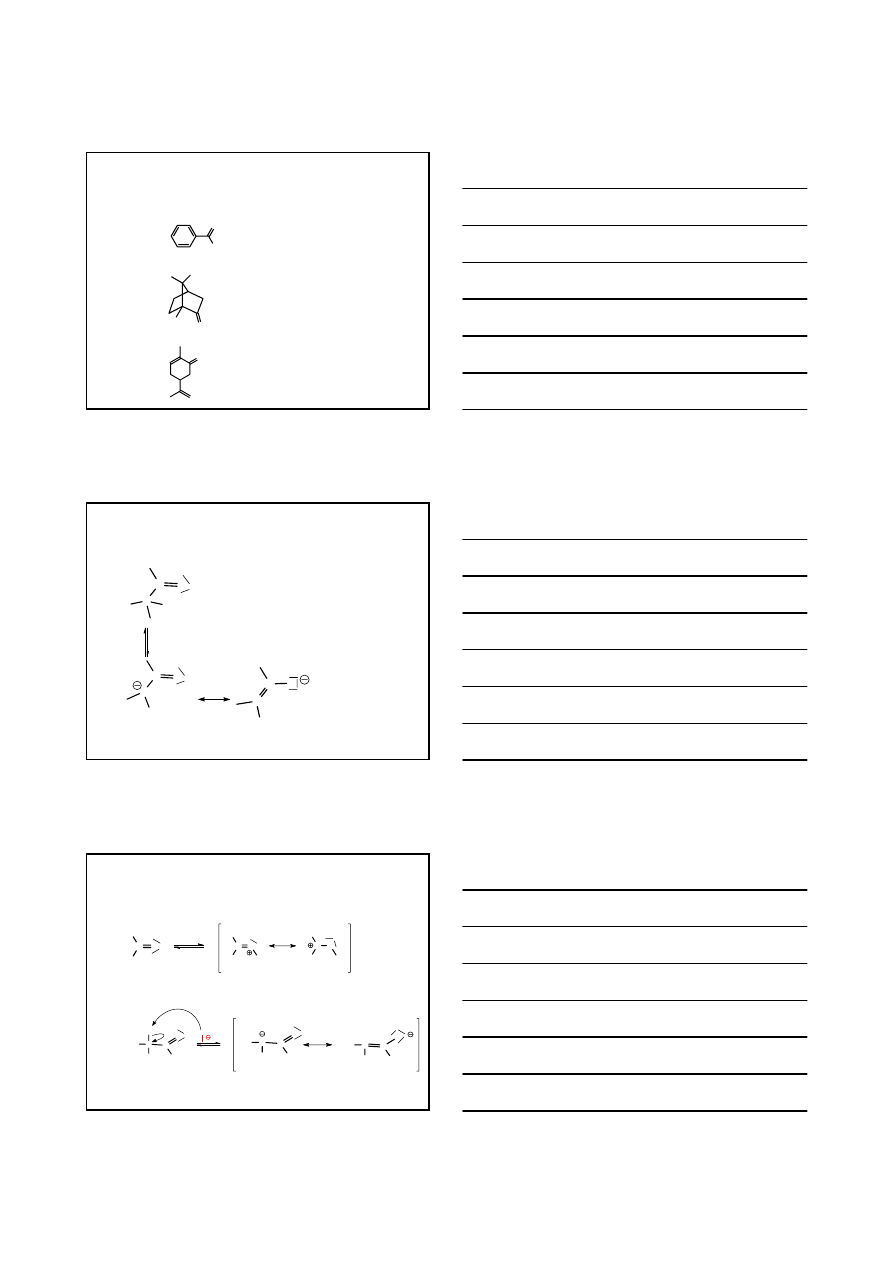
Związki karbonylowe izolowane ze źródeł naturalnych
(CH
2
)
13
CH
2
CH
2
O
(CH
2
)
7
(CH
2
)
7
O
muskon
O
kora drzewa cynamonowego – aldehyd cynamonowy
fiołki - n-oktanal + n-nonanal
H
H
O
H
olejek różany – 50% n-heptanal
jaśmin – pochodna pochodna cyklopentenonu
makrocykliczne ketony utrwalające zapachy – piżmo
5
ZWIĄZKI KARBONYLOWE
OTRZYMYWANIE
4.
Związki karbonylowe izolowane ze źródeł naturalnych
olejek migdałowy – aldehyd benzoesowy
kamfora
olejek miętowy – karwon
H
O
O
O
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI CHEMICZNE
2.
DEFICYT ELEKTRONOWY NA ATOMIE WĘGLA
C
H C
O
1.
SPOLARYZOWANE WIĄZANIE C=O – niewiążące pary
elektronów na atomie tlenu
+δ
−δ
3.
‘RUCHLIWY’ PROTON NA ATOMIE WĘGLA C
α
H
4.
TAUTOMERIA – wiązanie podwójne C=C
-H
+
C
C
O
C
C
O
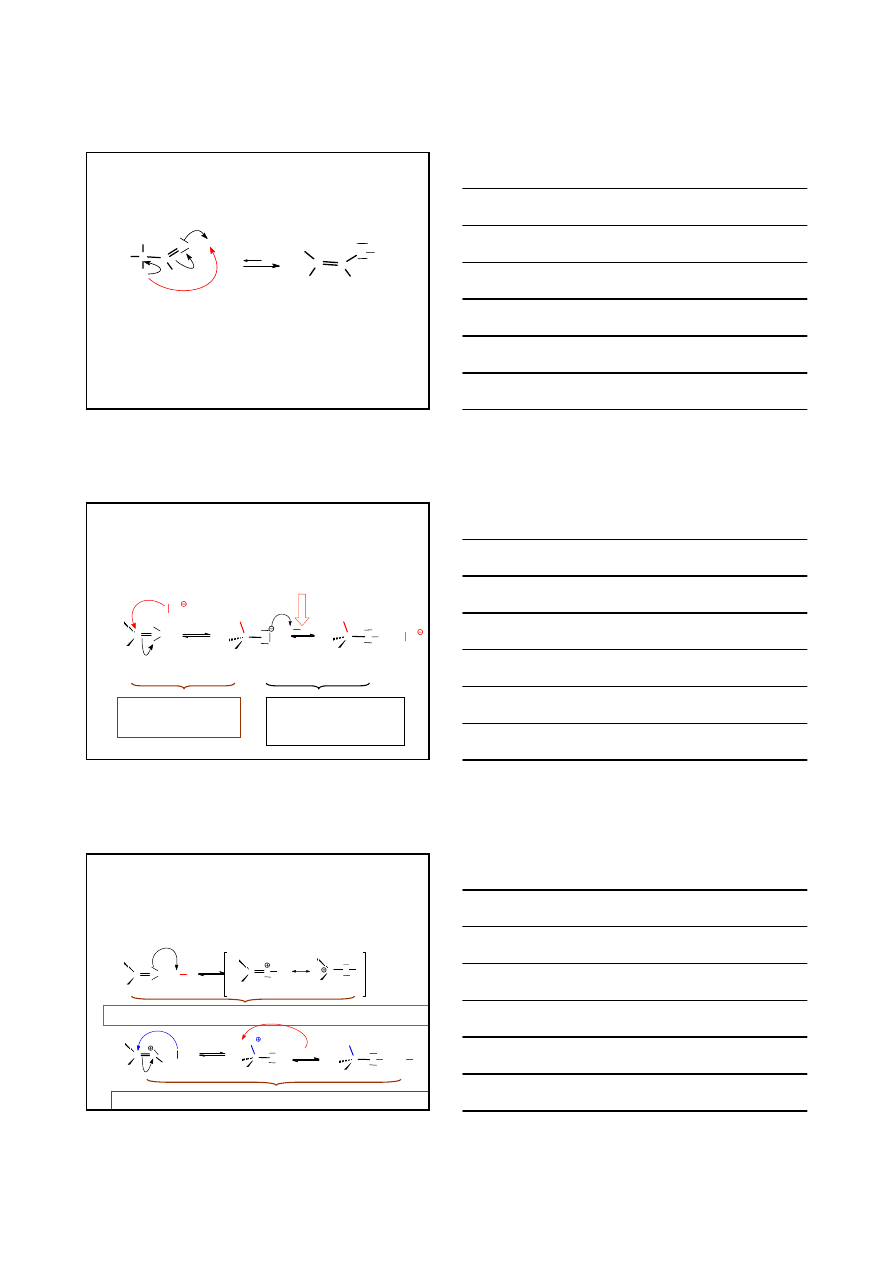
Ad. 1. SPOLARYZOWANE WIĄZANIE C=O – niewiążące pary elektronów na atomie tlenu
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI CHEMICZNE
+H
+
H
C
R
O
H
C
R
O
H
H
C
R
O
H
Ad. 3. RUCHLIWY’ PROTON NA ATOMIE WĘGLA C
α
H
C
C
O
H
R
H
B
H
C
C
O
R
H
H
C
C
O
R
H
6
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI CHEMICZNE
Ad. 4. TAUTOMERIA – wiązanie podwójne C=C
H
C
C
O
H
R
H
H
C
C
O
H
R
H
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI CHEMICZNE
Ad. 2.
DEFICYT ELEKTRONOWY NA ATOMIE WĘGLA –
reakcje przyłączenia nukleofilowego do wiązania C=O
MECHANIZM REAKCJI BIEGNĄCEJ PRZY UDZIALE SILNEGO NUKLEOFILA
R
C
R'
O
Nu
+δ −δ
wolno
R
C
R'
O
Nu
szybko
Nu
H
R
C
R'
O
Nu
H
Nu
+
CZĄSTECZKA
PLANARNA
INTERMEDIAT
TETRAEDRYCZNY
PRODUKT
TETRAEDRYCZNY
ETAP 1
Nukleofil tworzy wiązanie z atomem
wegla C
karbonyl
poprzez ‘przekazanie’
swojej pary elektronów
ETAP 2
Jon alkoksylowy jako silna zasada
‘odrywa’ proton od jakiegokolwiek
kwasu, np. odczynnika nukleofilowego
czy rozpuszczalnika
KW
A
S
ZWIĄZKI KARBONYLOWE
WŁAŚCIWOŚCI CHEMICZNE
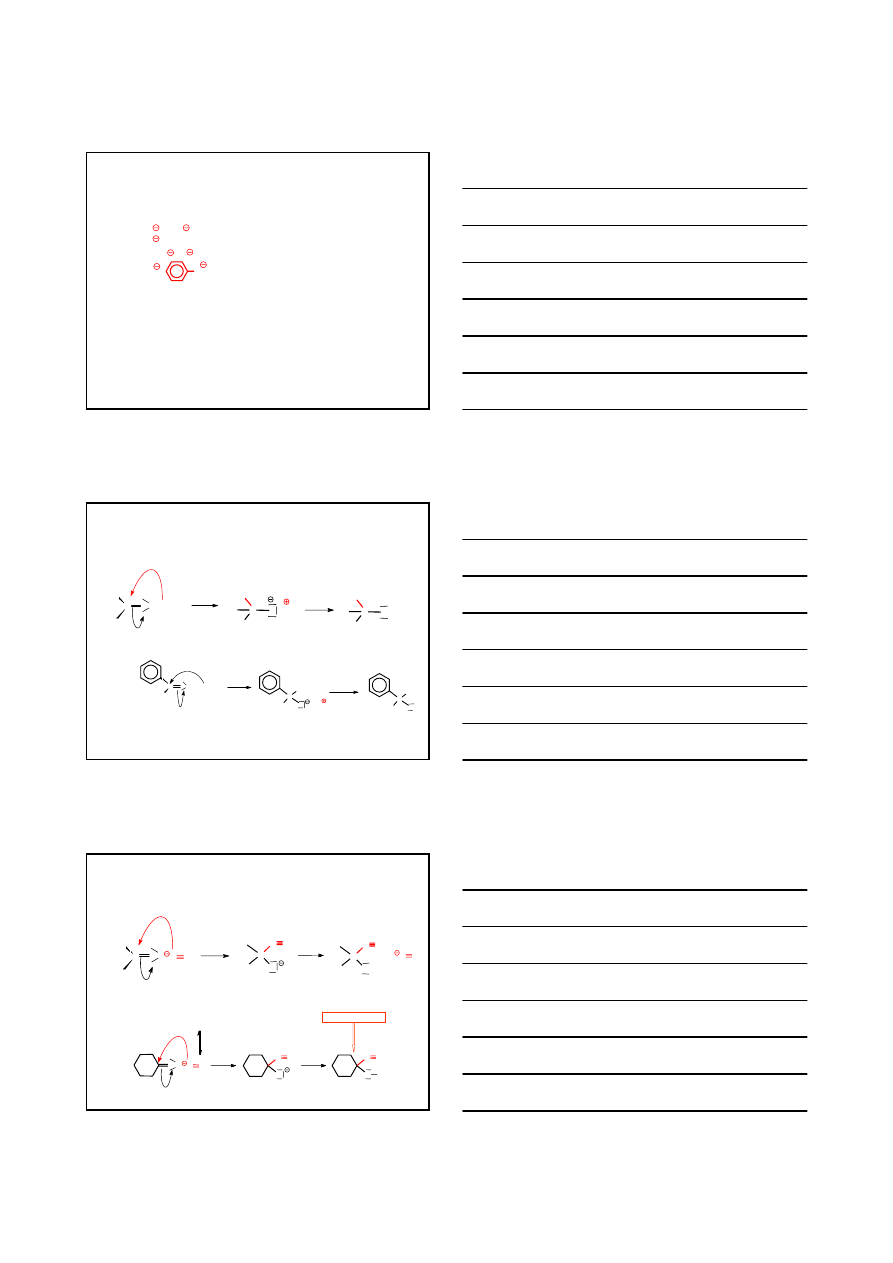
Ad. 2.
DEFICYT ELEKTRONOWY NA ATOMIE WĘGLA –
reakcje przyłączenia nukleofilowego do wiązania C=O
MECHANIZM REAKCJI BIEGNĄCEJ PRZY UDZIALE
SŁABEGO NUKLEOFILA
– niezbędna kataliza kwasem
R
C
R'
O
H
R
C
R'
O
H
+δ
−δ
R
C
R'
O
+
szybko
H A
-A
-
ETAP 1
Elektrony par niewiążących atomu tlenu O
karbonyl
‘przyjmują’ proton od kwasu Lewisa lub
Brønsteda; tworzy się jon oksoniowy, w którym ułatwiony jest atak nukleofila na atom węgla C
karbonyl
wolno
NuH
R
C
R'
O
H
R
C
R'
O
H
HNu
R
C
R'
O
Nu
H
A
-
szybko
+
H
A
ETAP 2
Nukleofil atakuje atom wegla C
karbonyl
, tworzy wiązanie C–O, a następnie zasada odrywa
proton
7
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
NUKLEOFILE
H
2
O ROH
H
2
S RSH NaHSO
3
NH
2
NH
2
NH
2
OH
NH
3
RNH
2
R
2
NH
HO RO
HS
HC
≡C R
O
CN
REAKCJE ADDYCJI NUKLEOFILOWEJ ZWIĄZKÓW GRIGNARDA DO WIĄZANIA C=O
+δ
−δ
R'
C
H
O
RMgX
+δ
−δ
H
C
R'
O
MgX
R
H
3
O
+
H
2
O
H
C
R'
OH
R
CH
3
MgI
C
O
H
3
C
H
2
O/NH
4
Cl
C
O
H
3
C
CH
3
MgI
CH
3
H
3
C
O
H
C
PRZYKŁAD
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
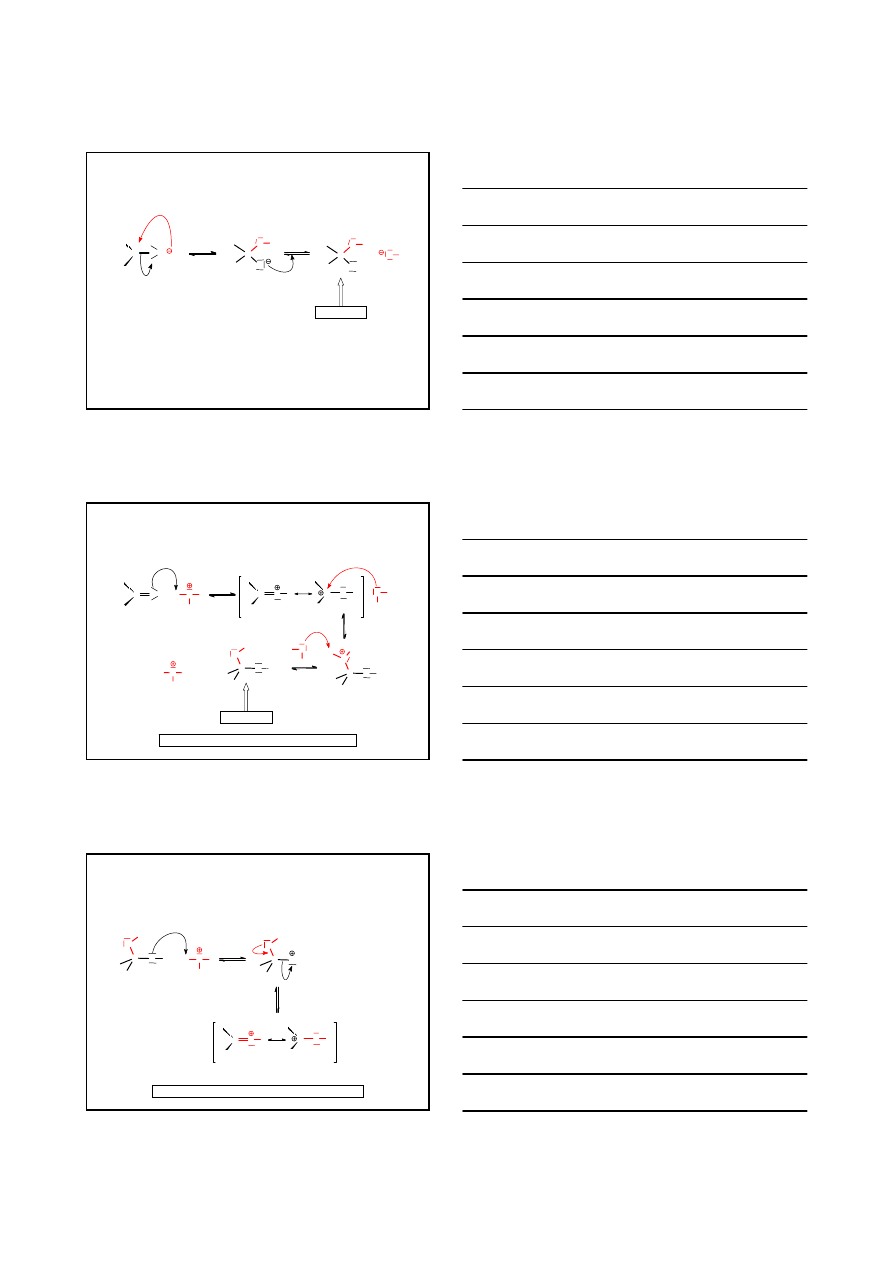
REAKCJE ADDYCJI NUKLEOFILOWEJ JONU CYJANKOWEGO DO WIĄZANIA C=O
+δ
−δ
R'
C
H
O
C N
PRZYKŁAD
NaCN
+ HCl
-
Na
Cl
CYJANOHYDRYNA
H
C
R'
O
C N
H+
H
C
R'
O
H
C N
C N
+
O
C N
O
C N
H+
O
C N
H
8
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
W ŚRODOWISKU ZASADOWYM
+δ
−δ
R'
C
H
O
OR
HEMIACETAL
+
H
C
R'
O
O R
HOR
H
C
R'
O
H
O R
O R
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
W ŚRODOWISKU KWASOWYM
+δ
−δ
H
C
R'
O
+
szybko
H O
R
H
H
C
R'
O
H
H
C
R'
O
H
O
R
H
HEMIACETAL
ETAP 1
kwasowo katalizowane tworzenie HEMIACETALU
H
C
R'
O
H
O
H
R
+
H O
H
R
O
R
H
H
C
R'
O
H
O
R
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
W ŚRODOWISKU KWASOWYM
ETAP 2
kwasowo katalizowana eliminacja cząsteczki wody
+
H O
R
H
H
C
R'
O
H
O
R
H
C
R'
O
H
2
O
R
-H
2
O
H
C
R'
O R
H
C
R'
O R
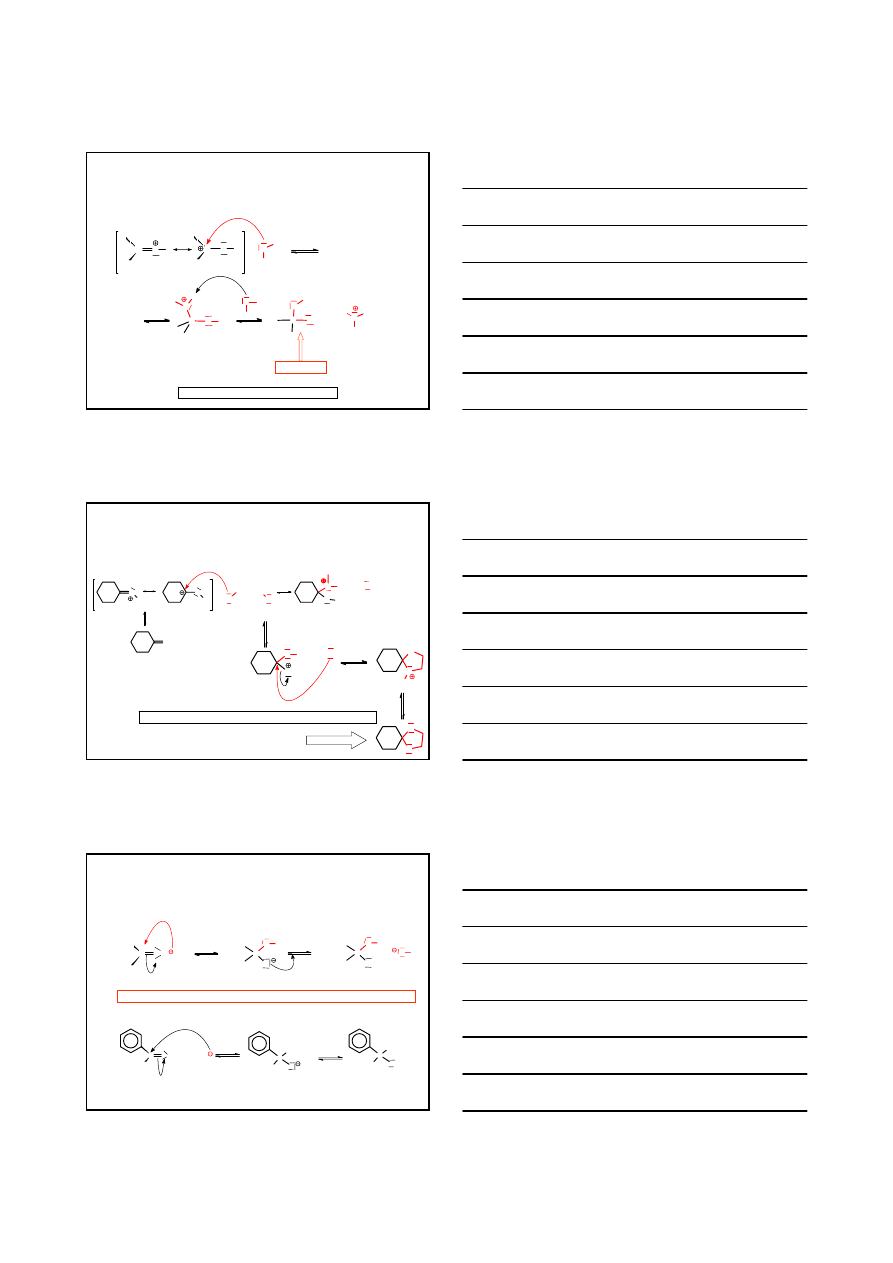
9
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
W ŚRODOWISKU KWASOWYM
ETAP 3
reakcja z drugą cząsteczką alkoholu
ACETAL
H
C
R'
O
R
H
C
R'
O
R
O
R
H
H
C
R'
O R
O
R
H
O
R
H
H
C
R'
OR
O
R
O
R
H
H
+
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
PRZYKŁADY
OH
2
O CH
2
CH
2
OH
H
+
-H
2
O
O
O
H
W ŚODOWISKU KWASOWYM – REAKCJA CAŁKOWICIE ODWRACALNA
-H
+
O
O
KETAL
O
CH
2
CH
2
HO
OH
O
H
O
H
O H
O CH
2
CH
2
OH
H
H
+
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ ALKOHOLI DO WIĄZANIA C=O
PRZYKŁADY
+δ
−δ
CH
3
CH
2
C
H
O
OCH
3
H
C
CH
3
CH
2
O
O CH
3 HOCH
3
+
H
C
CH
3
CH
2
O
H
O CH
3
O CH
3
W ŚODOWISKU ZASADOWYM REAKCJA NIE BIEGNIE DALEJ – POWSTAJE HEMIACETAL
C
O
H
3
C
CH
3
CH
2
OH
OCH
2
CH
3
H
3
C
OH
C
CH
3
CH
2
O
C
O
H
3
C
OCH
2
CH
3
HEMIKETAL
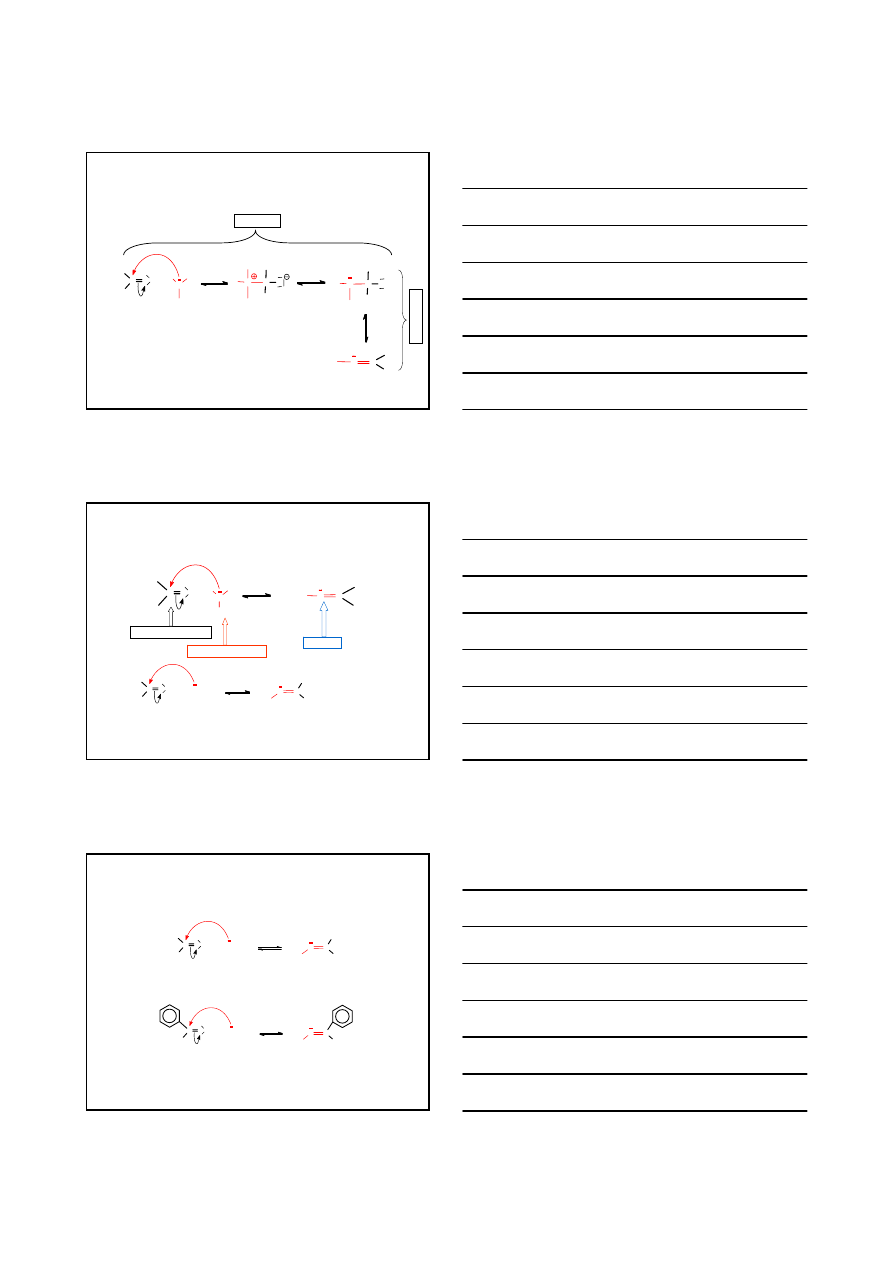
10
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
H
C
R
O
N
H
H
N
H
H
O
R
C
H
N
H
O
H
R
C
H
-
H
2
O
N
R
C
H
ADDYCJA
ELIMIN
A
C
JA
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z HYDROKSYLOAMINĄ
KETON lub ALDEHYD
HYDROKSYLOAMINA
OKSYM
PRZYKŁADY
ACETALDEHYD
ACETALD
OKSYM
C O
N
H
OH
H
N
HO
C
+
-
H
2
O
N
HO
H
C
CH
3
+
H
3
C
C
H
O
NH
2
OH
-
H
2
O
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z HYDROKSYLOAMINĄ – PRZYKŁADY
ACETON
OKSYM
ACETONU
ACETOFENON
OKSYM
ACETOFENONU
N
HO
CH
3
C
CH
3
+
H
3
C
C
H
3
C
O
NH
2
OH
-
H
2
O
N
HO
C
CH
3
+
H
3
C
C O
NH
2
OH
-
H
2
O
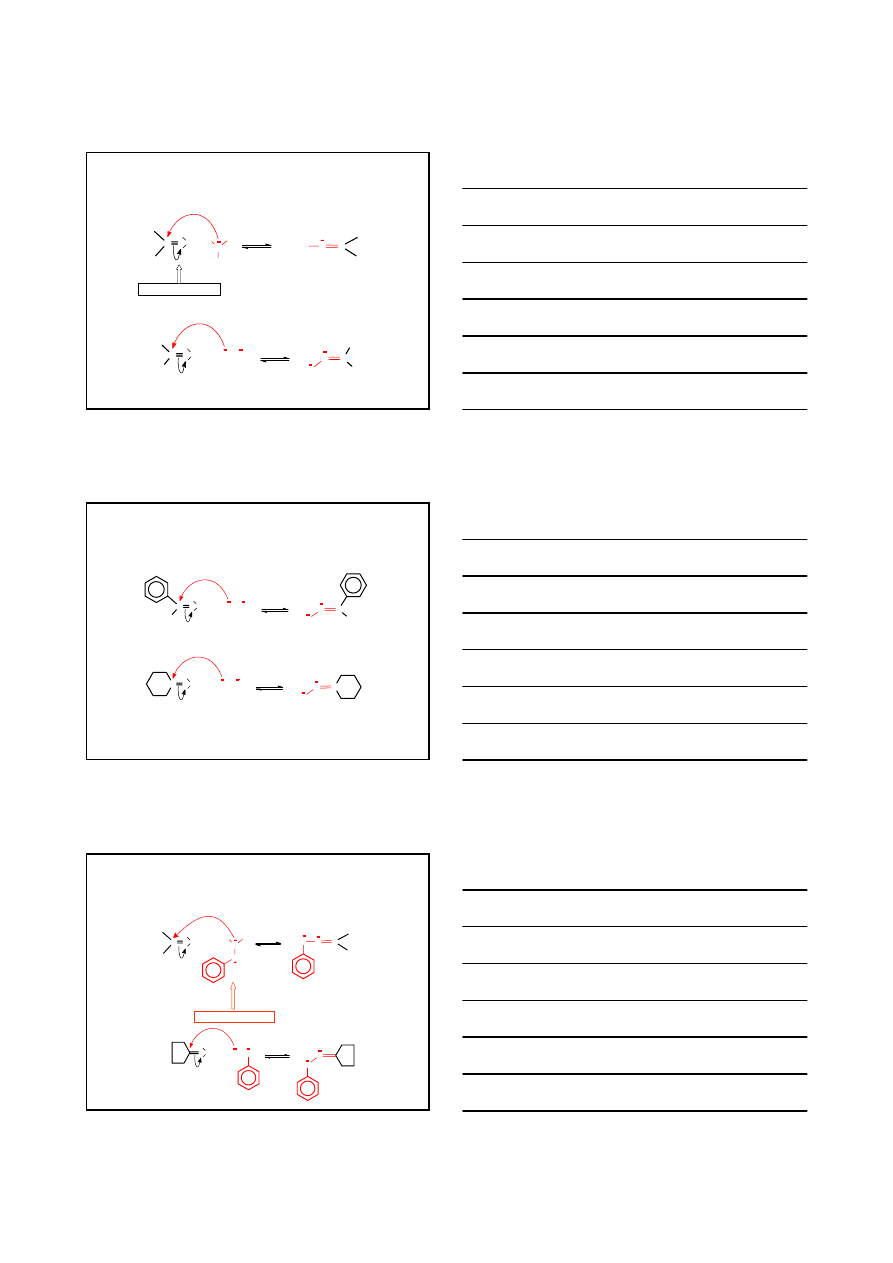
11
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z HYDRAZYNĄ
-
H
2
O
C O
N
H
NH
2
H
N
H
2
N
C
+
KETON lub ALDEHYD
PRZYKŁADY
2-BUTANON
HYDRAZON
2-BUTANONU
N
H
2
N
CH
2
CH
3
C
CH
3
+
H
3
C
C
CH
3
CH
2
O
NH
2
NH
2
-
H
2
O
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z HYDRAZYNĄ - PRZYKŁADY
-
H
2
O
N
H
2
N
C
H
+
H
C O
NH
2
NH
2
BENZALDEHYD
HYDRAZON
BENZALDEHYDU
-
H
2
O
N
H
2
N
C
+
C O
NH
2
NH
2
CYKLOHEKSANON
HYDRAZON
CYKLOHEKSANONU
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z FENYLOHYDRAZYNĄ
FENYLOHYDRAZYNA
PRZYKŁADY
-
H
2
O
N
HN
C
+
C O
N
H
NH
H
-
H
2
O
N
HN
+
O
NH
2
NH
CYKLOPENTANON
FENYLOHYDRAZON
CYKLOPETANONU
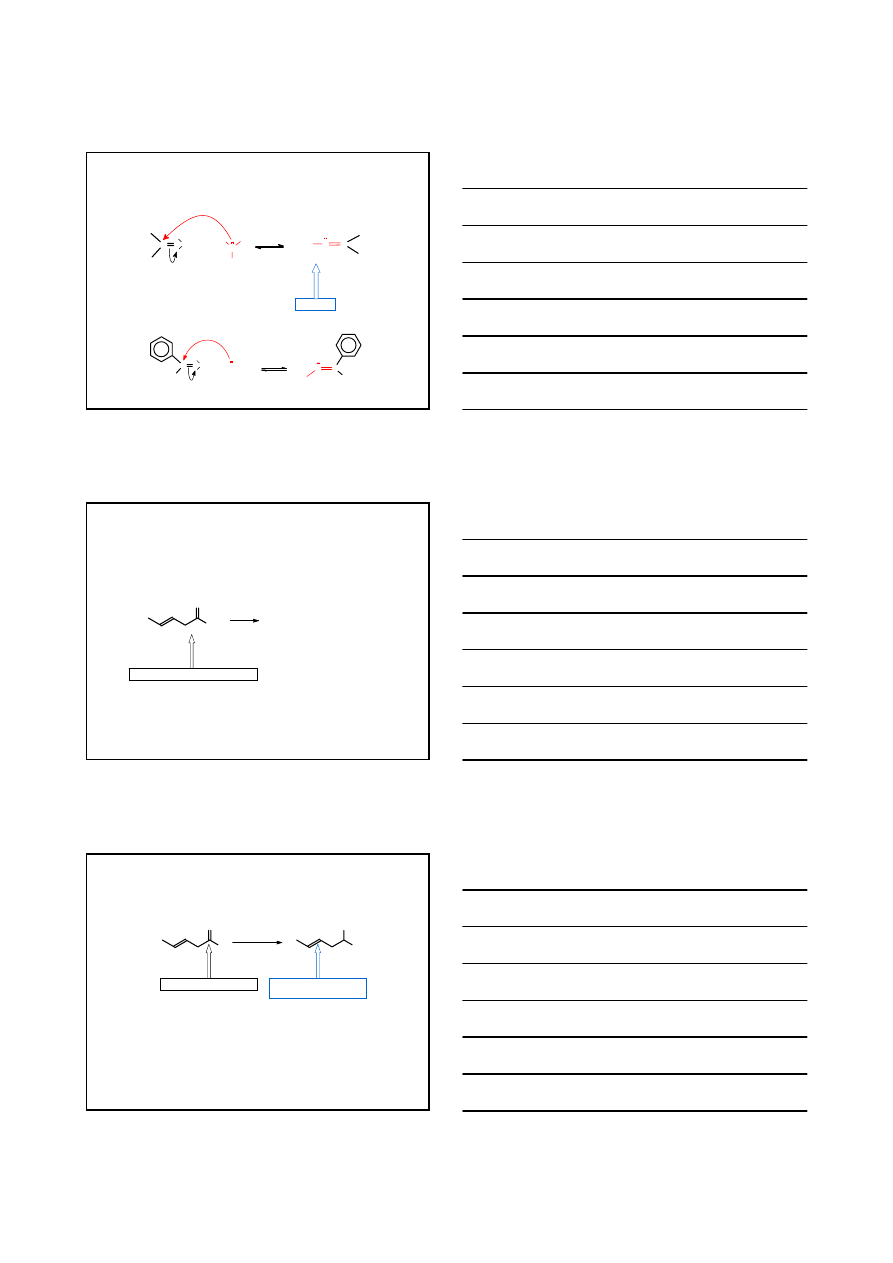
12
ZWIĄZKI KARBONYLOWE
REAKCJE ADDYCJI NUKLEOFILOWEJ DO WIĄZANIA C=O
REAKCJE ADDYCJI NUKLEOFILOWEJ N-NUKLEOFILI DO WIĄZANIA C=O
REAKCJE Z AMINAMI 1°
IMINA
PRZYKŁADY
-
H
2
O
N
R
C
+
C O
N
H
R (Ar)
H
(Ar)
-
H
2
O
N
CH
3
C
H
+
H
C O
H
3
CNH
2
BENZALDEHYD
METYLOAMINA
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE ADDYCJI WODORU DO WIĄZANIA C=O
H
O
H
2
/Pt
CH
3
CH
2
CH
2
CH
2
CH
2
OH
H
2
/ Ni lub Pt (70 atm, 50°C)
REDUKCJA WIĄZAŃ C=C ORAZ C=O
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE ADDYCJI WODORKU DO WIĄZANIA C=O
REDUKCJA WIĄZANIA C=O
H
O
1. LiAlH
4
2. H
2
O/H
3
O
+
H
OH
WIĄZANIE C=C POZOSTAE
NIENARUSZONE
LiAlH
4
/ eter, np. THF
NaBH
4
/ alkohol
3-PENTEN-1-OL
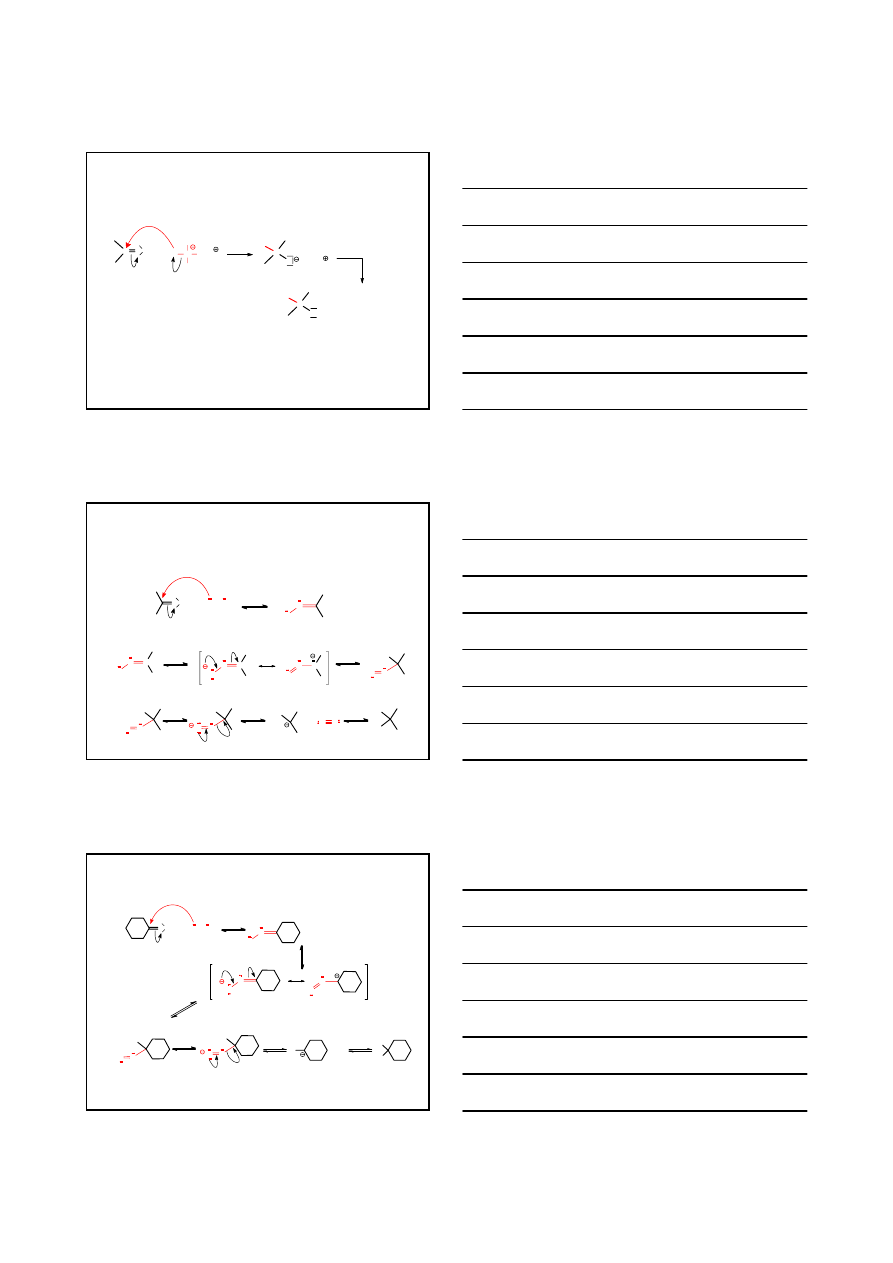
13
+
C O
Li
Al
H
H
H
H
H
C
O
AlH
3
Li
H
2
SO
4
/H
2
O
H
C
OH
+ Al
2
(SO
4
)
3
+ Li
2
SO
4
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE ADDYCJI WODORKU DO WIĄZANIA C=O
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJA REDUKCJI WOLFF’A – KIŻNERA WIĄZANIA
C=O
DO
-CH
2
-
+
H
2
O
N
H
2
N
+
O
NH
2
NH
2
ETAP 1 Tworzenie hydrazonu
ETAP 2 Zasadowa hydroliza hydrazonu
H
2
O
N
H
2
N
C
OH
-
N
HN
C
N
HN
C
N
HN
H
H
2
O
OH
-
N
HN
H
N
N
H
N N
+
H
H
H
N
HN
+
H
2
O
+
NH
2
NH
2
O
N
H
2
N
OH
-
N
HN
H
2
O
OH
-
N
HN
H
N
N
H
+
H
N
2
H
H
H
2
O
REAKCJA REDUKCJI WOLFF’A – KIŻNERA WIĄZANIA
C=O
DO
-CH
2
-
CYKLOHEKSANON
CYKLOHEKSAN
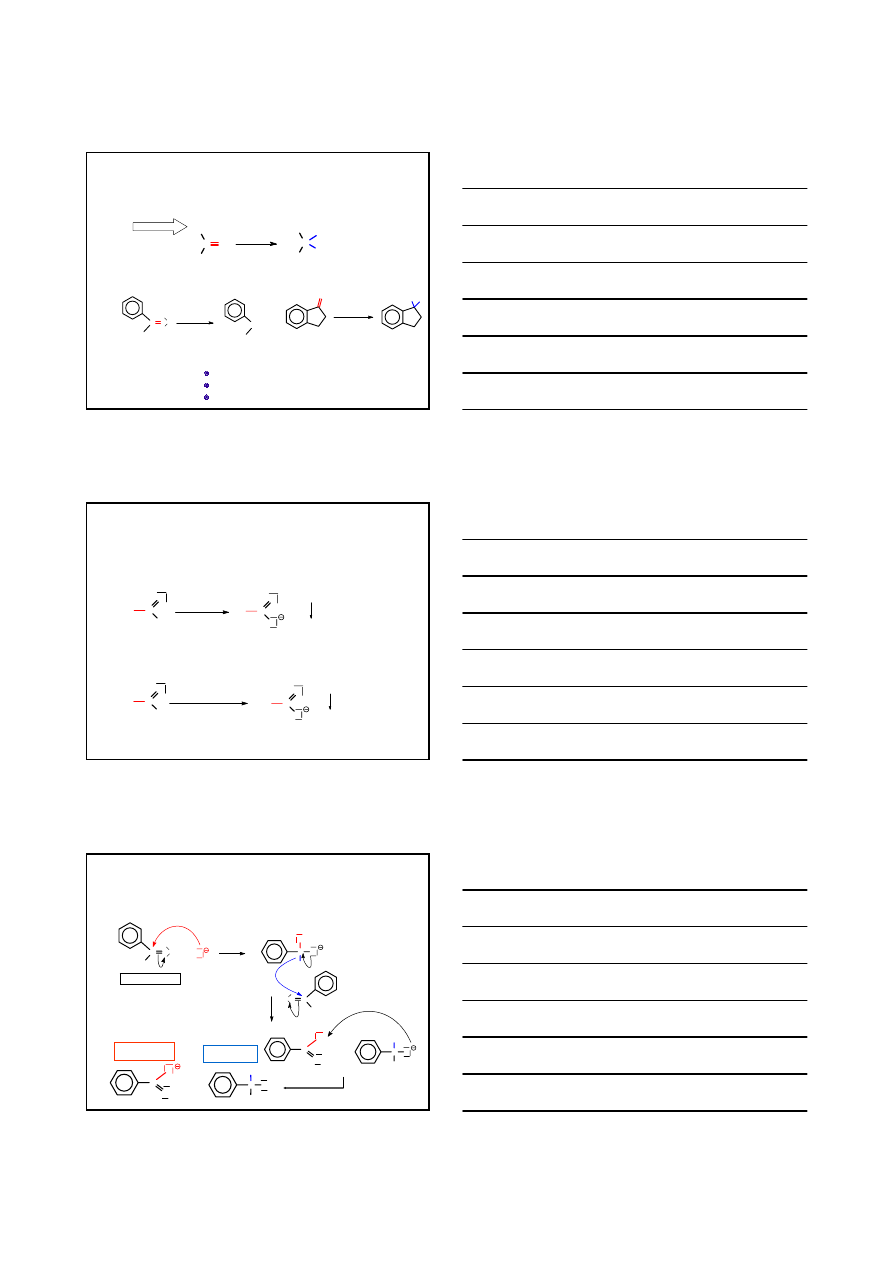
14
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJA REDUKCJI CLEMMENSEN’A WIĄZANIA
C=O
DO
-CH
2
-
stosuje się tylko dla ketonów posiadających podstawnik arylowy
silnie kwaśne środowisko
Zn/HCl – redukuje również inne grupy, np. nitrową –NO
2
C O
Ar
R
Zn(Hg)
HCl,
∆
C
H
Ar
R
H
ARYL
PRZYKŁADY
CH
3
CH
2
C O
Zn(Hg)/HCl
∆
CH
3
CH
2
CH
2
O
Zn(Hg)/HCl
∆
H H
1-FENYLO-1-PROPANON
(PROPIOFENON)
n-
PROPYLOBENZEN
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE UTLENIANIA ALDEHYDÓW
1.
TEST TOLLENS’A
Ag(NH
3
)
2
+
H
2
O
R
C
H
O
R
C
O
O
+ Ag
2.
TEST FEHLING’A
* CuSO
4
* NaOH + WINIAN
SODOWO-POTASOWY
R
C
H
O
R
C
O
O
+ Cu
2
O
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE UTLENIANIA ALDEHYDÓW
3.
REAKCJA CANNIZZARO
+
H
C O
HO
C
OH
H
O
H
C
O
C
OH
O
C
H
H
O
+
+
C
O
O
C
H
H
O
H
ALDEHYDY BEZ
H
α
ANION KWASU
BENZOESOWEGO
ALKOHOL
BENZYLOWY
BENZALDEHYD
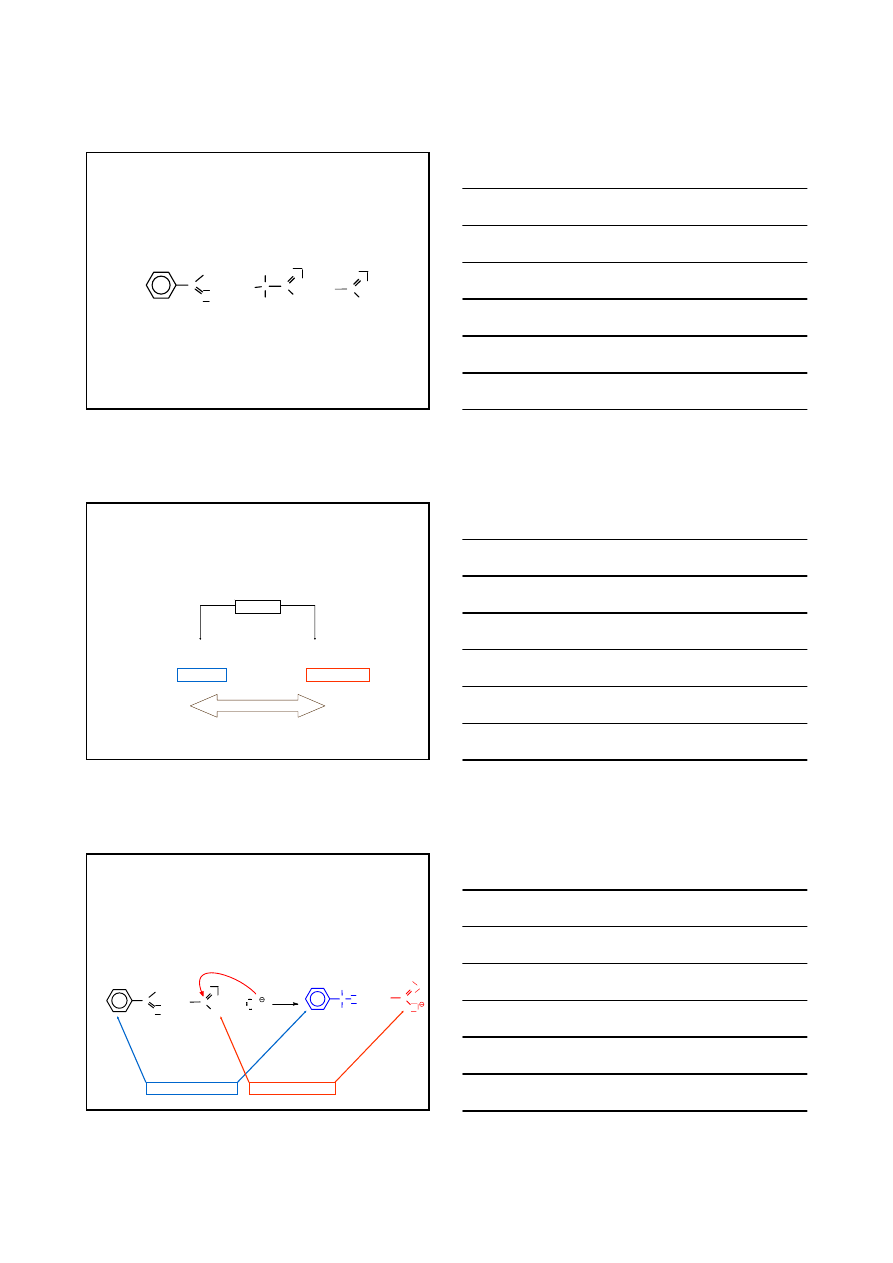
15
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE UTLENIANIA ALDEHYDÓW
3.
REAKCJA CANNIZZARO
H
C
H
O
C
H
O
C
C
H
O
CH
3
H
3
C
CH
3
Reakcji Cannizzaro ulegają aldehydy takie, jak:
BENZALDEHYD
FORMALDEHYD
2,2-DIMETYLOPROPANAL
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE UTLENIANIA ALDEHYDÓW
3.
REAKCJA CANNIZZARO
ALDEHYD
ALKOHOL
CZĄSTECZKA ULEGA REDUKCJI
ANION KWASU
CZĄSTECZKA ULEGA UTLENIENIU
REAKCJA DYSPROPORCJONOWANIA
ZWIĄZKI KARBONYLOWE
REAKCJE UTLENIANIA I REDUKCJI GRUPY KARBONYLOWEJ C=O
REAKCJE UTLENIANIA ALDEHYDÓW
3.
KRZYŻOWA REAKCJA CANNIZZARO
H
C
H
O
+
C
H
O
OH
+
C
H
H
OH
H
C
O
O
+
ALDEHYD REDUKOWANY
ALDEHYD UTLENIANY
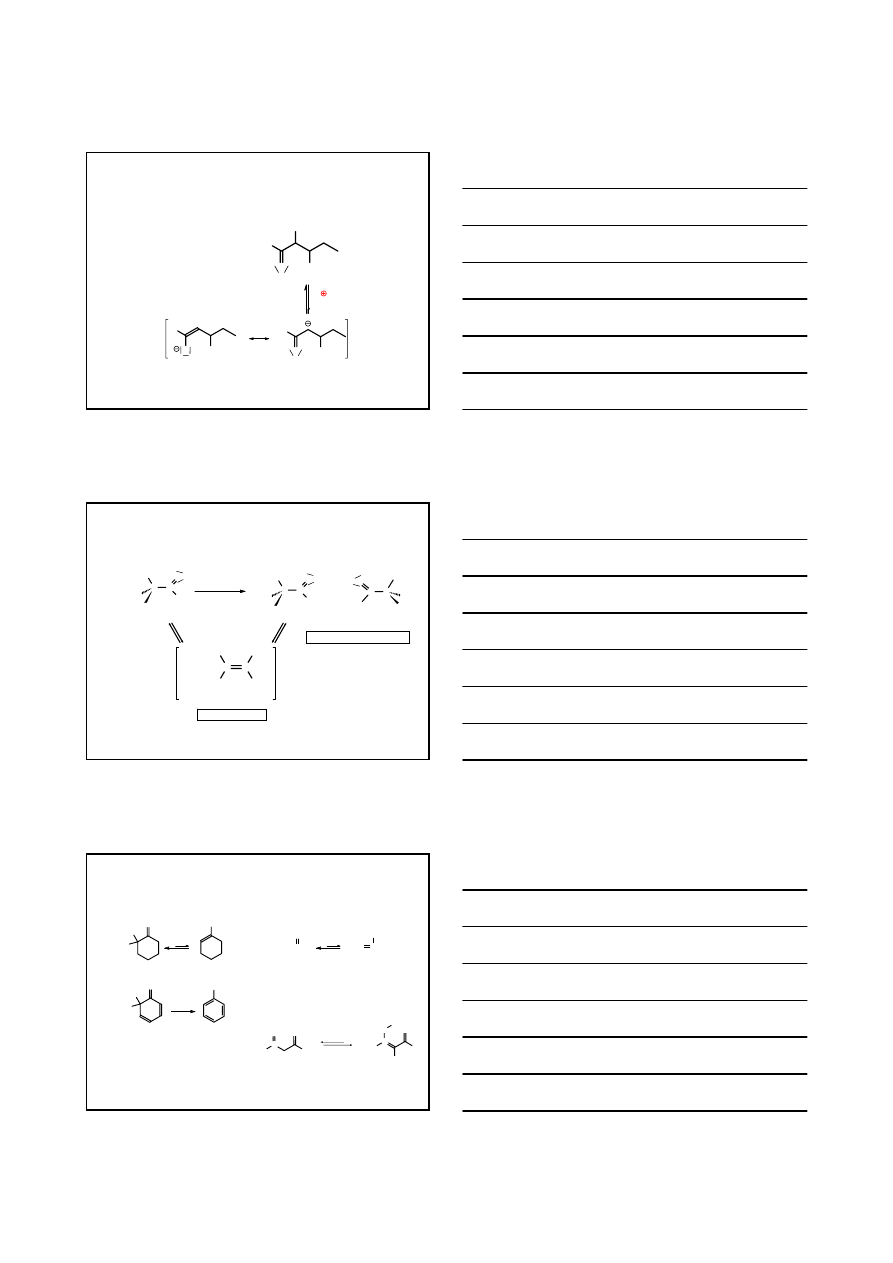
16
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
R
O
H
H
α
β
dla H
α
p
K
a
19 – 20
dla H
β
p
K
a
40
CH
3
– CH
3
p
K
a
50
CH
2
= CH
2
p
K
a
44
HC
≡ CH
p
K
a
25
- H
R
O
H
R
O
H
ENOLAN
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
RACEMIZACJA
CH
3
CH
2
C C
O
Ph
H
3
C
H
OH
-
lub H
3
O
+
CH
3
CH
2
C
C
O
Ph
H
3
C
H
O
C
C
CH
2
CH
3
H
Ph
CH
3
+
C
C
O
H
CH
3
CH
2
Ph
H
3
C
(R)-1-FENYLO-2-METYLO-1-BUTANON
(R)- i (S)-1-FENYLO-2-METYLO-1-BUTANON
MIESZANINA RACEMICZNA
ACHIRALNY ENOL
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
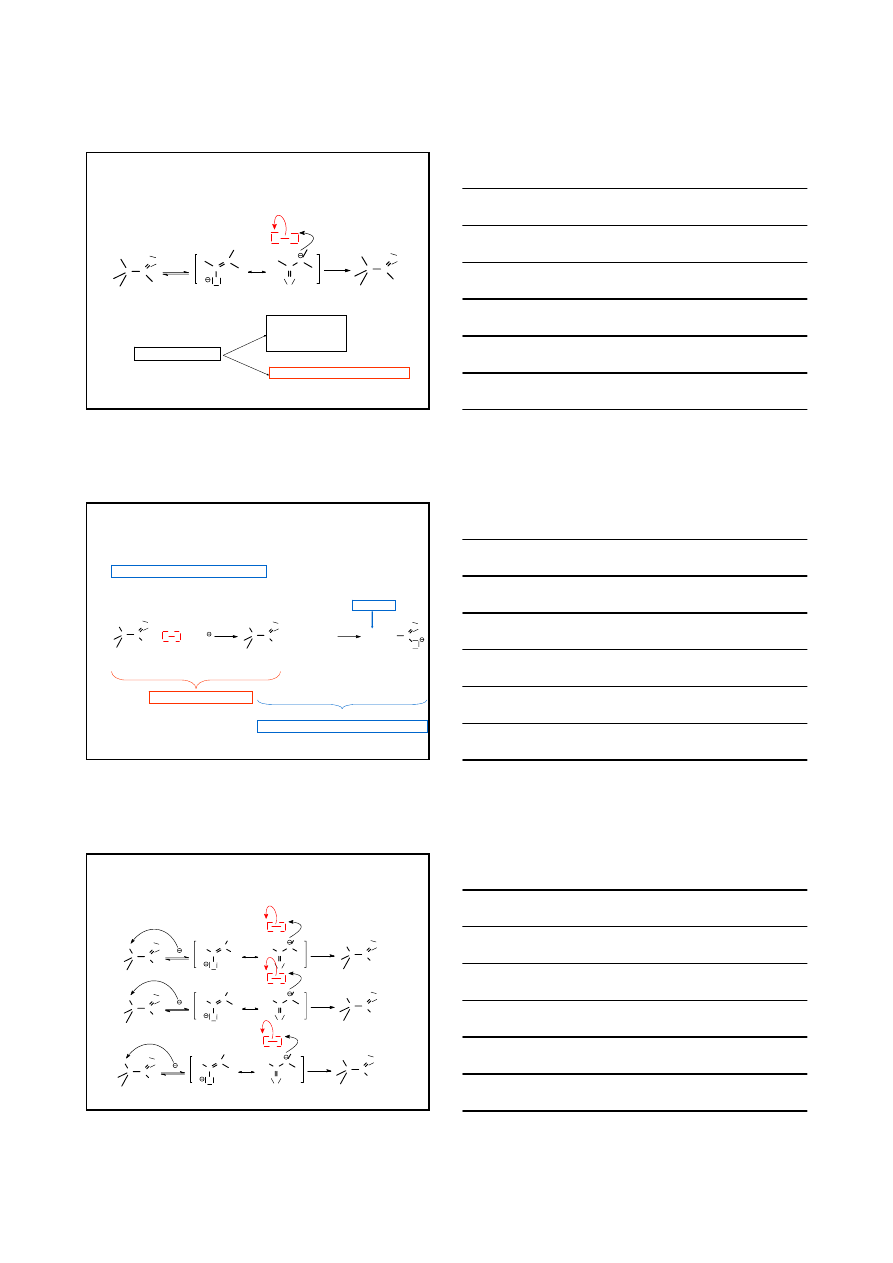
TAUTOMERIA
PRZYKŁADY
O
H
H
O
H
24%
76%
C
H
3
CCH
3
O
CCH
3
O
H
H
2
C
>99%
1.5
×10
–4
%
OH
O
H
H
≈100%
H
3
C
C
O
H
O
CH
3
H
H
3
C
C
O
O
CH
3
98.8%
1.2%
17
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
REAKCJA HALOGENOWANIA KETONÓW
C C
O
H
wolno
C
C
O
C
C
O
Cl
Cl
C
C
O
Cl
Cl
-
+
SZYBKOŚĆ REAKCJI
ZALEŻY OD:
STĘŻENIA KETONU
STĘŻENIA KWASU
NIE ZALEŻY OD RODZAJU CHLOROWCA
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
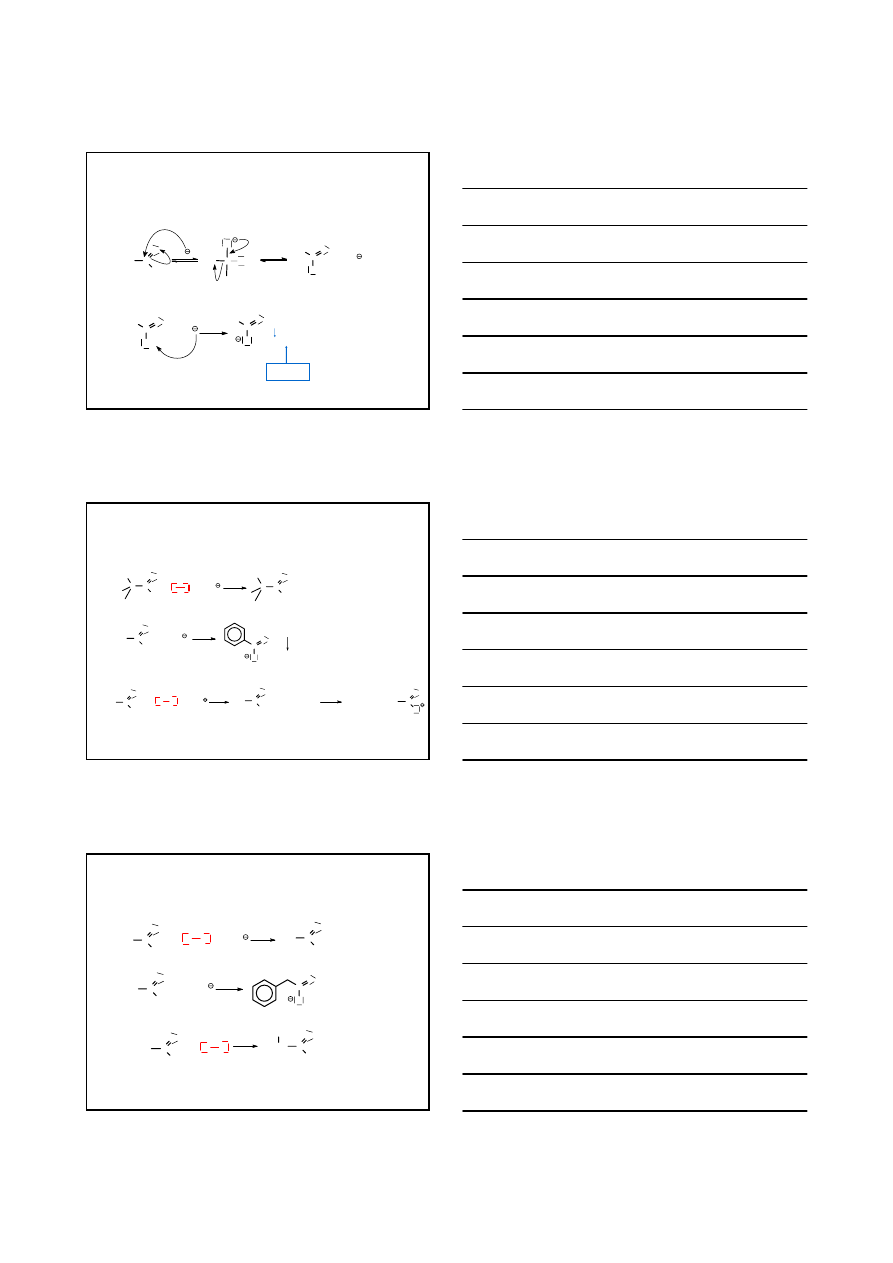
REAKCJA HALOGENOWANIA KETONÓW –
REAKCJA HALOFORMOWA
H
C
C
O
R
H
H
X X
X
C C
O
R
X
X
3
X
-
+
3
+
+
+ 3 H
2
O
3 OH
OH
-
X
3
CH + R
C
O
O
dla metyloketonów w środowisku zasadowym
HALOFORM
X
2
: Cl
2
Br
2
I
2
ETAP 1
HALOGENOWANIE
ETAP 2 ROZSZCZEPIENIE HALOGENOKETONU
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
REAKCJA HALOGENOWANIA KETONÓW –
REAKCJA HALOFORMOWA
H
C C
O
R
H
H
OH
R
C
C
H
O
H
R
C
C
H
O
H
l
l
H
C C
O
R
H
l
l
-
+
MECHANIZM –
ETAP 1
H
C C
O
R
H
I
OH
R
C
C
I
O
H
R
C
C
I
O
H
l
l
H
C
C
O
R
I
l
l
-
+
H
C C
O
R
I
I
OH
R
C
C
I
O
I
R
C
C
I
O
I
l
l
I
C C
O
R
I
l
l
-
+
KETON
TRIJODOMETYLOWO
ALKILOWY
18
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
REAKCJA HALOGENOWANIA KETONÓW –
REAKCJA HALOFORMOWA
MECHANIZM –
ETAP 2
I
3
C
C
O
R
OH
I
3
C
C
O
R
OH
+
R
C
O
OH
l
3
C
R
C
O
O
+
R
C
O
OH
l
3
C
+
l
3
CH
JODOFORM
– żółty osad
TEST ANALITYCZNY NA OBECNOŚĆ METYLOWYCH KETONÓW
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
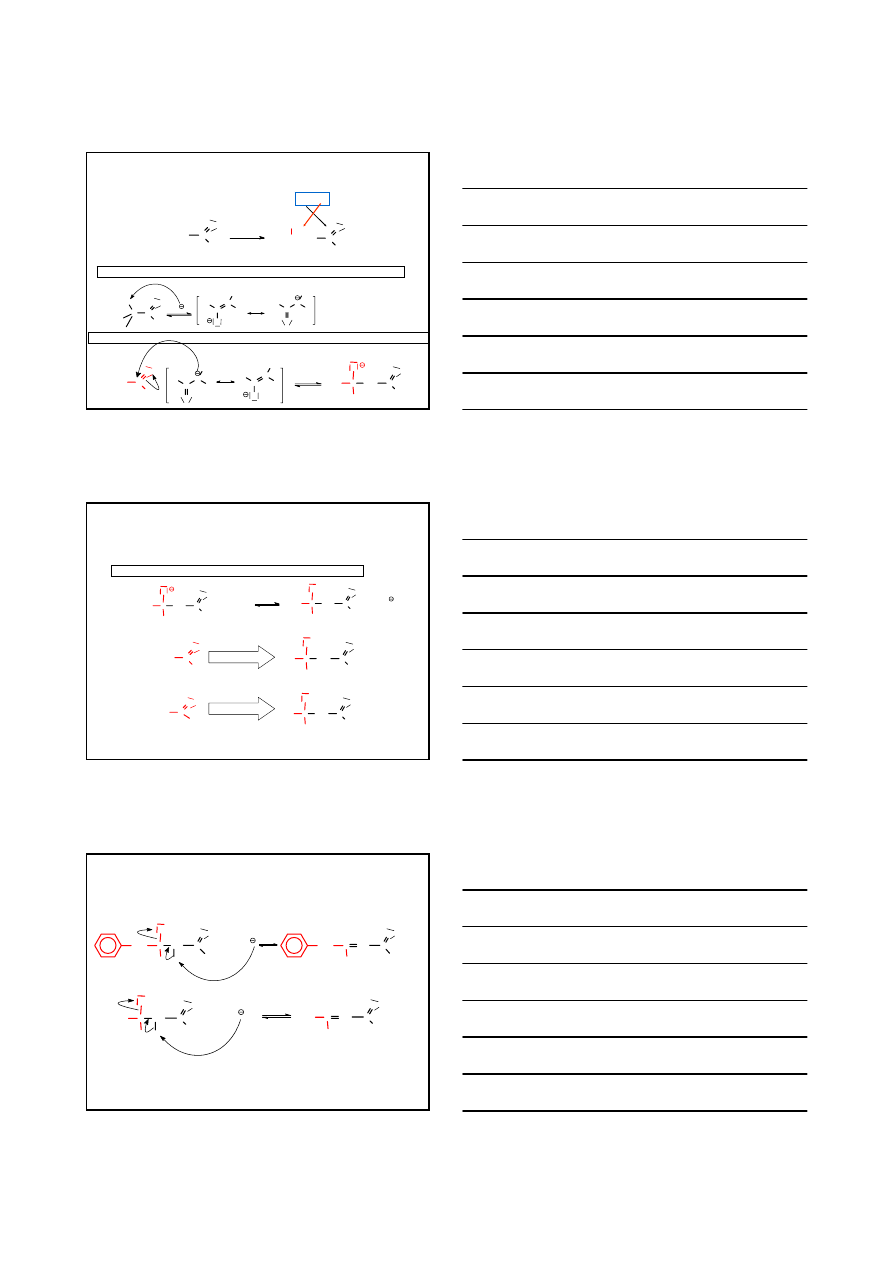
REAKCJA HALOGENOWANIA KETONÓW
PRZYKŁADY
H
C C
O
C
6
H
5
H
H
I
I
I
C
C
O
C
6
H
5
I
I
3
I
-
+
3
+
+
+ 3 H
2
O
3 OH
I
3
C
C
O
C
6
H
5
OH
+
+
l
3
CH
C
O
O
OH
-
Br
3
CH + CH
3
CH
2
C
O
O
H
3
C
C
O
CH
2
CH
3
Br
3
C
C
O
CH
2
CH
3
3
Br
-
+
3
+
+
+ 3 H
2
O
3 OH
Br Br
FENYLOETANON
ANION KWASU BENZOESOWEGO
ANION KWASU PROPANOWEGO
2-BUTANON
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
REAKCJA HALOGENOWANIA KETONÓW
PRZYKŁADY
H
3
C
C
O
CH
2
C
6
H
5
Cl
3
C
C
O
CH
2
C
6
H
5
3
Cl
-
+
3
+
+
+ 3 H
2
O
3 OH
Cl
Cl
1-FENYLO-2-PROPANON
FENYLOOCTAN
CI
3
C
C
O
CH
2
C
6
H
5
OH
+
C
O
O
+
Cl
3
CH
CH
3
CH
2
C
O
CH
2
C
6
H
5
CH
3
CH
C
O
CH
2
C
6
H
5
Cl
+
Cl
Cl
H
+
1-FENYLO-2-BUTANON
1-FENYLO-
3-CHLORO
-2-BUTANON
19
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
KONDENSACJA ALDOLOWA
10% NaOH
H
2
O, 5°C
CH
3
C
O
H
2
CH
3
CH
CH
2
C
O
H
OH
ETANAL
3-HYDROKSYBUTANAL
ALD
OL
MECHANIZM
H
C
C
O
H
H
H
OH
H
C
C
H
O
H
H
C
C
H
O
H
+ H
2
O
ENOLAN
ETAP 1
Oderwanie protonu przez zasadę; tworzenie się stabilizowanego rezonansem jonu enolanowego
ETAP 2
Jon enolanowy – nukleofil atakuje atom węgla karbonylowego drugiej cząsteczki; tworzy się jon alkoksylowy
H
3
C
C
O
H
H
C
C
H
O
H
H
C
C
H
O
H
H
3
C
C
O
H
CH
2
C
O
H
JON ALKOKSYLOWY
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
KONDENSACJA ALDOLOWA
MECHANIZM
ETAP 3
Jon alkoksylowy – silna zasada odrywa proton od rozpuszczalnika – wody
H
3
C
C
O
H
CH
2
C
O
H
+ H
2
O
H
3
C
C
O
H
H
CH
2
C
O
H
+ OH
H
3
C
C
O
H
H
3
C
C
O
H
H
CH
2
C
O
H
ALDEHYD
β-HYDROSKSYALDEHYD
KETON
β-HYDROSKSYKETON
H
3
C
C
O
H
H
CH
2
C
O
CH
3
H
3
C
C
O
CH
3
ALDOL
3-HYDROKSYBUTANAL
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
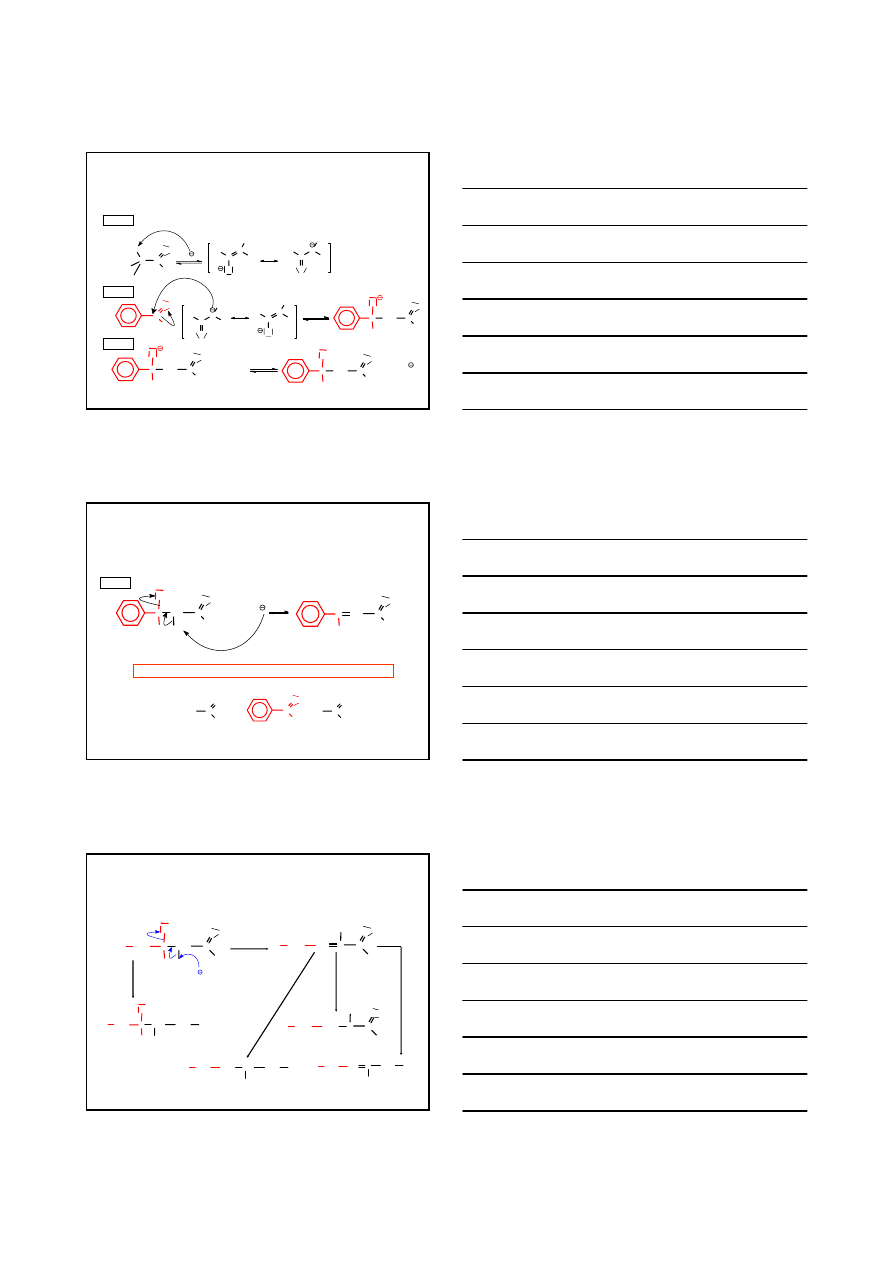
REAKCJA DEHYDRATACJI PRODUKTU ADDYCJI
5-FENYLO-3-PENTEN-2-ON
CH
2
C
O
H
H
CH
CH
3
O
C
H
+ OH
CH
2
C
H
CH
CH
3
O
C
+ H
2
O
∆
H
3
C
C
O
H
H
CH
CH
3
O
C
H
+ OH
H
3
C
C
H
CH
CH
3
O
C
+ H
2
O
3-PENTEN-2-ON
∆
20
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
KRZYŻOWA KONDENSACJA ALDOLOWA
ENOLAN
ETAP 1
H
C
C
O
H
H
H
OH
H
C
C
H
O
H
H
C
C
H
O
H
+ H
2
O
ETAP 2
ETAP 3
4-FENYLO-3-HYDROKSYBUTANAL
C
O
H
H
C
C
H
O
H
H
C
C
H
O
H
C
O
H
CH
2
C
O
H
+ H
2
O
+ OH
C
O
H
CH
2
C
O
H
C
O
H
H
CH
2
C
O
H
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
KRZYŻOWA KONDENSACJA ALDOLOWA
C
O
H
H
CH
H
O
C
H
+ OH
+ H
2
O
C
H
CH
H
O
C
ETAP 4
3-FENYLO-2-PROPENAL
KOMPONENTY DO KRZYŻOWEJ KONDESACJI ALDOLOWEJ BEZ H
α
C
O
H
H
C
O
H
(CH
3
)
3
C
C
O
H
ZWIĄZKI KARBONYLOWE
REAKCJE BIEGNĄCE PRZEZ
ENOL
lub
ENOLAN
CH
2
C
O
H
H
CR'
R
H
O
C
H
OH
NaBH
4
CH
2
C
O
H
H
CR'
R
OH
CH
2
H
1,3-ALKANODIOL
∆
CH
2
CH
2
CH
R
OH
CH
2
R'
CH
2
CH
C
R
OH
CH
2
R'
CH
2
CH
C
R
H
O
C
R'
ALKOHOL
2-ALKEN-1-OL
alkohol typu
allilowego
LiAlH
4
H
2
, Ni, ciś.
CH
2
CH
2
C
R
H
O
C
R'
H
2
, Pd/C
ALDEHYD
ZASTOSOWANIA SYNTYETYCZNE
2-ALKENAL
α,β-nienasycony aldehyd
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron