1
KWASY KARBOKSYLOWE
C
O
C
OH
C
O
OH
GRUPA HYDROKSYLOWA
GRUPA KARBONYLOWA
GRUPA KARBOKSYLOWA
KWASY KARBOKSYLOWE
NOMENKLATURA
1. NOMENKLATURA SYSTEMATYCZNA
nazwa składa się ze słowa ‘
KWAS
” oraz nazwy alkanu o takiej samej liczbie
atomów węgla, do której dodaje się końcówkę ‘
-OWY
’
H C
O
OH
KWAS
METAN
OWY
CH
3
C
O
OH
KWAS
ETAN
OWY
CH
3
CH
2
C
O
OH
KWAS
PROPAN
OWY
CH C
O
OH
CH
3
CH
3
KWAS
2
-METYLOPROPAN
OWY
3 1
2
2. NOMENKLATURA ZWYCZAJOWA
KWAS MRÓWKOWY
KWAS OCTOWY
KWAS PROPIONOWY
KWAS IZOMASŁOWY
KWASY KARBOKSYLOWE
NOMENKLATURA ZWYCZAJOWA
C C C C C C
O
OH
6 5 4 3 2 1
ε δ γ β α
CH C
O
OH
Cl
CH
3
kwas 2-chloropropanowy
kwas
α-chloropropionowy
ALE
CH C
O
OH
CH
2
kwas 2-propenowy
kwas akrylowy
C
O
OH
kwas benzoesowy
C
O
OH
Cl
kwas p-chlorobenzoesowy
2
KWASY KARBOKSYLOWE
PODSTAWNIKI
H C
O
FORMYL
CH
3
C
O
ACETYL
C
O
BENZOIL
PRZYKŁADY
C
O
Cl
CHLOREK
BENZOILU
O
C
CH
2
CH
2
CH
2
C
O
OH
H
KWAS 4-
FORMYLO
BUTANOWY
COOH
O
C
O
CH
3
KWAS O-
ACETYLO-
SALICYLOWY
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI FIZYCZNE
STAN CIEKŁY: CZĄSTECZKI KWASU SĄ ZASOCJOWANE – WYSTĘPUJĄ W
POSTACI DIMERÓW POWIĄZANYCH WIĄZANIAMI WODOROWYMI
ROZPUSZCZALNOŚĆ KWASÓW KARBOKSYLOWYCH W WODZIE
C
1
– C
4
C
12
> C
12
rozpuszczalne w H
2
O
nierozpuszczalne w H
2
O
OSTRY, NIEPRZYJEMNY ZAPACH
R
C
O
O H
R
C
O
O
H
KWASY KARBOKSYLOWE
OTRZYMYWANIE – REAKCJE UTLENIANIA
1. UTLENIANIE ALKENÓW
R
CH CH
R'
KMnO
4
, OH
-
∆
O
C
R'
HO
R
C
O
OH
+
H
3
O
+
+
R
C
O
O
-
K
+
O
C
R'
K
+-
O
R
CH CH
R'
O
3
O
C
R'
HO
R
C
O
OH
+
H
2
O
2
+
R
C
O
H
O
C
R'
H
PRZYKŁADY
CH
3
CH CH
CH
3
KMnO
4
, OH
-
2 CH
3
C
O
OH
H
3
O
+
2 CH
3
C
O
O
-
K
+
∆
KWAS ETANOWY
+
CH
3
CH
2
CH CH
2
KMnO
4
, OH
-
CH
3
CH
2
C
O
OH
H
3
O
+
CH
3
CH
2
C
O
O
-
K
+
∆
CO
2
+ H
2
O
KWAS PROPANOWY
3
2. UTLENIANIE ALKOHOLI 1°
∆
R
C
O
O
-
K
+
H
3
O
+
R
C
O
OH
KMnO
4
, OH
-
R
CH
2
OH
PRZYKŁADY
∆
C
O
O
-
K
+
H
3
O
+
KMnO
4
, OH
-
CH
2
OH
C
O
OH
KWAS BENZOESOWY
ALKOHOL BENZYLOWY
CH
3
CH
2
CH
2
OH
KMnO
4
, OH
-
CH
3
CH
2
C
O
OH
H
3
O
+
CH
3
CH
2
C
O
O
-
K
+
∆
KWAS PROPANOWY
PROPANOL
KWASY KARBOKSYLOWE
OTRZYMYWANIE – REAKCJE UTLENIANIA
3. UTLENIANIE ALDEHYDÓW
PRZYKŁADY
R
C
O
H
Ag(NH
3
)
2
+
OH
-
Ag + R
C
O
O
-
R
C
O
OH
H
3
O
+
Ag(NH
3
)
2
+
OH
-
Ag +
C
O
O
-
H
3
O
+
C
O
OH
C
O
H
KWAS BENZOESOWY
BENZALDEHYD
KWASY KARBOKSYLOWE
OTRZYMYWANIE – REAKCJE UTLENIANIA
Ag(NH
3
)
2
+
, OH
-
CH
3
CH
2
C
O
H
CH
3
CH
2
C
O
O
H
3
O
+
CH
3
CH
2
C
O
O
H
PROPANAL
KWAS PROPANOWY
4.
UTLENIANIE METYLOKETONÓW –
REAKCJA HALOFORMOWA
H
C
C
O
R
H
H
X X
X
C C
O
R
X
X
3
X
-
+
3
+
+
+ 3 H
2
O
3 OH
OH
-
X
3
CH + R
C
O
O
środowisko zasadowe
X
2
: Cl
2
Br
2
I
2
PRZYKŁADY
I
2
, OH
-
CHI
3
+
C
O
O
-
H
3
O
+
C
O
OH
C
O
CH
3
ACETOFENON
KWAS BENZOESOWY
KWASY KARBOKSYLOWE
OTRZYMYWANIE – REAKCJE UTLENIANIA
Br
2
, OH
-
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
C
O
C
Br
3
OH
-
CH
3
CH
2
C
O
O
+
C
HBr
3
2-BUTANON
KWAS PROPANOWY
4
∆
C
O
O
-
K
+
H
3
O
+
KMnO
4
, OH
-
CH
2
R
C
O
OH
5. UTLENIANIE ALKILOBENZENÓW
PRZYKŁADY
KWAS BENZOESOWY
KWAS BENZOESOWY
∆
C
O
O
-
K
+
H
3
O
+
KMnO
4
, OH
-
CH
2
CH
3
C
O
OH
ETYLOBENZEN
KWASY KARBOKSYLOWE
OTRZYMYWANIE – REAKCJE UTLENIANIA
CH
3
CH
3
O
O
O
O
2
, 350
°C
V
2
O
5
BEZWODNIK FTALOWY
KWASY KARBOKSYLOWE
OTRZYMYWANIE – METODY HYDROLITYCZNE
HYDROLIZA POCHODNYCH KWASOWYCH:
NITRYLI
AMIDÓW
ESTRÓW
R
C
O
O
R'
H
+
/H
2
O
lub
1. OH
-
/H
2
O
2. H
3
O
+
R
C
O
OH
R
C
O
NH
2
H
+
/H
2
O,
∆
lub
1. OH
-
/H
2
O,
∆
2. H
3
O
+
R
C
O
OH
R
C
N
H
+
/H
2
O,
∆
lub
1. OH
-
/H
2
O,
∆
2. H
3
O
+
R
C
O
OH
KWASY KARBOKSYLOWE
OTRZYMYWANIE – SYNTEZY BEZPOŚREDNIE
wykorzystujące jon cyjankowy
CN
-
R
X
+
IC N
R
CN
S
N
2
H
3
O
+
H
2
O,
∆
R
C
O
NH
2
H
3
O
+
H
2
O,
∆
R
C
O
OH
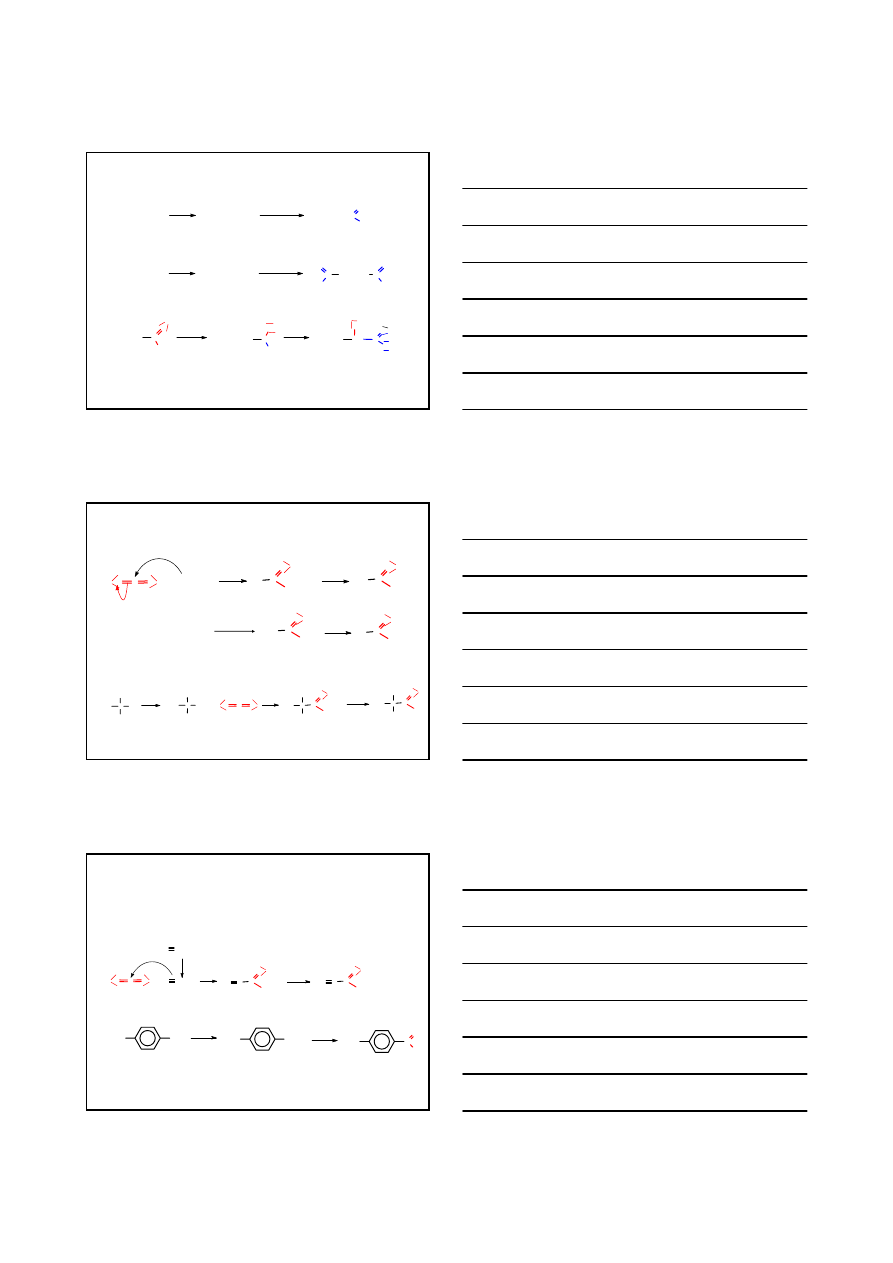
5
KWASY KARBOKSYLOWE
OTRZYMYWANIE – METODY BEZPOŚREDNIE
PRZYKŁADY
HOCH
2
CH
2
Cl
CN
-
HOCH
2
CH
2
CN
1. OH
-
, H
2
O
2. H
3
O
+
HOCH
2
CH
2
C
O
OH
3-HYDROKSYPROPANONITRYL
KWAS 3-HYDROKSYPROPANOWY
BrCH
2
CH
2
Br
CN
-
NC
CH
2
CH
2
CN
1. OH
-
, H
2
O
2. H
3
O
+
CH
2
CH
2
C
O
HO
C
O
OH
KWAS GLUTAROWY
CN
-
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
OH
CN
H
3
O
+
CH
3
CH
2
CH
OH
C
O
OH
CYJANOHYDRYNA
KWAS 2-HYDROKSYBUTANOWY
KWASY KARBOKSYLOWE
OTRZYMYWANIE – SYNTEZY BEZPOŚREDNIE
C
O
O
RMgX
R
C
O
O
-
Mg
+
X
R
C
O
OH
H
3
O
+
PRZYKŁADY
CH
3
C
H
3
C
CH
3
Cl
Mg
Et
2
O
CH
3
C
H
3
C
CH
3
MgCl
C
O
O
H
3
O
+
C
C
O
O
-
Mg
+
Br
H
3
C
CH
3
CH
3
C
C
O
OH
H
3
C
CH
3
CH
3
KWAS 2,2-DIMETYLOPROPANOWY
ArLi
Ar
C
O
O
-
Li
+
H
3
O
+
Ar
C
O
OH
ArMgX
wykorzystujące dwutlenek węgla
CO
2
PRZYKŁADY
C
O
O
H
3
O
+
C
C
O
O
-
Mg
+
Br
HC
C
C
O
OH
HC
HC CMgBr
CH
HC
+ CH
3
MgBr
- CH
4
KWAS PROPYNOWY
KWASY KARBOKSYLOWE
OTRZYMYWANIE – SYNTEZY BEZPOŚREDNIE
wykorzystujące dwutlenek węgla
CO
2
H
3
C
Br
H
3
C
MgBr
H
3
C
C
O
OH
Mg
Et
2
O
1.
CO
2
2. H
3
O
+
KWAS p-METYLOBENZOESOWY
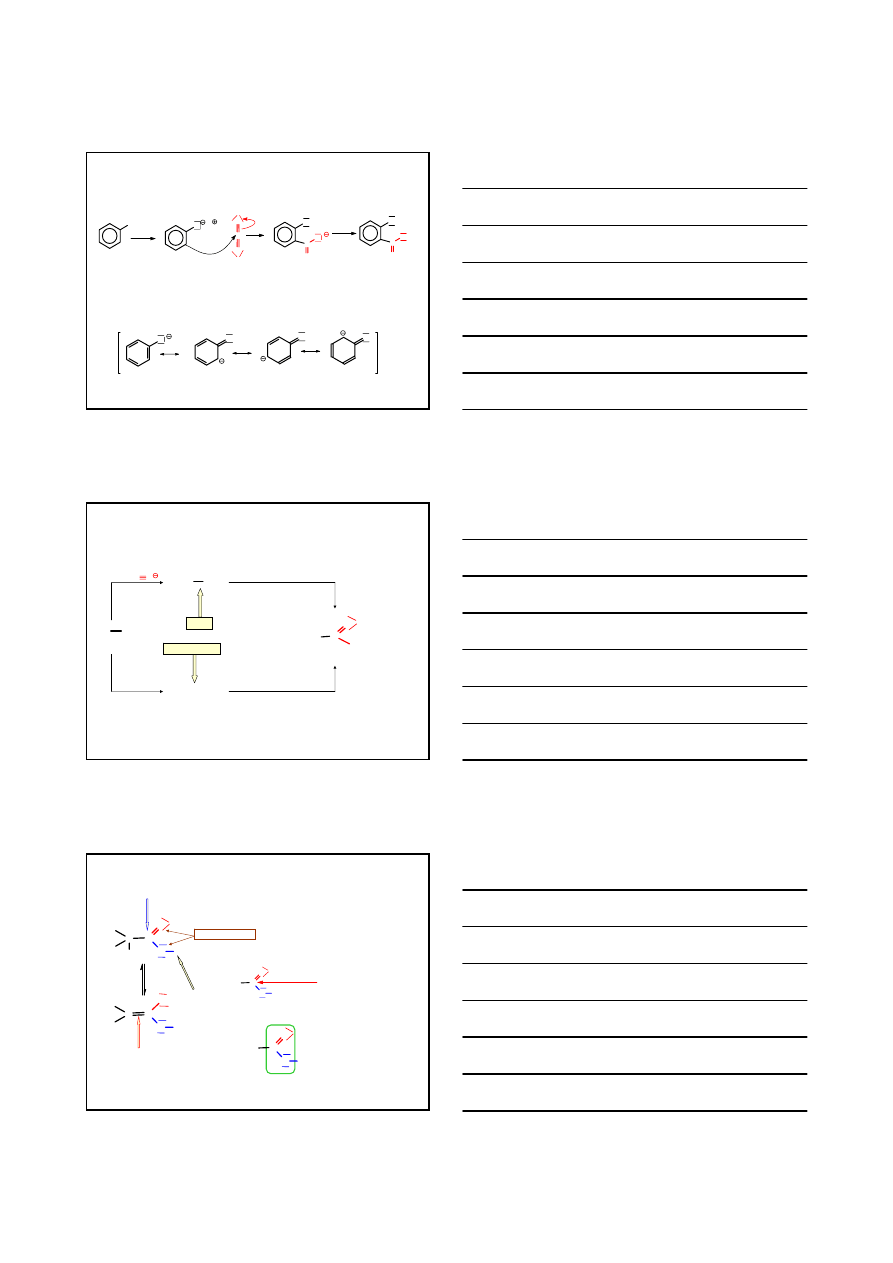
6
KWASY KARBOKSYLOWE
OTRZYMYWANIE – SYNTEZY BEZPOŚREDNIE
KWAS SALICYLOWY
OH
NaOH
O
C
O
O
H
3
O
+
Na
OH
C
O
O
OH
C
O
O
H
wykorzystujące dwutlenek węgla
CO
2
O
O
O
O
KWASY KARBOKSYLOWE
OTRZYMYWANIE – SYNTEZY BEZPOŚREDNIE
PORÓWNANIE
R
MgX
R
CN
R
C
O
OH
R
X
IC N
H
3
O
+
H
2
O,
∆
Mg
Et
2
O
R: 1°
R: 1°, 2°, 3°
1. CO
2
2. H
3
O
+
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
reakcje polegające na rozerwaniu wiązania
O–H
reakcje przebiegające przy udziale atomu węgla
grupy karbonylowej C
=O
reakcje dekarboksylacji – polegające na rozerwaniu
wiązania C
α
–C
karbonyl
reakcje zachodzące w podstawniku połączonym z grupą karboksylową
A
E
atak Nu
-
C
C
O
O H
H
C
C
O
H
O H
α
R
C
O
O H
Nu
R
C
O
O
H
α
centrum kwasowe
centrum zasadowe
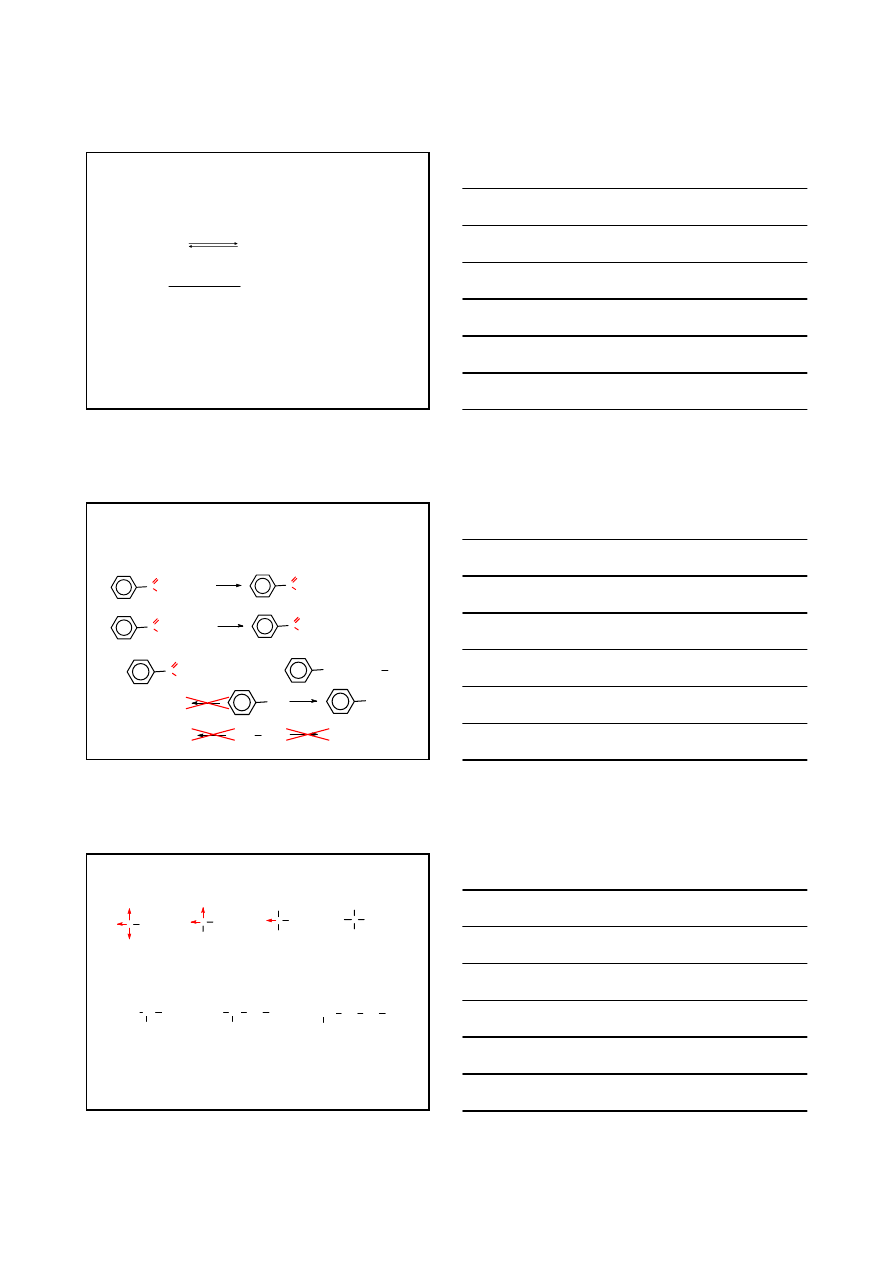
7
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE – KWASOWOŚĆ KWASÓW
DYSOCJACJA KWASÓW
R – COOH + H
2
O R – COO
-
+ H
3
O
+
K
a
K
a
=
[RCOO
-
][H
3
O
+
]
[RCOOH]
dla CH
3
COOH
K
a
= 1.75
× 10
-5
pK
a
= 4.75
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE – KWASOWOŚĆ KWASÓW
TWORZENIE SOLI
+ NaOH
C
O
O
-
Na
+
H
2
O
C
O
OH
+ H
2
O
+ H
2
O + CO
2
C
O
OH
H
2
O
C
O
O
-
Na
+
+ NaHCO
3
C
O
OH
H
2
CO
3
OH
R
OH
>
>
>
OH
O
-
Na
+
NaHCO
3
NaOH
R
OH
NaHCO
3
NaOH
PORÓWNANIE
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE – KWASOWOŚĆ KWASÓW
H
C
H
H
COOH
H
C
Cl
H
COOH
Cl
C
Cl
H
COOH
Cl
C
Cl
Cl
COOH
>
>
>
pKa
0.70
1.48
2.86
4.75
>
>
CH
3
CH
2
CH COOH
Cl
CH CH
2
COOH
CH
3
Cl
CH
2
CH
2
COOH
CH
3
Cl
pKa
2.86
4.05
4.50
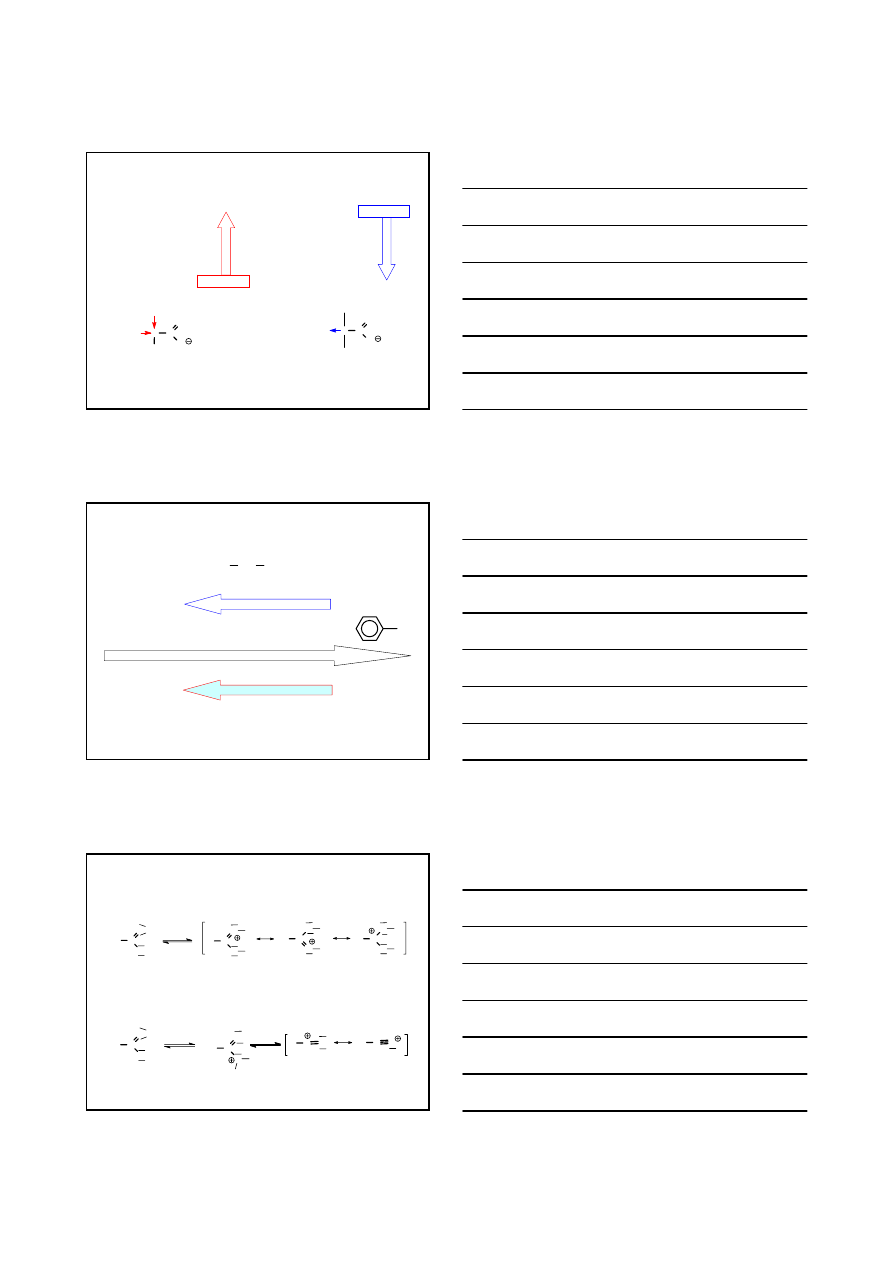
8
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE – KWASOWOŚĆ KWASÓW
+I
pK
a
- I
pK
a
H – COOH
3.75
CH
3
– COOH
CH
3
CH
2
– COOH
(CH
3
)
2
CH – COOH
(CH
3
)
3
C – COOH
4.85
MOC KWASU
H – CH
2
–COOH
4.7
I – CH
2
–COOH
Br–CH
2
–COOH
CI–CH
2
–COOH
F –CH
2
–COOH 2.68
MOC KWASU
CH
3
C
CH
3
H
C
O
O
H
C
Cl
H
C
O
O
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE – KWASOWOŚĆ KWASÓW
Y: NO
2
CN F COOH OH
>
>
>
>
≥
Y CH
2
COOH
- I
pKa
1.7
2.68
2.85
3.87
4.31
MOC KWASU
KWASY KARBOKSYLOWE
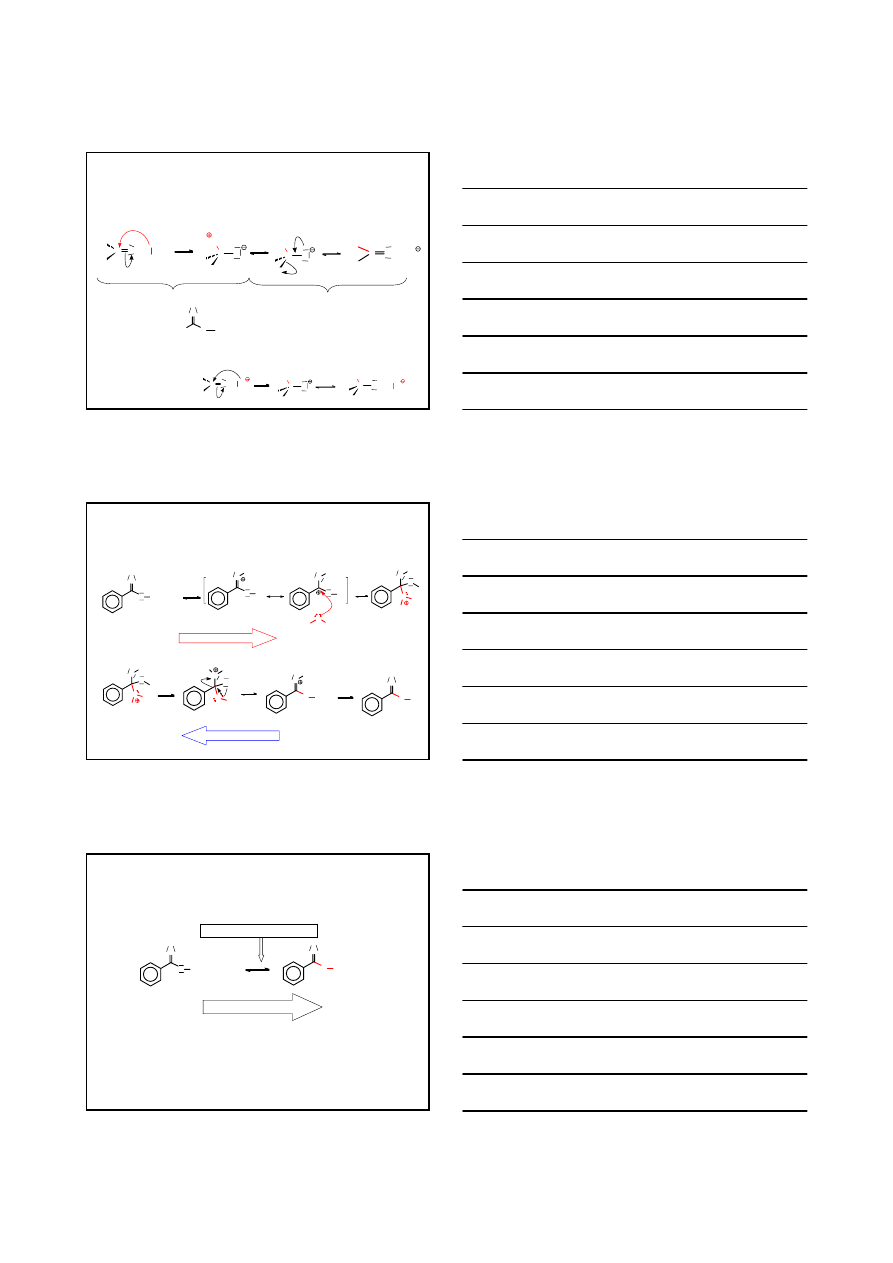
WŁAŚCIWOŚCI CHEMICZNE–ZASADOWOŚĆ KWASÓW
- H
2
O
R
C
O
OH
R
C
O
O H
H
R
C O
R
C O
+H
+
dla R – objętościowego
kation acyliowy
R
C
O
OH
R
C
O
O
H
H
R
C
O
O
H
H
R
C
O
O
H
H
+H
+
9
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
R
X
C O
NuH
R
X
C
O
HNu
R
X
C
O
Nu
-H
+
R
C
O
Nu
+ X
ADDYCJA
sp
3
sp
2
ELIMINACJA
sp
2
X: Cl, RO– , HO– ,
O
O
R
R
R
C O
Nu
R
R
C
O
Nu
R
R
C
O
H
Nu
+HNu
Nu
+
PORÓWNANIE Z A
N
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
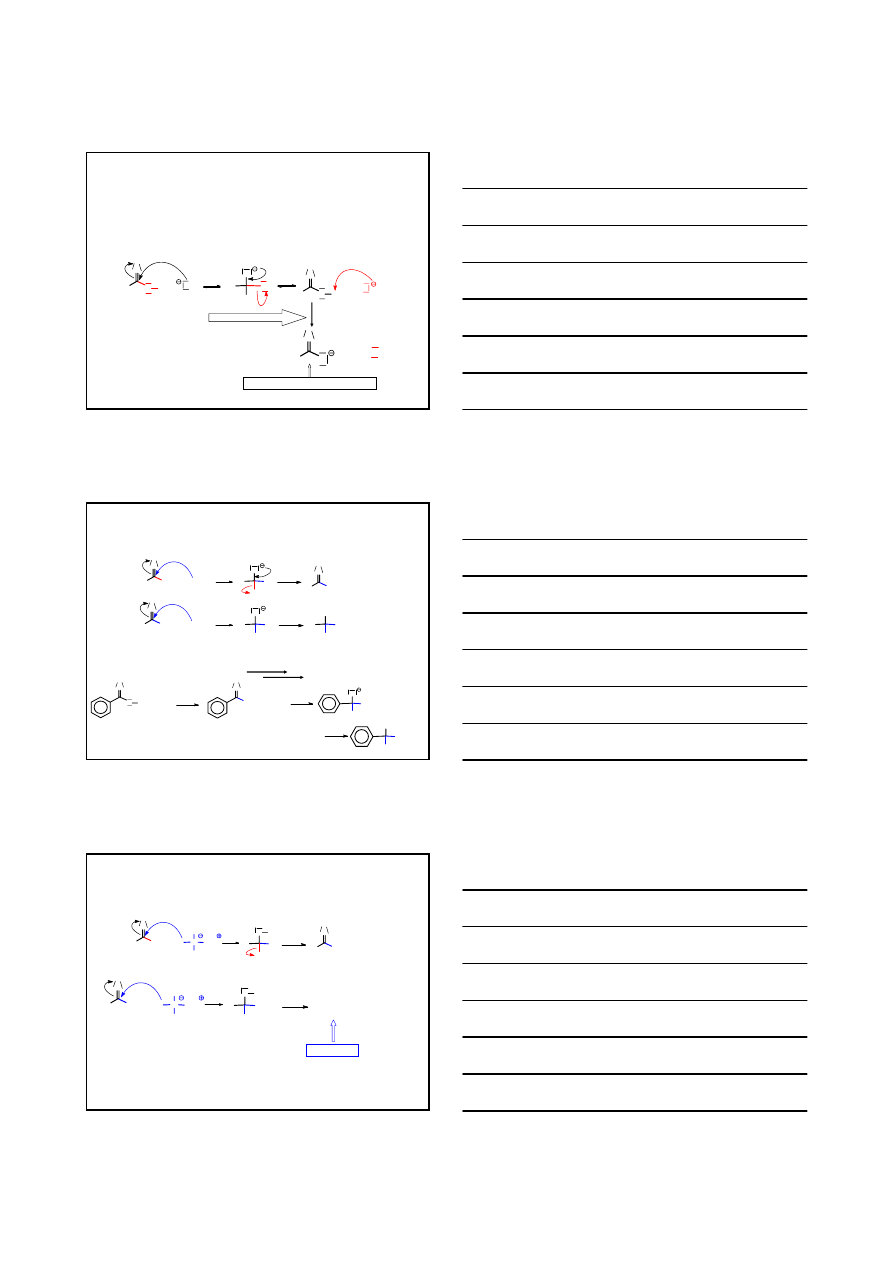
MECHANIZM REAKCJI ESTRYFIKACJI KWASÓW KARBOKSYLOWYCH KATALIZOWANYCH KWASEM
O
O H + H
+
O
O H
H
O
O H
H
sp
2
CH
3
O
H
O
O
H
H
O
H
3
C
H
sp
3
O
O
H
H
O
H
3
C
H
O
OH
H
O CH
3
H
wolno
O
O CH
3
-H
2
O
O
O CH
3
H
-H
+
sp
2
KWAS BENZOESOWY
BENZOESAN
METYLU
ESTRYFIKACJA
HYDROLIZA ESTRU
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
MECHANIZM REAKCJI ESTRYFIKACJI KWASÓW KARBOKSYLOWYCH KATALIZOWANYCH KWASEM
O
O H +
CH
3
OH
sp
2
O
O CH
3
sp
2
H
+
+ H
2
O
REAKCJA ODWRACALNA
‘PRZESUWANIE’ RÓWNOWAGI
katalizator – mocny kwas mineralny, najlepiej o właściwościach higroskopijnych, np. H
2
SO
4
usuwanie jednego z produktów ze środowiska reakcji – najczęściej usuwana jest H
2
O
stosowanie nadmiaru jednego z substratów, np. alkohol CH
3
OH jest substratem i rozpuszczalnikiem
10
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
MECHANIZM REAKCJI HYDROLIZY ESTRÓWI KWASÓW KARBOKSYLOWYCH KATALIZOWANYCH
ZASADĄ, tzw. ZMYDLANIE ESTRÓW
H
2
O
O
O
R
R'
OH
O
OR'
R
OH
O
O
R
H
R'O
+
+
+
R'O
H
O
O
R
ETAP NIEODWRACALNY
karboksylan – nie ulega reakcji S
Nacyl
ESTER
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
MECHANIZM REAKCJI ESTRÓW KWASÓW KARBOKSYLOWYCH ZE
ZWIĄZKAMI GRIGNARD’A
REASUMUJĄC
1 MOL ESTRU + 2 MOLE
RMgX
ALKOHOL 3
°
H
2
O
NH
4
Cl
R"MgX
O
R"
R
R"
O
R"
R
+
+
MgX
+
MgX
2
OH
R"
R
R"
O
O CH
3
+
CH
3
CH
2
MgI
O
CH
2
CH
3
+
CH
3
CH
2
MgI
MgX
+
O
CH
2
CH
3
CH
2
CH
3
H
2
O
NH
4
Cl
OH
CH
2
CH
3
CH
2
CH
3
R"MgX
O
R"
R
OR
O
OR
R
+
+
MgX
+
MgX
+
(
RO
-
)
O
R"
R
SUBSTYTUCJA NUKLEOFILOWA PRZY ATOMIE WĘGLA GRUPY KARBONYLOWEJ
S
N
acyl
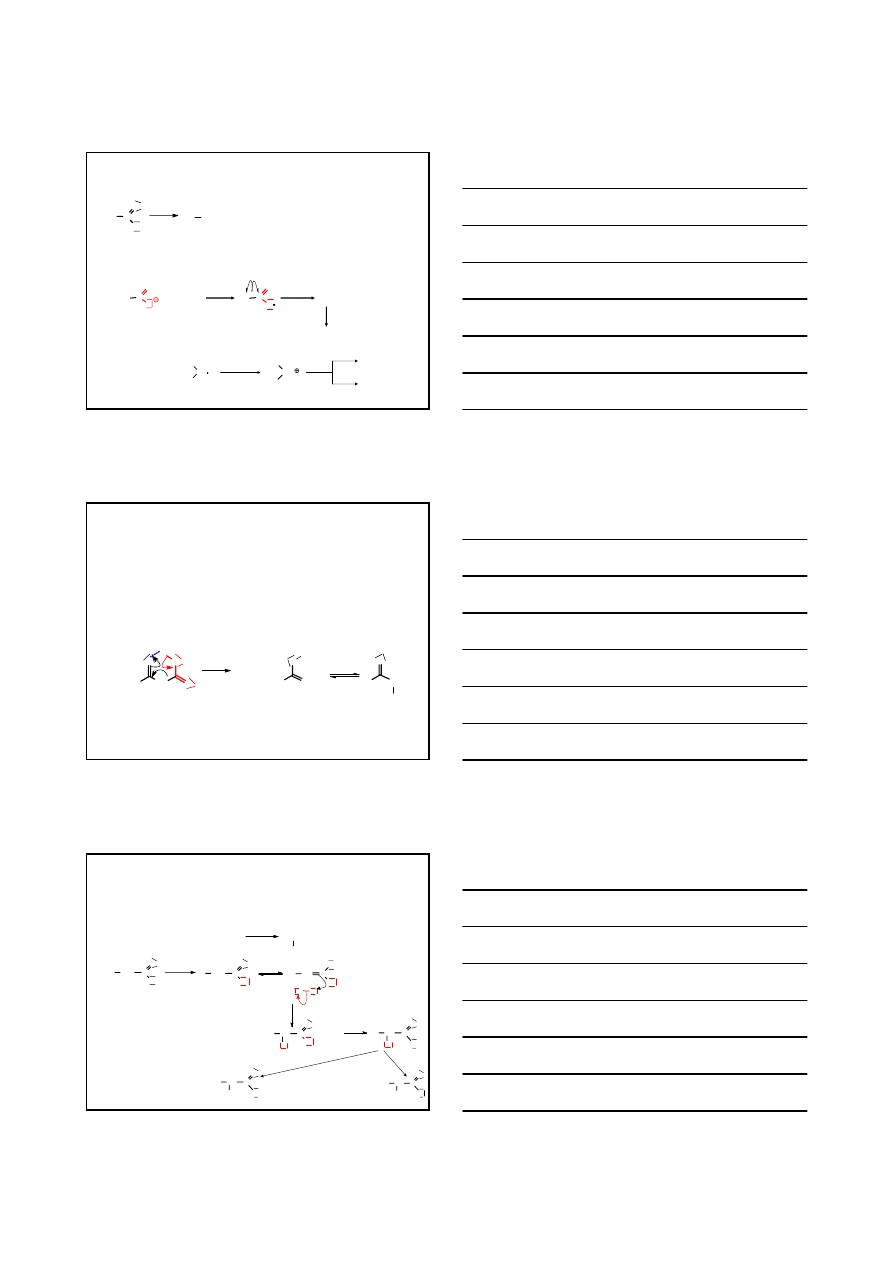
MECHANIZM REAKCJI REDUKCJI ESTRÓW KWASÓW KARBOKSYLOWYCH
O
H
R
OR
AlH
3
-
Li
+
O
OR
R
+
+
Li
+
AlH
3
OR
-
O
H
R
H
Al H
H
H
Li
H
2
O
RC
H
2
OH + Al(OH)
3
+ Li
+
O
H
R
H
AlH
2
OR
-
Li
+
+
O
H
R
OR
Al H
H
H
Li
ALKOHOL 1
°
11
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
REAKCJE DEKARBOKSYLACJI – ROZERWANIE WIĄZANIA C – C
karbonyl
R
C
O
OH
R
H + CO
2
REAKCJA KOLBE’GO – reakcja dekarboksylacji anodowej
MECHANIZM I SZYBKOŚĆ REAKCJI DEKARBOKSYLACJI
ZALEŻY OD BUDOWY KWASU KARBOKSYLOWEGO
R
C
O
O
ANODA
K
+
Na
+
NH
4
+
– e
–
R
C
O
O
R•
+
CO
2
REKOMBINACJA
R –R
OGRANICZENIA – dla objętościowych alkili
CH
CH
3
CH
3
R:
– e
–
CH
CH
3
CH
3
E
S
N
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
REAKCJE DEKARBOKSYLACJI – ROZERWANIE WIĄZANIA C – C
karbonyl
dla
β-ketokwasów
O
CH
2
O
H
R
O
CO
2
+
O
CH
2
R
H
O
CH
2
R
H
tautomeria
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
REAKCJE ZACHODZĄCE W PODSTAWNIKU POŁĄCZONYM Z GRUPĄ KARBOKSYLOWĄ
dla alifatycznych kwasów karboksylowych
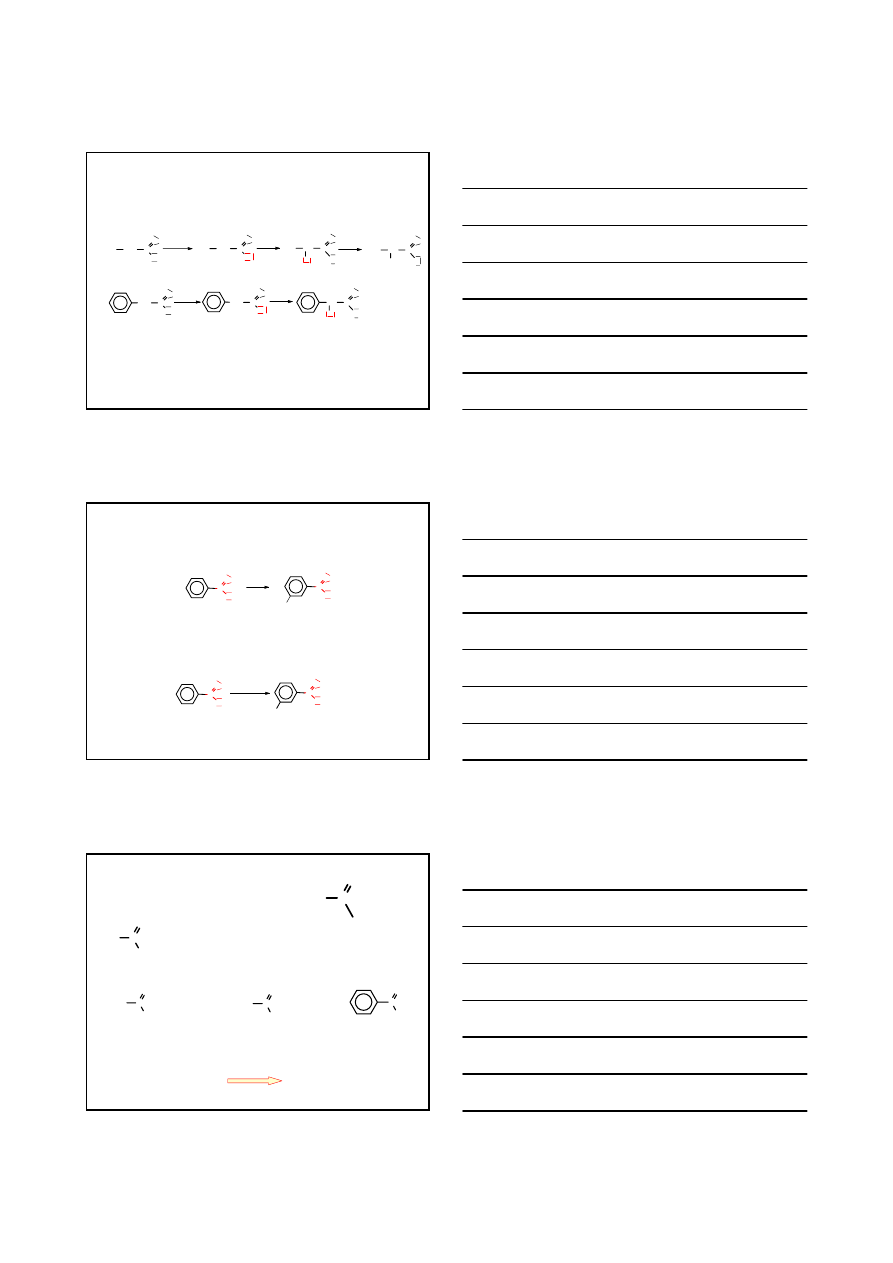
REAKCJA HELL – VOLHARD – ZELINSKI – tworzenie
α-halogenokwasów
RCH
2
COOH
RCHCOOH
X
1.
X
2
/P
CZ
2. H
2
O
R CH
2
C
O
OH
R CH
2
C
O
Br
R CH C
OH
Br
BROMEK ACYLU
ENOL
P+
Br
2
(P
Br
3
)
Br
Br
A
E
R CH C
O
Br
Br
R CH C
O
OH
Br
+ H
Br
H
2
O
R CH C
O
OH
OH
1. OH
-
2. H
+
KWAS
α-
HYDROKSY
KARBOKSYLOWY
R CH C
O
O
NH
3
+
NH
3
-
α-
AMINO
KWAS
12
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
REAKCJE ZACHODZĄCE W PODSTAWNIKU POŁĄCZONYM Z GRUPĄ KARBOKSYLOWĄ
dla alifatycznych kwasów karboksylowych
REAKCJA HELL – VOLHARD – ZELINSKI – tworzenie
α-halogenokwasów
PRZYKŁADY
P+
Br
2
(P
Br
3
)
CH
3
CH
2
C
O
OH
CH
3
CH
2
C
O
Br
CH
3
CH C
O
OH
Br
NH
3
1. Br
2
2. H
2
O
CH
3
CH C
O
O
NH
3
+
-
α-ALANINA
KWAS PROPANOWY
CH
2
C
O
OH
CH C
O
OH
Br
1. Br
2
2. H
2
O
(P
Br
3
)
P+
Br
2
CH
2
C
O
Br
KWAS FENYLOOCTOWY
KWAS
α-
BROMO
-
FENYLOOCTOWY
KWASY KARBOKSYLOWE
WŁAŚCIWOŚCI CHEMICZNE
REAKCJE ZACHODZĄCE W PODSTAWNIKU POŁĄCZONYM Z GRUPĄ KARBOKSYLOWĄ
dla aromatycznych kwasów karboksylowych
grupa
–COOH
efekt –I ZMNIEJSZANIE GĘSTOŚCI ELEKTRONOWEJ W PIERŚCIENIU
grupa
–COOH
efekt –M KIERUJE PODSTAWNIK W POZYCJĘ meta-
PRZYKŁADY
C
O
OH
E
+
C
O
OH
E
C
O
OH
HNO
3
/H
2
SO
4
C
O
OH
O
2
N
KWAS BENZOESOWY
KWAS
m
-NITRO
BENZOESOWY
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
zawierają w swojej strukturze ugrupowanie acylowe; ulegają
reakcji hydrolizy, której produktem jest kwas karboksylowy
R
X
C
O
X: Cl, Br
HALOGENKI KWASOWE
CH
3
Cl
C
O
CHLOREK ACETYLU
CH
3
CH
2
Cl
C
O
CHLOREK PROPANOILU
CHLOREK BENZOILU
Cl
C
O
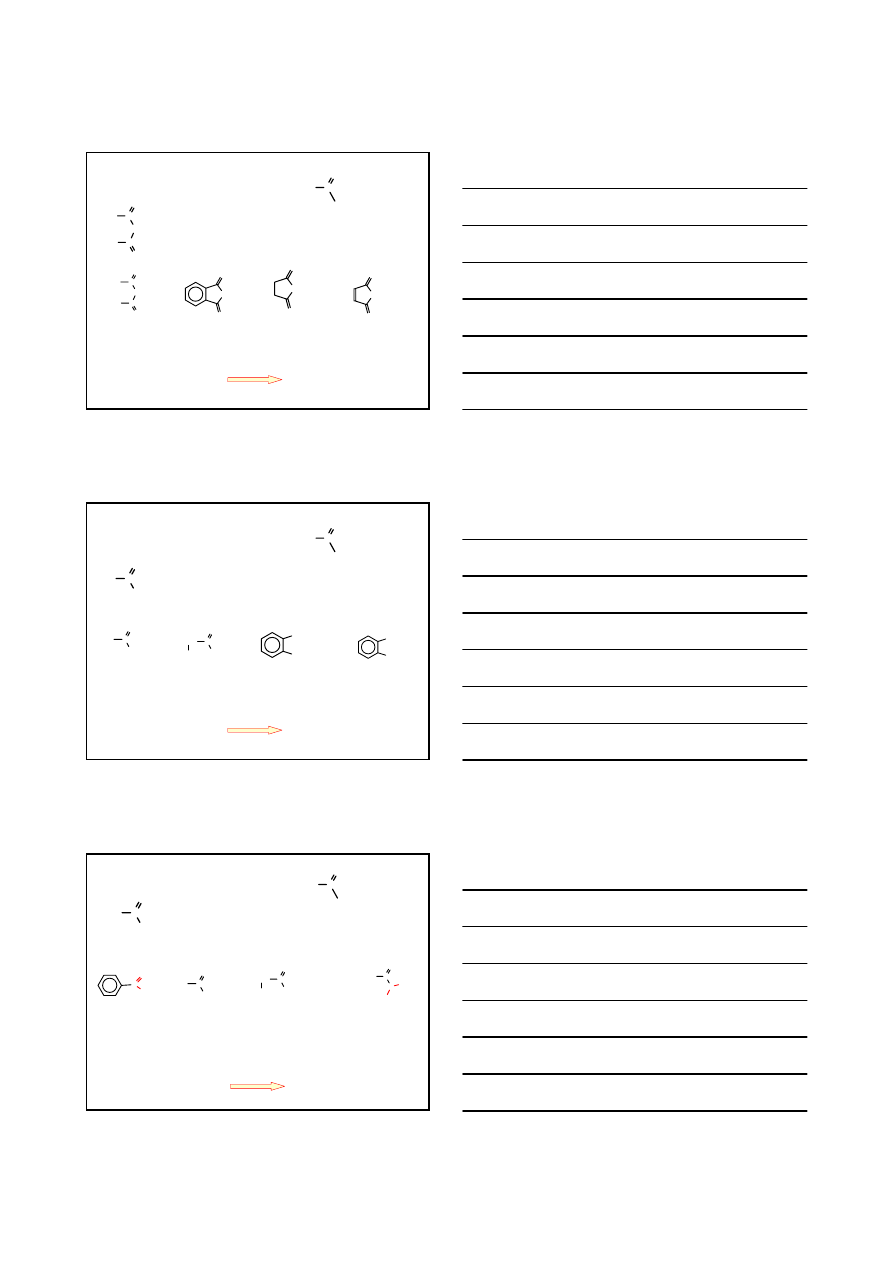
w nazwie kwasu wymienia się końcówkę –owy na –oilu i dodaje słowo ‘chlorek’
KWAS
BUTAN
OWY
CHLOREK
BUTAN
OILU
13
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
R C
O
O
C
O
R
BEZWODNIKI KWASOWE
w nazwie kwasu wymienia się słowo „kwas” na „bezwodnik’
KWAS
BUTANOWY
BEZWODNIK
BUTANOWY
CH
3
C
O
O
C
O
CH
3
BEZWODNIK OCTOWY
(bezwodnik etanowy)
O
O
O
BEZWODNIK FTALOWY
O
O
O
BEZWODNIK
BURSZTYNOWY
O
O
O
BEZWODNIK MALEINOWY
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
R
OR'
C
O
R, R’: alkil, aryl
ESTRY KWASÓW
KARBOKSYLOWYCH
w nazwie kwasu wymienia się końcówkę –owy na –ian i dodaje słowo określające rodzaj alkilu
KWAS
BUTAN
OWY
BUTAN
IAN
ALKILU
CH
3
CH
OCH
3
C
O
CH
3
CH
3
OCH
3
C
O
OCTAN
METYLU
(etan
ian
metylu)
IZOMAŚLAN
METYLU
(2-metylopropan
ian
metylu)
CO
OCH
2
CH
3
CO
OCH
2
CH
3
FTALAN DI
ETYLU
CO
OCH
3
CO
2
H
WODOROFTALAN
METYLU
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
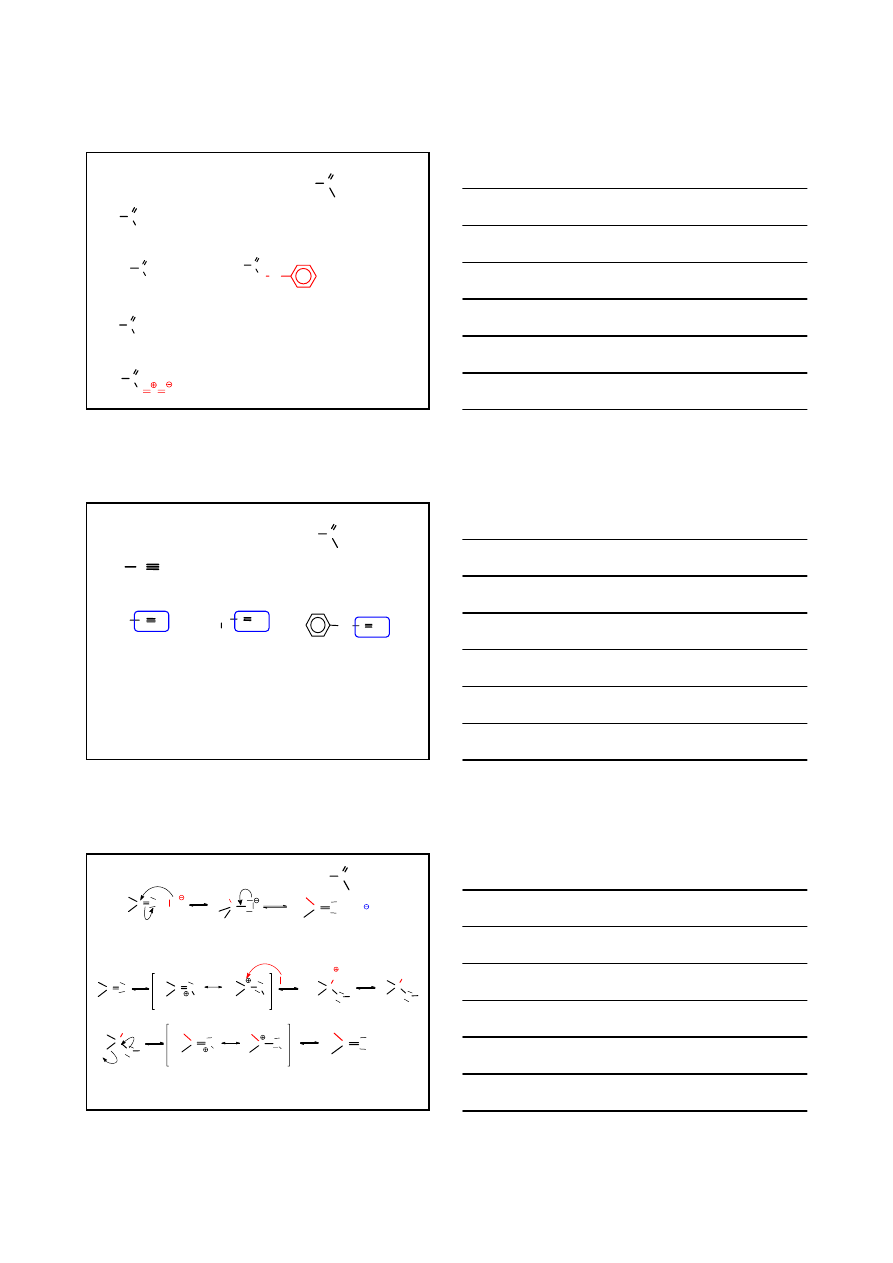
AMIDY KWASÓW KARBOKSYLOWYCH
R
NR'
2
C
O
R, R’: alkil, aryl
C
O
NH
2
BENZ
AMID
CH
3
NHCH
3
C
O
N
-METYLO
ACET
AMID
CH
3
CH
N(CH
2
CH
3
)
2
C
O
CH
3
N,N
-DIETYLO
-3-
METYLOPROPANO-
AMID
CH
3
CH
2
CH
2
N
C
O
CH
2
CH
3
CH
3
N
-ETYLO-N-METYLO-
BUTANO
AMID
dla amidów podstawionych na atomie azotu przed nazwą amidu po literze N- podaje
się nazwę alkilu połączonego z azotem
KWAS
BUTAN
OWY
N-
ALKILO
BUTANO
AMID
w nazwie kwasu pomija się słowo „kwas”; do nazwy alkanu dodaje się słowo „amid”
14
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
HYDRAZYDY KWASÓW
KARBOKSYLOWYCH
R
NHNH
2
C
O
R: alkil, aryl
CH
3
NHNH
2
C
O
R: alkil, aryl
R
NHOH
C
O
R
N
C
O
N N
R: alkil, aryl
KWASY HYDROKSAMOWE
AZYDEK ACYLOWY
CH
3
CH
2
CH
2
NH
C
O
NH
N
-FENYLOHYDRAZYD
KWASU BUTANOWEGO
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
R
N
C
R: alkil, aryl
NITRYLE KWASÓW KARBOKSYLOWYCH
CH
2
N
C
FENYLOACETO
NITRYL
CH
3
N
C
ACETO
NITRYL
CH
3
CH
N
C
CH
3
2-METYLOPROPIO
NITRYL
cyjanek
benzylu
cyjanek
izopropylu
cyjanek
metylu
w nazwie kwasu pomija się słowo „kwas”; do nazwy dodaje się słowo „nitryl”
nazwę wyprowadza się jak dla soli kwasu cyjanowodorowego oraz alkanu
LUB
ACYLOWE POCHODNE KWASOWE
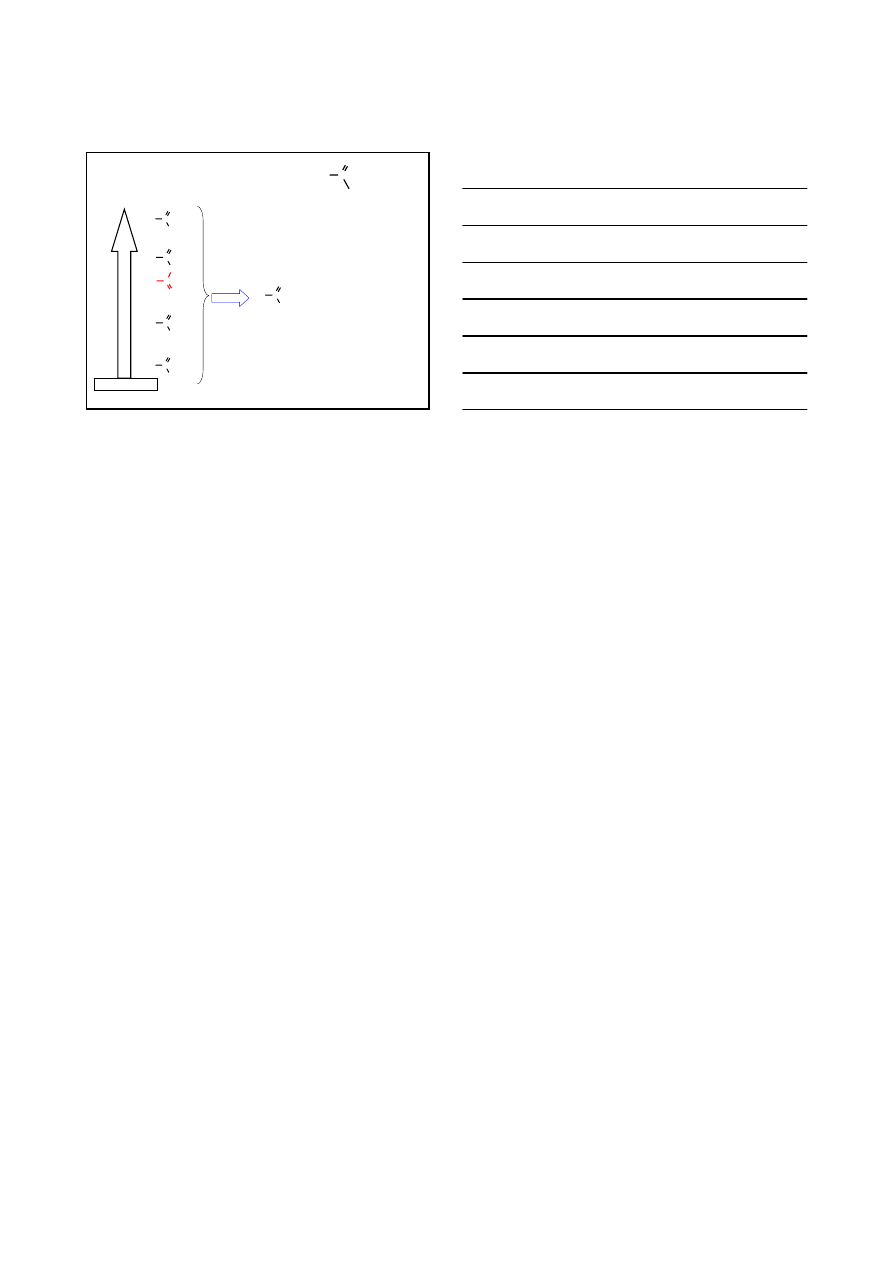
R C
O
ACYL
S
Nacyl
H
+
R
X
C O
R
X
C O
H
R
X
C O
H
NuH
wolno
KATALIZA KWASEM
R
X
C
O H
NuH
R
X
C
O H
Nu
R
C
O
Nu
-H
+
wolno
szybko
R
C
O
Nu
R
X
C O
Nu
R
X
C
O
Nu
+
X
R
X
C
O H
Nu
R
C
O
Nu
H
R
C
O
Nu
H
X
-
15
ACYLOWE POCHODNE KWASOWE
R C
O
ACYL
S
Nacyl
REAKCJA HYDROLIZY POCHODNYCH KWASOWYCH
R
NH
2
C
O
R
OR'
C
O
R C
O
O
C
O
R
R
Cl
C
O
H
2
O
R
OH
C
O
H
Cl
RCOOH
R’OH
NH
3
+
REAKTYWNOŚĆ
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron