
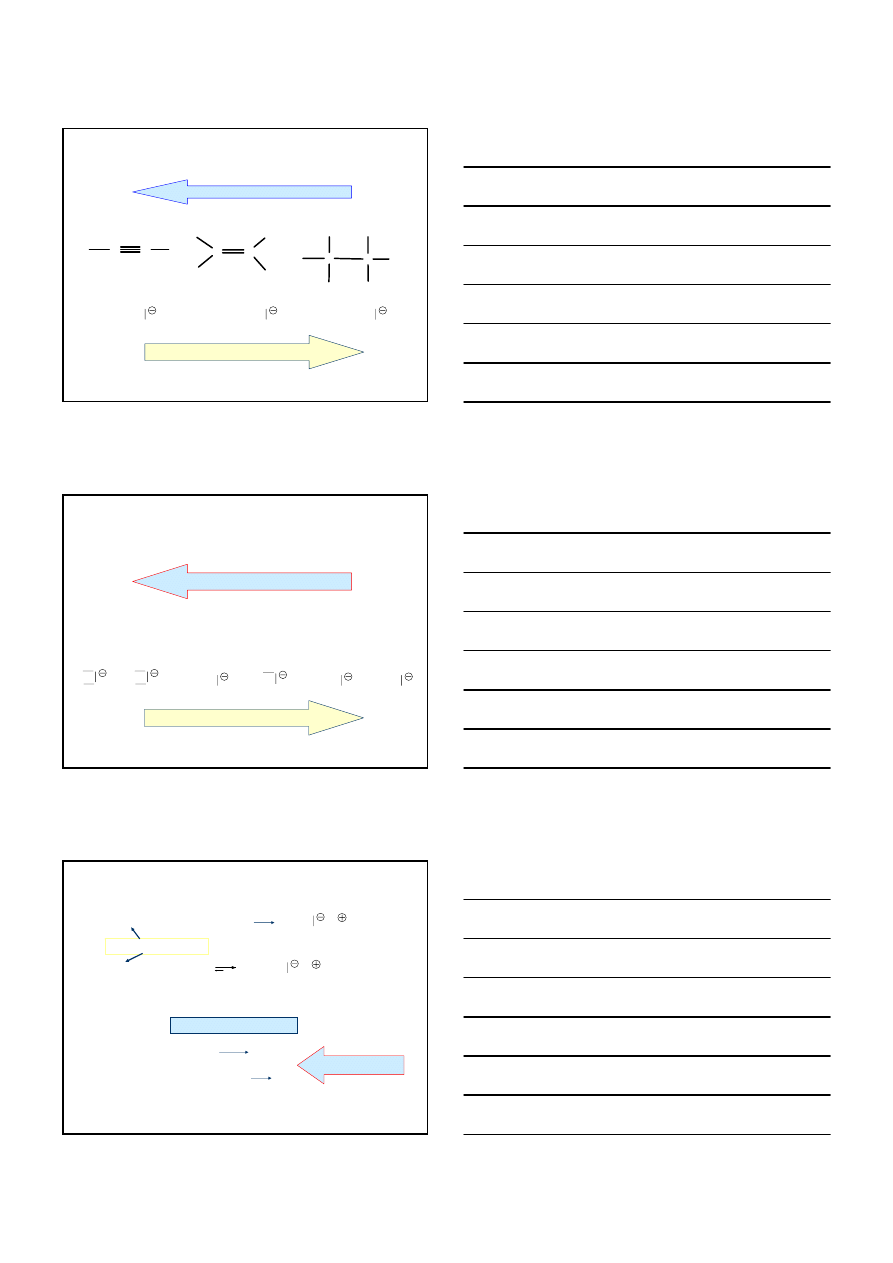
1
CaCO
3
CaO + CO
2
CaO
+ 3C CaC
2
+ CO
2 000
°C
CaC
2
+ 2H
2
O Ca(OH)
2
+ H – C
≡ C – H
HYDROLIZA WĘGLIKA WAPNIA
UTLENIANIE METANU (z ropy naftowej)
6CH
4
+ O
2
2 H – C
≡ C – H + 2CO + 10 H
2
1 500
°C
ALKINY
C
n
H
2n-2
OTRZYMYWANIE
1. OTRZYMYWANIE ETYNU – metody przemysłowe
ALKINY
C
n
H
2n-2
OTRZYMYWANIE
2. OTRZYMYWANIE INNYCH ALKINÓW
ELIMINACJA DWÓCH CZĄSTECZEK CHLOROWCOWODORU Z
vic-DICHLOROWCOALKANÓW
CH
3
– CH = CH
2
+ Br
2
CH
3
– CH – CH
2
Br
Br
CH
3
– CH – CH
2
Br CH
3
– CH = CHBr + HBr
Br
KOH / EtOH
CH
3
– CH = CHBr
CH
3
– C
≡ C – H + HBr
NaNH
2
/ NH
3
ALKINY
C
n
H
2n-2
OTRZYMYWANIE
2. OTRZYMYWANIE INNYCH ALKINÓW
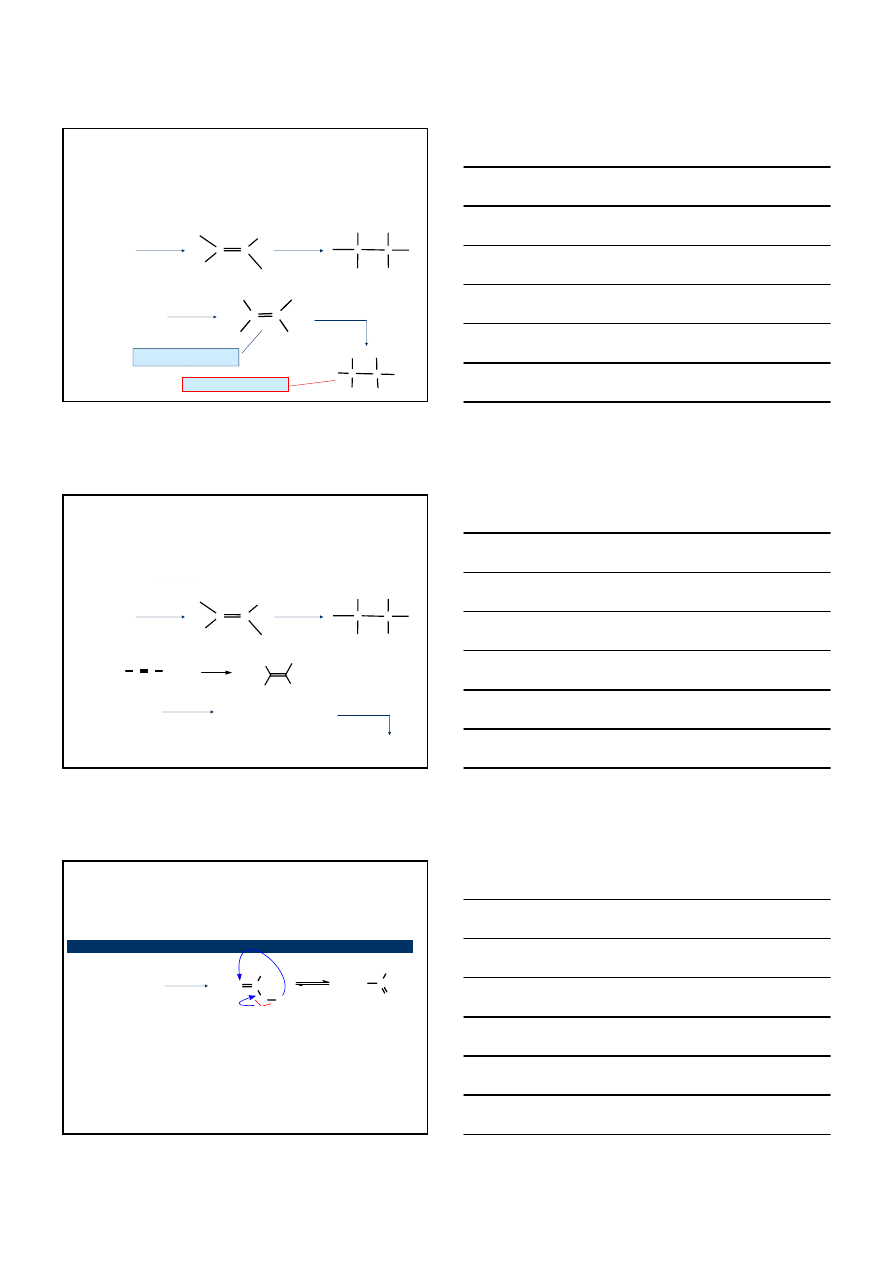
REAKCJA PODSTAWIENIA CHLOROWCOALKANÓW
ACETYLENKIEM SODU
H – C
≡ C – H H – C ≡ C Na
NaNH
2
/ NH
3/C/
ACETYLID MONOSODOWY
H – C
≡ C Na +
CH
3
– Br
H – C
≡ C –
CH
3
+ Na
B
r
propyn
2
ALKINY
C
n
H
2n-2
KWASOWOŚĆ TERMINALNYCH ALKINÓW
C
C
H
H
C
C
H
H
H
H
C
C
H
H
H
H
H
H
p
K
a
= 25
Csp
p
K
a
= 44
Csp
2
p
K
a
= 50
Csp
3
HC
≡C
CH
2
=CH
CH
3
CH
2
ZASADOWOŚĆ
KWASOWOŚĆ
ALKINY
C
n
H
2n-2
KWASOWOŚĆ TERMINALNYCH ALKINÓW
HO
RO
HC
≡C H
2
N CH
2
=CH CH
3
CH
2
ZASADOWOŚĆ
KWASOWOŚĆ
HO –
H
RO –
H
HC
≡ C –
H
H
2
N –
H
CH
2
=CH –
H
CH
3
CH
2
–
H
p
K
a
15.7 16 – 17 25
38 44 50
ALKINY
C
n
H
2n-2
KWASOWOŚĆ TERMINALNYCH ALKINÓW
ALE
R–C
≡C–H + NaNH
2
R–C
≡C Na + NH
3
R–C
≡C –R + NaNH
2
R–C
≡C – H + Ag(NH
3
)
2
+
OH
-
R–C
≡C Ag
R–C
≡C– R + Ag(NH
3
)
2
+
OH
-
BRAK REAKCJI
TERMINALNY ALKIN
BRAK WIĄZANIA C
sp
– H
3
ALKINY C
n
H
2n-2
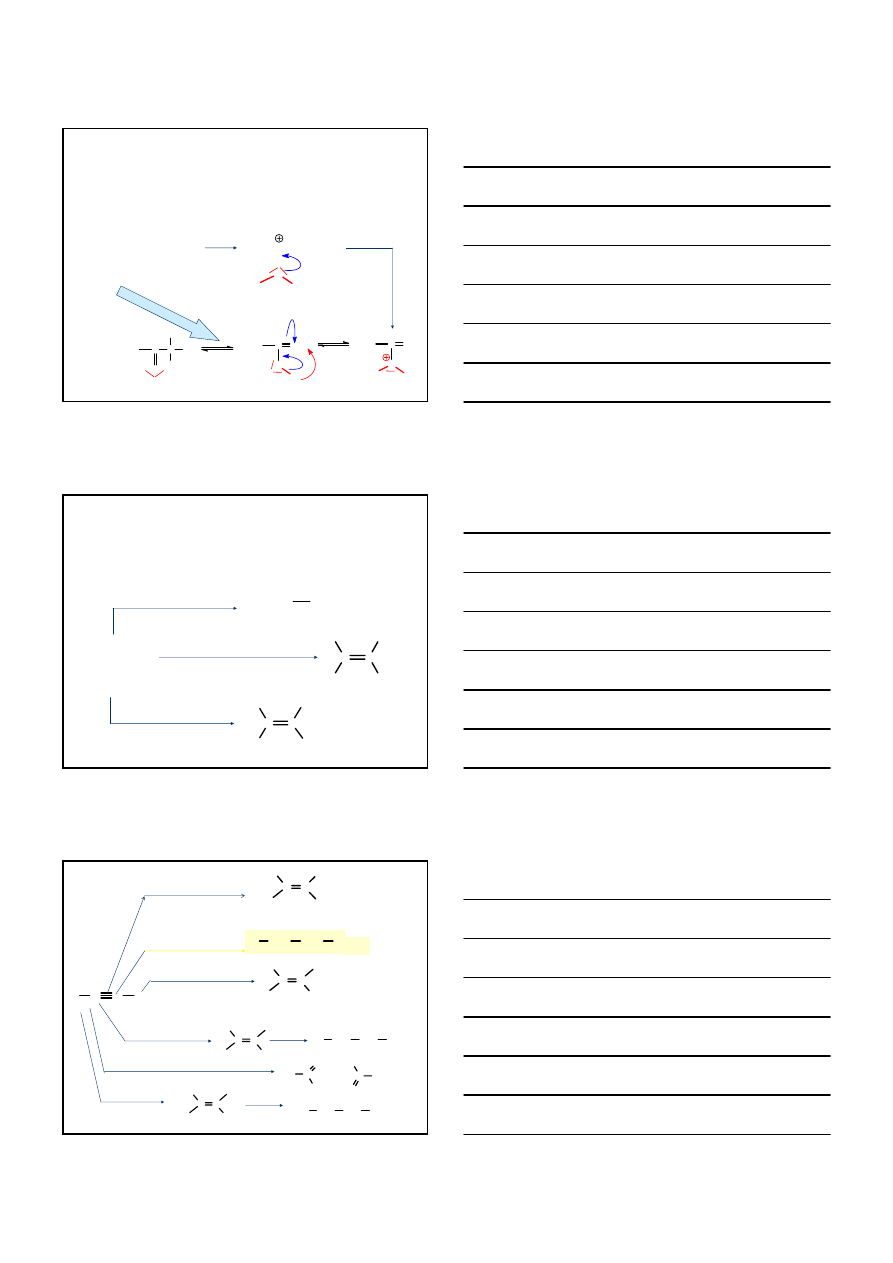
REAKCJE PRZYŁĄCZANIA DO ALKINÓW
REAKCJE ADDYCJI
HALOGENOWODORÓW
DO ALKINÓW
– C
≡ C –
C
C
H
X
H – X
H – X
C
C
H
X
H
X
CH
3
CH
2
–C
≡ C –CH
3
H – Br
H – Br
C
C
H
Br
CH
3
CH
2
CH
3
C
C
H
CH
3
CH
3
CH
2
Br
H
Br
2-
BROMO
-2-PENTEN
2,2-DI
BROMO
PENTAN
REAKCJE ADDYCJI
HALOGENÓW
DO ALKINÓW
ALKINY C
n
H
2n-2
REAKCJE PRZYŁĄCZANIA DO ALKINÓW
– C
≡ C –
X – X
X – X
C
C
X
X
C
C
X
X
X
X
HOOC C C COOH
Br
2
1 MOL
HOOC
Br
COOH
Br
kwas acetylenodikarboksylowy
70%
CH
3
(CH
2
)
3
C
≡CCH
3
CH
3
(CH
2
)
3
C
Br
=C
Br
CH
3
CH
3
(CH
2
)
3
C
Br
2
–C
Br
2
CH
3
Br
2
CCl
4
Br
2
CCl
4
2,2,3,3-TERABROMOHEPTAN
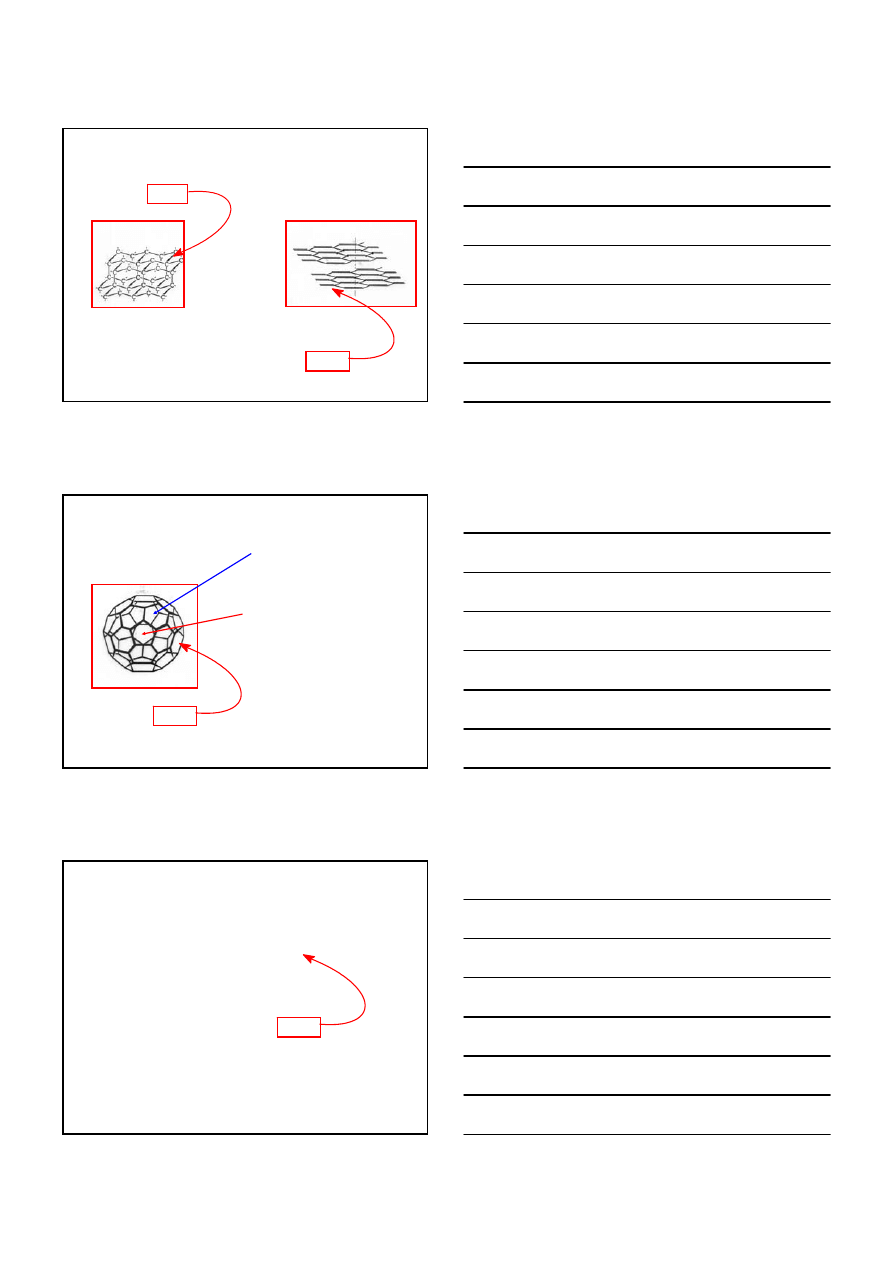
HC
≡CH + HCl
H
2
C=CHCl
Hg
+2
CHLOREK WINYLU
ALKINY C
n
H
2n-2
REAKCJE PRZYŁĄCZANIA DO ALKINÓW
REAKCJE ADDYCJI
WODY
DO ALKINÓW
REAKCJA KUCZEROWA – przemysłowa metoda otrzymywania aldehydu octowego
HC
≡CH + H
2
O
H
2
SO
4
HgSO
4
C
H
2
C
O
H
H
C
H
3
C
O
H
4
ALKINY C
n
H
2n-2
REAKCJE PRZYŁĄCZANIA DO ALKINÓW
REAKCJE ADDYCJI
WODY
DO ALKINÓW
CH
3
–C
≡C–H + H
+
[CH
3
– C = CH
2
]
H
H
O
CH
3
C CH
2
H
O
H
CH
3
C CH
2
H
O
CH
3
C C
H
H
H
O
TAU
TOM
ERIA
ALKINY C
n
H
2n-2
REAKCJE PRZYŁĄCZANIA DO ALKINÓW
REAKCJE UWODORNIENIA ALKINÓW
R – C
≡ C – R
2H
2
/
Pt, Ni lub Pd
H
2
/
katalizator
LINDLARA Lub Ni
2
B
Na lub K/ NH
3
H
H
C
C
R
R
H
H
C
C
R
R
RC
H
2
C
H
2
R
ALKINY C
n
H
2n-2
R C C R
H
2
/kat. Lindlara
A syn
H
C
C
H
R
R
H
C
C
H
R
R
H
3
/
Pt
A anti
HX,
GDZIE
X: Cl, Br
X
C
C
H
R
R
HX
R C
H
2
C
X
2
R
Li/NH
3
A anti
R C
H
2
C
H
2
R
1.
O
3
2.
H
2
O
R C
O
OH
C R
HO
O
+
A anti
X
2
,
GDZIE
X: Cl, Br
X
C
C
X
R
R
X
2
R C
X
2
C
X
2
R
5
WĘGIEL
C
sp
3
C
sp
2
DIAMENT
GRAFIT
ODMIANY ALOTROPOWE
WĘGIEL
C
sp
2
ODMIANY ALOTROPOWE
FULERENY
WĘGIEL
POLIYNY
– C
≡ C – C ≡ C – C ≡ C – C ≡ C – C ≡ C – C ≡ C –
ODMIANY ALOTROPOWE
C
sp
rozpuszczają się w rozpuszczalnikach organicznych, np. toluenie
przewodzą prąd elektryczny wzdłuż osi łańcucha; zastosowanie –
‘drut cząsteczkowy’
łatwo pokrywają inne substancje
6
ALKADIENY C
n
H
2n-2
wiązania izolowane CH
2
= CH – (CH
2
)
n
– CH = CH
2
n
= 1, 2, ...
dla n = 1 CH
2
= CH – CH
2
– CH = CH
2
1,4
-PENTA
DIEN
wiązania skumulowane CH
2
= C = CH – CH
2
– CH
3
1,2
-PENTA
DIEN
wiązania sprzężone CH
2
= CH – CH = CH – CH
3
1,3
-PENTA
DIEN
alkadieny o wiązaniach izolowanych
właściwości chemiczne analogiczne jak dla alkenów
ALKADIENY C
n
H
2n-2
Alkadieny o wiązaniach skumulowanych –
ALLENY
CH
2
= C = CH
2
ALLEN
sp
2
sp
2
sp
C
C
H
H
C
C
H
H
90°
ALKADIENY C
n
H
2n-2
Alkadieny o wiązaniach skumulowanych –
ALLENY
CH
2
= C = CH
2
+
H
2
O/H
+
[CH
3
– C = CH
2
]
H
H
O
CH
3
C CH
2
O
H
H
CH
3
C CH
2
O
H
H
CH
3
C CH
2
O
H
CH
3
C CH
3
O
TAUTOMERIA
7
ALKADIENY C
n
H
2n-2
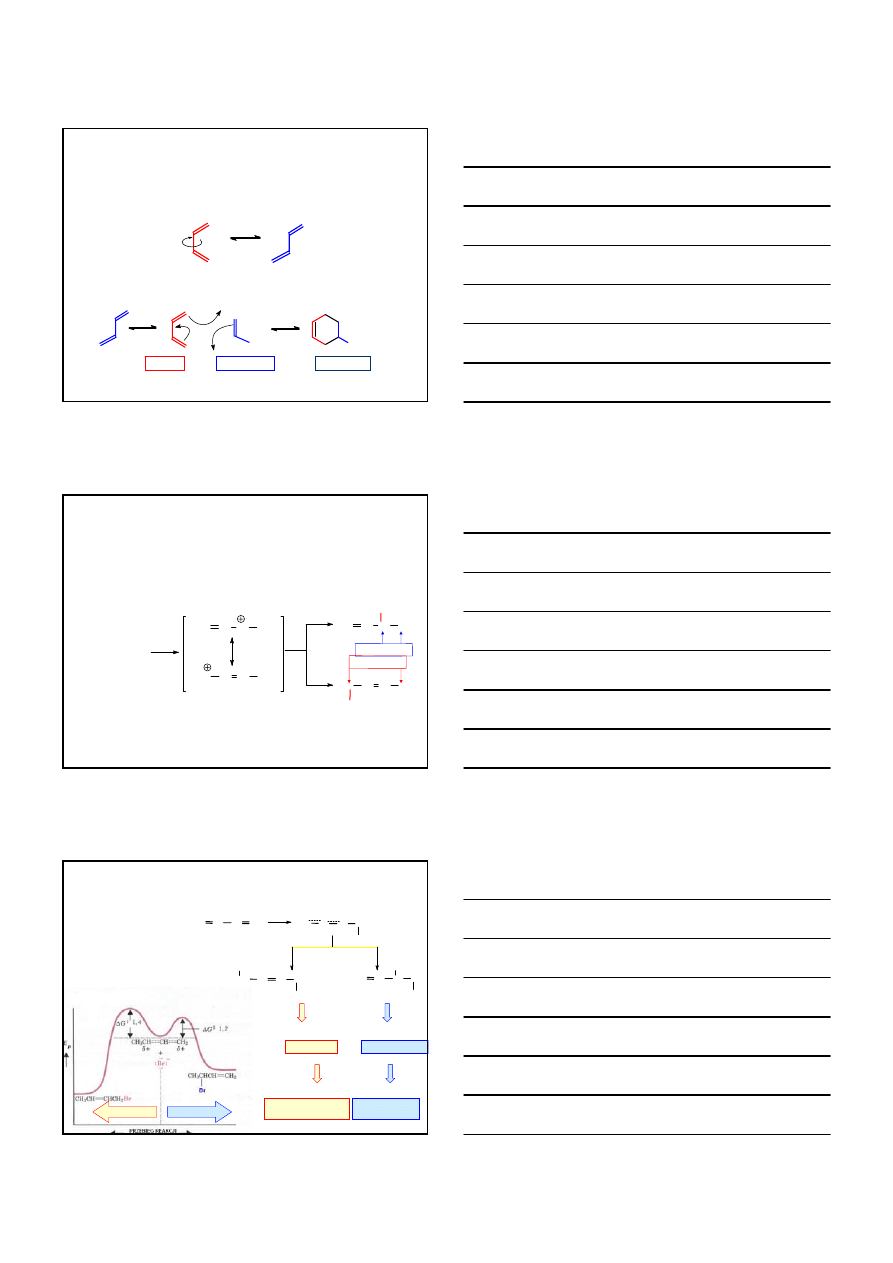
Alkadieny o wiązaniach sprzężonych
CH
3
– CH
3
1.55Å
= CH – CH =
1.46Å
s-cis
s-trans
+
R
DIEN
DIENOFIL
R: COOR’, NO
2
, CHO itp.
R
ADDUKT
1,4 – CYKLOADDYCJA – reakcja Diels-Aldera
ALKADIENY C
n
H
2n-2
Alkadieny o wiązaniach sprzężonych
CH
2
= CH – CH = CH
2
H
2
C CH CH CH
3
H
2
C CH CH CH
3
HBr
H
2
C CH CH CH
3
Br
H
2
C CH CH CH
3
Br
Br
-
Br
-
+40°C
-80°C
1-bromo
-2-buten
3-bromo
-1-buten
1,2 ADDYCJA
1,4 ADDYCJA
ALKADIENY C
n
H
2n-2
Alkadieny o wiązaniach sprzężonych
CH
2
CH
CH
CH
2
CH
2
CH
CH
CH
2
H
+δ
+δ
CH
2
CH
CH
CH
2
H
Br
CH
2
CH
CH
CH
2
H
Br
KONTROLA
TERMODYNAMICZNA
KONTROLA
KINETYCZNA
stabilniejszy
łatwiej powstaje
1,4 ADDYCJA
1,2 ADDYCJA
8
KAUCZUK I GUMY
2-METYLO-1,3-BUTADIEN
tzw.
izopren
Z
(cis)
n
E
(trans)
n
kauczuk naturalny
tzw.
gutaperka
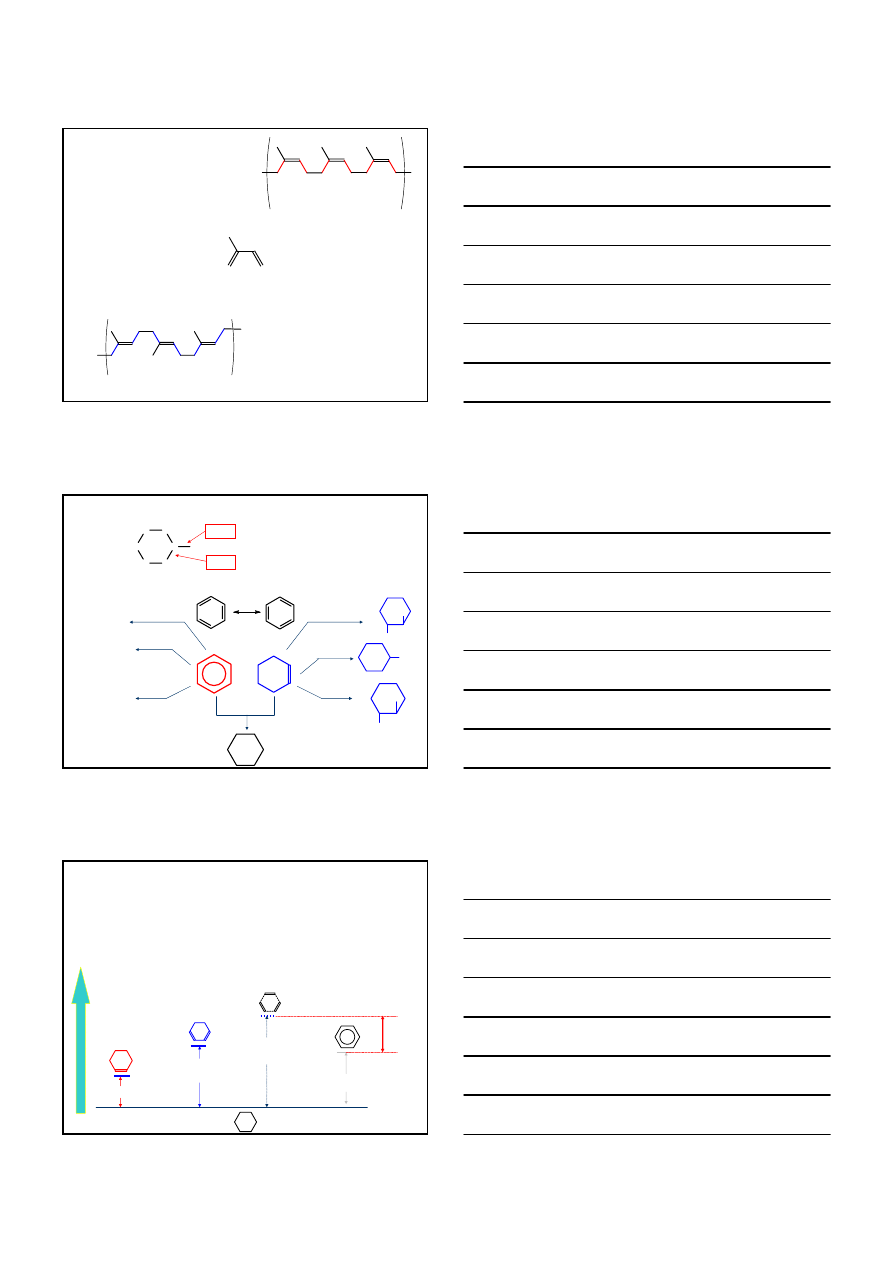
WĘGLOWODORY AROMATYCZNE – ARENY
C
6
H
6
C
sp
3
– C
sp
3
1.51Å
C
sp
2
= C
sp
2
1.33Å
C
C
C
C
C
C
H
1.04Å
1.39Å
Br
2
/CCl
4
brak reakcji
Br
2
/CCl
4
A
E
Br
Br
H
2
O/H
+
brak reakcji
H
2
O/H
+
A
E
OH
brak reakcji
KMnO
4
KMnO
4
OH
OH
H
2
/Pt
100 –200 °C
100 atm
25 °C
1.4 atm
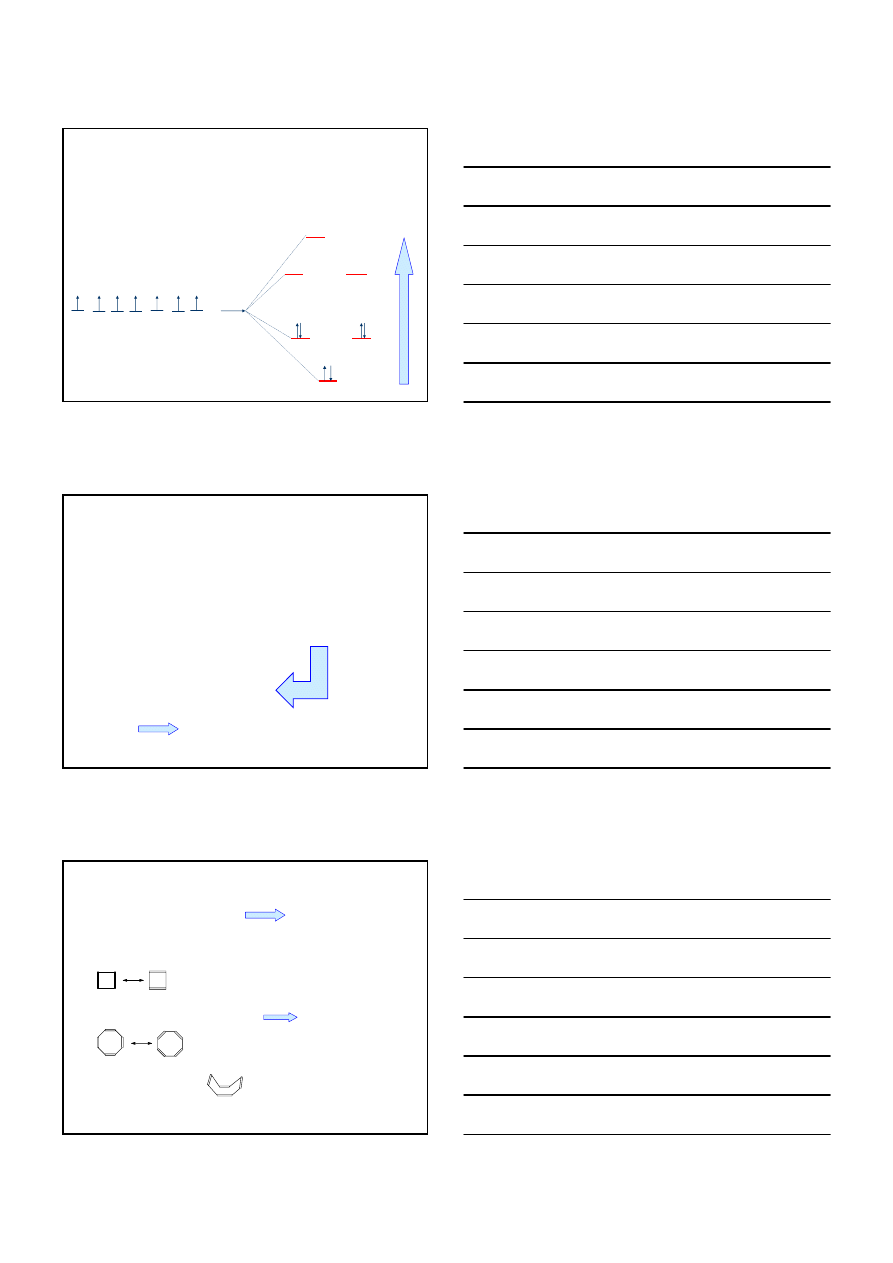
ARENY
STABINOŚĆ BENZENU
E
p
+ H
2
∆H ° = -28.6 kcal/mol
+ 2H
2
∆H ° =2 (-28.6)
–55.4 kcal/mol
+ 3H
2
∆H ° =3 (-28.6)
–85.8 kcal/mol
+ 3H
2
∆H ° = -49.8 kcal/mol
ENERGIA REZONANSU – różnica między energią hipotetycznej
cząsteczki heksatrienu a energią rzeczywistą cząsteczki benzenu
36 kcal/mol
9
ARENY
6 izolowanych orbitali atomowych p
Ψ
1
Ψ
2
Ψ
3
Ψ∗
6
Ψ∗
4
Ψ∗
5
E
ARENY
stabilniejszy o 36 kcal/mol niż to
wynika z ciepła uwodornienia
cykloheksatrienu
6
nie ulega reakcjom A
E
cykliczna cząsteczka o kształcie
heksagonalnym;
∠CCH 120°, C – C 1.39 Å
hybryda dwóch struktur rezonansowych
C
6
H
6
1.
jest płaska, cykliczna; o wiązaniach
skoniugowanych; z orbitalem p na
każdym atomie tego układu
2.
układ zawiera
4n + 2 gdzie n = 0, 1, 2,..
elektronów na orbitalach p
CZĄSTECZKA MA CHARAKTER AROMATYCZNY, GDY
SPEŁNIA WARUNKI:
REGUŁA HÜCKLA
C
6
H
6
CZĄSTECZKA AROMATYCZNA
ARENY
CZĄSTECZKA AROMATYCZNA
PŁASKA
CYKLICZNA
2, 6, 10, 14, 16, ... elektronów
π
4 elektrony
π
ulega reakcji Diels-Aldera
8 elektronów
π
ulega reakcji z Br
2
, HCl i KMnO
4
cząsteczka niepłaska
CZĄSTECZKI
NIEAROMATYCZNE
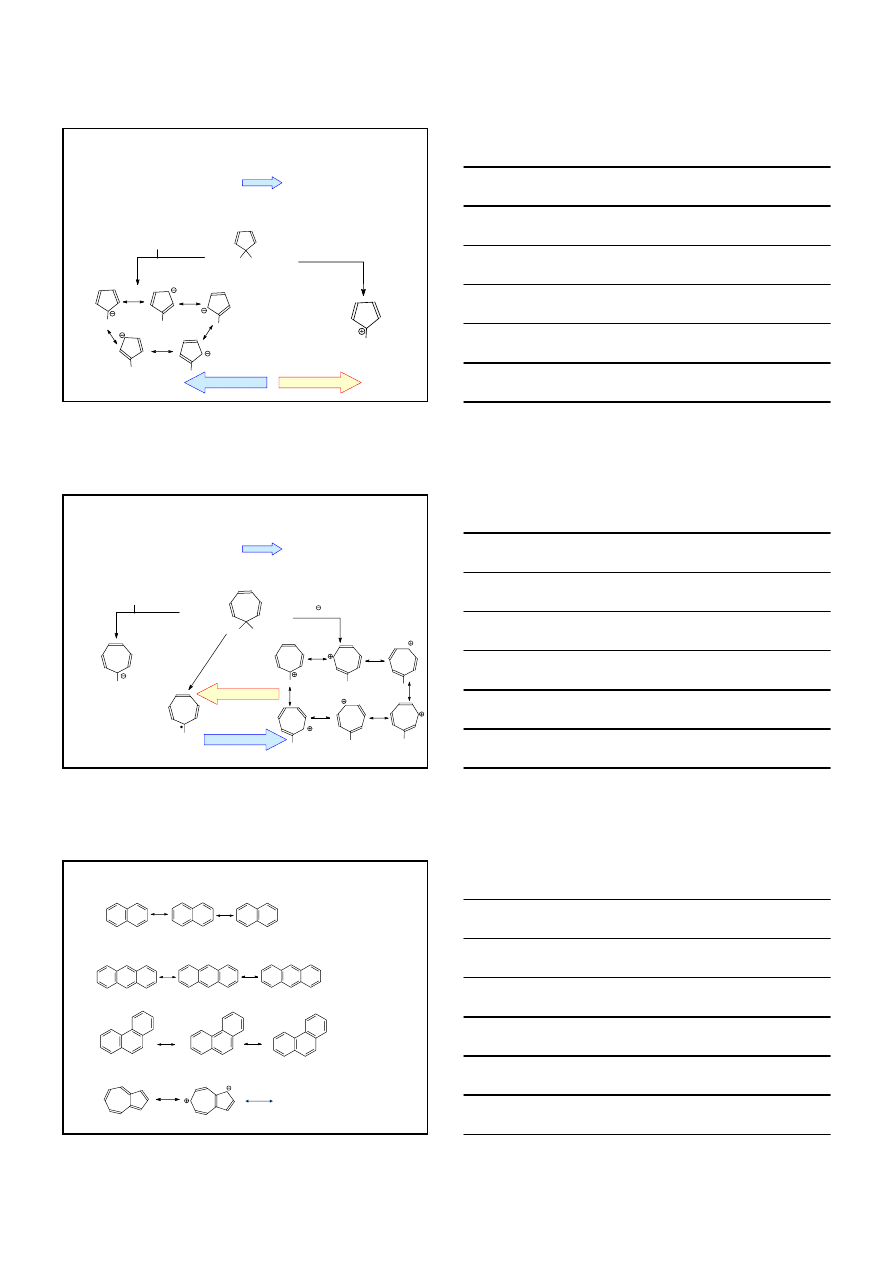
10
ARENY
CZĄSTECZKA AROMATYCZNA
PŁASKA
CYKLICZNA
2, 6, 10, 14, 16, ... elektronów
π
B
H
H
H
H
H
6 elektronów
π
H
- H-
4 elektrony
π
NIEAROMATYCZNY
AROMATYCZNY
ANION CYKLOPENTADIENYLOWY
H
H
sp3
4 elektrony
π
CYKLOPENTADIEN
ARENY
CZĄSTECZKA AROMATYCZNA
PŁASKA
CYKLICZNA
2, 6, 10, 14, 16, ... elektronów
π
sp3
H
H
6 elektronów
π
CYKLOPENTADIEN
H
- H
H
H
H
H
H
6 elektronów
π
KATION TROPYLIOWY
B
H
H
8 elektronów
π
7 elektronów
π
NIEAROMATYCZNY
AROMATYCZNY
WĘGLOWODORY AROMATYCZNE O SKONDENSOWANYCH
PIERŚCIENIACH BENZENOWYCH
NAFTALEN
10 elektronów
π
FENANTREN
14 elektronów
π
ANTRACEN
14 elektronów
π
AZULEN
10 elektronów
π

11
ARENY –
NOMENKLATURA
NH
2
ANILINA
OH
FENOL
COOH
KWAS
BENZOESOWY
C
H
O
BENZALDEHYD
OCH
3
ANIZOL
Cl
CHLOROBENZEN
Br
BROMOBENZEN
NO
2
NITROBENZEN
C
O
CH
3
ACETOFENON
CH
3
TOLUEN
POCHODNE MONOPODSTAWIONE
POCHODNE DIPODSTAWIONE
ARENY –
NOMENKLATURA
R
R
1,2 –
o
rto–
R
R
1,3 –
m
eta–
R
R
1,4 –
p
ara–
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
o
-ksylen m-ksylen p-ksylen
CH
3
Cl
NH
2
NO
2
OH
Br
o
-chlorotoluen
m
-nitroanilina p-bromofenol
F
Cl
I
NO
2
Br
Br
o
-chlorofluorobenzen
m
-jodonitrobenzen
p
-dibromobenzen
1,2- chlorofluorobenzen 1,3-jodonitrobenzen 1,4-dibromobenzen
ARENY –
NOMENKLATURA
POCHODNE TRIPODSTAWIONE
2,6-difluoro
toluen
Jeżeli nazwę wyprowadza się od
zwyczajowej, to charakterystyczny
dla tej nazwy podstawnik otrzymuje
lokant 1
F
CH
3
F
I
NO
2
Cl
Br
Br
Br
Podstawniki wymienimy w
kolejności alfabetycznej
2-chloro-1-jodo-3-nitrobenzen
1,2,4-tribromobenzen
NIE
1,3,4-tribromobenzen
12
ARENY –
NOMENKLATURA
ARYLE
FENYL
CH
2
BENZYL
CH
2
Cl
CHLOREK BENZYLU
Br
CH
2
Br
BROMEK m-
BROMO
BENZYLU
CH
2
CH
2
CH
2
CH
3
n-
BUTYLOBENZEN
CH
2
=CHCHCH
3
3-FENYLO-1-BUTEN
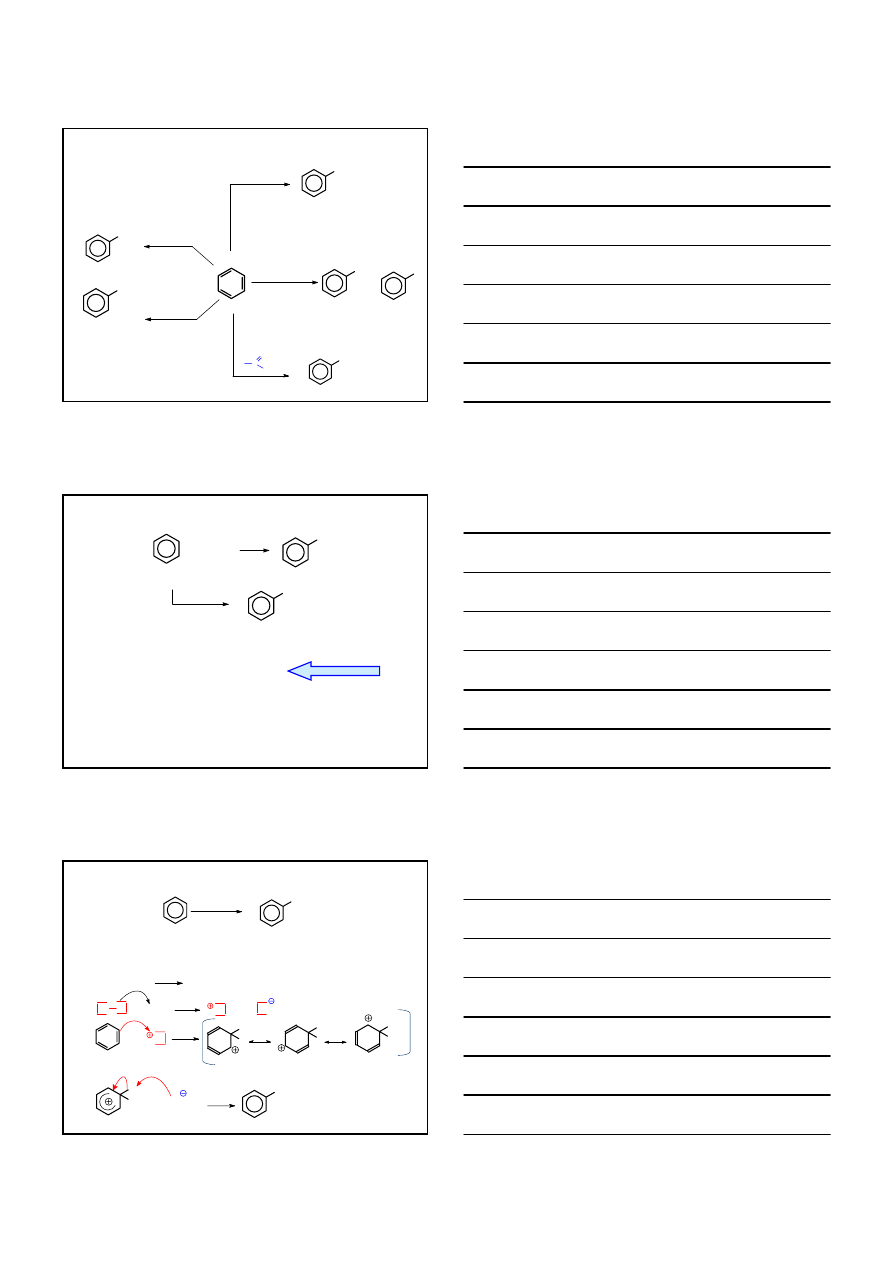
ARENY – S
Earom
+
E
+
E
+ H
+
MECHANIZM
ETAP 1
H
E
H
E
H
E
+
E
+
WOLNO
ETAP 2
E
+ H
+
H
E
SZYBKO
KATION ARENIOWY
ETAP 2
H
E
SZYBKO
E
+ H
+
PORÓWNANIE Z A
E
DO ALKENÓW
ETAP 1
ETAP 2
CH
2
CH
2
+
E
+
CH
2
C
E
H
H
WOLNO
+
Y
-
CH
2
C
E
H
H
CH
2
C
E
H
H
Y
13
S
Earom
X
2
/FeX
3
lub AlX
3
X
2
: Br
2
lub Cl
2
Cl
Br
LUB
HNO
3
/ H
2
SO
4
NO
2
/ AlCl
3
R
C
O
Cl
COR
SO
3
H
stez. H
2
SO
4
R
ROH / H
2
SO
4
RX / AlCl
3
LUB
LUB
CH
2
=CHR' / H
3
PO
4
CHLOROBENZEN
LUB
BROMOBENZEN
ALKILOBENZEN
KETON ALKILOWOFENYLOWY
S
Earom
HALOGENOWANIE
+
Cl
2
AlCl
3
25°C
Cl
+ H
Cl
90%
75%
F
2
> Cl
2
> Br
2
> I
2
REAKTWNOŚĆ
KATALIZATOR: kwas Lewisa, najczęściej AlCl
3
lub FeX
3
Br
2
/ FeBr
3
∆
Br
+ H
Br
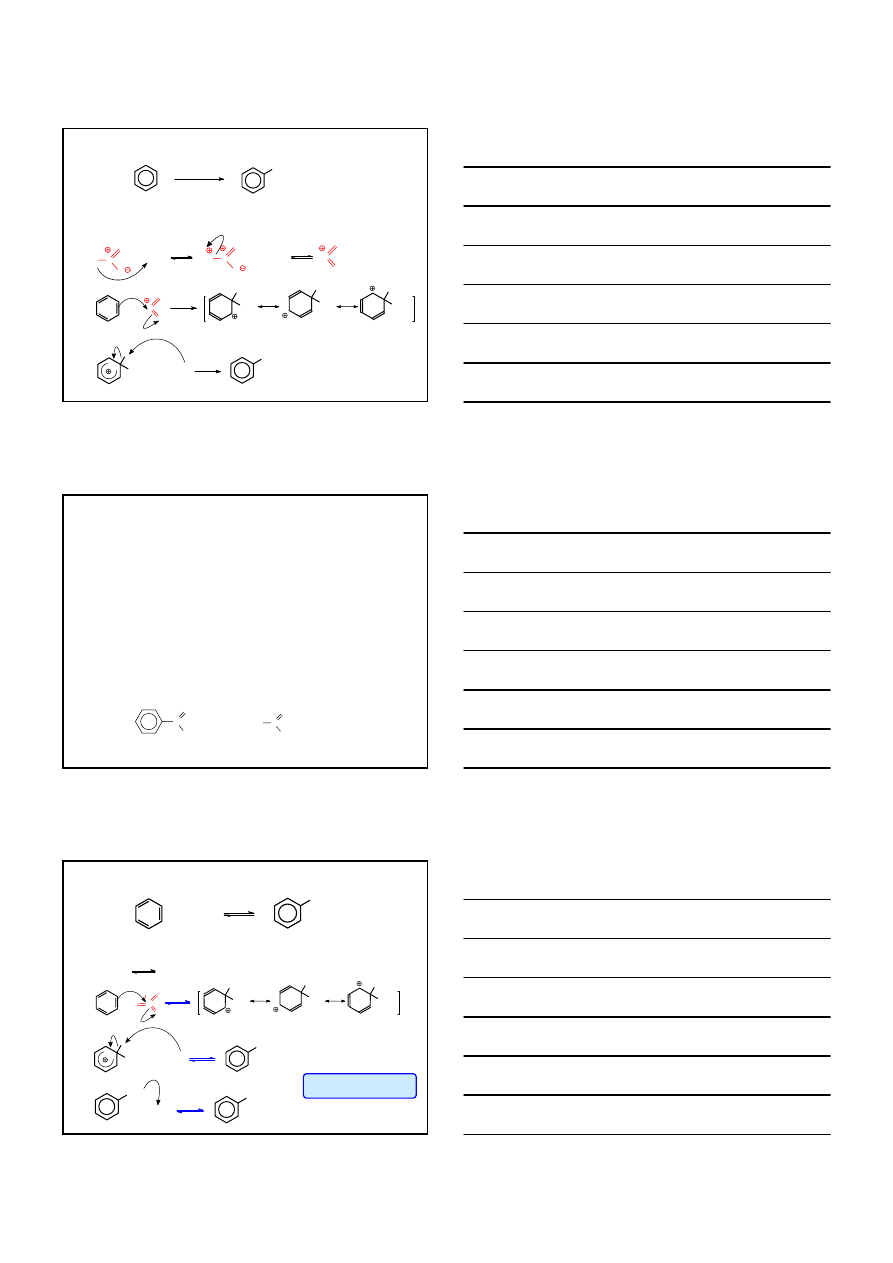
S
Earom
HALOGENOWANIE
MECHANIZM
Br
2
/ Fe
∆
Br
+ H
Br
2Fe + 3 Br
2
2FeBr
3
+ FeBr
3
Br Br
Br
+
Br
FeBr
3
H
Br
Br
H
Br
H
Br
WOLNO
H
Br
+ BrFeBr
3
+ FeBr
3
+ HBr
Br
KATION ARENIOWY
14
S
Earom
NITROWANIE
MECHANIZM
50°C
+ H
3
O
+
+
HSO
4
-
HNO
3
/ H
2
SO
4
NO
2
H
2
SO
4
HO
N
O
O
H
2
O
N
O
O
HSO
4
-
+ SO
4
-
2
+ H
3
O
+
N
O
O
KATION NITRONIOWY
N
O
O
WOLNO
H
NO
2
H
NO
2
H
NO
2
KATION ARENIOWY
H
NO
2
SZYBKO
+ HSO
4
-
NO
2
+ H
2
SO
4
S
Earom
NITROWANIE
Inne układy nitrujące:
mieszanina nitrująca HNO
3
+ H
2
SO
4
HNO
3
HNO
3
+ kwas octowy
azotan benzoilu
azotan acetylu
CH
3
C
O
O
NO
2
C
O
O
NO
2
S
Earom
SULFONOWANIE
H
2
SO
4
SO
3
H
+ H
2
O
25°C
+
2 H
2
SO
4
SO
3
+ H
3
O
+
+ HSO
4
-
H
SO
3
-
SZYBKO
+ HSO
4
-
SO
3
-
+ H
2
SO
4
+ H
3
O
+
SO
3
-
SO
3
H
+ H
2
O
REAKCJA ODWRACALNA
MECHANIZM
S
O
O
O
WOLNO
H
SO
3
-
H
SO
3
-
H
SO
3
-
15
S
Earom
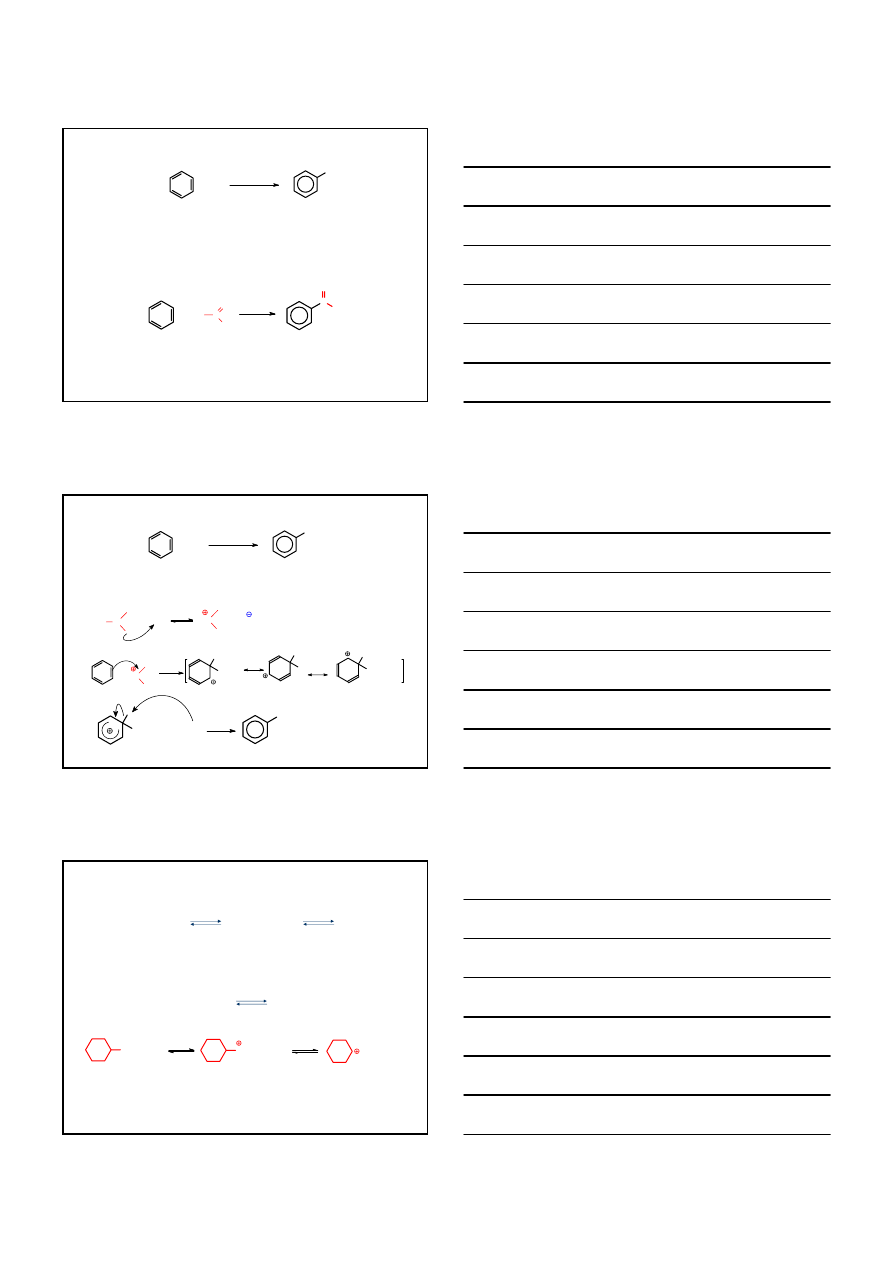
REAKCJA FRIEDEL – CRAFTS’A
ALKILOWANIE
ACYLOWANIE
RX
R
+ HX
katalizator
+
R
C
O
Cl
C
O
R
+ HX
+
AlCl
3
S
Earom
REAKCJA FRIEDEL – CRAFTS’A
ALKILOWANIE
MECHANIZM
RX
R
+ HX
katalizator
+
R – X: R – alkil X – Cl, Br, I
Katalizator: AlCl
3
HC
CH
3
CH
3
+ AlCl
4
AlCl
3
CH
3
CH
CH
3
Cl
HC
CH
3
CH
3
WOLNO
H
CH(CH
3
)
2
H
CH(CH
3
)
2
H
CH(CH
3
)
2
H
CH(CH
3
)
2
SZYBKO
+ Cl AlCl
3
-
CH(CH
3
)
2
+ AlCl
3
S
Earom
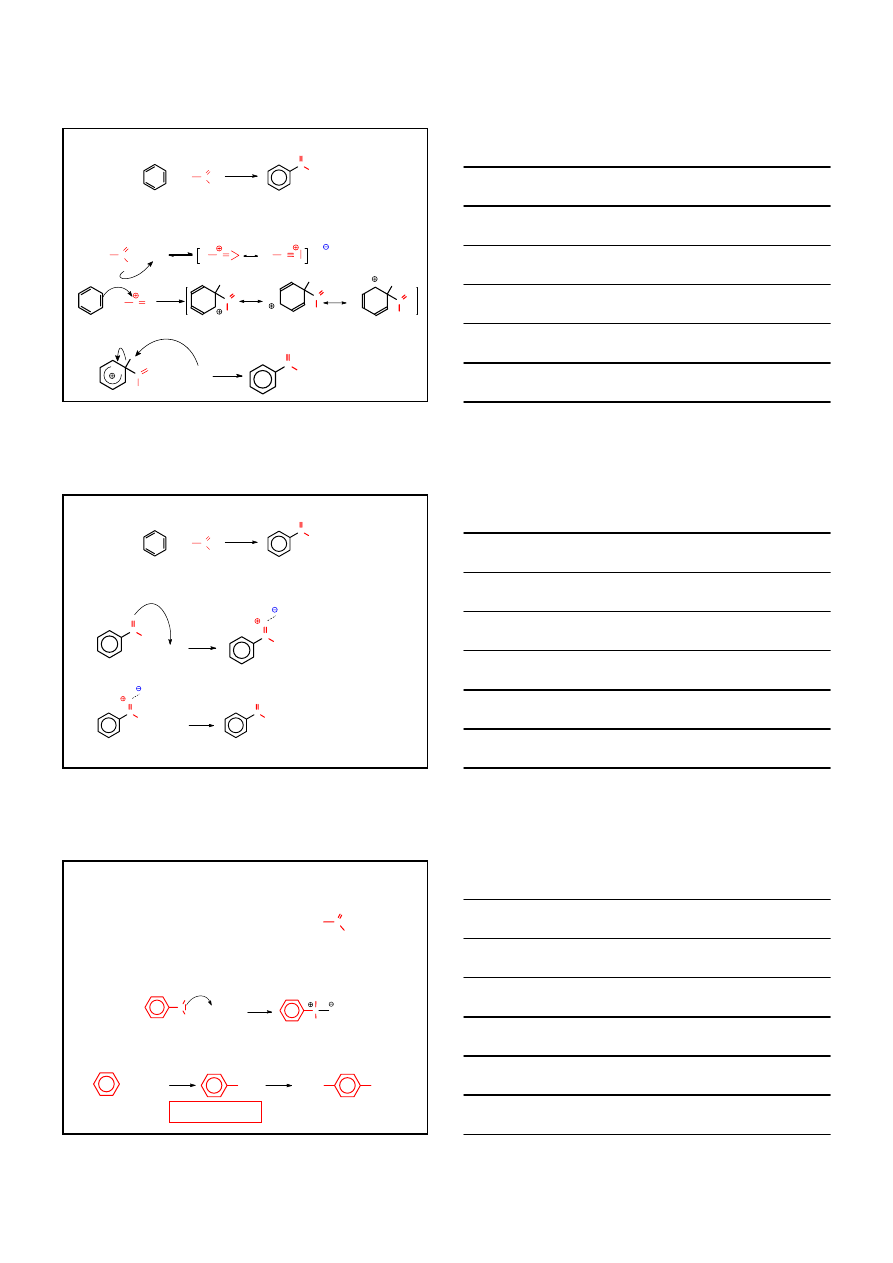
REAKCJA FRIEDEL – CRAFTS’A
ALKILOWANIE
Inne układy alkilujące:
alken /HI lub H
3
PO
4
CH
3
– CH = CH
2
+ H
3
PO
4
CH
3
– CH – CH
3
+ H
2
PO
4
-
+
alkohol /H
2
SO
4
lub H
3
PO
4
+ HSO
4
-
OH
+ H
2
SO
4
OH
2
+ SO
4
-
2
+ H
3
O
+
chlorek alkilowy /AlCl
3
CH
3
– CH
2
– CH
2
Cl
CH
3
– CH
2
– CH
2
CH
3
– CH – CH
3
+
+
AlCl
3
16
S
Earom
REAKCJA FRIEDEL – CRAFTS’A
MECHANIZM
ACYLOWANIE
CH
3
C
O
Cl
C
O
CH
3
+ HCl
+
AlCl
3
80°C
KATION ACYLIOWY
+ AlCl
4
AlCl
3
R
C
O
Cl
R
C O
R
C O
R
C O
WOLNO
H
C
O
R
H
C
O
R
H
C
O
R
KATION ARENIOWY
C
O
R
H
C
R
O
SZYBKO
+ Cl AlCl
3
-
+ HCl + AlCl
3
S
Earom
REAKCJA FRIEDEL – CRAFTS’A
MECHANIZM
ACYLOWANIE
CH
3
C
O
Cl
C
O
CH
3
+ HCl
+
AlCl
3
80°C
C
O
R
+ AlCl
3
C
O
R
AlCl
3
+ Al(OH)
3
+ H
3
O
+
C
O
R
+ 3 H
2
O
C
O
R
AlCl
3
S
Earom
REAKCJA FRIEDEL – CRAFTS’A
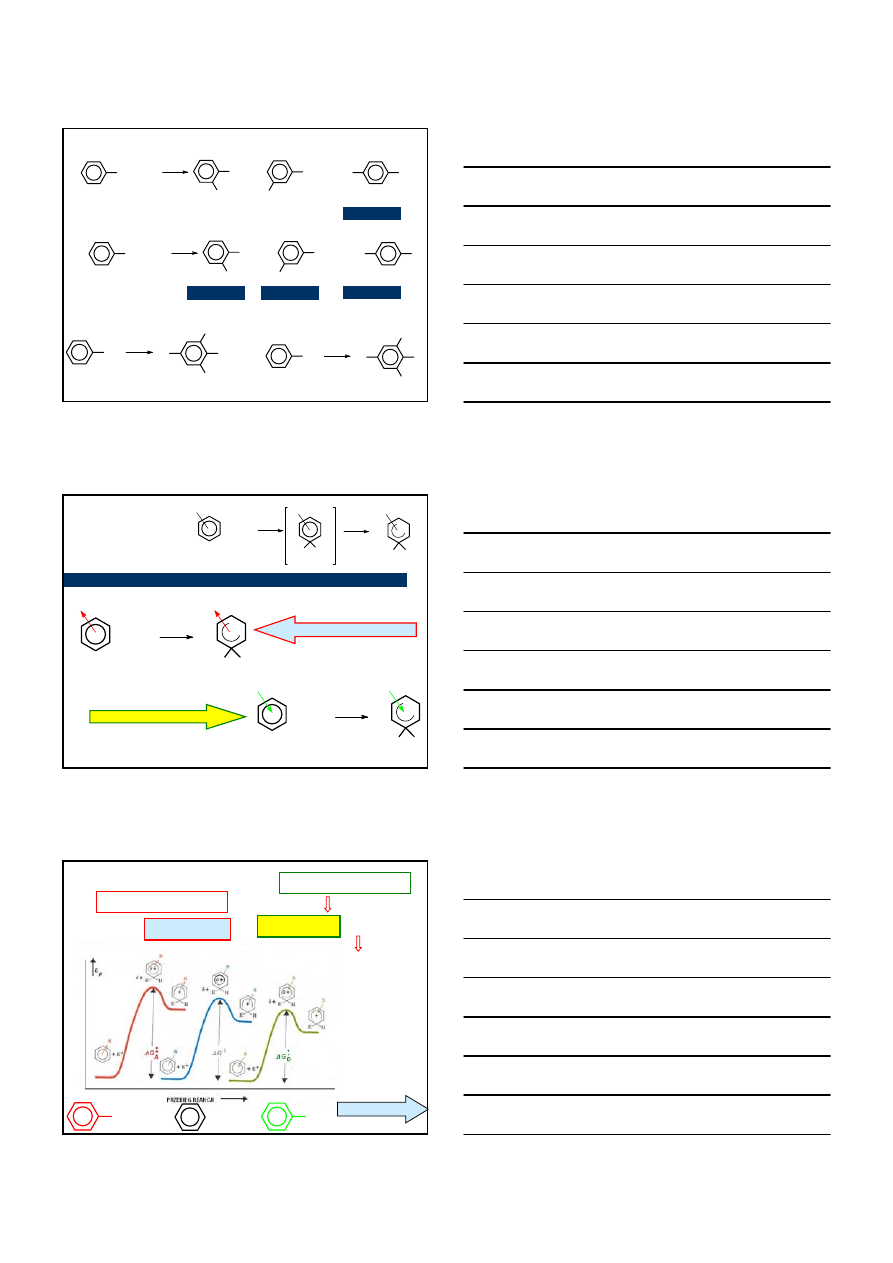
OGRANICZENIA
podstawniki pierścieni aromatycznych, m. in.
– NH
2
oraz
– NR
2
wchodzą w reakcje z katalizatorami
reakcji nie ulegają pierścienie aromatyczne z podstawnikami
silnie elektronoakceptorowymi:
N
R
R
AlCl
3
N
R
R
AlCl
3
podczas alkilowania pierścieni aromatycznych często powstają
di– oraz trialkilopochodne
+ (CH
3
)
2
CHOH
H
3
PO
4
CH(CH
3
)
2
H
3
PO
4
(CH
3
)
2
CHOH
CH(CH
3
)
2
(CH
3
)
2
CH
BARDZIEJ REAKTYWNY
ANIŻELI BENZEN
24%
14%
– NO
2
, – NR
3
, – CO
2
H, – CF
3
, – SO
3
H,
R
O
C
+
17
S
Earom
PODSTAWIONYCH
ARENÓW
o–
59%
p–
37%
m–
ślady
NITROWANIE TOLUENU
BROMOWANIE ANILINY I FENOLU
NITROWANIE NITROBENZENU
o–
6
%
p–
1%
m–
93%
NO
2
O
2
N
NO
2
H
2
SO
4
+ HNO
3
NO
2
NO
2
NO
2
O
2
N
+
+
∆
CH
3
O
2
N
CH
3
H
2
SO
4
+ HNO
3
CH
3
NO
2
CH
3
O
2
N
+
+
NH
2
H
2
O
Br
2
NH
2
Br
Br
Br
OH
H
2
O
Br
2
OH
Br
Br
Br
100%
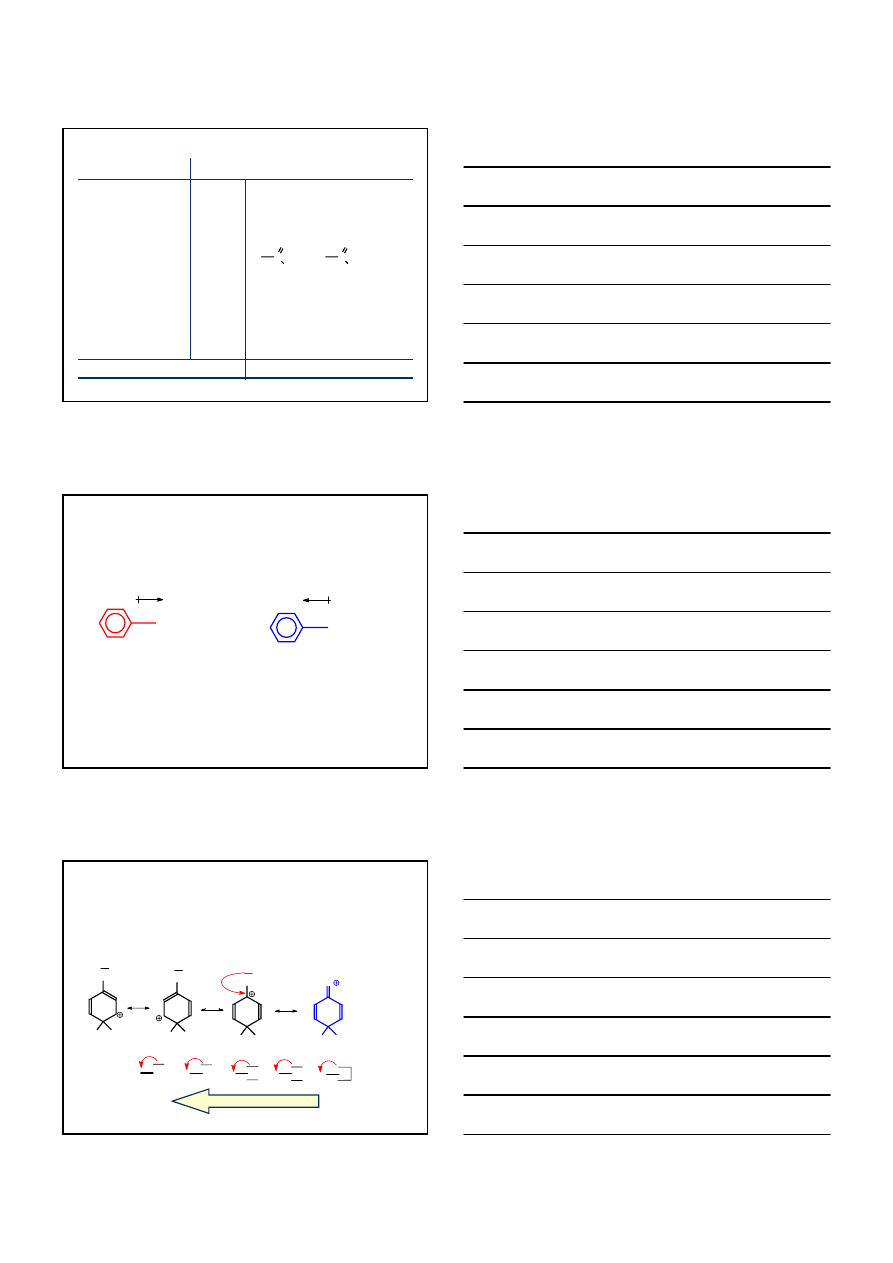
S
Earom
PODSTAWIONYCH
ARENÓW
+ E
+
S
E
H
+δ
+δ
E
H
S
+
S
WOLNO
SZYBKOŚĆ REAKCJI S
Earom
ZALEŻY OD TRWAŁOŚCI KATIONU ARENIOWEGO
WOLNO
S
+
S
E
H
+ E
+
PODSTAWNIK O CHARAKTERZE
ELEKTRONOAKCEPTOROWYM
PODSTAWNIK O CHARAKTERZE
ELEKTRONODONOROWYM
+ E
+
E
H
S
+
S
WOLNO
KATION ARENIOWY DESTABILIZOWANY
KATION ARENIOWY STABILIZOWANY
S
Earom
PODSTAWIONYCH
ARENÓW
KATION ARENIOWY
DESTABILIZOWANY
KATION ARENIOWY
STABILIZOWANY
PODSTAWNIK O CHARAKTERZE
ELEKTRONOAKCEPTOROWYM
PODSTAWNIK O CHARAKTERZE
ELEKTRONODONOROWYM
∆G
‡
A
>
∆G
‡
>
∆G
‡
D
NO
2
<
<
OH
REAKTYWNOŚĆ
18
S
Earom
PODSTAWIONYCH
ARENÓW
PODSTAWNIKI
AKTYWUJĄCE
DEZAKTYWUJĄCE
ORTO –
i PARA –
META –
umiarkowanie aktywujące
–NHCOR oraz –OR
gdzie R – alkil lub aryl
silnie aktywujące
–NH
2
, – NHR, –NR
2
, –OH, –O–
słabo aktywujące
R – np. CH
3
– , CH
3
CH
2
–
Ar –
np. C
6
H
5
–
słabo
dezaktywujące
F –
Cl –
Br –
I –
umiarkowanie dezaktywujące
–C
≡N
,
–SO
3
H, –COOH, –COOR,
C
O
H
C
O
R
gdzie R – alkil lub aryl
mocno dezaktywujące
–NO
2
, –NR
3
–CX
3
gdzie X – chlor lub fluor
gdzie R – alkil lub aryl
+
– jest wynikiem elektrostatycznego oddziaływania powodującego polaryzację
wiązania pomiędzy podstawnikiem a atomem węgla pierścienia
X
δ+
δ−
–I
X: –F, –Cl, –Br, –I, –NR
3
+
DEZAKTYWUJĄCY
CH
3
δ+
δ−
+ I
AKTYWUJĄCY
EFEKT INDUKCYJNY
I
EFEKT MEZOMERYCZNY
M
PODSTAWNIKA – opisuje możliwości zwiększenia lub zmniejszenia
stabilizacji intermediatu – kationu areniowego – w obecności podstawnika
E
H
S
E
H
S
E
H
S
E
H
S
+ M
NH
2
OR
OH
NR
2
X
+M
19
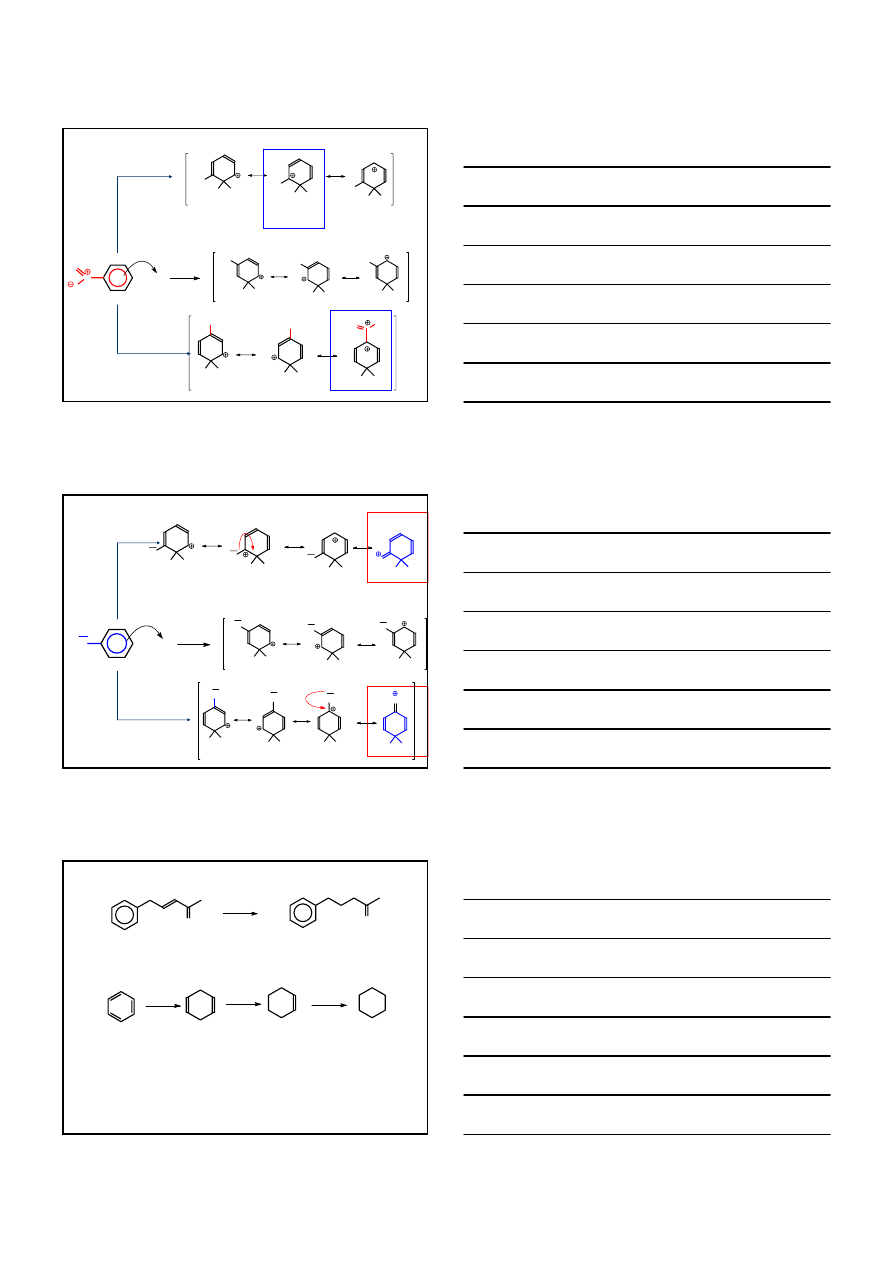
PODSTAWNIKI KIERUJĄCE NASTĘPNY
PODSTAWNIK W POZYCJĘ meta-
-
O
O
N
+ E
+
WOLNO
E
H
O
2
N
H
E
O
2
N
E
H
O
2
N
E
H
NO
2
E
H
NO
2
H
E
N
O
O
E
H
O
2
N
E
H
O
2
N
H
E
O
2
N
NIEKORZYSTNE STRUKTURY REZONANSOWE
META
PARA
ORTO
PODSTAWNIKI KIERUJĄCE NASTĘPNY
PODSTAWNIK W POZYCJĘ para- i orto-
+ E
+
WOLNO
H
2
N
E
H
H
2
N
E
H
H
2
N
H
E
H
2
N
E
H
H
2
N
E
H
H
2
N
H
E
H
2
N
E
H
H
2
N
KORZYSTNE STRUKTURY REZONANSOWE
ORTO
PARA
META
E
H
NH
2
E
H
NH
2
NH
2
H
E
E
H
NH
2
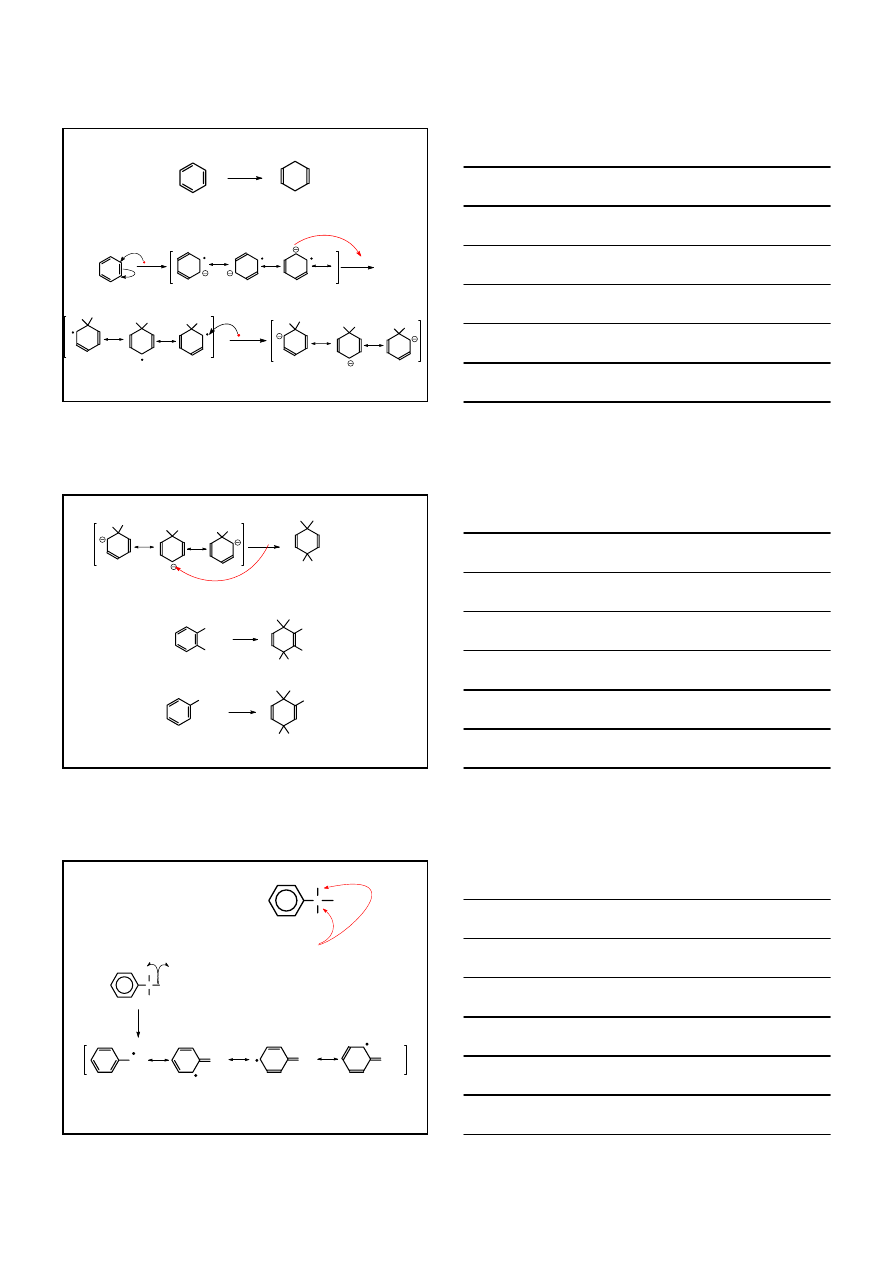
REDUKCJA PIERŚCIENIA
AROMATYCZNEGO
O
H
2
, Pd
EtOH
O
5-fenylo-3-penten-2-on
5-fenylo-2-pentanon
H
2
, Ni
wolno
H
2
, Ni
szybko
H
2
, Ni
szybko
200°C, 100 atm
20
REDUKCJA PIERŚCIENIA
AROMATYCZNEGO
REDUKCJA BIRCH’A
Na
, NH
3
EtOH
1,4-CYKLOHEKSADIEN
MECHANIZM
Na
EtOH
H
H
H
H
H
H
Na
anionorodnik benzenowy
rodnik cykloheksadienylowy
H
H
H
H
H
H
anion cykloheksadienylowy
REDUKCJA PIERŚCIENIA
AROMATYCZNEGO
H
H
H
H
H
H
anion cykloheksadienylowy
EtOH
H
H
H
H
1,4-CYKLOHEKSADIEN
H
H
H
H
CH
3
CH
3
CH
3
CH
3
Na/NH
3
EtOH
77- 92%
1,2-DIMETYLO-1,4-CYKLOHEKSADIEN
Li/NH
3
EtOH
80%
OCH
3
H
H
H
H
OCH
3
1-METOKSY-1,4-CYKLOHEKSADIEN
ANIZOL
RODNIK BENZYLOWY
REAKCJE W ŁAŃCUCHU
BOCZNYM
C
(CH
2
)nCH
3
H
H
POZYCJA BENZYLOWA
WODORY BENZYLOWE
C H
H
H
CH
2
CH
2
CH
2
CH
2

21
KATION BENZYLOWY
REAKCJE W ŁAŃCUCHU
BOCZNYM
C
(CH
2
)nCH
3
H
H
CH
2
CH
2
CH
2
CH
2
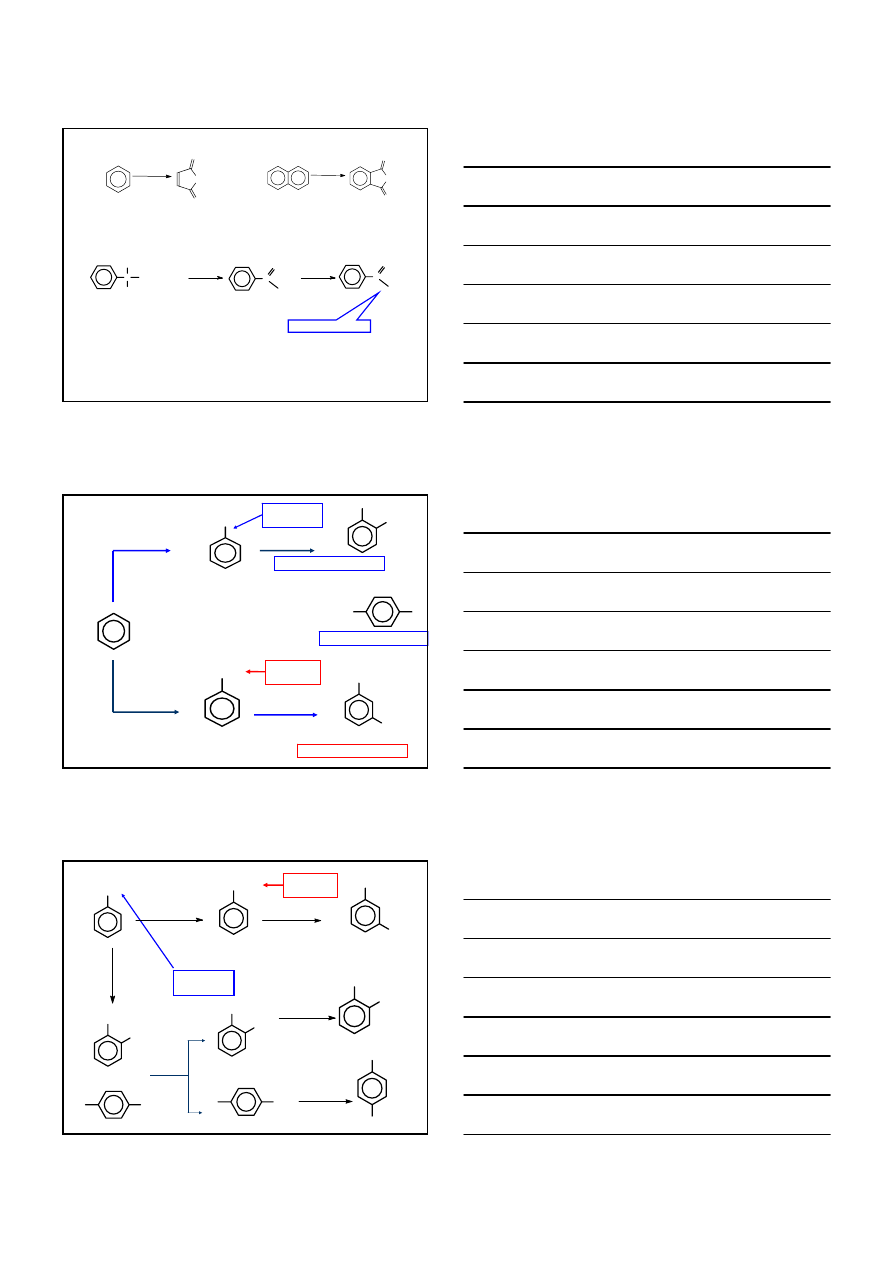
REAKCJE W ŁAŃCUCHU
BOCZNYM
N
O
O
Br
C
R
H
H
+
CCl
4
h
ν
C
R
H
Br
+
N
O
O
H
N
O
O
Br
+
CCl
4
h
ν
N
O
O
Br
C
H
R
H
C
R
H
+
Br
H
Br
N
O
O
H
N
O
O
Br
+
H
Br
+
Br
2
MECHANIZM
CCl
4
h
ν
Br
Br
2
2
REAKCJE W ŁAŃCUCHU
BOCZNYM
N
O
O
Br
C
R
H
H
+
CCl
4
h
ν
C
R
H
Br
+
N
O
O
H
+
Br
Br
2
C
R
H
C
Br
R
H
+
C
H
R
H
C
R
H
Br
CHR
CHR
CHR
CHR
+ H
Br
22
REAKCJE W
ŁAŃCUCHU BOCZNYM
UTLENIANIE ARENÓW
C
(CH
2
)nCH
3
H
H
KMnO
4
/
∆
C
O
O
-
K
+
H
3
O
+
C
O
OH
KWAS BENZOESOWY
V
2
O
5
/O
2
O
O
O
350°
V
2
O
5
/O
2
O
O
O
400°
bezwodnik ftalowy
bezwodnik maleinowy
SYNTETYCZNE ZASTOSOWANIA
S
E
arom
Br
2
/FeBr
3
HNO
3
/ H
2
SO
4
B r
N O
2
HNO
3
/ H
2
SO
4
Br
2
/FeBr
3
KIERUJE W
orto-/para-
KIERUJE W
meta-
NO
2
Br
m
-
bromo
nitro
benzen
Br
NO
2
O
2
N
Br
+
o
-
bromo
nitro
benzen
p
-
bromo
nitro
benzen
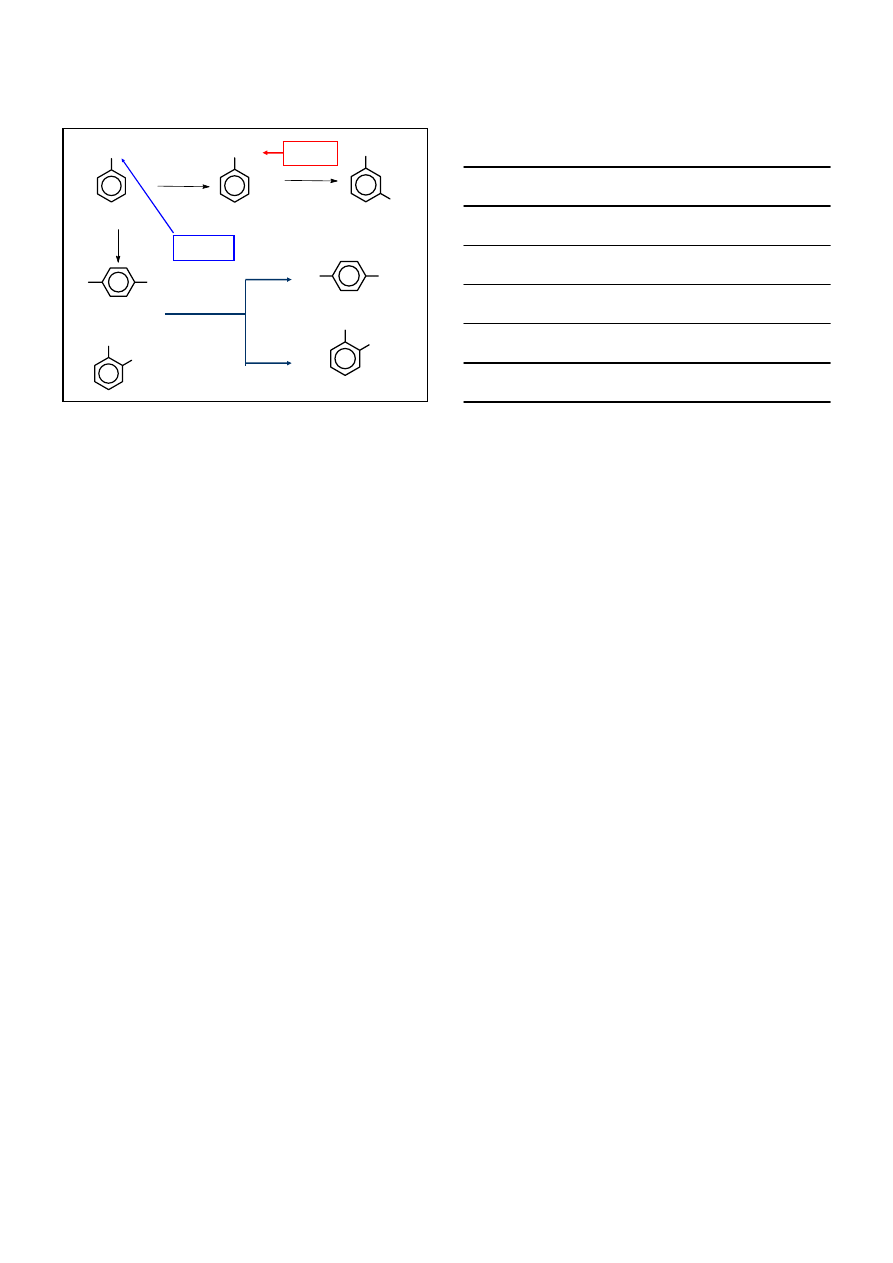
SYNTETYCZNE ZASTOSOWANIA
S
E
arom
CH
3
KIERUJE W
meta-
KIERUJE W
orto-/para-
HNO
3
/H
2
SO
4
kwas m-nitrobenzoesowy
1. KMnO
4
,
∆
2. Η
3
Ο
+
COOH
COOH
NO
2
CH
3
NO
2
CH
3
NO
2
+
HNO
3
/H
2
SO
4
CH
3
NO
2
CH
3
NO
2
ROZDZIELENIE
COOH
NO
2
1. KMnO
4
,
∆
2. Η
3
Ο
+
COOH
NO
2
1. KMnO
4
,
∆
2. Η
3
Ο
+
kwas o-nitrobenzoesowy
kwas p-nitrobenzoesowy
23
SYNTETYCZNE ZASTOSOWANIA
S
E
arom
CH
3
KIERUJE W
orto-/para-
CBr
3
Br
2
h
ν
KIERUJE W
meta-
CBr
3
Br
Br
2
Fe
1-bromo-3-(tribromometylo)benzen
CH
3
Br
Br
2
/Fe
+
CH
3
Br
CBr
3
Br
Br
3
C
Br
1. ROZDZIELENIE
2. Br
2
, h
ν
1-bromo-
4-(tribromometylo)
benzen
1-bromo
-2-(tribromometylo)
benzen
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron