
PODSTAWY CHEMII ORGANICZNEJ
1. Wstęp
Chemia organiczna to chemia związków węgla (oprócz tlenków oraz kwasu węglowego i jego
pochodnych). Istnieje ogromna liczba związków organicznych występujących w przyrodzie oraz
syntezowanych przez człowieka (obecnie > 10 000 000). Wszystkie związki organiczne podlegają jednak
kilku podstawowym zasadom:
− atomy
węgla w związkach organicznych są zawsze czterowartościowe,
− atomy
węgla mogą łączyć się trwale w proste lub rozgałęzione łańcuchy o dowolnej długości,
tworzyć pierścienie oraz kombinacje pierścieni i łańcuchów,
− atomy
węgla mogą łączyć się ze sobą lub atomami innych pierwiastków za pomocą wiązań
pojedynczych, podwójnych lub potrójnych,
− elektrony nie uczestniczące w wiązaniach pomiędzy atomami węgla są wykorzystywane do
tworzenia wiązań z innymi pierwiastkami,
− każdy związek organiczny charakteryzuje się właściwą sobie budową, określoną przez rodzaj,
liczbę i sposób powiązania tworzących go atomów,
Nazwa związku organicznego musi być dokładna i jednoznaczna, tzn., na jej podstawie można
napisać wzór strukturalny tylko jednego, określonego związku organicznego. Pod jednym wzorem
ogólnym może kryć się kilka związków o różnej strukturze.
Tworzenie nazw związków organicznych
PRZEDROSTEK
–
RDZEŃ
–
PRZYROSTEK
1. Znajdź najdłuższy łańcuch węglowy w cząsteczce i użyj go do nazwy rdzenia łańcucha.
2. Gdy w cząsteczce są dwa łańcuchy o równej długości, to do budowy nazwy rdzenia wybierz ten o
największej liczbie punktów rozgałęzień.
3. Atomy węgla w łańcuchu rdzenia ponumeruj tak, by podstawniki miały jak najniższą liczbę
określającą ich położenie.
4. W nazwie podstawniki ustawiamy w kolejności alfabetycznej, nie zaś kolejności występowania w
cząsteczce.
5. Jeżeli w cząsteczce są dwa identyczne podstawniki użyj przedrostka di-, tri-, tetra-, itd.
Przedrostki nie ustawiamy w porządku alfabetycznym.
2. Hybrydyzacja atomów węgla i wiązania wielokrotne
Węgiel posiada w stanie wzbudzonym 4 elektrony walencyjne, 1 na orbitalu s i 3 na orbitalu p.
2s
2p
2s
2p
stan podstawowy C:
stan wzbudzony C*:
Powstawanie wiązań wielokrotnych w związkach organicznych możliwe jest dzięki hybrydyzacji
(ujednoliceniu pod względem energetycznym) orbitali walencyjnych atomu węgla.
określa położenie
podstawników
liczba atomów
węgla
klasa związków
↑↓
↑
↑
↑
↑
↑
↑
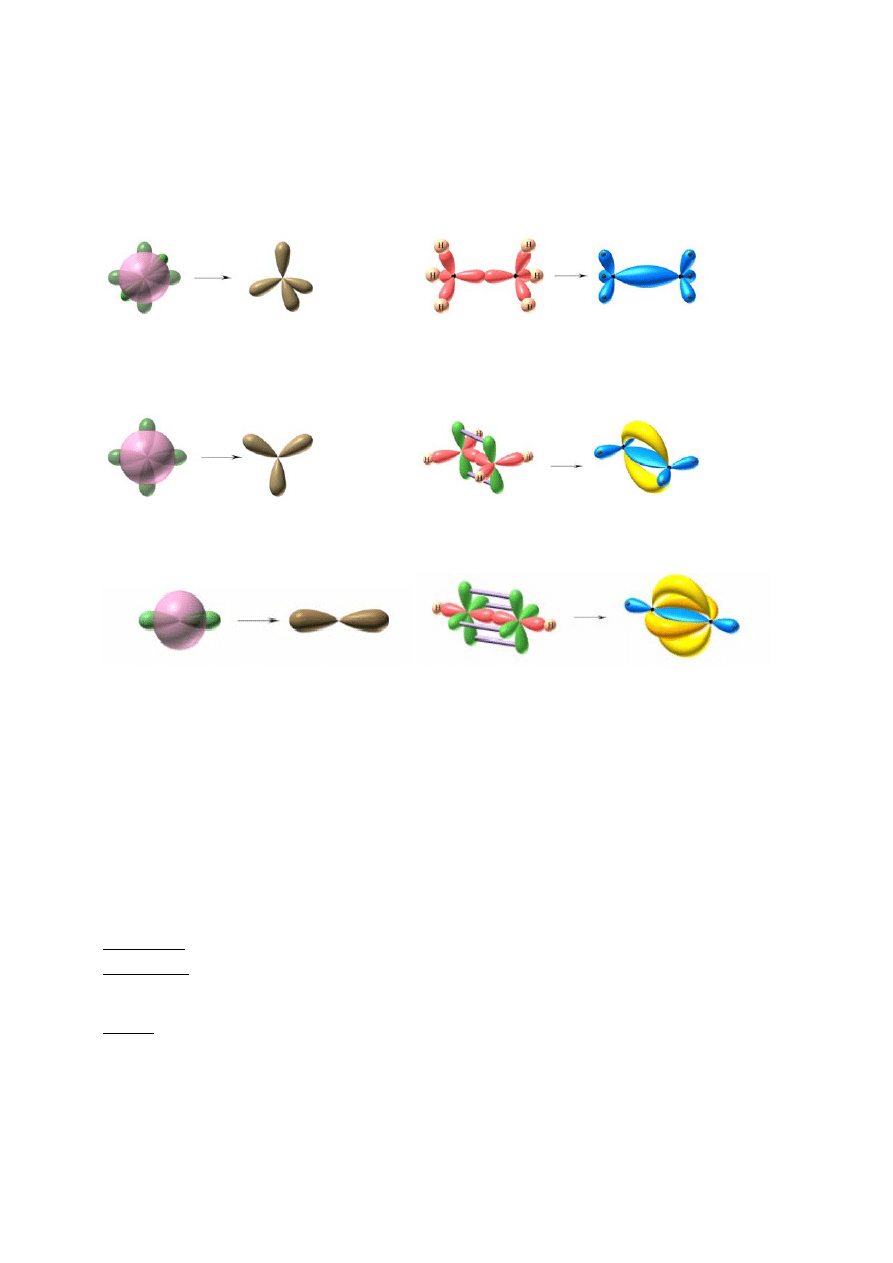
Hybrydyzacja sp
3
Powstaje w wyniku wymieszania orbitalu s i trzech orbitali p, powstają wówczas cztery równorzędne
wiązania δ (sigma) - wiązania leżące w jednej linii z jądrami łączących się atomów, np. jak w cząsteczce
etanu:
Hybrydyzacja sp
2
Powstaje poprzez nałożenie się dwóch orbitali p i jednego orbitalu s, atom C może wówczas utworzyć
trzy wiązania δ i jedno mniej trwałe π (pi) z nałożenia się niezhybrydyzowanych orbitali p, czyli jedno
podwójne (δ i π) i dwa pojedyncze (δ), np. jak w cząsteczce etenu:
Hybrydyzacja sp
Powstaje poprzez nałożenie się jednego orbitalu s i jednego p. Możliwe jest wówczas powstanie wiązania
potrójnego (jedno δ i dwa π) oraz jednego pojedynczego.
3. Charakterystyka wybranych związków organicznych
Podział związków organicznych
Związki organiczne dzielimy ogólnie na: węglowodory – w ich skład wchodzą wyłącznie atomy C i
H, oraz związki z grupami funkcyjnymi, zawierające także atomy innych pierwiastków: O, N, S, itd.
Węglowodory występują w postaci łańcuchowej, jak i cyklicznej, mogą być nasycone (wszystkie
wiązania pomiędzy atomami węgla są pojedyncze – alkany, cykloalkany) lub nienasycone (występują
wiązania wielokrotne – alkeny, alkiny, węglowodory aromatyczne).
Grupy funkcyjne w pozostałych związkach organicznych determinują własności cząsteczki
3.1. Węglowodory
3.1.1. Alkany, cykloalkany
Alkany są węglowodorami nasyconymi – wszystkie wiązania pomiędzy atomami węgla są pojedyncze.
Wzór ogólny: C
n
H
2n+2
Nazewnictwo: nazwę związku tworzymy poprzez dodanie do nazwy rdzenia łańcucha końcówkę –an,
podstawniki pochodzące od alkanów otrzymują końcówkę –ylo, np.: CH
4
(metan) CH
3
- (metylo).
Szereg homologiczny: Grupa związków o podobnej budowie i właściwościach, których cząsteczki różnią
się o jedną lub więcej -CH
2
- nosi nazwę szeregu homologicznego. Metan, etan, propan, butan, pentan,
heksan, heptan, oktan, nonan, dekan, undekan, dodekan, tridekan, tetradekan, pentadekan, itd.
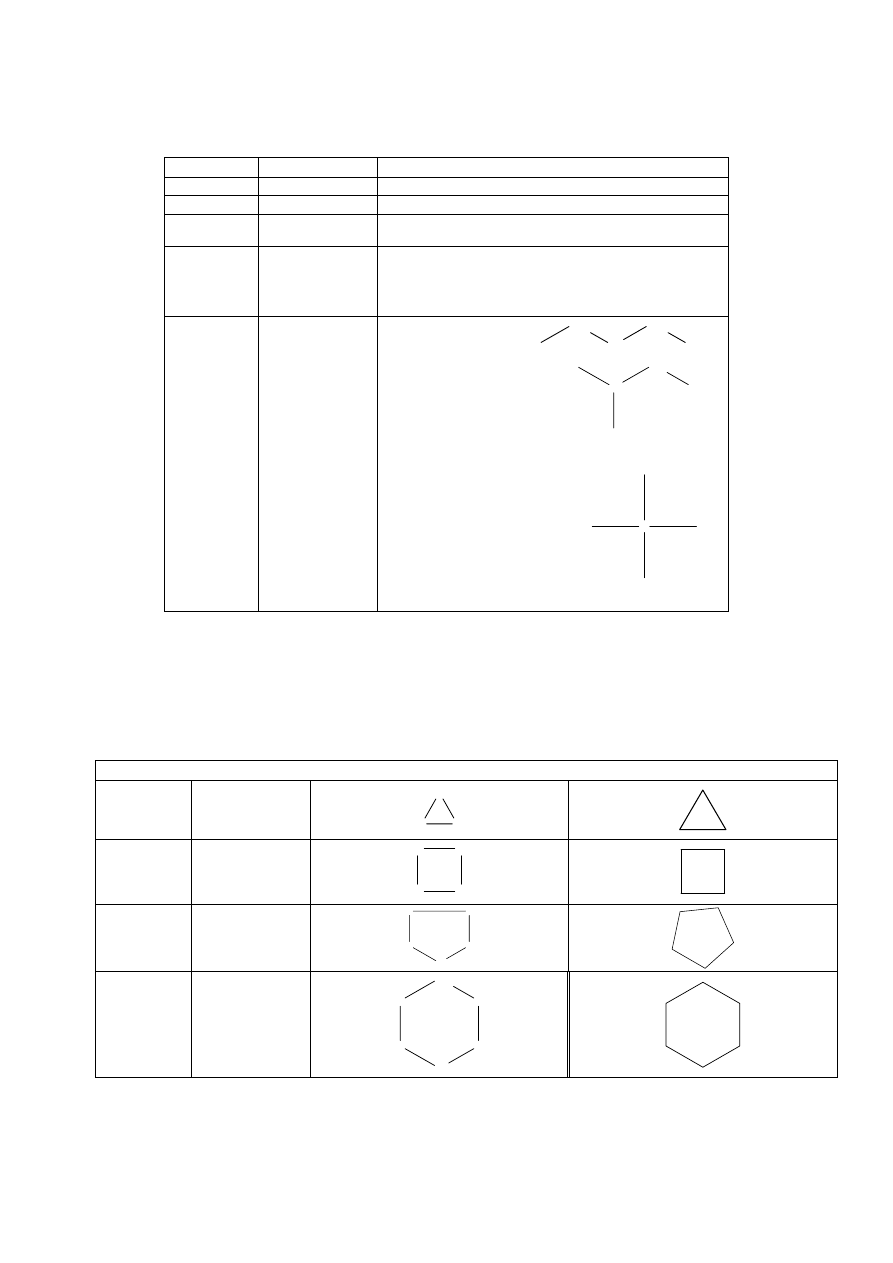
Nazwa
wzór ogólny
wzór grupowy
metan
CH
4
CH
4
etan
C
2
H
6
CH
3
–CH
3
propan
C
3
H
8
CH
3
–CH
2
–CH
3
butan
C
4
H
10
CH
3
-CH
2
-CH
2
-CH
3
CH
3
-CH-CH
3
⏐
CH
3
n-butan 2-metylopropa (izobutan)
pentan
C
H
3
CH
2
CH
2
CH
2
CH
3
2-metylobutan (izopentan)
C
H
3
CH
CH
2
CH
3
CH
3
pentan C
5
H
12
C
H
3
C
CH
3
CH
3
CH
3
2,2-dimetylopropan (neopentan)
Począwszy od butanu łańcuch węglowy może się rozgałęziać, występuje zjawisko izomerii, czyli
różnic w budowie lub właściwościach cząsteczek o takim samym składzie atomowym. W przypadku
alkanów jest to izomeria konstytucyjna – rodzaj izomerii cząsteczek chemicznych, posiadających tę
samą liczbę tych samych atomów, między którymi występuje jednak inny układ wiązań chemicznych.
Izomery konstytucyjne posiadają ten sam ogólny wzór sumaryczny. Izomery konstytucyjne mają zbliżone
własności chemiczne, różnią się między sobą własnościami fizycznymi (np. temperaturą wrzenia).
Cykloalkany
cyklopropan
C
3
H
6
CH
2
H
2
C
CH
2
cyklobutan
C
4
H
8
H
2
C
CH
2
CH
2
H
2
C
cyklopentan
C
5
H
10
H
2
C
CH
2
H
2
C
CH
2
CH
2
cykloheksan C
6
H
12
H
2
C
CH
2
CH
2
H
2
C
CH
2
CH
2

Otrzymywanie
Alkany uzyskuje się przede wszystkim ze źródeł naturalnych: gazu ziemnego oraz ropy naftowej w
procesie rafinacji.
Właściwości fizyczne
Pierwsze cztery homologi w warunkach normalnych są gazami, C5–C15 są cieczami, Cn>15 są ciałami
stałymi. Wszystkie alkany mają gęstość niższą od wody. Są nierozpuszczalne w wodzie, rozpuszczają się
w eterze, benzenie i innych rozpuszczalnikach organicznych. Cyklopropan i cyklobutan są nietrwałe,
pozostałe cykloalkany mają własności podobne do alkanów.
Właściwości chemiczne
Alkany są mało reaktywne ze względu na wysycenie wiązań (wszystkie wiązania są pojedyncze). Ulegają
wyłącznie reakcjom substytucji (podstawiania) za atomy wodoru.
Najważniejsze reakcje:
− spalanie
do
dwutlenku
węgla i wody, np.:
CH
4
+ 4O
2
→ CO
2
+ 2H
2
O
CH
4
+ 3/2O
2
→ CO + 2H
2
O
CH
4
+ O
2
→ CO + 2H
2
O
− substytucja (podstawianie) halogenowcami F
2
, Br
2
i Cl
2
(za atomy wodoru) w obecności światła
jako katalizatora:
HCl
Cl
CH
CH
Cl
CH
2
3
ŚWIATłO
2
3
+
⎯
⎯
⎯
→
⎯
+
Zastosowanie
Uzyskiwanie energii z procesów spalania: metan – gaz ziemny, propan–butan – gaz turystyczny, izooktan
(2,2,4–trimetylopentan) – paliwo wzorcowe do wyznaczania liczby oktanowej oraz dodatek do paliwa
(liczba oktanowa określa odporność mieszanki paliwowo-powietrznej na samozapłon i spalanie stukowe,
dla izooktanu wynosi 100); rozpuszczalniki – heksan, halogenowcopochodne – substraty do syntez
organicznych.
3.1.2. Alkeny, dieny
Alkeny (dieny) są węglowodorami nienasyconymi – w cząsteczce występuje jedno wiązanie
podwójne pomiędzy atomami węgla ( w przypadku dienów – dwa wiązania podwójne).
Wzór ogólny C
n
H
2n
(C
n
H
2n–2
)
Nazewnictwo –en (–dien)
Szereg homologiczny eten, propen, buten, penten, butadien, pentadien, itd.
Nazwa
wzór
ogólny
wzór grupowy
eten (etylen)
C
2
H
4
C
H
2
CH
2
propen (propylen)
C
3
H
6
C
H
2
CH
CH
3
buten
C
4
H
8
C
H
2
CH
CH
2
CH
3
but–2–en (2–
buten)
C
4
H
8
CH
CH
CH
2
C
H
3
buta–1,3–dien
(1,3–butadien)
C
4
H
6
CH
C
H
2
CH
CH
2
buta–1,2–dien
(1,2–butadien)
C
4
H
6
C
H
2
C
CH
CH
3
W alkenach oprócz izomerii konstytucyjnej (np. różne położenie wiązania podwójnego w
butadienie) występuje także izomeria geometryczna (izomeria trans-cis) związana z położeniem
podstawników przy wiązaniach wielokrotnych (większe podstawniki po tej samej stronie wiązania
podwójnego – izomeria cis, po przeciwnych stronach – izomeria trans).
C
C
H
CH
3
H
C
H
3
C
C
H
CH
3
C
H
3
H
trans but-2-en
cis but-2-en
Otrzymywanie
Alkeny otrzymuje się m.in. poprzez eliminację halogenowcowodorów z halogenowcopochodnych alkanów.
CH
3
–CH
2
–Cl → CH
2
=CH
2
+ HCl
Większość alkenów stosowanych w przemyśle pochodzi z przeróbki (krakingu niskociśnieniowego, tzw.
olefinowego) różnych frakcji ropy, głównie benzyny ciężkiej.
Właściwości fizyczne
Alkeny wykazują właściwości fizyczne zbliżone do analogicznych alkanów, w zależności od ilości atomów
węgla w łańcuchu.
Właściwości chemiczne
Alkeny są bardziej reaktywne od alkanów ze względu na obecność wiązania podwójnego, które pęka i
daje możliwość przyłączania (addycji) innych cząsteczek. Ulegają także reakcjom polimeryzacji
addycyjnej.
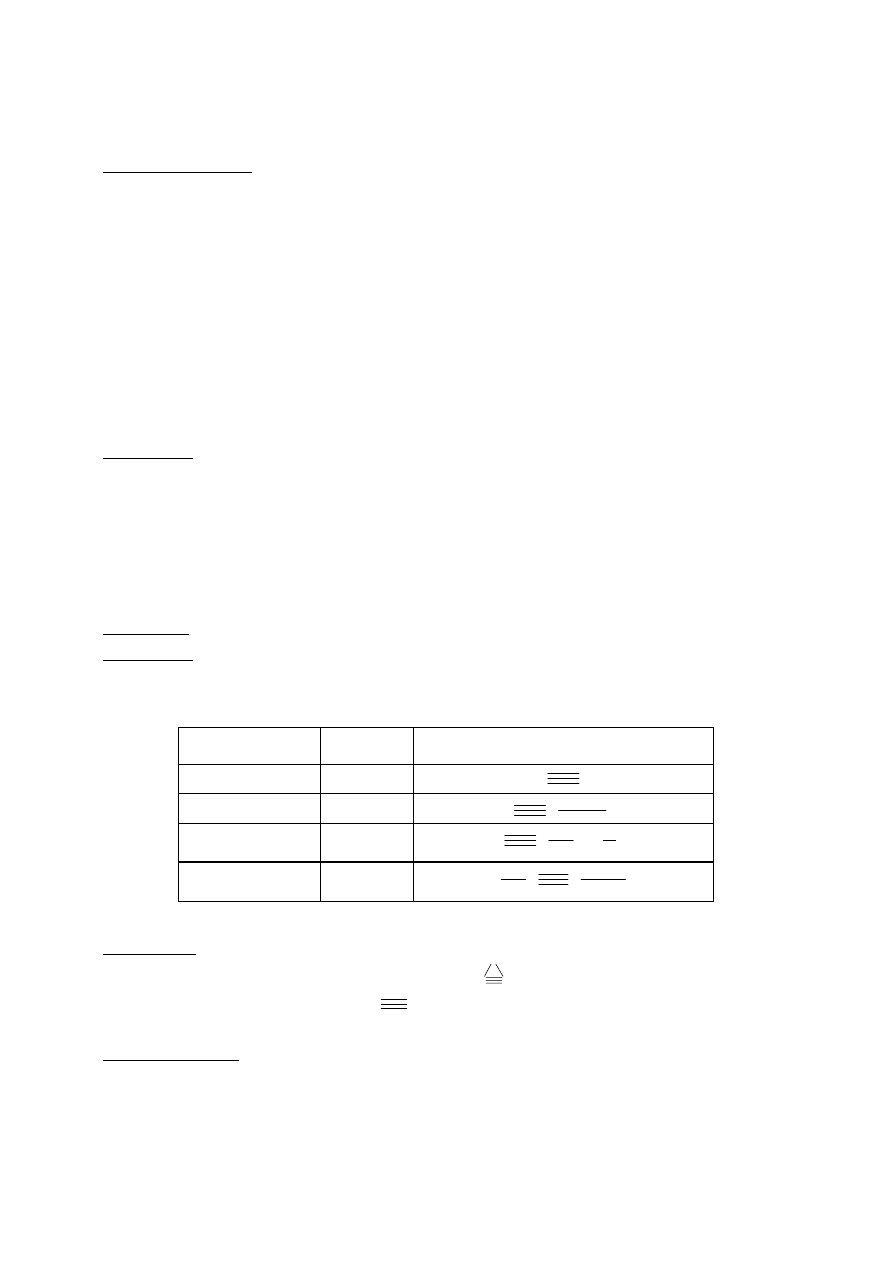
Najważniejsze reakcje:
− addycja
cząsteczki wodoru (uwodornienie):
CH
2
=CH
2
+ H
2
→ CH
3
–CH
3
− addycja
cząsteczki halogenowa:
CH
2
=CH
2
+ F
2
→ CFH
3
–CFH
3
(1,2-difluoroetan)
− addycja
halogenowcowodoru:
CH
3
-CH=CH
2
+ HCl → CH
3
–CClH-CH
2
(2-chloropropan)*
− addycja
cząsteczki wody:
CH
2
=CH
2
+ H
2
O → CH
3
–CH
2
-OH
* podczas przyłączania halogenocwowodorów, atom wodoru przyłączany jest do atomu węgla
zawierającego większą ilość atomów wodoru, tą zasadę określamy mianem reguły Miarkownikowa.
Zastosowanie
Alkeny mają zastosowanie przede wszystkim w syntezach organicznych i polimeryzacji. Największe
zastosowanie jako substrat ma etylen, otrzymuje się z niego między innymi: polietylen (PE), polichlorek
winylu (PCW), rozpuszczalniki, leki, włókna syntetyczne, żywice, farby, kleje, polistyren, itp.
3.1.3. Alkiny
W cząsteczce alkinów występuje jedno wiązanie potrójne, są więć węglowodorami
nienasyconymi.
Wzór ogólny C
n
H
2n-2
Nazewnictwo –yn
(–in)
Szereg homologiczny
etyn, propyn, butyn, pentyn, itd.
Nazwa
wzór
ogólny
wzór grupowy
etyn (acetylen)
C
2
H
2
C
H
CH
propyn C
3
H
4
C
H
C
CH
3
butyn
C
4
H
6
C
H
C
CH
2
CH
3
but-2-yn (2-butyn)
C
4
H
6
C
H
3
C
C
CH
3
Otrzymywanie
Acetylen otrzymuje się w reakcji karbidu (węglik wapnia -
C
C
Ca
) z wodą:
CaC
2
+ H
2
O →
C
H
CH
Właściwości fizyczne
Pierwsze homologi są bezbarwnymi, wybuchowymi gazami o charakterystycznym zapachu.
Właściwości chemiczne
Alkiny są jeszcze bardziej reaktywne od alkenów ze względu na obecność wiązania potrójnego, i również
ulegają reakcją addycji.
Najważniejsze reakcje:
− addycja
cząsteczki wodoru (uwodornienie):
C
H
CH
2
+ H
2
→ CH
2
=CH
2
+ H
2
→ CH
3
–CH
3
− addycja
cząsteczki halogenowa:
C
H
CH
+ Br
2
→ CBrH=CBrH (1,2-dibromoeten)
− addycja
halogenowcowodoru:
C
H
CH
+ HCl → CH
2
=CClH
(1-chloroeten)
− addycja
cząsteczki wody:
C
H
CH
+ H
2
O → CH
3
COH
C
H
3
C
O
H
(aldehyd octowy)
− spalanie
do
dwutlenku
węgla i wody (przy wystarczającym dostępie tlenu), np.:
2
C
H
CH
+ 5O
2
→ 4CO
2
+ 2H
2
O
Zastosowanie
Największe zastosowanie posiada etyn, stosowany jest przede wszystkim w palnikach acetylenowo-
tlenowych do spawania i cięcia metali (osiąga temp. 2700ºC), służy do produkcji tworzyw sztucznych.
3.1.4. Węglowodory aromatyczne
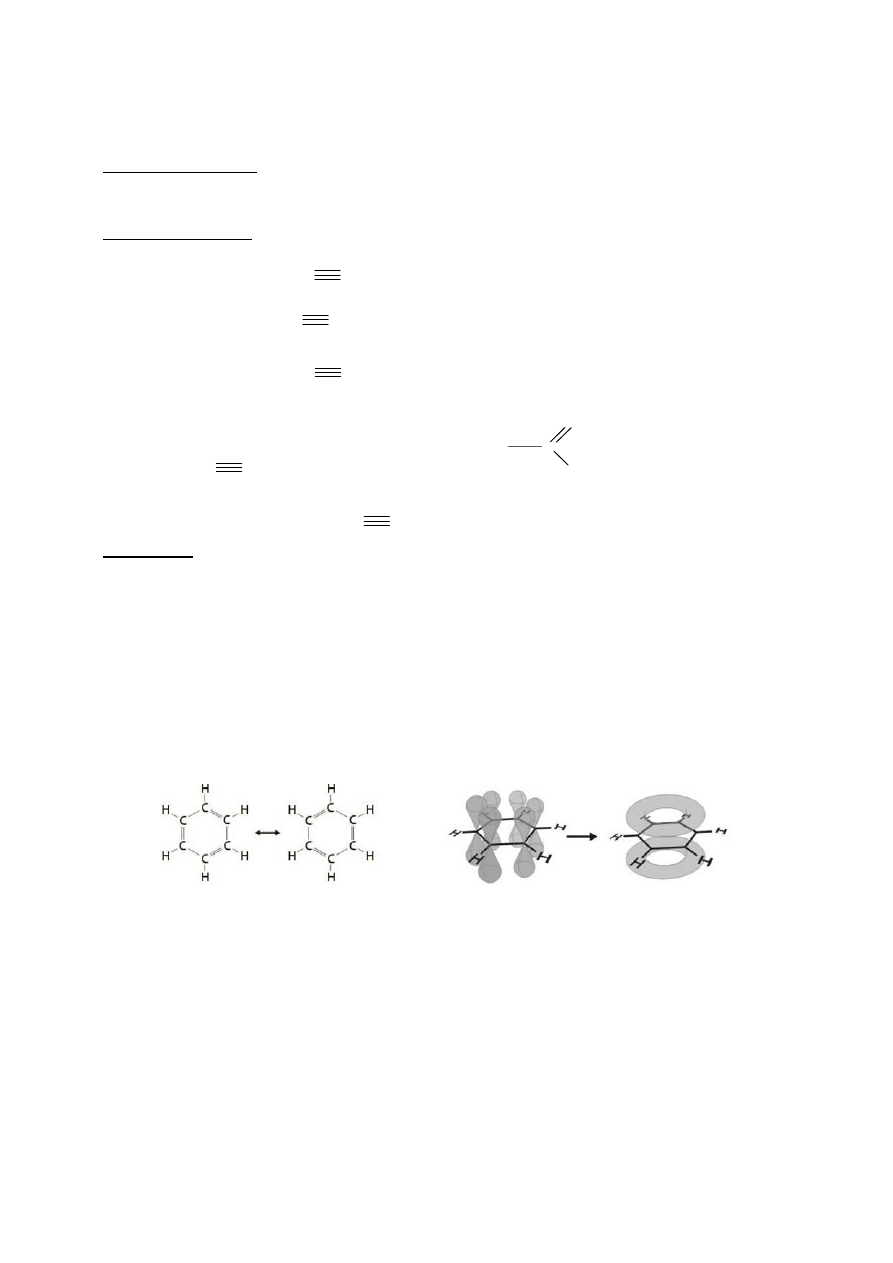
Węglowodory aromatyczne są to związki cykliczne ze sprzężonym układem wiązań podwójnych
(ułożonych naprzemiennie) o specyficznych właściwościach. Najważniejszym związkiem aromatycznym
jest benzen. Teoretyczna struktura benzenu, a raczej dwie równorzędne struktury (struktury Kekule’go –
prawdziwe tylko w warunkach niskotemperaturowych) posiadają układ trzech wiązań podwójnych. W
rzeczywistości sześć elektronów ze słabych wiązań π ma możliwość poruszania się po całej cząsteczce
tworząc sekstet (sześć) zdelokalizowanych elektronów – chmurę elektronową wokół cząsteczki benzenu.
teoretyczne struktury Kekule’go struktura rzeczywista
Szereg homologiczny
benzen, toluen, ksylen, etylobenzen, itd.
Nazwa
wzór
ogólny
wzór grupowy
benzen
C
6
H
6
toluen (metylobenzen)
C
6
H
5
CH
3
CH
3
ksylen (orto–, meta–, para
ksylen)
C
6
H
5
(CH
3
)
2
CH
3
CH
3
o-ksylen
CH
3
CH
3
CH
3
C
H
3
m-ksylen p-ksylen
etylobenzen
C
6
H
5
C
2
H
5
CH
2
CH
3
etylenobenzen
(winylobenzen, styren)
C
6
H
5
C
2
H
3
CH
CH
2
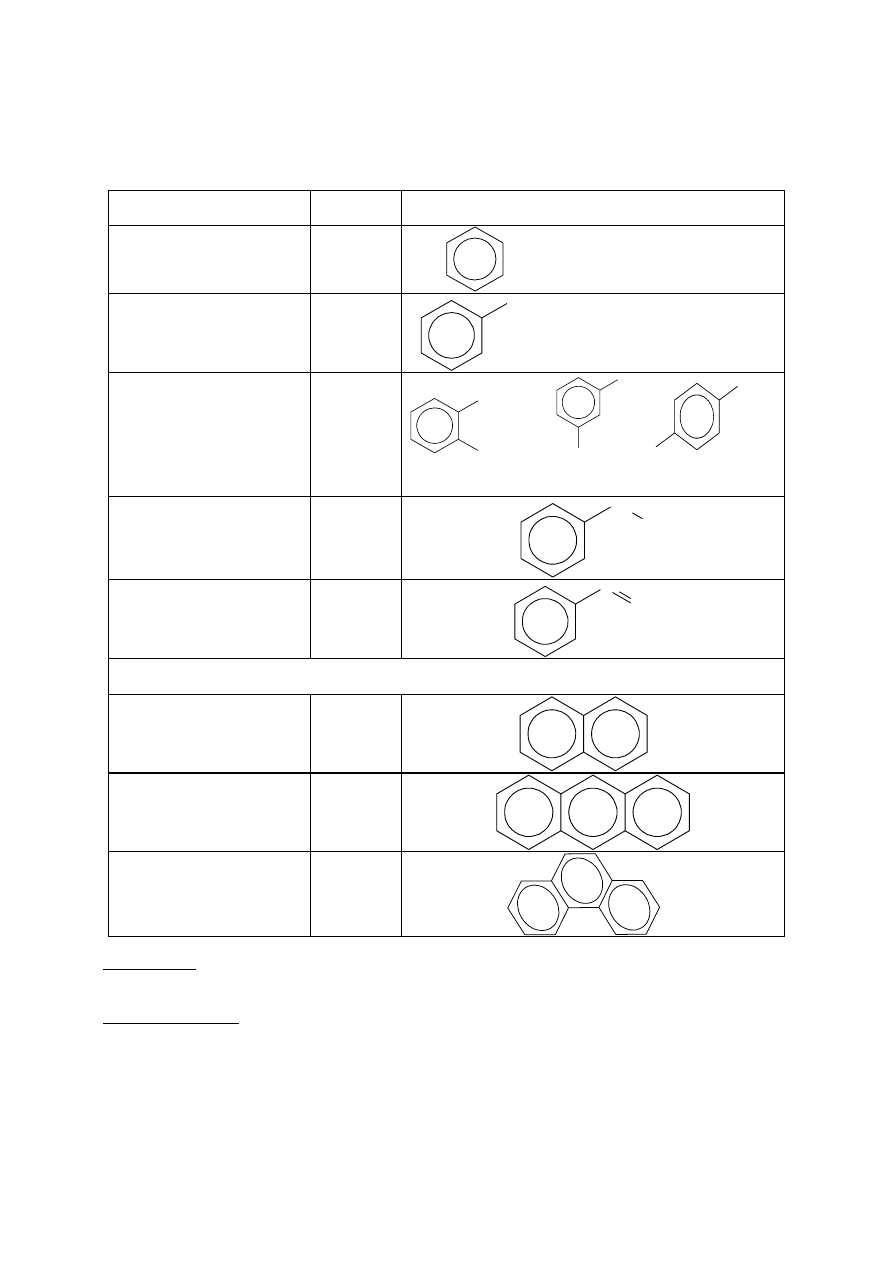
Układy wielopierścieniowe
naftalen
C
10
H
8
antracen
C
14
H
10
fenantren
C
14
H
10
Otrzymywanie
Benzen otrzymuje się z przeróbki ropy naftowej (piroliza, reforming).
Właściwości fizyczne
Benzen jest bezbarwną, palną cieczą o gęstości mniejszej od wody, posiada charakterystyczny zapach,
ma własności rakotwórcze. Homologi benzenu mają własności zbliżone do alkanów i benzenu.
Właściwości chemiczne
Struktura benzenu (sześć elektronów krążących po całej cząsteczce) jest bardzo trwała. W związku z tym,
pomimo trzech wiązań nienasyconych, benzen ulega reakcjom substytucji (podstawiania) za atomy
wodoru.
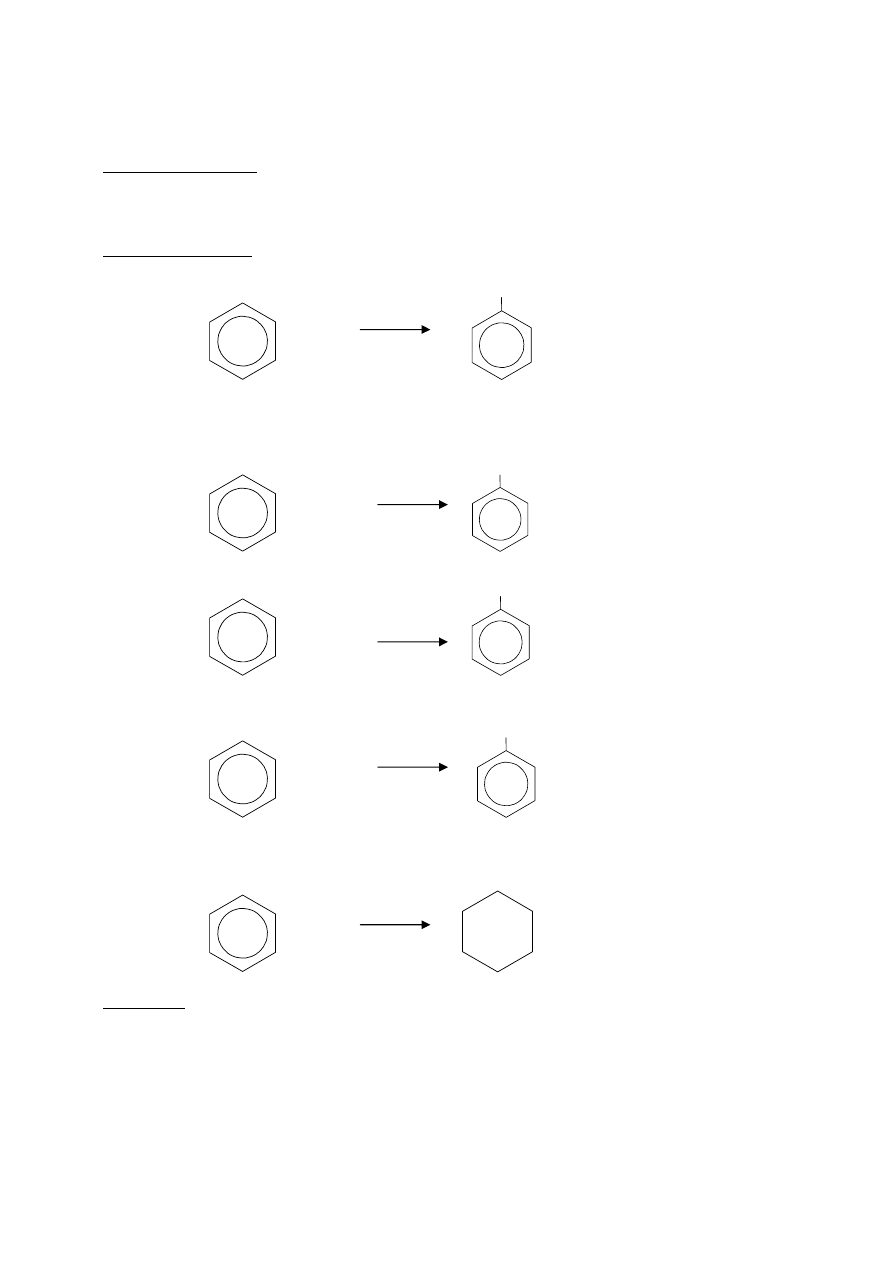
Najważniejsze reakcje:
−
halogenowcowanie:
Cl
− alkilowanie:
C
H
3
− nitrowanie:
O
2
N
− sulfonowanie:
HO
3
S
− uwodornienie:
Podstawniki: wyróżniamy dwa rodzaje podstawników:
* podstawniki pierwszego rodzaju kierują kolejne przyłączane do łańcucha benzenu podstawniki w
pozycję orto i para - należą do nich: CH
3
-; Cl-, OH-, NH
2
-, HS-.
* podstawniki drugiego rodzaju posyłają kolejny podstawnik tylko w pozycję meta. Do podstawników
drugiego rodzaju zaliczamy: SO
3
H-, NO
2
H, -COOH, CHO-, CN-
+ Cl
2
AlCl
3
+ HCl
+ HONO
2
H
2
SO
4
-H
2
O
+ CH
3
Cl
AlCl
3
+ HCl
+ HOSO
3
-H
2
O
+ 3H
2
katalizator
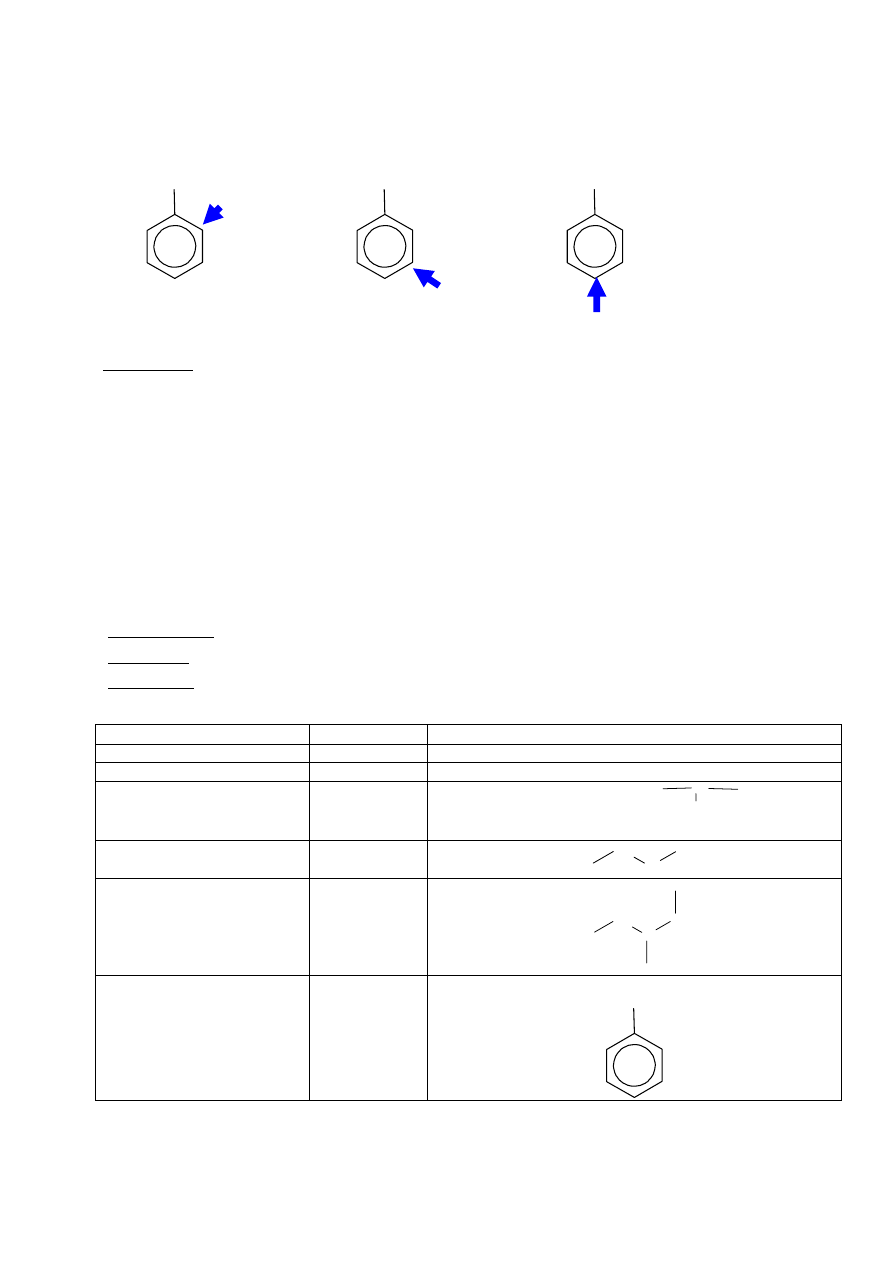
Podstawnik
Podstawnik
Podstawnik
pozycja orto
pozycja meta
pozycja para
Zastosowanie
Benzen, kiedyś stosowany jako rozpuszczalnik, obecnie ze względu na własności rakotwórcze został
wycofany z użytku. Stanowi za to jeden z najważniejszych surowców w syntezie organicznej, służy m. in.
do produkcji tworzyw sztucznych, włókien syntetycznych, barwników, leków, detergentów, pestycydów, a
także do otrzymywania aniliny, fenolu i acetonu, itp.
3.2. Związki z grupami funkcyjnymi
Oprócz węglowodorów zbudowanych wyłącznie z atomów C i H, istnieje szereg związków
organicznych zawierających atomy innych pierwiastków, najczęściej tlenu, azotu i siarki. Obecność tych
atomów powoduje, że związki wykazują specyficzne właściwości. Grupę atomów, która decyduje o
charakterze związku organicznego nazywamy grupą funkcyjną.
3.2.1. Alkohole, fenole, glikole (alkohole wielowodorotlenowe)
Grupa funkcyjna
–OH hydroksylowa
Wzór ogólny
R–OH, Ar–OH,
Nazewnictwo
–ol, alkohol –owy, fenol
Szereg homologiczny
metanol, etanol, propanol, butanol, fenol, krezol, itd.
Nazwa
wzór ogólny
wzór grupowy
metanol (alkohol metylowy)
CH
3
OH
CH
3
OH
etanol (alkohol etylowy)
C
2
H
5
OH
CH
3
–CH
2
−OH
propanol (alkohol propylowy)
C
3
H
8
OH
CH
3
–CH
2
–CH
2
–OH
C
H
3
CH
CH
3
O
H
propan–1–ol (n–propanol) propan–2–ol (izopropanol)
glikol etylenowy etan–1,2–diol
C
2
H
4
(OH)
2
CH
2
CH
2
OH
O
H
gliceryna propan–1,2,3–triol
C
3
H
5
(OH)
3
CH
2
CH
CH
2
O
H
OH
OH
fenol (hydroksybenzen)
C
6
H
5
OH
O
H
Rzędowość alkoholi
Rzędowość alkoholi jest powiązana z ilością atomów węgla, połączonych z atomem C, przy którym
znajduje się grupa hydroksylowa.
O
H
CH
2
CH
2
CH
2
CH
3
alkohol pierwszorzędowy (butan-1-ol, butanol)
C
H
3
C
H
CH
2
CH
3
OH
alkohol drugorzędowy (butan-2-ol; 2-butanol)
C
H
3
C
CH
3
OH
C
H
3
alkohol trzeciorzędowy (2-metylo-propan-2-ol)
Otrzymywanie
Alkohole, zwłaszcza etanol otrzymuje się w wyniku fermentacji alkoholowej, do celów przemysłowych jest
produkowany również poprzez bezpośrednią syntezę z tzw. gazu syntezowego (mieszanina CO, H
2
i H
2
O).
Alkohole można również otrzymać w drodze reakcji:
− hydrolizy halogenków alkilów w środowisku kwaśnym:
HCl
OH
CH
CH
O
H
Cl
CH
CH
2
3
2
2
3
+
⎯→
⎯
+
− addycji
cząsteczki wody do alkenów:
OH
CH
CH
CH
O
H
CH
CH
CH
2
2
3
2
2
3
⎯→
⎯
+
=
− redukcji aldehydów (alkohole 1 rzędowe):
OH
CH
CH
H
CHO
CH
2
3
]
H
[
2
3
2
⎯
⎯ →
⎯
+
− redukcji ketonów (alkohole 2 rzędowe):
3
3
]
H
[
3
3
CHOHCH
CH
COCH
CH
2
⎯
⎯ →
⎯
Właściwości fizyczne
Alkohole są lotnymi cieczami o charakterystycznym zapachu. Alkohol metylowy i glikole
dwuwodorotlenowe są silnymi truciznami. Alkohol etylowy ma własności narkotyczne.
Właściwości chemiczne
Wodne roztwory alkoholi mają odczyn obojętny. Alkohole ulegają utlenieniu do aldehydów (1rzędowe) i
ketonów (2 rzędowe).
Najważniejsze reakcje:
− utlenianie do aldehydów, a następnie do kwasów organicznych (alkohole 1 rzędowe):
RCOOH
RCHO
OH
RCH
]
O
[
]
O
[
2
2
2
⎯
⎯ →
⎯
⎯
⎯ →
⎯
− utlenienie do ketonów
3
3
]
O
[
3
3
COCH
CH
CHOHCH
CH
2
⎯
⎯ →
⎯
− spalanie:
O
H
CO
O
OH
CH
2
2
2
3
+
→
+
− reakcja z metalami – tworzenie alkoholanów:
O
H
ONa
CH
CH
Na
2
OH
CH
CH
2
2
2
3
2
3
+
⎯→
⎯
+
− katalityczna dehydratacja (odwodnienie):
O
H
CH
CH
Na
2
OH
CH
CH
2
2
2
kat
2
3
+
=
⎯
⎯ →
⎯
+
− estryfikacja -reakcja z kwasami organicznymi bądź nieorganicznymi z utworzeniem estrów:
O
H
CH
COOCH
CH
COOH
CH
OH
CH
CH
2
3
2
3
3
2
3
+
⎯→
⎯
+
− reakcja jodoformowa Liebena, charakterystyczna dla ugrupowania CH
3
CO– oraz związków,
które dają to ugrupowanie w reakcji utlenienia, np. etanolu:
8NaOH + 4I
2
+ CH
3
–CH
2
–OH → CHI
3
+ HCOONa + NaI + 8H
2
O jodoform
Zastosowanie
Alkohole stosowane są najczęściej jako rozpuszczalniki organiczne, substraty do syntez organicznych,
etanol stosowany jest do produkcji leków i celów spożywczych. Gliceryna stosowana jest w przemyśle:
farmaceutycznym, spożywczym, kosmetycznym (kremy, mydła) i skórzanym (garbowanie),
wykorzystywana jest także do produkcji materiałów wybuchowych, barwników, płynów hamulcowych i
chłodniczych.
3.2.2. Aldehydy
Grupa funkcyjna
aldehydowa
R
C
O
H
Wzór ogólny
R–CHO
Otrzymywanie
Aldehydy uzyskuje się w reakcji utleniania alkoholi pierwszorzędowych
RCHO
OH
RCH
]
O
[
2
2
⎯
⎯ →
⎯
Nazewnictwo
–al, aldehyd –owy
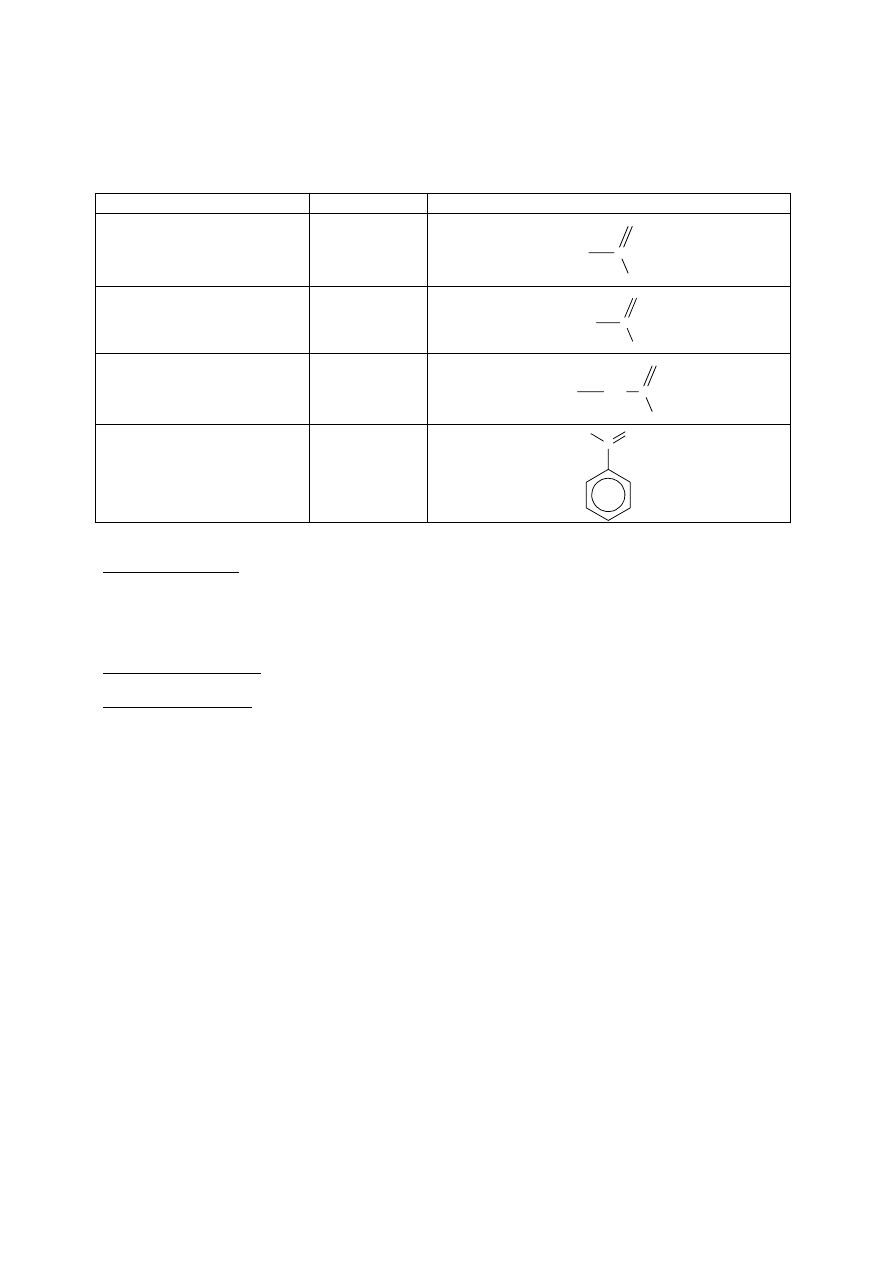
Szereg homologiczny
metanal, etanal, propanal, butanal, itd.
Nazwa
wzór ogólny
wzór grupowy
metanal (aldehyd mrówkowy,
formaldehyd, formalina)
CH
2
O
H
C
O
H
etanal (aldehyd octowy)
C
2
H
4
O
C
H
3
C
O
H
propanal (aldehyd
propionowy)
C
3
H
6
O
CH
2
C
O
H
C
H
3
aldehyd benzoesowy
C
7
H
6
O
C
O
H
Właściwości fizyczne
Aldehydy są to toksyczne substancje będące w większości ciałami stałymi, słabo rozpuszczalnymi w
wodzie, o charakterystycznym, dusznym zapachu. Wyjątek stanowią aldehyd mrówkowy i octowy, które
są gazami dobrze rozpuszczalnymi w wodzie (do ok. 40% wagowych). Aldehyd benzoesowy jest
nietoksyczny.
Właściwości chemiczne
Aldehydy posiadają silne właściwości redukujące, same utleniając się do kwasów
organicznych.
Najważniejsze reakcje:
− redukcja do alkoholi 1 rzędowych:
OH
CH
CH
CHO
CH
2
3
]
H
[
3
2
⎯
⎯ →
⎯
− utlenianie do kwasów organicznych:
COOH
CH
CHO
CH
3
]
O
[
3
2
⎯
⎯ →
⎯
Przykładami reakcji utleniania aldehydów są:
próba Tollensa (lustra srebrnego)
polegająca na reakcji aldehydu z jonem kompleksowym srebra
(dwuamminosrebra), w wyniku której ulega on utlenieniu do kwasu organicznego, zaś srebro jest
redukowane do srebra metalicznego:
2[Ag(NH
3
)
2
]OH + HCHO + NH
4
OH →2Ag↓ + HCOOH + 2H
2
O + 5NH
3
↑
próba Fehlinga
, w której utleniający się aldehyd redukuje jony miedzi (II) do miedzi (I):
2Cu(OH)
2
+ CH
3
CHO + NaOH → Cu
2
O↓ + CH
3
COONa + 3H
2
O
Zastosowanie
Aldehydy stosowane są do syntez organicznych (tworzywa sztuczne, barwniki), w przemyśle
spożywczymkosmetycznym (składniki kompozycji zapachowych i aromatów spożywczych). w garbarstwie
(aldehyd glutarowy).
3.2.3. Ketony
Grupa funkcyjna
–C=O karbonylowa
Wzór ogólny R'–CO–R”
Nazewnictwo -on, – keton
Szereg homologiczny
propanon, butanon, pentanon, itd.
Nazwa
wzór ogólny
wzór grupowy
propanon
dimetyloketon, aceton
CH
3
COCH
3
C
H
3
C
CH
3
O
butanon
etylometyloketon
CH
3
COC
2
H
5
C
H
3
C
CH
2
O
CH
3
pentan–2–on
metylopropyloketon
CH
3
COC
3
H
7
C
H
3
C
CH
2
O
CH
2
CH
3
pentan–3–on
dietyloketon
C
2
H
5
COC
2
H
5
CH
2
C
CH
2
O
CH
3
C
H
3
Otrzymywanie
Ketony otrzymuje się podczas utleniania alkoholi 2 rzędowych:
3
3
]
O
[
3
3
COCH
CH
CHOHCH
CH
2
⎯
⎯ →
⎯
Właściwości fizyczne
Niższe ketony są mało toksycznymi, rozpuszczalnymi w wodzie, łatwopalnymi cieczami o
charakterystycznym zapachu.
Właściwości chemiczne
Ketony mają własności zbliżone do aldehydów.
Najważniejsze reakcje:
− utlenianie do kwasów karboksylowych (cząsteczka ketonu ulega rozpadowi):
C
H
3
C
CH
3
O
C
H
3
C
O
OH
H
C
O
OH
− redukcja do alkoholi 2 rzędowych:
3
2
2
3
]
H
[
3
2
2
3
CH
CHOHCH
CH
CH
CH
COCH
CH
CH
2
⎯
⎯ →
⎯
− reakcja jodoformowa Gunninga (charakterystyczna dla metyloketonów – zawierających grupę
+
O
2
CH
3
CO):
RCOCH
3
+ 3I
2
+4NaOH →RCOONa + CHI
3
+ 3H
2
O + 3NaI
Zastosowanie
Ketony są szeroko stosowane jako rozpuszczalniki (aceton), półprodukty w syntezie chemicznej, składniki
kompozycji zapachowych i przypraw spożywczych, chloro- i bromopochodne ketony są stosowane jako
środki trujące (chloroacetofenon, chloro- i bromoaceton).
3.2.4. Kwasy karboksylowe
Grupa funkcyjna
karboksylowa
R
C
O
OH
Wzór ogólny RCOOH
Nazewnictwo
kwas –owy
Szereg homologiczny
kwas metanowy, etanowy, propanowy, butanowy, itd.
Nazwa
wzór ogólny
wzór grupowy lub uproszczony
kwas metanowy
(mrówkowy)
CH
2
O
2
H
C
O
OH
kwas etanowy (octowy)
C
2
H
4
O
2
C
H
3
C
O
OH
kwas propanowy
(propionowy)
C
3
H
6
O
2
CH
2
C
O
OH
C
H
3
kwas butanowy (masłowy)
C
4
H
8
O
2
CH
2
C
O
OH
CH
2
C
H
3
kwas palmitynowy
C
15
H
31
COOH
C
H
3
OH
O
kwas stearynowy
C
17
H
35
COOH
C
H
3
OH
O
kwas etanodiowy
(szczawiowy)
(COOH)
2
C
O
OH
O
O
H
kwas benzoesowy
C
6
H
5
COOH
O
OH
kwas ftalowy kwas 1,2–
benzenodikarboksylowy
C
6
H
5
(COOH)
2
O
OH
O
O
H

Otrzymywanie
Kwasy karboksylowe uzyskuje się w wyniku utleniania alkoholi i aldehydów:
RCOOH
RCHO
OH
RCH
]
O
[
]
O
[
2
2
2
⎯
⎯ →
⎯
⎯
⎯ →
⎯
Właściwości fizyczne
Kwasy karboksylowe z krótkimi łańcuchami są dobrze rozpuszczającymi się w wodzie cieczami o ostrym,
nieprzyjemnym zapachu. Kwasy karboksylowe o długich (powyżej 10 atomów węgla) są ciałami stałymi i
noszą nazwę kwasów tłuszczowych. Kwas mrówkowy ma własności grzybobójcze.
Właściwości chemiczne
Kwasy organiczne są słabymi kwasami, ulegają dysocjacji. Tworzą sole z wodorotlenkami i estry z
alkoholami. Sole sodowe i potasowe wyższych kwasów tłuszczowych
Najważniejsze reakcje:
− redukcja do aldehydów i alkoholi:
OH
CH
CH
CHO
CH
COOH
CH
2
3
]
H
[
3
]
H
[
3
2
2
⎯
⎯ →
⎯
⎯
⎯ →
⎯
− tworzenie soli (zobojętnianie wodorotlenkami):
O
H
COONa
CH
NaOH
COOH
CH
2
3
3
+
⎯→
⎯
+
− estryfikacja (reakcja z alkoholami):
O
H
CH
COOCH
CH
COOH
CH
OH
CH
CH
2
3
2
3
3
2
3
+
⎯→
⎯
+
Zastosowanie
Kwasy stosowane są do produkcji środków zapachowych, barwników, leków. Kwasy tłuszczowe służą do
produkcji mydła, kwas mrówkowy – do produkcji środków grzybobójczych, kwas tereftalowy - do produkcji
włókien poliestrowych oraz włókien poliamidowych o dużej wytrzymałości na zrywanie (kevlar - kamizelki
kuloodporne).
3.2.5. Estry
Grupa funkcyjna
karboksylowa
R
C
O
O
R
Wzór ogólny RCOOR’’
Nazewnictwo
–an-ylu, ester –owy kwasu-owego
Nazwa
wzór ogólny
wzór grupowy
mrówczan metylu ester metylowy kwasu
metanowego
HCOOCH
3
H
C
O
O
CH
3
mrówczan etylu ester etylowy kwasu
metanowego
CH
3
COOCH
3
C
H
3
C
O
O
CH
3
octan etylu ester etylowy kwasu etanowego
CH
3
COOC
2
H
5
C
H
3
C
O
O
CH
2
CH
3
Otrzymywanie
Estry powstają w reakcji kwasów karboksylowych z alkoholami:
O
H
CH
COOCH
CH
COOH
CH
OH
CH
CH
2
3
2
3
3
2
3
+
⎯→
⎯
+
lub reakcji kwasów nieorganicznych z alkoholami:
3
2
2
2
2
3
CH
OCH
NO
HONO
OH
CH
CH
⎯→
⎯
+
Właściwości fizyczne
Estry niższych kwasów karboksylowych i alkoholi są cieczami słabo mieszającymi się z wodą, o
intensywnym i dość przyjemnym zapachu, toksyczne w większych dawkach. Estry kwasów tłuszczowych i
gliceryny to tłuszcze.
Właściwości chemiczne
Estry w wodzie ulegają hydrolizie, podobnie jak sole słabych kwasów nieorganicznych. Z wodorotlenkiem
sodu lub potasu ulegają zmydlaniu.
Najważniejsze reakcje:
− hydroliza:
CH
3
COOC
2
H
5
+ H
2
O → CH
3
COOH + C
2
H
5
OH
− zmydlanie (reakcja estrów kwasów tłuszczowych i gliceryny z wodorotlenkiem sodu lub potasu):
C
H
2
C
H
CH
2
O
O
O
CH
3
CH
3
CH
3
3
C
H
3
COONa
+
CH
2
CH
CH
2
O
H
OH
O
H
Zastosowanie
Kiedyś szeroko stosowane jako związki zapachowe w przemyśle spożywczym i kosmetycznym, obecnie
wycofane ze względu na własności rakotwórcze. Tłuszcze – estry wyższych kwasów (>C15) i gliceryny
stosowane są do produkcji mydeł.
PYTANIA KONTROLNE
1. Podział węglowodorów.
2. Scharakteryzować alkany i alkiny (wzory, nazewnictwo, reakcje).
3. Omówić wiązanie występujące w pierścieniu aromatycznym.
4. Jakie znasz alkohole wielowodorotlenowe?
5. Co to są fenole?
6. Jak otrzymuje się aldehydy i ketony?
7. Kwasy karboksylowe i ich pochodne.
8. Na czy polega reakcja estryfikacji?
+ 3 NaOH
Wyszukiwarka
Podobne podstrony:
Chemia organiczna W 8 id 112721 Nieznany
chemia organiczna id 112638 Nieznany
Chemia organiczna 2 id 112634 Nieznany
Geny a organizm id 187793 Nieznany
chemia zadania 2 id 113035 Nieznany
chemia opracowanie id 112613 Nieznany
chemia klucz (2) id 112361 Nieznany
5 kultura organizacyjna id 402 Nieznany
chemia tablice id 112030 Nieznany
Chemia 03 id 557778 Nieznany
Chemia 10 3 id 111757 Nieznany
Chemia 11 3 id 111768 Nieznany
arkusz zr Chemia tablice id 625 Nieznany (2)
Oczyszczanie organizmu id 33057 Nieznany
CHEMIA EGZAMIN 2 id 112139 Nieznany
(CHEMIA WYKLAD 3)id 1241 Nieznany
(CHEMIA WYKLAD 6)id 1242 Nieznany (2)
chemia sem 2 id 112875 Nieznany
Chemia 12 id 111779 Nieznany
więcej podobnych podstron