1
Piotr LUDWIKOWSKI
2008/2009 Fizyka
29 kwietnia 2009
Środa, 17:15
dr I. Mróz
WYZNACZANIE CIEPŁATOPNIENIA LODU I SKRAPLANIA PARY WODNEJ
Temperatura początkowa wody:
Lp. Czas/s Temperatura/°C
1
30
27,3
2
60
27,2
3
90
27,2
4 120
27,2
5 150
27,2
6 180
27,1
7 210
27,1
8 240
27,1
9 270
27,1
10 300
27,1
Pomiary temperatury po wrzuceniu lodu:
Lp. Czas/s Temperatura/°C
1
30
22,3
2
60
20,4
3
90
18,9
4 120
17,4
5 150
16,7
6 180
15,5
7 210
15,0
8 240
14,5
9 270
14,3
10 300
14,4
11 330
14,3
12 360
13,8
13 390
13,6
14 420
13,8
15 450
13,5
16 480
13,4
17 510
13,6
18 540
13,6
19 570
13,6
20 600
13,8
21 630
13,7
Zmiany temperatury wody:
Lp. Temperatura/°C
1
14,7
2
14,7
3
14,7
4
14,8
5
14,8
6
14,9
7
14,9
8
14,9
9
15,0
10
15,0
11
15,0
12
15,0
13
15,1
14
15,2
15
15,2
16
15,3
17
15,1
18
15,2
19
15,3
20
15,4
21
15,5
22
15,5
23
15,5
24
15,7
25
15,6
26
15,6
27
15,7
28
15,6
29
15,8
30
15,8
31
15,8
32
15,9
33
15,9
34
16,0
Pomiary po dodaniu pary wodnej:
Lp. Czas/s
Temperatura/°C
1
30
22,7
2
60
22,8
3
90
23,5
4
120
24,2
5
150
27,2
6
180
29,3
7
210
30,3
8
240
31,6
9
270
32,5
10
300
33
11
330
33,7
12
360
33,8
13
390
34,4
14
420
34,5
15
450
34,6
16
480
34,7
17
510
34,8
18
540
34,8
19
570
34,8
20
600
34,9
21
630
34,9
22
660
34,9
Niepewność pomiaru czasu: 0,2 s
Niepewność pomiaru temp.: 0,1 °C
Niepewność pomiaru masy: 0,1 g
Masa naczynka: 97,9 g
Masa naczynka z wodą: 288,5 g
Masa naczynka z lodem: 320,3 g
Masa naczynka z parą wodną: 329,5 g
27

2
TEORIA:
Ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do danego ciała (o
określonej masie), aby temperatura tego ciała wzrosła o jednostkę temperatury.
W układzie SI ciepło właściwe to wielkość określająca ilość energii jaką należy dostarczyć do pewnego
ciała o masie jednego kilograma, aby jego temperatura wzrosła o jeden kelwin.
Natomiast ciepłem topnienia nazywamy ilość ciepła potrzebna do zmiany 1 kg ciała stałego danej
substancji o temperaturze topnienia na ciecz o tej samej temperaturze.
Wynika z tego, ze Q=c
t
m (gdzie Q - ciepło potrzebne do stopienia danego ciała stałego o masie m, c
t
-
ciepło topnienia tego ciała).
Na energię wewnętrzną ciała stałego składa się:
energia kinetyczna cząstek (związana z drganiami cieplnymi)
energia potencjalna wzajemnego oddziaływania cząstek.
Podczas podgrzewania ciała stałego można zauważyć zmianę jego objętości. Wynika to z tego, ze
podgrzewając dostarczamy energii, którą przejmują cząsteczki ciała znajdujące się w sieci krystalicznej
(drgają z coraz większą amplituda - potrzebują więcej miejsca) w efekcie tego objętość ciała wzrasta.
Podczas dalszego ogrzewania ciała dochodzi się do pewnej charakterystycznej temperatury (zwanej
temperatura topnienia) w której zachodzi zjawisko topnienia - czyli proces przejścia ze stanu stałego ciała w
stan ciekły. Ciekawe jest, ze towarzyszy temu stała temperatura. Jest to spowodowane tym, iż podczas tego
zjawiska energia dostarczana przechodzi tylko w energie potencjalna oddziaływań cząstek między sobą i w
wyniku tego zniszczone zostają wiązania międzycząsteczkowe (ciało przechodzi w ciecz przy stałej
temperaturze).
Okazuje się, ze temperatura topnienia zależy od ciśnienia w jakim ta przemiana następuje. Zależność tą
oddaje równanie Clausiusa - Clapeyrona:
gdzie:
T -
temperatura przemiany przy ciśnieniu p
Δp - przyrost ciśnienia względem p
ΔT - Przyrost temperatury przemiany spowodowany przyrostem ciśnienia o Δp
q -
ciepło przemiany (np. ciepło topnienia)
V
1
,V
2
- objetosci ciała przed i po przemianie
Ciepło topnienia lodu wyznaczamy z bilansu cieplnego dla procesu stopienia pewnej ilości lodu w
kalorymetrze:
Q
1
=Q
2
- równanie bilansu cieplnego
gdzie:
Q
1
-ciepło potrzebne do stopienia lodu i ciepło potrzebne do ogrzania powstałej z lodu wody
Q
2
-ciepło dostarczone przez wodę w naczyniu kalorymetrycznym oraz ciepło dostarczone przez
kalorymetr z mieszadłem.
gdzie:
L –
szukane ciepło topnienia lodu;
c
w
–
ciepło właściwe wody;
m
l
– masa lodu;
c
k
–
ciepło właściwe kalorymetru;
m
k
– masa kalorymetru;
m
w
– masa wody w kalorymetrze;
czyli:
stąd:

3
Ciepło skraplania pary wodnej wyznaczamy z bilansu cieplnego:
gdzie:
Q
1
-ciepło potrzebne do skraplania pary wodnej w temperaturze 100°C
Q
2
-ciepło ciepło oddane przez wodę, która powstała ze skroplenia pary wodnej
Q
3
– pobrana ilość ciepła
R – szukane ciepło skraplania pary wodnej;
t
0
– temperatura wrzenia wody;
czyli:
Tekst na podst.
H. Szydłowski, Pracownia Fizyczna, T. Dryński, Ćwiczenia laboratoryjne z fizyki oraz wiedzy własnej.
OPRACOWANIE WYNIKÓW:
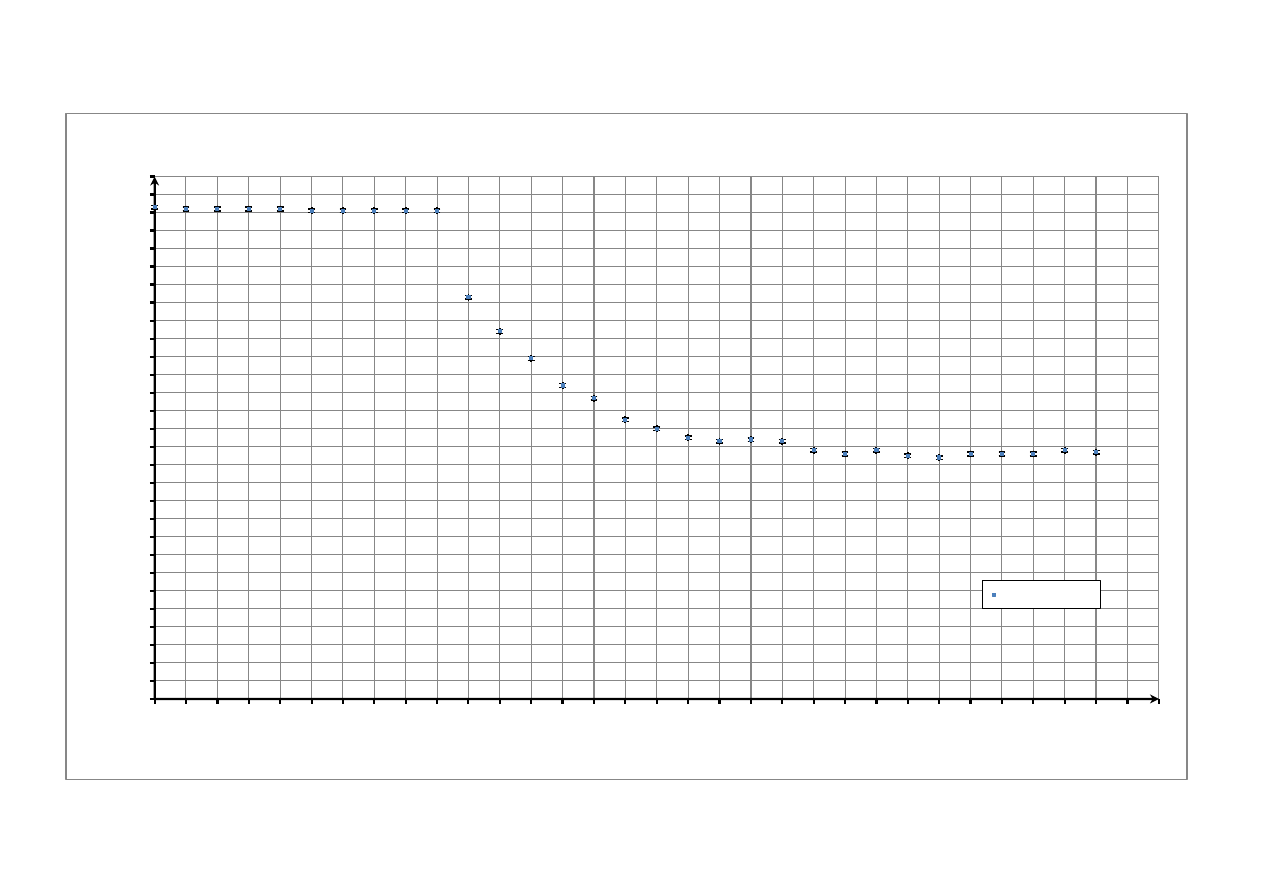
Najpierw na podstawie pomiarów sporządzimy wykres zmian temperatury w funkcji czasu. Niepewność
pomiaru czasu wyniosła 0,2 s (zbyt mała by zaznaczyć ją na wykresie), zaś niepewność pomiaru temperatury
0,1°C. Zanim jednak to nastąpi podamy jeszcze dwie wielkości potrzebne do dalszych obliczeń.
ciepło właściwe wody:
4190 J/kg∙K
ciepło właściwe kalorymetru (aluminium):
922 J/kg∙K
4
0,0
1,0
2,0
3,0
4,0
5,0
6,0
7,0
8,0
9,0
10,0
11,0
12,0
13,0
14,0
15,0
16,0
17,0
18,0
19,0
20,0
21,0
22,0
23,0
24,0
25,0
26,0
27,0
28,0
29,0
0
30
60
90 120 150 180 210 240 270 300 330 360 390 420 450 480 510 540 570 600 630 660 690 720 750 780 810 840 870 900 930 960
te
m
p
e
ratu
ra/
°C
czas/s
Zmiana temperatury w funkcji czasu
temperatura/°C
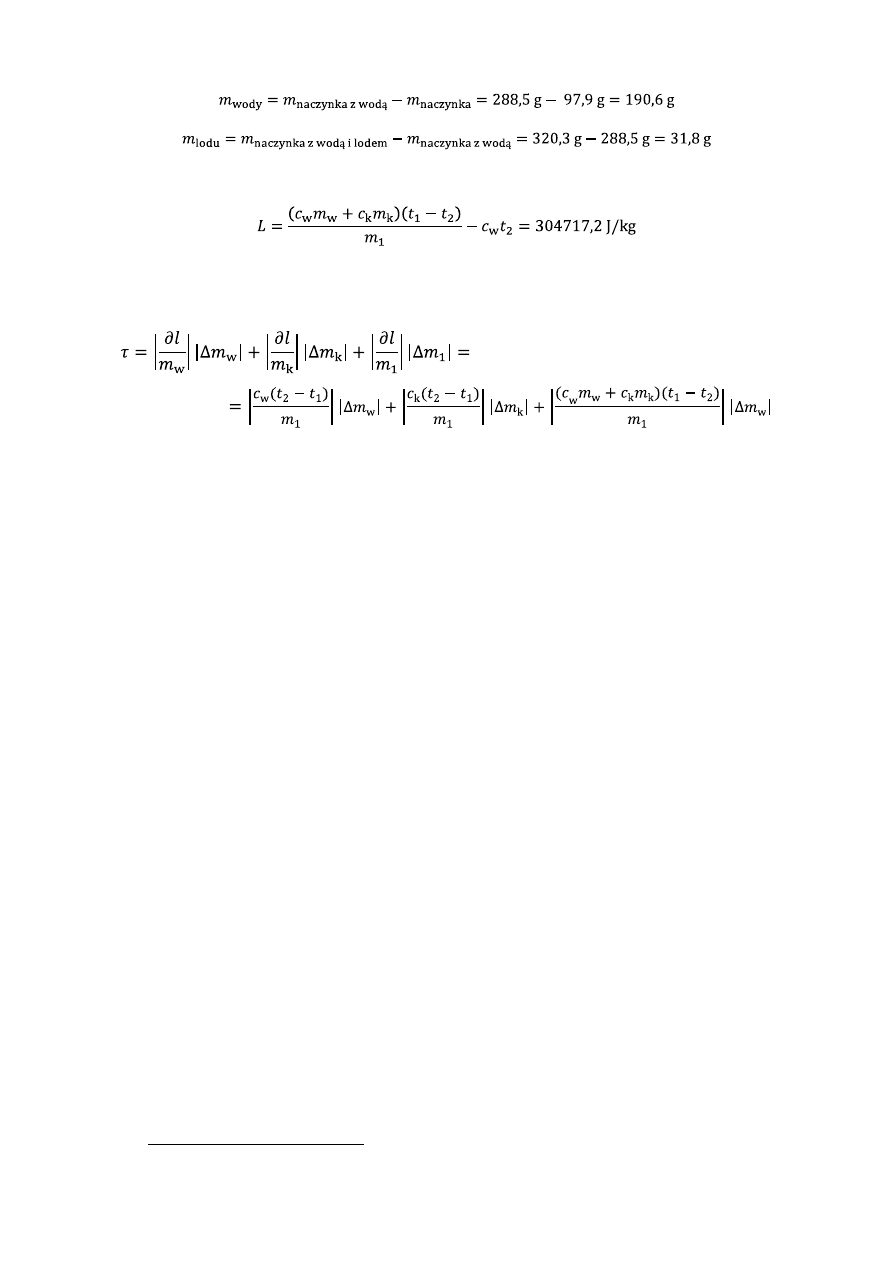
5
Obliczymy teraz początkową masę wody, oraz masę wrzuconego lodu:
Wyliczymy teraz ciepło topnienia lodu L. Posłużymy się wzorem:
Obliczymy teraz niepewność wyliczonej wartości. Znając niepewności maksymalne (podane na
pierwszej stronie)
1
, skorzystamy z proponowanego w instrukcji wzoru, który przyjmie postać:
Z obliczeń uzyskujemy: τ = 266,57 J/kg.
Temperaturę początkową i końcową wody w kalorymetrze wyznaczono metodą ekstrapolacji (por.
wykres, str. 4)
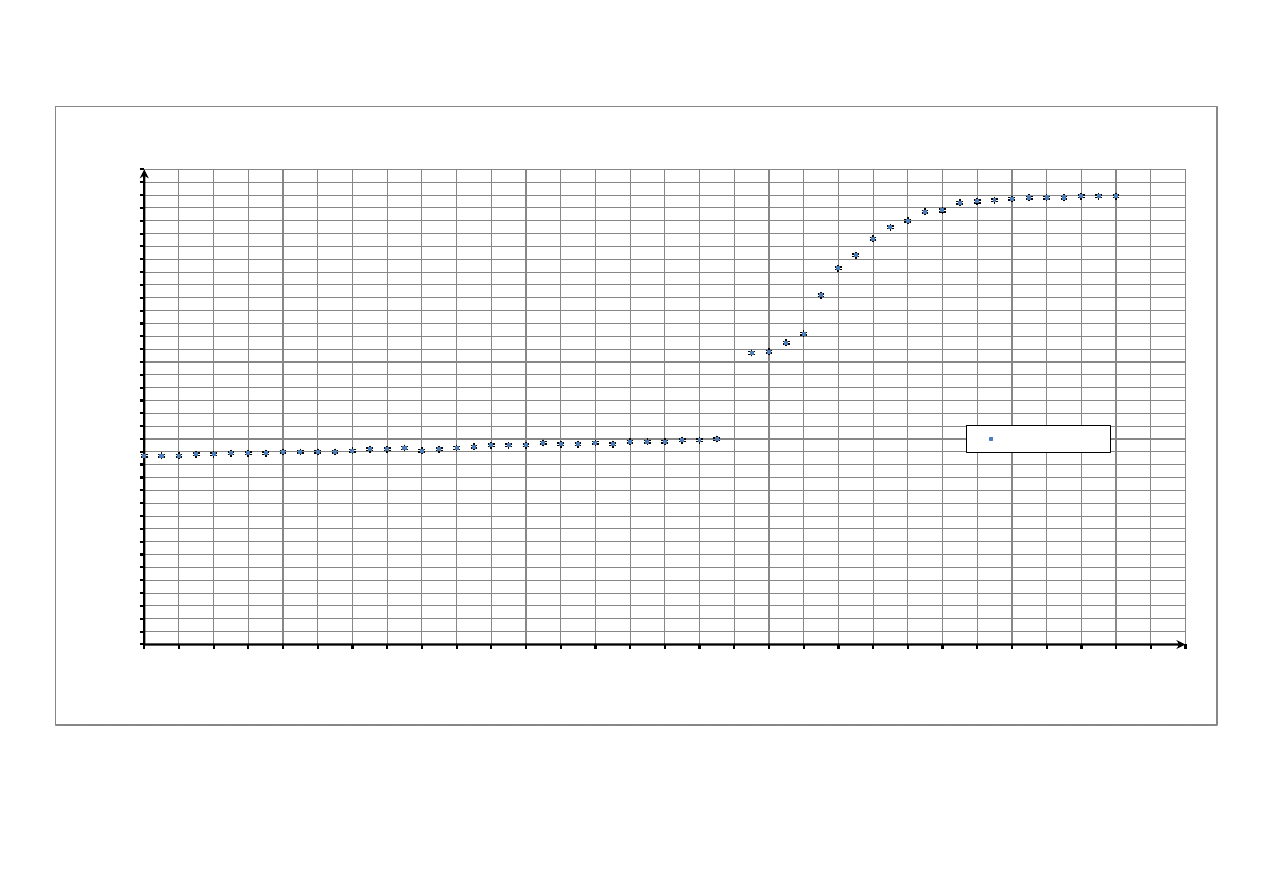
Następnie wykonujemy wykres zmian temperatury w funkcji czasu dla drugiej części doświadczenia.
Niepewność pomiaru są takie same dla jak na pierwszym wykresie i podobnie jak tam nie można
zaznaczyć niepewności pomiaru czasu.
1
Przyjmujemy, że niepewność maksymalna jest w tym przypadku równa niepewności pomiaru.
6
0,0
1,0
2,0
3,0
4,0
5,0
6,0
7,0
8,0
9,0
10,0
11,0
12,0
13,0
14,0
15,0
16,0
17,0
18,0
19,0
20,0
21,0
22,0
23,0
24,0
25,0
26,0
27,0
28,0
29,0
30,0
31,0
32,0
33,0
34,0
35,0
36,0
37,0
0
60
120 180 240 300 360 420 480 540 600 660 720 780 840 900 960 1020 1080 1140 1200 1260 1320 1380 1440 1500 1560 1620 1680 1740 1800
te
m
p
e
ratu
ra/
°C
czas/s
Zmiana temperatury w funkcji czasu
temperatura/°C

7
Wyliczymy teraz ciepło skraplania pary wodnej R. Posłużymy się wzorem:
Obliczymy teraz niepewność wyliczonej wartości. Znając niepewności maksymalne (podane na
pierwszej stronie), skorzystamy z proponowanego w instrukcji wzoru. Otrzymujemy:
WNIOSKI:
Celem ćwiczenia było m.in. zmierzenie ciepła topnienia lodu. Pomiary dały wynik
.
Wartość ciepła topnienia podawana w tablicach fizycznych wynosi 340000 J/kg. Błąd bezwzględny
wyniku to 35282,3 J/kg co jest spora wartością, lecz jako błąd względny daje ostatecznie ok. 10 %.
Wyliczona niepewność wynosi 266,57 J/kg.
Na wykresie „topnienia” widać, ze charakterystyka jest "zaokrąglona", nie ma tam kątów ostrych
(teoretycznie - bez uwzględniania warunków praktycznych pomiaru powinny być ostre). Wynika to z
bezwładności cieplnej wszystkich elementów biorących udział praktycznie w wymianie ciepła, więc:
kalorymetr, woda, termometr, mieszadełko kalorymetru, powietrze w kalorymetrze i poza nim, stół na
którym stał kalorymetr. Największy wpływ na zaokrąglenie charakterystyki miały czynniki bezpośrednio
stykające się z lodem.
Pomiar ciepła topnienia lodu był pośredni (nie można zmierzyć tego bezpośrednio - należy wyliczyć
ze wzoru). W związku z tym, ze wzór był dość rozbudowany i składał się z wielu zmiennych. Na błąd
pomiaru wpływało wiele czynników takich jak :
dokładność pomiaru mas (kalorymetru, kalorymetru z woda, kolorymetru z woda i lodem)
dokładność pomiaru temperatury w rożnych chwilach
Generalnie na błędy najbardziej wpłynął pomiar temperatury.
Dodatkowo niedokładności mogły być związane z wymiana ciepła miedzy kalorymetrem, a
powietrzem (niedokładne odizolowanie wewnętrznego naczynia kalorymetru od zewnętrznego). Pewna
wymianę ciepła z otoczeniem dawał także termometr i mieszadełko kalorymetru. Poza tym, podczas
gotowania wody zauważyłem, że duża część ciepła ogrzewała dość silnie osłonę kalorymetru.
Wyznaczone ciepło skraplania pary wodnej wyniosło 1462568,74 J/kg. Wyliczona niepewność
wynosi 3962,67 J/kg. Wartość tablicowa to 2260000 J/kg. Błąd bezwzględny tego wyniku to 7974,31 J/kg.
Jako błąd względny daje on ostatecznie ok. 55%, co moim zdaniem jest wartością nie do przyjęcia. Myślę,
że na taki wynik miały wpływ czynniki takie jak dokładność pomiaru temperatury w różnych chwilach.
Poza tym, podobnie jak wcześniej niedokładności mogły być związane z wymiana ciepła miedzy
kalorymetrem, a powietrzem.
Wyszukiwarka
Podobne podstrony:
SPRI(27)
Prezentacje, Spostrzeganie ludzi 27 11
27 407 pol ed02 2005
2012 02 27, ćwiczenie 1 0001
Materiały do wykładu 4 (27 10 2011)
BTI AWAX 26 27 45
53 Prostownik 27 150
ei 03 2002 s 27
Prz 3 w 27 DROGA GOŚCINNOŚCI
09 1993 27 32
4 27 Life coaching
27 Pigalle
27 28 Polimery NOWE
egzamin 2 termin 27 06 2005 id Nieznany
28 rozdzial 27 vmxgkzibmm3xcof4 Nieznany (2)
27 letni żołnierz USA skazany za zamordowanie więźniów (30 03 2009)
DGP 2014 06 27 prawnik
więcej podobnych podstron