
R
E
OD
ROZWI
Ą
EGZA
D ROK
PO
ĄZANIA
AMIN
KU SZ
C
ZIOM
A ZADA
(A1,
G
N MA
ZKOL
CHEM
M ROZ
A
ē I SCH
, A2, A3,
GRUDZIE
ē
ATUR
NEGO
MIA
SZERZ
HEMAT
, A4, A7
ē 2013
RALN
O 2014
ZONY
TY PUNK
7)
NY
4/2015
Y
KTOWA
5
ANIA
pobrano z www.sqlmedia.pl

Zadanie 1. (0–2)
Wymagania ogólne
Wymagania szczegó
áowe
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
3. Wi
ązania chemiczne. Zdający:
3.5) rozpoznaje typ hybrydyzacji (sp, sp
2
, sp
3
) w prostych
cz
ąsteczkach związków nieorganicznych […];
3.6) okre
Ğla typ wiązania (ı i ʌ) w prostych cząsteczkach.
a) (0–1)
Poprawna odpowied
Ĩ:
Wzór sumaryczny: CO
2
Typ hybrydyzacji: sp
Budowa przestrzenna: liniowa
Schemat punktowania:
1 pkt –
poprawne zidentyfikowanie i podanie wzoru sumarycznego zwi
ązku zbudowanego
z pierwiastków X i Z, poprawne okre
Ğlenie typu hybrydyzacji atomu pierwiastka
X (w
Ċgla) oraz poprawne okreĞlenie budowy przestrzennej związku (CO
2
)
0 pkt –
inna odpowied
Ĩ lub brak odpowiedzi
b) (0–1)
Poprawna odpowied
Ĩ:
Liczba wi
ązaĔ typu ı – 2
Liczba wi
ązaĔ typu
S – 2
Schemat punktowania:
1 pkt – poprawne okre
Ğlenie liczby wiązaĔ typu ı i typu
S przy poprawnym
zidentyfikowaniu zwi
ązku
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 2. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
1. Atomy, cz
ąsteczki i stechiometria chemiczna. Zdający:
1.5) dokonuje interpretacji […] ilo
Ğciowej równania reakcji
w uj
Ċciu molowym […];
5. Roztwory i reakcje zachodz
ące w roztworach wodnych.
Zdaj
ący:
5.2) wykonuje obliczenia […] z zastosowaniem poj
Ċcia
st
ĊĪenie procentowe […].
Przyk
áad poprawnego rozwiązania:
Z równa
Ĕ reakcji wynika, Īe stosunek molowy NaOH do CuO wynosi 2 : 1
M
NaOH
= 40 g · mol
1
M
CuO
= 80 g · mol
1
Masa wodorotlenku sodu, który wzi
ąá udziaá w reakcji
x
NaOH
g
80
=
CuO
g
10
CuO
g
80
x =
m
NaOH
= 10 g
pobrano z www.sqlmedia.pl

St
ĊĪenie procentowe roztworu wodorotlenku sodu
c
p
=
r
s
m
m
· 100% =
r
s
V
d
m
· 100%
c
p
=
3
3
cm
41
cm
g
22
,
1
g
10
· 100%
c
p
= 20%
St
ĊĪenie procentowe roztworu wodorotlenku sodu wynosiáo 20%.
Schemat punktowania:
2 pkt – zastosowanie poprawnej metody obliczenia, poprawne wykonanie oblicze
Ĕ, podanie
wyniku w procentach
1 pkt – zastosowanie poprawnej metody obliczenia i
– pope
ánienie báĊdów rachunkowych prowadzących do báĊdnego wyniku liczbowego
– b
áąd w zaokrągleniu wyników
– niepodanie wyniku w procentach
0 pkt – zastosowanie b
áĊdnej metody obliczenia lub brak rozwiązania
Zadanie 3. (0–1)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
6. Reakcje utleniania i redukcji. Zdaj
ący:
6.5) stosuje zasady bilansu elektronowego – dobiera
wspó
áczynniki stechiometryczne w równaniach reakcji
utleniania-redukcji (w formie cz
ąsteczkowej […]);
1. Atomy, cz
ąsteczki i stechiometria chemiczna. Zdający:
1.5. dokonuje interpretacji […] ilo
Ğciowej równania reakcji
w uj
Ċciu […] masowym […].
Poprawna odpowied
Ĩ:
3
CO + Fe
2
O
3
o
3
CO
2
+
2
Fe
Podanie stosunku masowego:
m
utl.
: m
red.
= 40 : 21
lub
80 : 42
lub
160:84
Schemat punktowania:
1 pkt – poprawny dobór wspó
áczynników i poprawne ustalenie stosunku masowego
utleniacza do reduktora
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 4. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.8) klasyfikuje substancje do kwasów lub zasad zgodnie
z teori
ą Brønsteda-Lowry’ego.
Poprawna odpowied
Ĩ:
C.
Schemat punktowania:
1 pkt – poprawne wskazanie zasady
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 5. (0–1)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.3) stosuje poj
Ċcia: egzoenergetyczny, endoenergetyczny,
[…] do opisu efektów energetycznych przemian;
4.4) interpretuje zapis
'+i'H>0 do okreĞlenia efektu
energetycznego reakcji;
4.7) stosuje regu
áĊ przekory do jakoĞciowego okreĞlenia
wp
áywu zmian temperatury […] na ukáad pozostający
w stanie równowagi dynamicznej.
Poprawna odpowied
Ĩ:
Reakcja zachodz
ąca w ukáadzie I (
wymaga
/nie wymaga) dostarczenia energii, poniewa
Ī jest
procesem (egzoenergetycznym/
endoenergetycznym
).
Ogrzanie w warunkach izobarycznych uk
áadu II, który osiągnąá stan równowagi, spowoduje
(wzrost/
spadek
) wydajno
Ğci otrzymywania amoniaku.
Schemat punktowania:
1 pkt – poprawne uzupe
ánienie obu zdaĔ
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 6. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.6) projektuje […] do
Ğwiadczenie, którego wynik pozwoli
porówna
ü aktywnoĞü chemiczną metali […].
Przyk
áad poprawnej odpowiedzi:
Probówka I:
Niebieski
roztwór
odbarwia
á siĊ
lub
p
áytka pokrywaáa siĊ
czerwonobrunatnym nalotem.
Probówka II:
Nie zaobserwowano zmian.
Probówka III:
Niebieski roztwór zmienia
á barwĊ na zielonkawą
lub
p
áytka pokrywaáa siĊ
czerwonobrunatnym nalotem.
Schemat punktowania:
1 pkt – poprawne okre
Ğlenie co najmniej jednego objawu reakcji w probówce I i III
i zaznaczenie braku objawów reakcji w probówce II
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 7. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.5) przewiduje kierunek przebiegu reakcji metali z […]
roztworami soli, na podstawie danych zawartych w szeregu
napi
Ċciowym metali.
Poprawna odpowied
Ĩ:
Probówka IV:
Zn + 2Ag
+
ĺ Zn
2+
+ 2Ag
Probówka V:
Fe + 2Ag
+
ĺ Fe
2+
+ 2Ag
Probówka VI:
Cu + 2Ag
+
ĺ Cu
2+
+ 2Ag
pobrano z www.sqlmedia.pl

Schemat punktowania:
1 pkt – poprawne napisanie równa
Ĕ reakcji zachodzących w probówkach IV–VI
0 pkt – b
áĊdne zapisanie równaĔ reakcji (báĊdne wzory reagentów, báĊdne wspóáczynniki
stechiometryczne, niew
áaĞciwa forma zapisu) lub brak odpowiedzi
Zadanie 8. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.5) przewiduje kierunek przebiegu reakcji metali z […]
roztworami soli, na podstawie danych zawartych w szeregu
napi
Ċciowym metali.
Poprawna odpowied
Ĩ:
Nazwa lub symbol metalu, z którego wykonano p
áytkĊ, zwiĊkszającą swoją masĊ w obu
do
Ğwiadczeniach:
Īelazo
lub
Fe
Schemat punktowania:
1 pkt – poprawne podanie nazwy lub symbolu metalu
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 9. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
1. Atomy, cz
ąsteczki i stechiometria chemiczna. Zdający:
1.5) dokonuje interpretacji jako
Ğciowej i iloĞciowej równania
reakcji w uj
Ċciu molowym, masowym […];
1.6) wykonuje obliczenia z uwzgl
Ċdnieniem […] mola
dotycz
ące: mas substratów i produktów (stechiometria […]
równa
Ĕ chemicznych), objĊtoĞci gazów w warunkach
normalnych.
Przyk
áad poprawnego rozwiązania:
Z równa
Ĕ reakcji wynika, Īe w reakcji 1 mola glinu z kwasem wydziela siĊ 1,5 mola wodoru,
a w reakcji 1 mola magnezu z kwasem wydziela si
Ċ 1 mol wodoru.
1
3
3
H
mol
dm
4
,
22
dm
85
,
11
n
2
= 0,53 mol
x – liczba moli Al w stopie y – liczba moli Mg w stopie
x · 27 g + y · 24 g = 10 g
1,5 x + y = 0,53
y = 0,53 – 1,5 x
27 x + 24 (0,53 – 1,5 x) = 10
x = 0,30 mol Al
m
Al
= 27 g · mol
1
· 0,30 mol
m
Al
= 8,1 g
%
Al
=
g
10
g
1
,
8
· 100% =
81%
%
Mg
= 100% – 81% =
19%
Stop zawiera
81% masowych glinu i 19% masowych magnezu.
pobrano z www.sqlmedia.pl

Schemat punktowania:
2 pkt – zastosowanie poprawnej metody obliczenia, poprawne wykonanie oblicze
Ĕ, podanie
wyniku w procentach
1 pkt – zastosowanie poprawnej metody i:
– pope
ánienie báĊdów rachunkowych prowadzących do báĊdnego wyniku liczbowego
– b
áąd w zaokrągleniu wyników
– niepodanie wyniku w procentach
0 pkt – zastosowanie b
áĊdnej metody obliczenia lub brak rozwiązania
Zadanie 10. (0–2)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.10) porównuje moc elektrolitów na podstawie warto
Ğci ich
sta
áych dysocjacji.
8. Niemetale. Zdaj
ący:
8.6) przedstawia i uzasadnia zmiany mocy kwasów […].
Przyk
áad poprawnej odpowiedzi:
Poprawne uzupe
ánienie tabeli
Symbol
pierwiastka
Promie
Ĕ
atomu,
pm
Wzór
kwasu
Sta
áa
dysocjacji
K
a1
Symbol
pierwiastka
Promie
Ĕ
atomu,
pm
Wzór
kwasu
Sta
áa
dysocjacji
K
a
F
58
HF
6,3 · 10
4
S
104
H
2
S
1,0 · 10
7
Cl
99
HCl
1,0 · 10
7
Se
117
H
2
Se
1,9 · 10
4
Br
114
HBr
3,0 · 10
9
Te
137
H
2
Te
2,5 · 10
3
I
133
HI
1,0 · 10
10
Wybrany czynnik i jego wp
áyw na moc kwasów beztlenowych pierwiastków poáoĪonych
w tej samej grupie:
Promie
Ĕ atomu. Moc kwasów beztlenowych wzrasta ze wzrostem promienia atomu
po
áączonego z atomem wodoru.
Wybrany czynnik i jego wp
áyw na moc kwasów beztlenowych pierwiastków poáoĪonych
w tym samym okresie:
Elektroujemno
Ğü. Moc kwasów beztlenowych wzrasta ze wzrostem elektroujemnoĞci
atomu po
áączonego z atomem wodoru.
Schemat punktowania:
2 pkt – poprawne uzupe
ánienie tabeli, poprawne wskazanie i okreĞlenie wpáywu wybranego
czynnika na moc kwasów w obu przypadkach
1 pkt – – poprawne uzupe
ánienie tabeli, poprawne wskazanie i okreĞlenie wpáywu
wybranego czynnika na moc kwasów w jednym przypadku
– b
áĊdne uzupeánienie tabeli lub brak uzupeánienia i poprawne wskazanie
i okre
Ğlenie wpáywu wybranego czynnika na moc kwasów w obu przypadkach
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl
Zadanie 11. (0–1)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.7) stosuje regu
áĊ przekory do jakoĞciowego okreĞlenia
wp
áywu zmian […] stĊĪenia reagentów […] na ukáad
pozostaj
ący w stanie równowagi dynamicznej;
4.9) interpretuje warto
Ğci staáej dysocjacji, pH […].
5. Roztwory i reakcje zachodz
ące w roztworach wodnych.
Zdaj
ący:
5.6) stosuje termin stopie
Ĕ dysocjacji dla iloĞciowego opisu
zjawiska dysocjacji elektrolitycznej.
Poprawna odpowied
Ĩ:
A.2.
Schemat punktowania:
1 pkt. – poprawne wskazanie wniosku i uzasadnienia
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 12. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.9) interpretuje warto
Ğci staáej dysocjacji, pH […].
5. Roztwory i reakcje zachodz
ące w roztworach wodnych.
Zdaj
ący:
5.6) stosuje termin stopie
Ĕ dysocjacji dla iloĞciowego opisu
zjawiska dysocjacji elektrolitycznej.
Przyk
áad poprawnego rozwiązania:
Obliczenie st
ĊĪenia jonów wodorowych w roztworze HF:
HF
қ
H
+
+ F
í
K
=
Į
2
·
c
0
, poniewa
Ī
Į
5%
0
[H ]
c
D
c
0
= D
]
H
[
2
]
H
[
D
D
K
K
= [H
+
] ·
D [H
+
] = D
K
[H
+
] =
03
,
0
10
3
,
6
4
0,021 czyli 0,21 ·10
–1
Wyznaczenie pH roztworu z karty wybranych wzorów i sta
áych fizykochemicznych (tablicy
warto
Ğci logarytmów):
pH = –log 0,21 ·10
–1
pH = –log10
–1
+ (–log 0,21)
pH = 1 – (– 0,678)
pH = 1,68
Schemat punktowania:
2 pkt – poprawna metoda obliczenia pH roztworu, wykonanie oblicze
Ĕ i podanie wyniku
z w
áaĞciwą dokáadnoĞcią
1 pkt – poprawna metoda obliczenia i pope
ánienie báĊdów rachunkowych lub podanie
wyniku z b
áĊdną dokáadnoĞcią
0 pkt – b
áĊdna metoda obliczenia lub brak rozwiązania
pobrano z www.sqlmedia.pl

Zadanie 13. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.4) […] planuje […] do
Ğwiadczenie, którego przebieg
pozwoli wykaza
ü, Īe […] wodorotlenek glinu wykazuje
charakter amfoteryczny.
Poprawna odpowied
Ĩ:
D.
Schemat punktowania:
1 pkt – poprawne wskazanie wniosku
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 14. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.7) przewiduje produkty redukcji zwi
ązków manganu(VII)
w zale
ĪnoĞci od Ğrodowiska […].
Przyk
áad poprawnej odpowiedzi:
Probówka I:
H
2
SO
4
(aq)
+ NaNO
2
(aq)
lub
(wodny roztwór)
kwasu siarkowego(VI) +
(wodny roztwór)
azotanu(III) sodu
Probówka II:
NaOH
(aq)
+ NaNO
2
(aq) lub (wodny roztwór)
wodorotlenku sodu +
(wodny
roztwór)
azotanu(III) sodu
Probówka III:
NaNO
2
(aq) lub (wodny roztwór)
azotanu(III) sodu
Schemat punktowania:
1 pkt – poprawny dobór odczynników w ka
Īdej z probówek i uzupeánienie schematu
do
Ğwiadczenia
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 15. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.7) przewiduje produkty redukcji zwi
ązków manganu(VII)
w zale
ĪnoĞci od Ğrodowiska […].
Przyk
áad poprawnej odpowiedzi:
Probówka II:
Roztwór zmieni
á barwĊ z fioletowej na zieloną.
Probówka III:
Wytr
ąciá siĊ brunatny osad.
Schemat punktowania:
1 pkt – poprawne okre
Ğlenie objawów reakcji w dwóch probówkach przy poprawnym
doborze odczynników w zadaniu 14.
0 pkt – b
áĊdne okreĞlenie objawów reakcji w jednej lub dwóch probówkach lub brak
odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 16. (0–3)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.7) przewiduje produkty redukcji zwi
ązków manganu(VII)
w zale
ĪnoĞci od Ğrodowiska […] bilansuje odpowiednie
równania reakcji.
a) (0–1)
Poprawna odpowied
Ĩ:
Probówka I:
Mn
2+
Probówka II:
2
4
MnO
Schemat punktowania:
1 pkt – poprawne napisanie wzorów jonów powstaj
ących w probówkach I i II
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
b)
(0–2)
Poprawna odpowied
Ĩ:
Równanie procesu redukcji:
4
2
2
MnO
2H O
3e
MnO
4OH
o
Równanie procesu utlenienia:
2
3
2
NO
2OH
NO
H O
2e
o
Schemat punktowania:
2 pkt – poprawne napisanie w formie jonowo-elektronowej obu równa
Ĕ
1 pkt – poprawne napisanie w formie jonowo-elektronowej tylko jednego równania
0 pkt – – b
áĊdne napisanie obu równaĔ (báĊdne wzory reagentów, báĊdne wspóáczynniki
stechiometryczne, niew
áaĞciwa forma zapisu)
– odwrotne przypisanie równa
Ĕ procesom utleniania i redukcji
– brak odpowiedzi
Zadanie 17 (0–1)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
7. Metale. Zdaj
ący:
7.7) przewiduje produkty redukcji zwi
ązków manganu(VII)
w zale
ĪnoĞci od Ğrodowiska […].
Poprawna odpowied
Ĩ:
Manganian(VII) potasu posiada najsilniejsze w
áaĞciwoĞci utleniające w Ğrodowisku
(oboj
Ċtnym / zasadowym / kwasowym), a najsáabsze w Ğrodowisku (obojĊtnym / zasadowym
/ kwasowym).
Schemat punktowania:
1 pkt – poprawne uzupe
ánienie zdania
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 18. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
I. Pozyskiwanie,
przetwarzanie i tworzenie
informacji
III etap edukacyjny
7. Sole. Zdaj
ący:
7.5) […] projektuje […] do
Ğwiadczenie pozwalające
otrzyma
ü sole w reakcjach strąceniowych […].
Przyk
áad poprawnej odpowiedzi:
Numer do
Ğwiadczenia: II
Wyja
Ğnienie: Jeden z u
Īytych reagentów w projekcie doĞwiadczenia I i III jest
nierozpuszczalny w wodzie i nie dostarcza jonów potrzebnych do zaj
Ğcia reakcji
str
ąceniowej.
Schemat punktowania:
1 pkt – poprawne wskazanie numeru do
Ğwiadczenia i poprawne wyjaĞnienie
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 19. (0–2)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
8. Niemetale. Zdaj
ący:
8.7) projektuje […] do
Ğwiadczenia pozwalające otrzymaü
tlen w laboratorium (np. reakcja rozk
áadu […] KMnO
4
);
zapisuje odpowiednie równania reakcji.
a)
(0–1)
Poprawna odpowied
Ĩ:
2KMnO
4
ĺ K
2
MnO
4
+ MnO
2
+ O
2
(
n
)
Schemat punktowania:
1 pkt – poprawne napisanie równania reakcji
0 pkt – b
áĊdne napisanie równania (báĊdne wzory reagentów, báĊdne wspóáczynniki
stechiometryczne, niew
áaĞciwa forma zapisu) lub brak odpowiedzi
b)
(0–1)
Poprawna odpowied
Ĩ:
lub
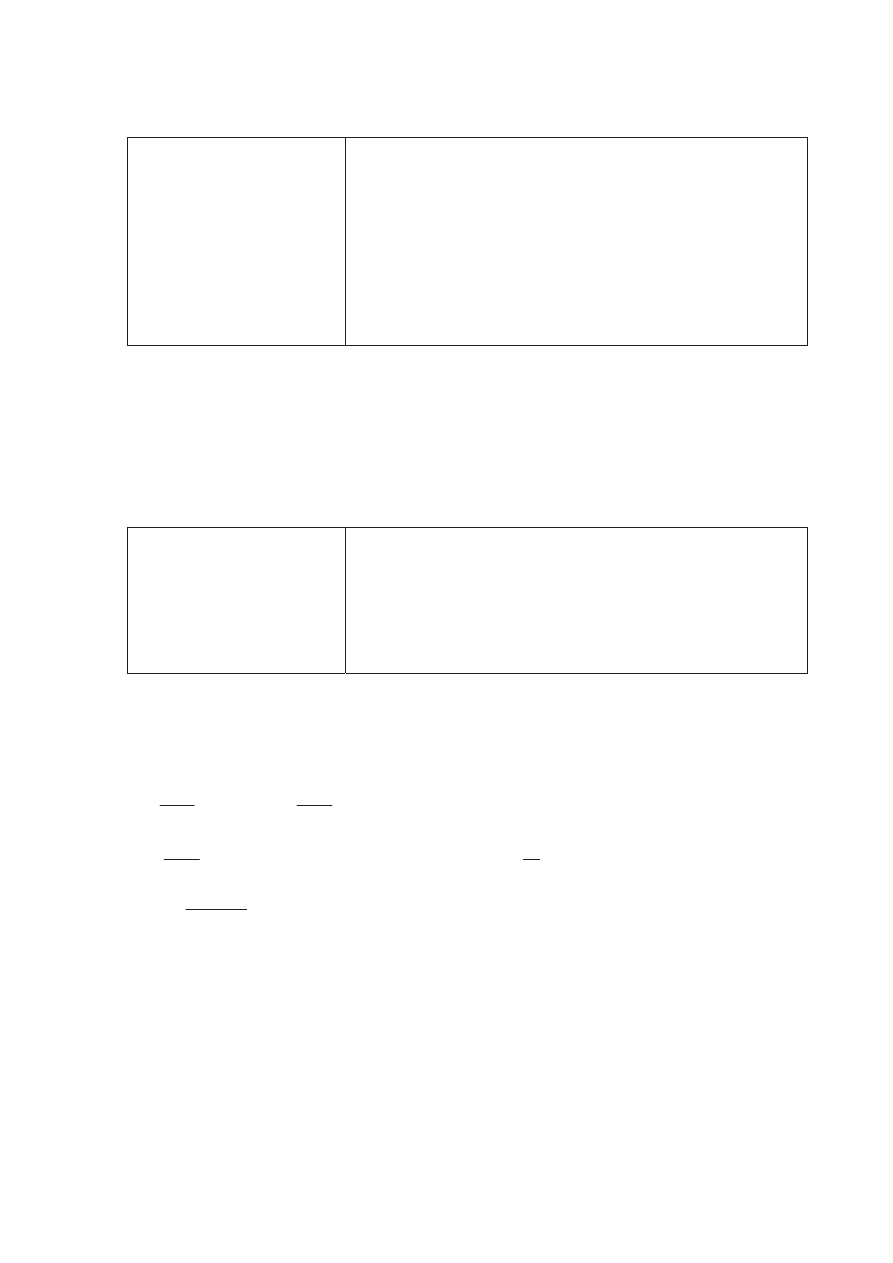
Schemat punktowania:
1 pkt – poprawny rysunek zestawu do
Ğwiadczalnego
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 20. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
5. Roztwory i reakcje zachodz
ące w roztworach. Zdający:
5.7) przewiduje odczyn roztworu po reakcji np. ([…]
wodorotlenku sodu z kwasem solnym), substancji
zmieszanych w ilo
Ğciach stechiometrycznych
i niestechiometrycznych.
Przyk
áad poprawnej odpowiedzi:
Hipoteza jest (poprawna / b
áĊdna).
Odczyn roztworu b
Ċdzie kwasowy.
Uzasadnienie: Liczba moli kwasu nie jest taka sama jak liczba moli zasady i w roztworze
znajduj
ą siĊ kationy wodorowe pochodzące z dysocjacji nadmiaru kwasu.
Schemat punktowania:
2 pkt – poprawna ocena i okre
Ğlenie odczynu oraz poprawne uzasadnienie
1 pkt – poprawna ocena i okre
Ğlenie odczynu oraz báĊdne uzasadnienie
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 21. (0–3)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny (poziom podstawowy)
2. Chemia
Ğrodków czystoĞci. Zdający:
2.2) […] bada wp
áyw twardoĞci wody na powstawanie
zwi
ązków trudno rozpuszczalnych […].
Poprawna odpowied
Ĩ:
Etap I: 2
3
HCO + Fe
2+
o FeCO
3
(
Ļ) + CO
2
+ H
2
O
Etap II: FeCO
3
+ H
2
O
o Fe(OH)
2
+ CO
2
Etap III: 4Fe(OH)
2
+ O
2
+ 2H
2
O
o 4Fe(OH)
3
Schemat punktowania:
3 pkt – poprawne napisanie trzech równa
Ĕ reakcji
2 pkt – poprawne napisanie dwóch równa
Ĕ reakcji
1 pkt – poprawne napisanie jednego równania reakcji
0 pkt – b
áĊdne napisanie trzech równaĔ reakcji (báĊdne wzory reagentów, báĊdne
wspó
áczynniki stechiometryczne, niewáaĞciwa forma zapisu) lub brak odpowiedzi
Zadanie 22. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
5. Roztwory i reakcje zachodz
ące w roztworach. Zdający:
5.8) uzasadnia (ilustruj
ąc równaniami reakcji) przyczynĊ […]
odczynu niektórych roztworów soli (hydroliza);
5.9) […] bada odczyn roztworu;
5.10) pisze równania reakcji […] hydrolizy soli w formie
[…] jonowej ([…] skróconej).
pobrano z www.sqlmedia.pl

Poprawna odpowied
Ĩ:
Barwa papierka
wska
Ĩnikowego
Równanie reakcji w formie jonowej skróconej
Probówka I
niebieski lub zielony,
lub niebieskozielony
C
6
H
5
O
–
+ H
2
O
қ
C
6
H
5
OH + OH
–
Probówka II czerwony lub ró
Īowy
Zn
2+
+ H
2
O
қ
ZnOH
+
+ H
+
lub
Zn
2+
+ 2H
2
O
қ
ZnOH
+
+ H
3
O
+
lub
Zn
2+
+ 2H
2
O
қ
Zn(OH)
2
+ 2H
+
lub
Zn
2+
+ 4H
2
O
қ
Zn(OH)
2
+ 2H
3
O
+
Schemat punktowania:
2 pkt – poprawne uzupe
ánienie obu wierszy tabeli
1 pkt – poprawne uzupe
ánienie jednego wiersza tabeli
0 pkt – b
áĊdne uzupeánienie obu wierszy tabeli lub brak odpowiedzi
Zadanie 23. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
9. W
Ċglowodory. Zdający:
9.4) […] wykazuje si
Ċ rozumieniem pojĊü: […] izomeria.
9.9) planuje ci
ąg przemian […].
10. Hydroksylowe pochodne w
Ċglowodorów – alkohole
i fenole. Zdaj
ący:
10.1) […] wskazuje wzory alkoholi pierwszo-, drugo-
i trzeciorz
Ċdowych.
Poprawna odpowied
Ĩ:
Zdanie
P/F
1.
Organiczny substrat reakcji oznaczonej numerem 2 ma takie same w
áaĞciwoĞci
fizyczne i chemiczne, jak organiczny substrat reakcji oznaczonej numerem 4.
F
2.
Zwi
ązki A i B są alkoholami o tej samej rzĊdowoĞci.
F
3.
Aldehyd i keton, które powsta
áy w wyniku opisanych przemian są wzglĊdem
siebie izomerami.
P
Schemat punktowania:
1 pkt – poprawna ocena prawdziwo
Ğci trzech zdaĔ
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 24. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
9. W
Ċglowodory. Zdający:
9.11) wyja
Ğnia na prostych przykáadach mechanizmy reakcji
[…].
Poprawna odpowied
Ĩ:
Typ reakcji: substytucja
Mechanizm reakcji: rodnikowy
Schemat punktowania:
1 pkt – poprawne okre
Ğlenie typu i mechanizmu reakcji
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 25. (0–2)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
13. Estry i t
áuszcze. Zdający:
13.10)
zapisuje […] odpowiednie równania reakcji wi
ąĪące
ze sob
ą wáaĞciwoĞci poznanych wĊglowodorów i ich
pochodnych.
11. Zwi
ązki karbonylowe – aldehydy i ketony. Zdający:
11.3) pisze równania reakcji utleniania alkoholu […]
drugorz
Ċdowego, np. tlenkiem miedzi(II).
Poprawna odpowied
Ĩ:
3: CH
3
CH(OH)CH
3
+ CuO
o
(T)
CH
3
COCH
3
+ Cu + H
2
O
4: CH
3
CH
2
CH
2
Cl + KOH
o
2
(H O)
CH
3
CH
2
CH
2
OH + KCl
Schemat punktowania:
2 pkt – poprawne napisanie dwóch równa
Ĕ reakcji
1 pkt – poprawne napisanie jednego równania reakcji
0 pkt – b
áĊdne napisanie obu równaĔ reakcji (báĊdne wzory reagentów, báĊdne
wspó
áczynniki stechiometryczne, niewáaĞciwa forma zapisu) lub brak odpowiedzi
Zadanie 26. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
9. W
Ċglowodory. Zdający:
4)
pos
áuguje siĊ poprawną nomenklaturą wĊglowodorów […]
i ich fluorowcopochodnych […].
11. Zwi
ązki karbonylowe – aldehydy i ketony. Zdający:
11.2) […] tworzy nazwy systematyczne prostych aldehydów
[…].
Poprawna odpowied
Ĩ:
a) 2-chloropropan
b) propanal
Schemat punktowania:
1 pkt – poprawne napisanie dwóch nazw systematycznych
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Zadanie 27. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
11. Zwi
ązki karbonylowe – aldehydy i ketony. Zdający:
11.5) planuje […] do
Ğwiadczenie, którego celem jest
odró
Īnienie aldehydu od ketonu […].
Przyk
áad poprawnej odpowiedzi:
Opisana próba pozwala na odró
Īnienie ketonu od aldehydu, poniewaĪ w otrzymanym
aldehydzie nie wyst
Ċpuje grupa acetylowa CH
3
CO–.
Schemat punktowania:
1 pkt – poprawne okre
Ğlenie wpáywu podstawnika
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 28. (0–1)
I. Wykorzystanie
i tworzenie informacji.
IV etap edukacyjny
10. Hydroksylowe pochodne w
Ċglowodorów – alkohole
i fenole. Zdaj
ący:
10.4) porównuje w
áaĞciwoĞci fizyczne i chemiczne: etanolu,
glikolu etylenowego i glicerolu […].
Poprawna odpowied
Ĩ:
C.
Schemat punktowania:
1 pkt – poprawne wskazanie wzoru zwi
ązku
0 pkt – inna odpowied
Ĩ lub brak uzupeánienia
Zadanie 29. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.6) wykazuje si
Ċ znajomoĞcią i rozumieniem pojĊü: stan
równowagi dynamicznej i sta
áa równowagi […].
Przyk
áad poprawnego rozwiązania:
Reakcja przebiega w fazie ciek
áej, bez zmiany objĊtoĞci, dlatego w wyraĪeniu na staáą
równowagi mo
Īna uĪyü liczbĊ moli reagentów.
x – liczba moli estru i wody w stanie równowagi
(2 – x) – liczba moli alkoholu w stanie równowagi
(1,25 – x) – liczba moli kwasu w stanie równowagi
2
C
x
(2 x)(1, 25 x)
K
)
x
25
,
1
)(
x
2
(
x
4
2
' = 49
ҧ
x
1
= 1,
x
2
= 3,33 (w zwi
ązku z iloĞcią reagentów w stanie początkowym – wartoĞü fizycznie nie jest
mo
Īliwa)
Powsta
á 1 mol etanianu etylu (octanu etylu).
pobrano z www.sqlmedia.pl
Schemat punktowania:
2 pkt – zastosowanie poprawnej metody rozwi
ązania, poprawne wykonanie obliczeĔ
i podanie liczby moli estru
1 pkt – – zastosowanie poprawnej metody rozwi
ązania, poprawne wykonanie obliczeĔ
i podanie obu wyliczonych warto
Ğci liczby moli estru
– zastosowanie poprawnej metody rozwi
ązania i popeánienie báĊdów przy wykonaniu
oblicze
Ĕ oraz podanie jednej wáaĞciwej wartoĞci liczby moli estru
0 pkt – b
áĊdna metoda lub brak rozwiązania
Zadanie 30. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
9. W
Ċglowodory. Zdający:
9.4) […] wykazuje si
Ċ rozumieniem pojĊü: […] izomeria.
Poprawna odpowied
Ĩ:
Ocena i uzasadnienie stanowiska:
Na podstawie podanych informacji nie mo
Īna jednoznacznie ustaliü wzoru
pó
ástrukturalnego triglicerydu, poniewaĪ wystĊpuje zjawisko izomerii. Istnieje wiĊcej
ni
Ī jeden wzór związku, w którym speániona jest zaleĪnoĞü podana w zadaniu.
Wzory:
CH
2
CH
CH
2
O
O
O
C
C
C
O
O
C
15
H
31
C
17
H
35
C
17
H
35
O
CH
2
CH
CH
2
O
O
O
C
C
C
O
O
C
17
H
35
C
15
H
31
C
17
H
35
O
Schemat punktowania:
2 pkt – poprawna ocena wraz z uzasadnieniem stanowiska i napisanie odpowiednich wzorów
1 pkt – poprawna ocena wraz z uzasadnieniem stanowiska i brak odpowiednich przyk
áadów
0 pkt – inna odpowied
Ĩ, np. podanie wyáącznie przykáadów bez oceny i uzasadnienia
stanowiska lub brak odpowiedzi
Zadanie 31. (0–2)
I. Wykorzystanie
i tworzenie informacji.
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
9. W
Ċglowodory. Zdający:
9.5) rysuje wzory […] izomerów optycznych […].
1. Atomy, cz
ąsteczki i stechiometria chemiczna. Zdający:
1.5) dokonuje interpretacji […] ilo
Ğciowej […] w ujĊciu
molowym […].
pobrano z www.sqlmedia.pl

a)
(0–1)
Poprawna odpowied
Ĩ:
Enancjomer D Enancjomer L
Schemat punktowania:
1 pkt – poprawny uzupe
ánienie obu schematów
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
b)
(0–1)
Poprawna odpowied
Ĩ:
Stosunek molowy: n
kwasu jab
ákowego
: n
NaOH
= 1 : 2
Uzasadnienie:
W cz
ąsteczce kwasu znajdują siĊ dwie grupy karboksylowe, które mogą reagowaü
z roztworem wodorotlenku sodu, a grupa hydroksylowa takiej reakcji nie ulega.
Schemat punktowania:
1 pkt. – poprawne okre
Ğlenie stosunku molowego i poprawne uzasadnienie
0 pkt – – poprawne okre
Ğlenie stosunku molowego i báĊdne uzasadnienie
– b
áĊdne okreĞlenie stosunku molowego i báĊdne uzasadnienie
– inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 32. (0–4)
I. Wykorzystanie
i tworzenie informacji.
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
14. Zwi
ązki organiczne zawierające azot. Zdający:
14.11) opisuje w
áaĞciwoĞci kwasowo-zasadowe
aminokwasów […].
4. Kinetyka i statyka chemiczna. Zdaj
ący:
4.10) porównuje moc elektrolitów […].
4.8) klasyfikuje substancje do kwasów lub zasad zgodnie
z teori
ą Brønsteda-Lowryƍego.
a)
(0–1)
Poprawna odpowied
Ĩ:
Wzór formy A
Wzór formy C
Schemat punktowania:
1 pkt – poprawne napisanie wzorów form A i C
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
C
COOH
CH
2
COOH
H
OH
C
COOH
CH
2
COOH
HO
H
CH
3
CH
NH
3
+
COOH
CH
3
CH
NH
2
COO
pobrano z www.sqlmedia.pl
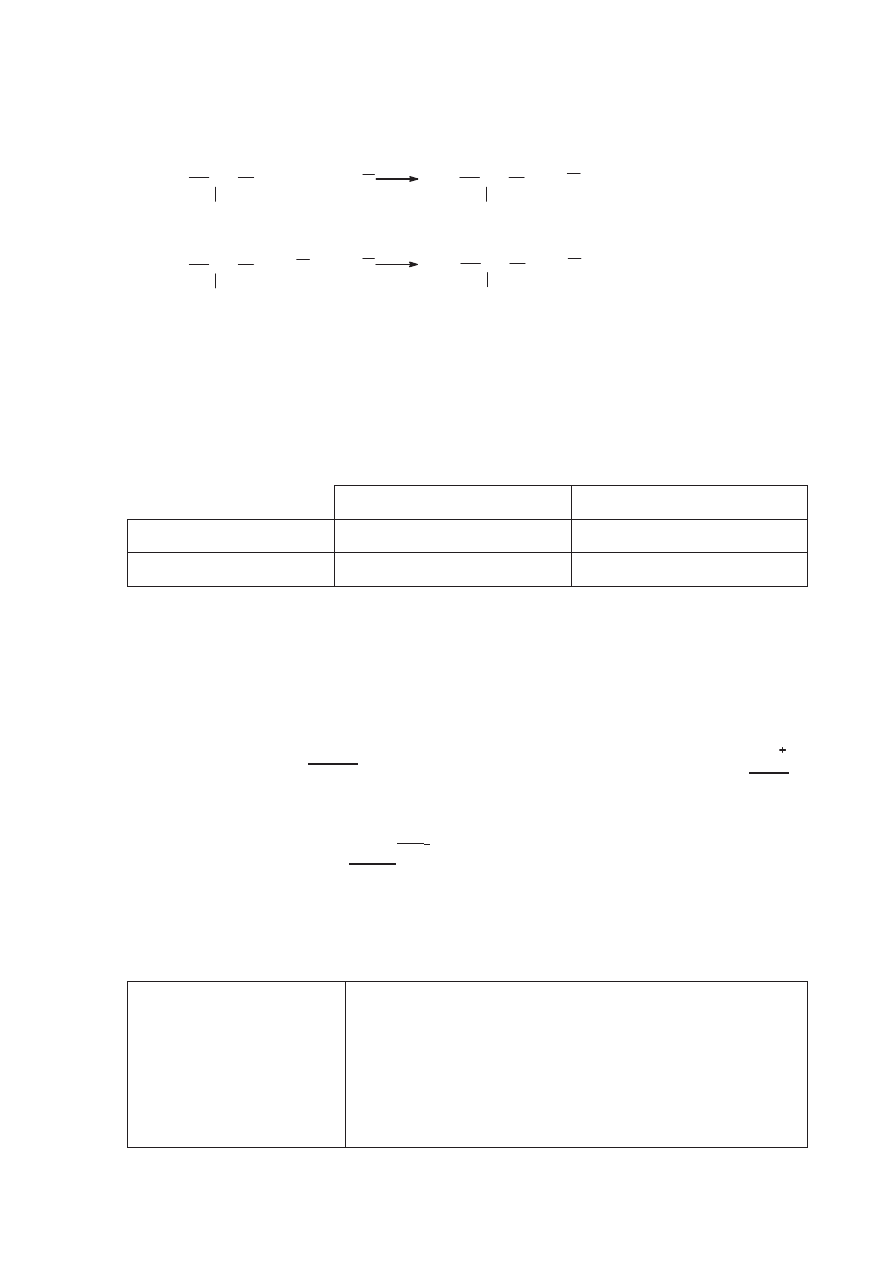
b)
(0–1)
Poprawna odpowied
Ĩ:
Schemat punktowania:
1 pkt – poprawne napisanie we w
áaĞciwej kolejnoĞci obu równaĔ reakcji
0 pkt – b
áĊdne napisanie równaĔ (báĊdne wzory reagentów, báĊdne wspóáczynniki
stechiometryczne, niew
áaĞciwa forma zapisu, niewáaĞciwa kolejnoĞü równaĔ) lub
brak odpowiedzi
c)
(0–1)
Poprawna odpowied
Ĩ:
Kwas
Zasada
Sprz
ĊĪona para I
A
B
Sprz
ĊĪona para II
B
C
Schemat punktowania:
1 pkt – poprawne uzupe
ánienie tabeli (kolejnoĞü sprzĊĪonych par moĪe byü dowolna)
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
d)
(0–1)
Poprawna odpowied
Ĩ:
1.
W
áaĞciwoĞci alaniny w wodnym roztworze o pH równym pI uwarunkowane są zasadowym
charakterem grupy ( –COO
–
/
–COOH ) i kwasowym charakterem grupy ( –NH
2
/
–
3
NH
).
2.
Poniewa
Ī grupa –COOH ma silniejsze wáaĞciwoĞci kwasowe niĪ grupa –
3
NH
, podczas
zakwaszania roztworu alaniny o odczynie zasadowym najpierw nast
ąpi przyáączenie
protonu do grupy ( –COO
–
/ –NH
2
), a dopiero przy wi
Ċkszym stĊĪeniu jonów
wodorowych – do grupy ( –COO
–
/ –NH
2
).
Schemat punktowania:
1 pkt – poprawne uzupe
ánienie obu zdaĔ
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
Zadanie 33. (0–2)
I. Wykorzystanie
i tworzenie informacji.
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
III etap edukacyjny
5. Woda i roztwory wodne. Zdaj
ący:
5.5) […] oblicza ilo
Ğü substancji, którą moĪna rozpuĞciü
w okre
Ğlonej iloĞci wody w podanej temperaturze.
IV etap edukacyjny
1. Atomy, cz
ąsteczki, stechiometria chemiczna. Zdający:
1.6) wykonuje obliczenia z uwzgl
Ċdnieniem […] mola
dotycz
ące: mas […].
CH
3
CH
NH
3
+
COOH
OH
+
+
CH
3
CH
NH
3
+
COO
H
2
O
1.
OH
+
CH
3
CH
NH
3
+
COO
2.
CH
3
CH
NH
2
COO
+ H
2
O
pobrano z www.sqlmedia.pl

Przyk
áad poprawnego rozwiązania:
Obliczenie masy metanu i chlorometanu, które rozpu
Ğciáy siĊ w wodzie na podstawie
odczytanych warto
Ğci rozpuszczalnoĞci:
100 g wody – 0,0023 g metanu i 0,92 g chlorometanu
1000 g wody – 0,023 g metanu i 9,2 g chlorometanu
Obliczenie pocz
ątkowej masy metanu (x
1
) i pocz
ątkowej masy chlorometanu (x
2
):
x
1
= 24,0 + 0,023 = 24,023 g
x
2
= 41,3 +9,2 = 50,5 g
Obliczenie stosunku obj
ĊtoĞciowego gazów:
0
V
n
V
i
m
n
M
1
1
2
2
n
V
n
V
n
1
=
mola
5
,
1
mol
g
16
g
023
,
24
1
n
2
=
mol
0
,
1
mol
g
5
,
50
g
5
,
50
1
V
1
:
V
2
= 1,5 : 1,0
lub
V
1
:
V
2
= 3 : 2
2 pkt – poprawna metoda obliczenia stosunku obj
ĊtoĞci gazów, wykonanie obliczeĔ
i podanie wyniku
1 pkt – poprawna metoda obliczenia stosunku obj
ĊtoĞci gazów i popeánienie báĊdów
rachunkowych
0 pkt – b
áĊdna metoda obliczenia lub brak rozwiązania
Zadanie 34. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
16. Cukry. Zdaj
ący:
16.7) wyja
Ğnia […], dlaczego sacharoza nie wykazuje
w
áaĞciwoĞci redukujących.
Poprawna odpowied
Ĩ:
sacharoza
Schemat punktowania:
1 pkt – poprawne podanie nazwy substancji znajduj
ącej siĊ w naczyniu B
0 pkt – inna odpowied
Ĩ lub brak rozwiązania
Zadanie 35. (0–1)
III. Opanowanie czynno
Ğci
praktycznych.
16. Cukry. Zdaj
ący:
16.5) opisuje w
áaĞciwoĞci glukozy i fruktozy; wskazuje
na podobie
Ĕstwa […];
16.7) wyja
Ğnia […], dlaczego sacharoza nie wykazuje
w
áaĞciwoĞci redukujących.
Poprawna odpowied
Ĩ:
Zaobserwowano powstanie ceglastoczerwonego osadu.
Schemat punktowania:
1 pkt – poprawne opisanie obserwacji
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl
Zadanie 36. (0–3)
III. Opanowanie czynno
Ğci
praktycznych.
IV etap edukacyjny
16. Cukry. Zdaj
ący:
16.5) planuje […] do
Ğwiadczenie pozwalające na odróĪnienie
glukozy i fruktozy.
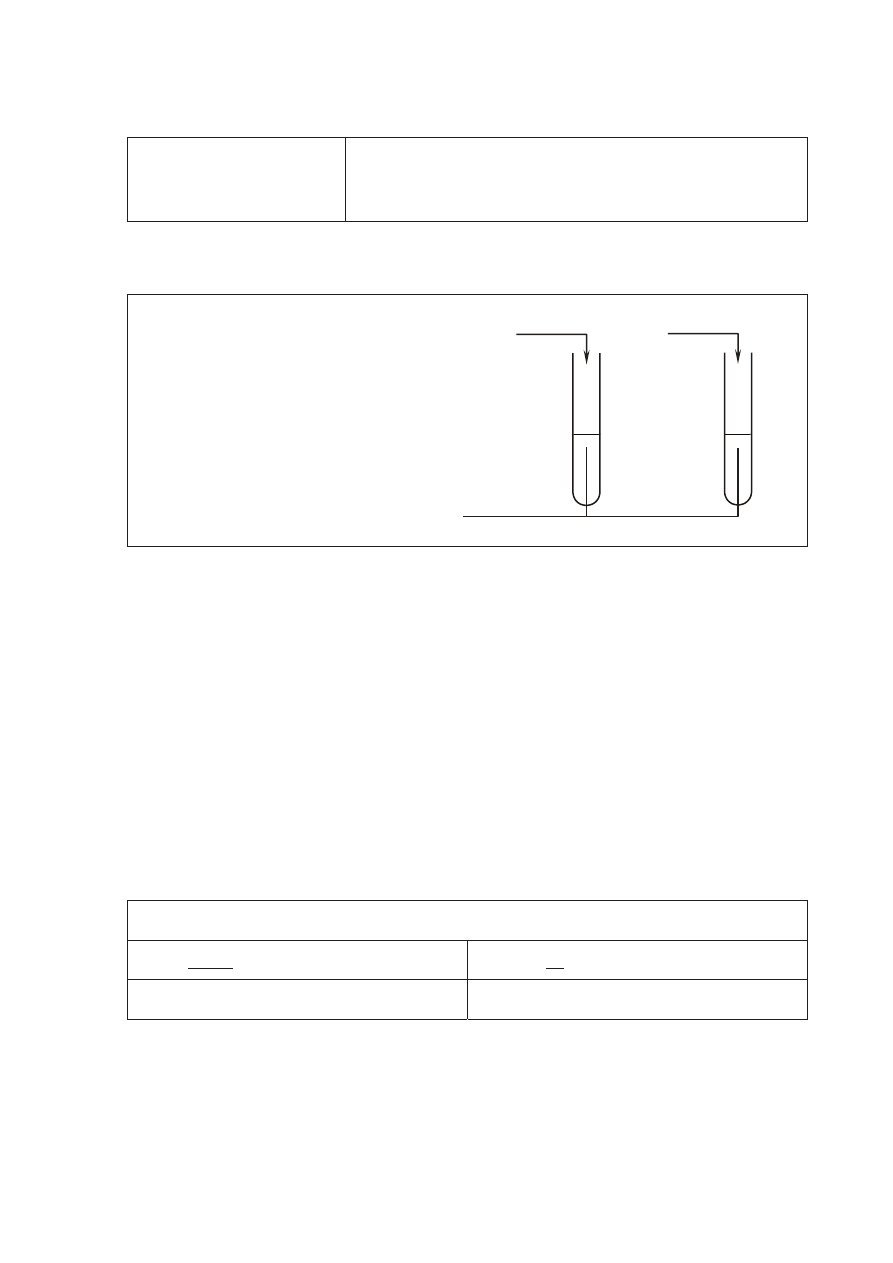
a)
(0–1)
Poprawna odpowied
Ĩ:
Schemat do
Ğwiadczenia:
Odczynnik:
woda bromowa z dodatkiem wodnego
roztworu wodorow
Ċglanu sodu
Schemat punktowania:
1 pkt – poprawny wybór odczynnika i uzupe
ánienie schematu doĞwiadczenia
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
b)
(0–1)
Poprawna odpowied
Ĩ:
Naczynie A: glukoza
Naczynie C: fruktoza
Schemat punktowania:
1 pkt – poprawna identyfikacja i podanie nazw substancji przy poprawnym wyborze
odczynnika w cz
ĊĞci a) zadania
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
c)
(0–1)
Poprawna odpowied
Ĩ:
Barwa zawarto
Ğci probówki I
przed zmieszaniem reagentów
po zmieszaniu reagentów
pomara
Ĕczowa lub brunatna, lub Īóáta
brak barwy
lub bezbarwna
Schemat punktowania:
1 pkt – poprawny opis zmian, które zaobserwowano, przy poprawnym wyborze odczynnika
w cz
ĊĞci a) zadania i przy poprawnym przyporządkowaniu substancji w czĊĞci b)
zadania
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
I
II
roztwór z naczynia A
roztwór z naczynia C
pobrano z www.sqlmedia.pl

Zadanie 37. (0–2)
II. Rozumowanie
i zastosowanie nabytej
wiedzy do rozwi
ązywania
problemów.
IV etap edukacyjny
15. Bia
áka. Zdający:
15.1) opisuje budow
Ċ biaáek […];
15.2) opisuje struktur
Ċ drugorzĊdową biaáek (Į- i ȕ-) […]
wyja
Ğnia stabilizacjĊ tej struktury przez grupy R-, zawarte
w resztach aminokwasów (wi
ązania jonowe, mostki
disiarczkowe, wi
ązania wodorowe […].
Poprawna odpowied
Ĩ:
a)
I (mostki) disiarczkowe lub disulfidowe
II (wi
ązanie) peptydowe
III (wi
ązania) wodorowe
b)
Za struktur
Ċ pierwszorzĊdową biaáka odpowiadają wiązania oznaczone numerem II
O strukturze, która jest okre
Ğlana jako struktura
D lub E decydują wiązania oznaczone
numerem III. Wi
ązanie oznaczone numerem I jest jednym z wiązaĔ stabilizujących strukturĊ
trzeciorz
Ċdową. StrukturĊ tĊ stabilizują równieĪ wiązania jonowe wystĊpujące pomiĊdzy
resztami aminokwasowymi.
Schemat punktowania:
2 pkt – poprawne okre
Ğlenie nazw wiązaĔ w czĊĞci a) zadania oraz poprawne uzupeánienie
zda
Ĕ w czĊĞci b) zadania
1 pkt – – poprawne okre
Ğlenie nazw wiązaĔ w czĊĞci a) zadania oraz báĊdne uzupeánienie
zda
Ĕ w czĊĞci b) zadania
– b
áĊdne okreĞlenie nazw wiązaĔ w czĊĞci a) zadania oraz poprawne uzupeánienie
zda
Ĕ w czĊĞci b) zadania
0 pkt – inna odpowied
Ĩ lub brak odpowiedzi
pobrano z www.sqlmedia.pl

Ogólne zasady oceniania
Zdaj
ący otrzymuje punkty za rozwiązania, w których zostaáa pokonana zasadnicza
trudno
Ğü rozwiązania zadania.
Rozwi
ązania zadaĔ, uwzglĊdniające inny tok rozumowania niĪ podany w schemacie
oceniania, oceniane s
ą zgodnie z ogólnymi zasadami punktacji.
x
Zdaj
ący otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające
poleceniom zawartym w zadaniach.
x
Gdy do jednego polecenia zdaj
ący podaje kilka odpowiedzi, (z których jedna jest
prawid
áowa, inne nieprawidáowe), nie otrzymuje punktów za Īadną z nich.
x
Rozwi
ązanie zadania otrzymane na podstawie báĊdnego merytorycznie zaáoĪenia, uznaje
si
Ċ w caáoĞci za niepoprawne.
x
Rozwi
ązania zadaĔ doĞwiadczalnych (spostrzeĪenia i wnioski) oceniane są wyáącznie
wtedy, gdy projekt do
Ğwiadczenia jest poprawny, czyli np. prawidáowo zostaáy dobrane
odczynniki. Je
Īeli polecenie brzmi: Zaprojektuj doĞwiadczenie …., to w odpowiedzi
zdaj
ący powinien wybraü wáaĞciwy odczynnik z zaproponowanej listy i wykonaü kolejne
polecenia.
Za
spostrze
Īenia i wnioski bĊdące konsekwencją niewáaĞciwie
zaprojektowanego do
Ğwiadczenia (np. báĊdnego wyboru odczynnika) zdający nie
otrzymuje punktów.
x
W rozwi
ązaniach zadaĔ rachunkowych oceniane są: metoda (przedstawiony tok
rozumowania), wykonanie oblicze
Ĕ i podanie wyniku z jednostką i odpowiednią
dok
áadnoĞcią. JeĞli w obliczeniach cząstkowych podawane są jednostki, to w kaĪdym
etapie musz
ą byü poprawne.
x
Wynik liczbowy wielko
Ğci mianowanej podany bez jednostek lub z niepoprawnym
ich zapisem jest b
áĊdny.
Uwaga: nale
Īy zwróciü uwagĊ na zaleĪnoĞü wartoĞci wyniku koĔcowego od
ewentualnych wcze
Ğniejszych zaokrągleĔ. Wszystkie wyniki, które są konsekwencją
przyj
Ċtych przez zdającego poprawnych zaokrągleĔ są poprawne.
x
Je
Īeli zamieszczone w odpowiedzi informacje (równieĪ dodatkowe, które nie wynikają
z tre
Ğci polecenia) Ğwiadczą o zasadniczych brakach w rozumieniu omawianego
zagadnienia i zaprzeczaj
ą udzielonej prawidáowej odpowiedzi, to za odpowiedĨ taką
zdaj
ący otrzymuje 0 punktów.
x
Je
Īeli polecenie brzmi: Napisz równanie reakcji w formie …., to w odpowiedzi zdający
powinien napisa
ü równanie reakcji w podanej formie z uwzglĊdnieniem bilansu masy
i
áadunku.
Notacja:
x
Za napisanie wzorów strukturalnych zamiast wzorów pó
ástrukturalnych (grupowych lub
uproszczonych) nie odejmuje si
Ċ punktów.
x
Zapis „
Ĺ”, „Ļ” w równaniach reakcji nie jest wymagany.
x
W równaniach reakcji, w których ustala si
Ċ stan równowagi, brak „
ҙ
” nie powoduje
utraty punktów. Je
Ğli reakcja jest nieodwracalna, zapis „
ҙ
” w równaniu reakcji powoduje
utrat
Ċ punktów.
pobrano z www.sqlmedia.pl
Wyszukiwarka
Podobne podstrony:
chm roz gru 13
chm roz mar 13 zamkor odp
chm pod czerw 13 odp
chm roz czerw 14 odp
fiz cwiczenia 13 odp
fiz-cwiczenia 13-odp
Test 13 odp
chm pod czerw 13
Springer, Lewy mózg, prawy mózg, roz 10, 13
Merry Gentry 07 roz 12 13
chm roz maj 06
TPL WYK 13 02 11?rozole
niemiecki roz odp
francuski roz odp
więcej podobnych podstron