POLSKIE WWW
ŚWIATOWE WWW
Układ okresowy
Powłoki
Obliczenia
Definicje
Linki do tematu
Chemia organiczna
Chemia ogólna
POWRÓT
Izomeria związków organicznych
Tutaj możesz kliknąć
Rodzaje izomerii
Izomeria strukturalna
izomeria łańcuchowa
izomeria położenia
izomeria z różnymi podstawnikami w cząsteczce
Stereoizomeria
izomeria geometryczna
izomeria optyczna
enacjomery
diastereoizomery
izomery konformacyjne
Rodzaje izomerii
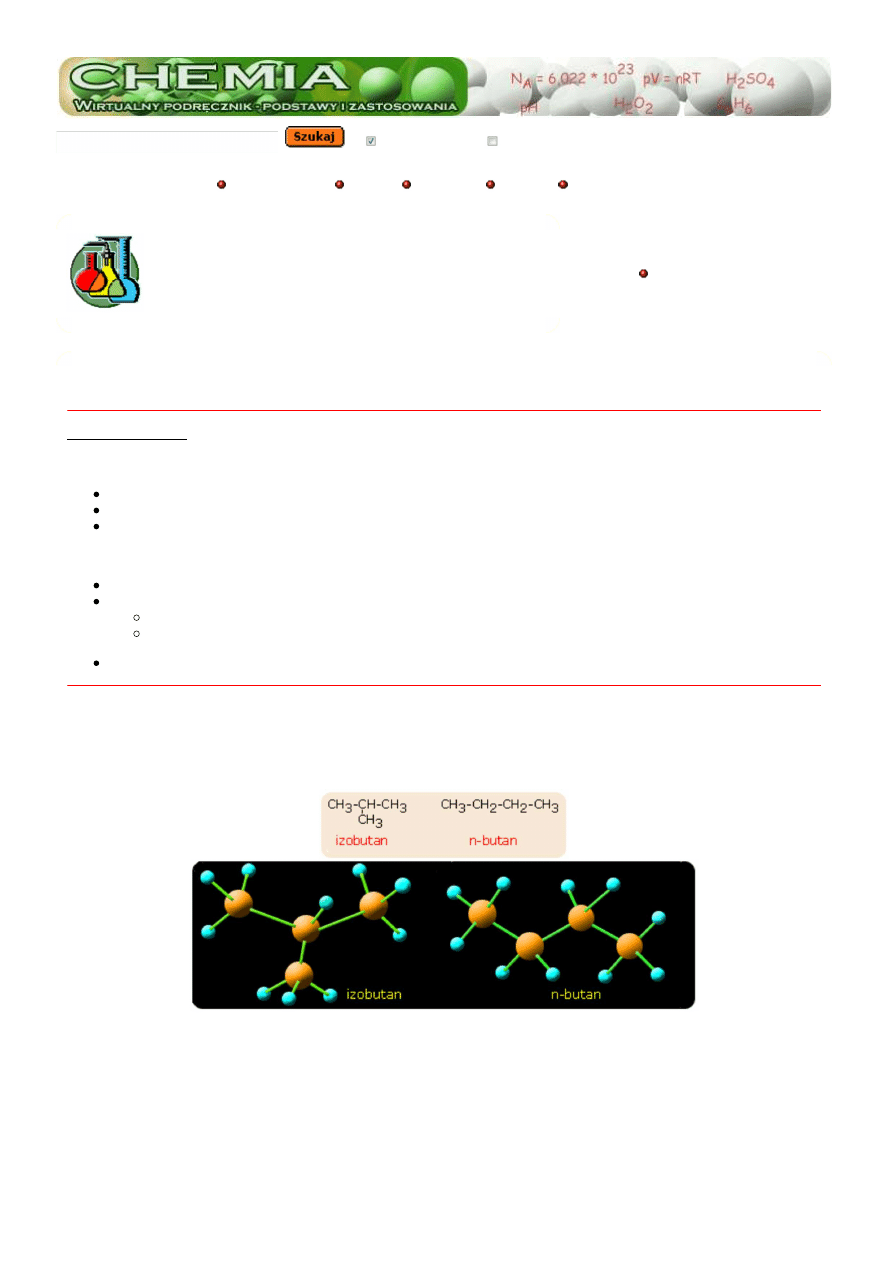
Pierwsze możliwe przestrzenne rozmieszczenie atomów węgla w cząsteczce występuje gdy cząsteczka zawiera 4 atomy węgla
(C
4
H
10
). W takiej cząsteczce są możliwe dwa sposoby połączenia atomów węgla w cząsteczce: w postaci łańcucha n-butanu i
w postaci rozgałęzionej, czyli metylopropanu (izobutan).
Na przedstawionym modelu widzimy, że cząsteczki zawierają taką samą liczbę atomów tego samego pierwiastka, lecz atomy te
są połączone z sobą w inny sposób. Innym przykładem jest związek chemiczny o wzorze sumarycznym - C
5
H
12
. Związek
chemiczny o takim wzorze może posiadać trzy odmiany strukturalne. Takie związki różniące się przestrzennym rozmieszczeniem
atomów nazywa się
izomerami
.
Rodzaje izomerii występujące w związkach organicznych przedstawia poniższy schemat.
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
1 z 7
2012-01-22 22:11

Wyróżnia się izomerię
strukturalną
steroeoizomeria (przestrzenna)
Izomeria strukturalna
Izomeria strukturalna
- polega na występowaniu związków izomerycznych, w których atomy tych samych pierwiastków są ze
sobą połączone w różnej kolejności
W odniesieniu do węglowodorów i ich pochodnych wyrózniamy izomerię
izomerię łańcuchową
, gdzie atomy węgla mogą przyjmować różne ułóżenia w łańcuchu
izomerię położenia
, gdzie mamy do czynienia z różnym położeniem wiązań nienasyconych oraz różnym położeniem
podstawników w cząsteczce
izomerię z różnymi podstawnikami w cząsteczce
Izomeria łańcuchowa
W cząsteczkach węglowodorów począwszy od butanu atomy węgla mogą przyjmować różne ułożenia w łąńcuchu
C
4
H
10
Ze wzrostem liczby atomów węgla szybko wzrasta ilość izomerów.
C
5
H
12
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
2 z 7
2012-01-22 22:11

Dla cząsteczki posiadającej 10 atomów węgla izomerów jest 75, dla 20 atomów węgla - 366319, dla 30 atomów węgla - 411109
izomerów.
Nazwa
Wzór
sumaryczny
Wzór
półstrukturalny
Ilość
izomerów
Nazwa
Wzór
sumaryczny
Wzór
półstrukturalny
Ilość
izomerów
Metan
CH
4
CH
4
1
Heksan
C
6
H
14
CH
3
(CH
2
)
4
CH
3
5
Etan
C
2
H
6
CH
3
CH
3
1
Heptan
C
7
H
16
CH
3
(CH
2
)
5
CH
3
9
Propan
C
3
H
8
CH
3
CH
2
CH
3
1
Oktan
C
8
H
18
CH
3
(CH
2
)
6
CH
3
18
Butan
C
4
H
10
CH
3
CH
2
CH
2
CH
3
2
Nonan
C
9
H
20
CH
3
(CH
2
)
7
CH
3
35
Pentan
C
5
H
12
CH
3
(CH
2
)
3
CH
3
3
Dekan
C
10
H
22
CH
3
(CH
2
)
8
CH
3
75
Izomeria położenia
Izomeria położenia dotyczy położenia podstawnika lub wiązania wielokrotnego w cząsteczce.
Przykłady:
C
3
H
7
-Cl
1-chloropropan
CH
3
-CH
2
-CH
2
-Cl
2-chloropropan
CH
3
-CHCl-CH
3
C
5
H
10
Izomeria z różnymi podstawnikami w cząsteczce
Stereoizomeria
Stereoizomeria
- to szczególny rodzaj izomerii, gdzie atomy połączone są między sobą w identycznej kolejności ale różnią się
sposobem rozmieszczenia atomów w przestrzeni. Wyróżniamy tutaj następujące rodzaje izomerii;
izomeria geometryczna
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
3 z 7
2012-01-22 22:11
izomeria optyczna
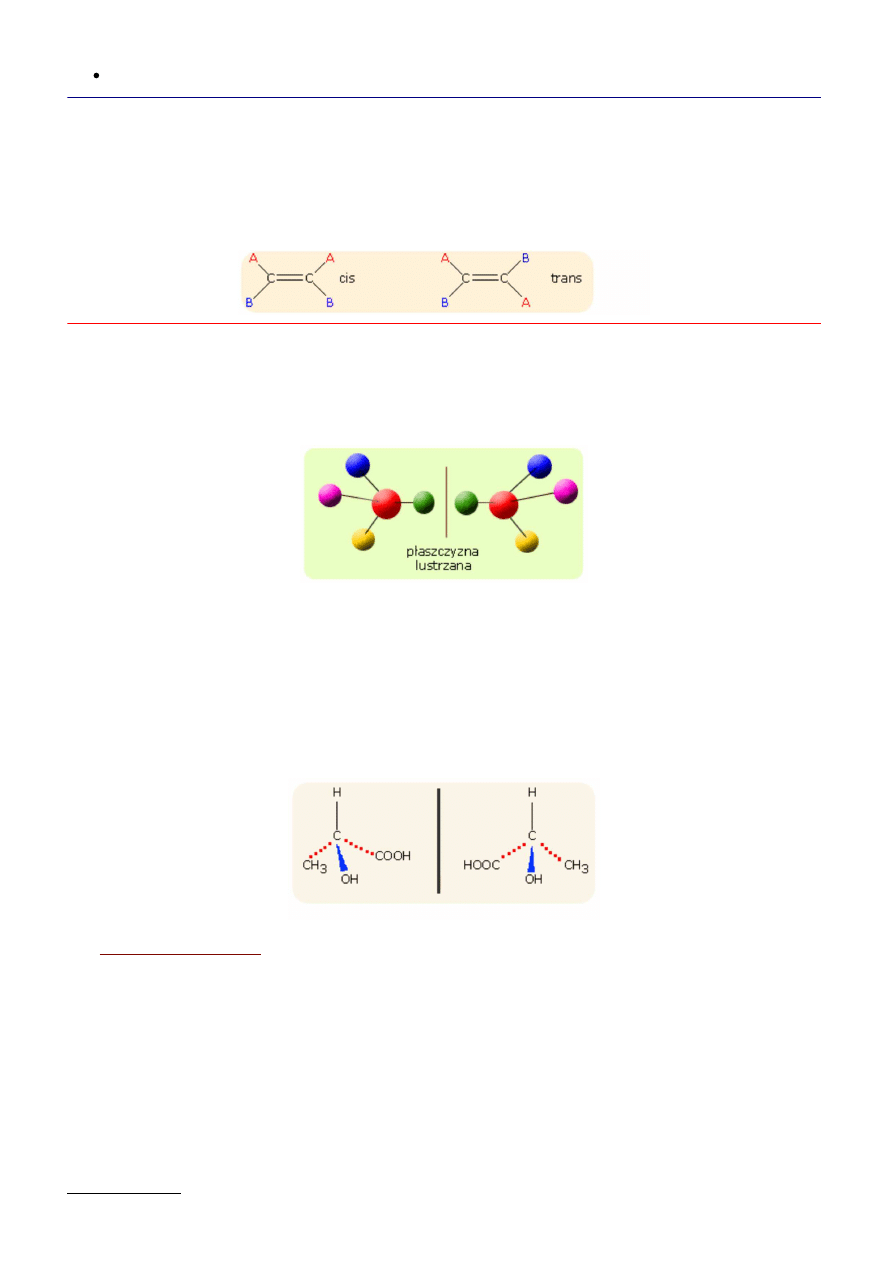
Izomeria geometryczna
Ten typ izomerii występuje wówczas, gdy w układzie przestrzennym cząsteczki zaznacza się określona płaszczyzna.
Jeżeli wyróżnione grupy cząsteczki leżą po tej samej stronie płaszczyzny mamy do czynienia z izomerem cis a jeżeli po
przeciwnych stronach z izomerem trans.
Konfigurację izomerów geometrycznych rozróżnia się za pomocą nazw, które zawierają przedrostek cis- lub -trans, co wskazuje
na usytuowanie grup po tej samej lub po przeciwnej stronie cząsteczki. Patrz rysunek
Izomeria optyczna
Jest to rodzaj stereoizomerii występującej w cząsteczkach chiralnych, które zawierają atom węgla, do którego przyłączone są
cztery różne grupy. Taki atom nosi nazwę centrum chiralności.
A to oznacza, że dla każdej cząsteczki posiadającej centrum chiralności możemy znalezć drugą cząsteczkę będącą jej lustrzanym
odbiciem
Izomeria optyczna wiąże się ze zdolnością skręcania płaszczyzny światła spolaryzowanego. Substancje takie nazywa się
optycznie czynnymi; skręcające płaszczyznę światła spolaryzowanego w prawo - nazywa się prawoskrętnymi /+/, a skręcajace
w lewo -lewoskrętnymi /-/.
Związki skręcające płaszczyznę światła w prawo zaznacza się za pomocą symbolu (+) przed nazwą związku,
skręcające w lewwo symbolem (-). Na przykład - (+) - glukoza, (-) - fruktoza
Izomery bedące wzajemnymi odbiciami lustrzanymi noszą nazwę enacjomerów
Przykład - kwas mlekowy
Właściwości enancjomerów
1. Enancjomery mają identyczne właściwości fizyczne z wyjątkiem kierunku skręcania płaszczyzny polaryzacji światła
2. Enancjomery wykazują identyczne właściwości chemiczne; wyjątkiem jest ich zachowanie się w stosunku do
optycznie czynnych reagentów. Oznacza to, że jeżeli reagent jest optycznie czynny, jego wpływ na oba enancjomery
nie jest identyczny podczas ataku i dlatego szybkość reakcji jest różna - w niektórych przypadkach tak dalece różna,
że reakcja z jednym izomerem w ogóle nie zachodzi.
Równocząsteczkowa mieszanina enacjomerów nie wykazuje optycznej czynności i nosi nazwę mieszaniny recemicznej
Odmiana racemiczna jest optycznie nieczynna. Jest wynikiem równoważenia skręcalności cząsteczki jednego izomeru
przez skręcalność cząsteczki drugiego izomeru.
W celu zaznaczenia racemicznego charakteru określonej próbki stosuje się znak (+/-), jak na przykład kwas
(+/-)-mlekowy.
Konfiguracja D- i L-
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
4 z 7
2012-01-22 22:11
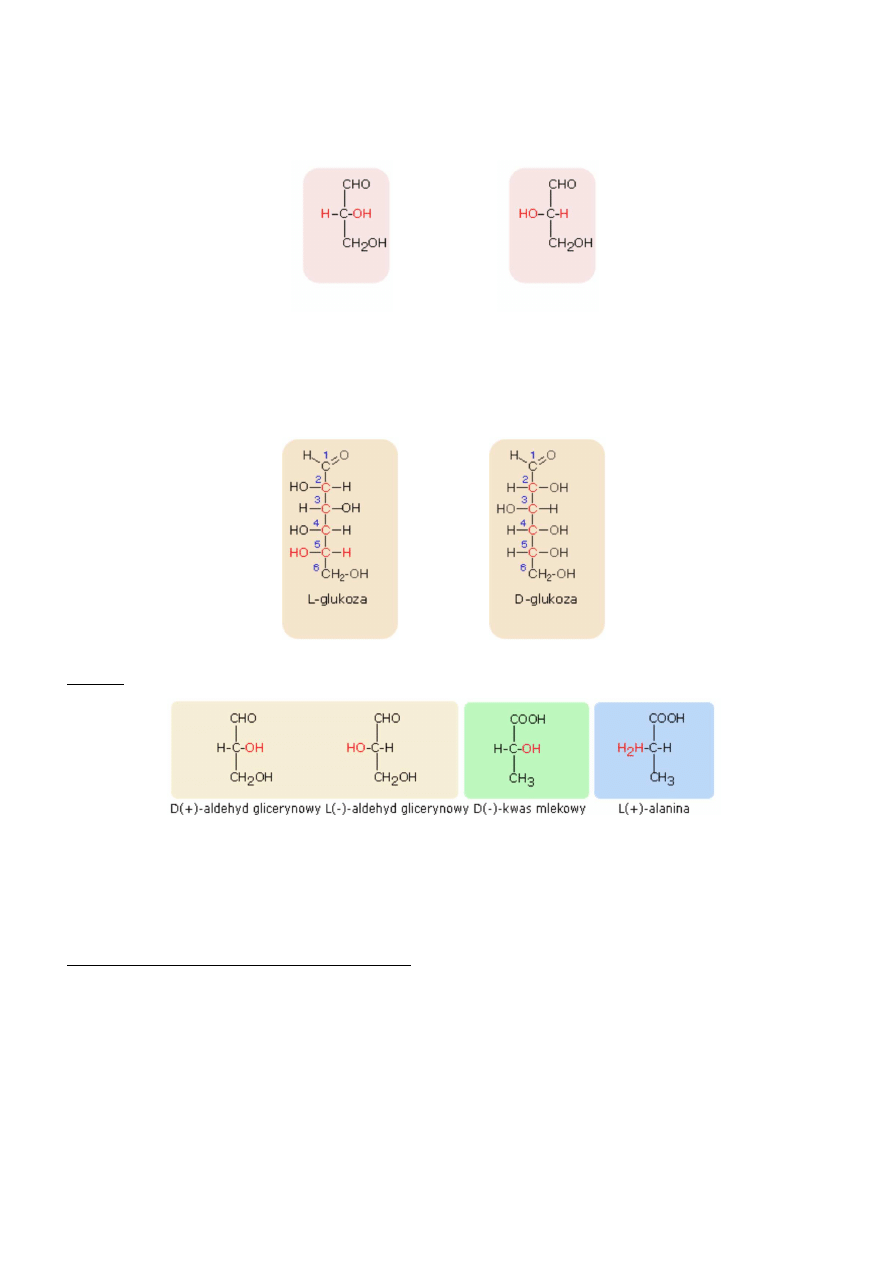
Często dla względnego charakteryzowania cząstek chiralnych wprowadzono pojęcie konfiguracji D- i L-, co uwidocznione jest w
nazwach związków. Na przykład - aldehyd D-glicerynowy, aldehyd L-glicerynowy
Punktem odniesienia dla konfiguracji D- i L- jest budowa cząsteczki aldehydu glicerynowego a konkretnie położenie
podstawników H- oraz HO- przy środkowym węglu.
D-aldehyd glicerynowy
L-aldehyd glicerynowy
Najczęściej konfigurację D- i L- spotykamy w grupie cukrów. Jeżeli cząsteczki cukrów prostych swoją budową nawiązuje do
D-aldehydu glicerynowego, zaliczane są do szeregu D, natomiast te, których budowa nawiązuje do L-aldehydu glicerynowego,
zaliczane są do szeregu L.
Uporządkowanie na szeregi D i L następuje według konfiguracji podstawników, przy czym bierzemy pod uwagę to centrum
chiralności, które jest najbardziej oddalone od grupy karbonylowej.
L-Glukoza
D-glukoza
Przykłady konfiguracji D- i L-.
W prezentowanych przykładach w nazwie zaznaczono skręcalność optyczną i konfiguracją D- i L- .Uzyskano tym
sposobem pełniejszą nazwę optycznie czynnego związku chemicznego. Na przykład - D(+) - aldehyd glicerynowy, L(-)
- aldehyd glicerynowy.
Często zachodzi potrzeba opisania konfiguracji w sposób prostszy i wygodniejszy, niż rysowanie jej za każdym razem.
Najbardziej użyteczny sposób,obecnie zalecany, polega na stosowaniu symboli
R i S
.
Konfiguracja R (łac. rectus -prawy) i S (łac. sinister - lewy)
W celu odczytania konfiguracji na podstawie modelu lub wzoru, podstawnikom przy asymetrycznym atomie trzeba najpierw
przypisać numery od 1 do 4 według tzw. reguł pierwszeństwa.
Reguły pierwszeństwa podstawników
Reguła 1. Jeżeli wszystkie cztery atomy połączone z centrum chiralności są różne, to pierwszeństwo grup zależy od
liczb atomowych, przy czym priorytet ma atom o wiekszej liczbie atomowej. Jeżeli dwa atomy są izotopami tego
samego pierwiastka, to pierwszeństwo ma atom o większej liczbie masowej.
Reguła 2 Jeżeli nie można na podstawie reguły 1 ustalić wzglednego pierwszeństwa dwóch grup, to należy
przeprowadzic podobne porównanie następnych atomów w tych grupach.
Następnie spoglądamy na cząsteczkę w taki sposób, aby grupa o najniższym pierwszeństwie (4) była jak najdalej od nas
oddalona. Trzeba pamiętać, żeby asymetryczny atom węgla znajdował się bliżej obserwatora niż podstawnik 4. Przy takim
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
5 z 7
2012-01-22 22:11
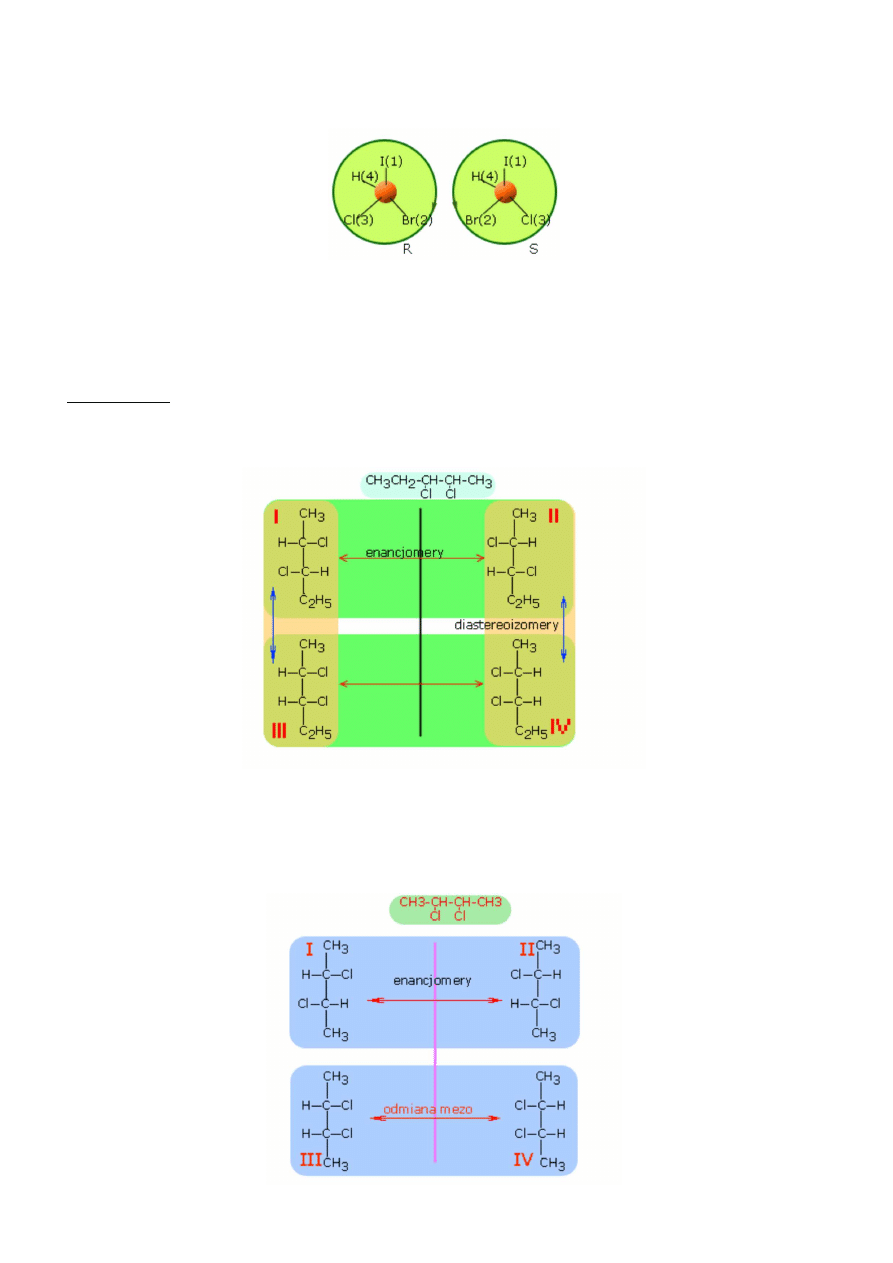
ustawieniu podstawniki 1, 2, 3 zwrócone są w stronę patrzącego i można wyobrazić sobie, że układają się na okręgu. Jeżeli
kolejność 1, 2, 3 jest zgodna z kierunkiem ruchu wskazówek zegara, to taką konfigurację oznaczamy symbolem R a odwrotnej
konfiguracji przypisujemy symbol S. Na przykład dla bromochlorojodometanu konfiguracje przedstawiają się następująco.
Dlaczego tak wygląda pierwszeństwo podstawników?
Ponieważ liczby atomowe Z podstawników odpowiednio wynoszą I - 53,
Br - 35, Cl - 17, H - 1. Prostym przykładem związku, który wymaga stosowania reguły 2, jest optycznie czynny alkohol amylowy.
Q związku tym przy asymetrycznym atomie znajduje się atom wodoru, grupa metylowa - CH
3
, grupa etylowa - CH
2
CH
3
i
hydroksymetylowa -CH
2
OH. Wodór otrzymuje numer 4, ponieważ Z = 1. Z reguły 2 wynika, że grupa -CH
2
OH otrzymuje numer
1, zawiera bowiem tlen o Z = 8, grupa -CH
2
CH
3
otrzymuje numer 2 (na drugiej pozycji znajduje się węgiel o Z = 6) a grupa -CH
3
numer 4.
Diastereoizomery
Istnieje grupa związków chemicznych, która zawiera więcej jak jedno centrum chiralności. W tej grupie związków chemicznych
obok już wcześniej zdefiniowanych enacjomerów spotykamy się z izomerami nie będące wzajemnymi lustrzanymi odbiciami.
Noszą one nazwę diastereoizomerów.
W przedstawionym przykładzie struktury I i II oraz III i IV są enancjomerami, natomiast struktura III jest diastereoizomerem
zarówno związku I, jak i związku II oraz struktura IV jest diastereoizomerem związków I i II.
Rozpatrując poniższy przykład (2,3-dichlorobutan), widzimy, że cząsteczka zawiera dwa centra chiralności. Struktury I i II są
enacjomerami (nie można na siebie nałożyć), natomiast struktury III i IV mimo że posiadają centra chralności możemy na siebie
nałożyć (wystarczy strukturę III obrócić o 180
o
, a pokryje się ona całkowicie ze strukturą IV).
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
6 z 7
2012-01-22 22:11

W przykładzie mamy tylko trzy struktury stereoizomeryczne, tj. I, II i III.
Związki chemiczne
, którego cząsteczki dają się nałożyć na swoje odbicia lustrzane, mimo iż zawierają centra chiralności noszą
nazwę
mezo
.
W zależności od ilości asymetrycznych atomów węgla (n), ilość izomerów optycznie czynnych (enancjomerów) obliczamy ze
wzoru 2
n
.
Przykładowo czasteczki o dwóch asymetrycznych atomach węgla dają cztery izomery optycznie czynne.
Izomery konformacyjne
Izomery konformacyjne
to stereoizomery różniące się między sobą rozmieszczeniem atomów w przestrzeni. Różne
konformacje
powstają przez obrót poszczególnych części cząsteczki wokół wiązań pojedyńczych i geometrycznie nie przystają do siebie
(patrz przykład)
Konformacje różnią się tylko stanem energetycznym gdzie najkorzystniejszą jest konformacja najuboższa energetycznie.
Konformacja ma znaczenie dla cząsteczek alkanów oraz ich pochodnych.
POWRÓT
DALEJ
Pojęcia i prawa
/
Reakcje chemiczne
/
Budowa atomu
/
Powłoki elektronowe
/
Układ okresowy
/
Wpływ budowy
/
Wiązania chemiczne
/
Energetyka
/
Roztwory
/
Elektrolity
/
Procesy
"Redox"
/
Elektrochemia
/
Nieorganiczna
/
Organiczna
/
Chemia w przemysle
/
Spis treści serwisu - liceum
/
Kontakt z autorem strony
/
ă
Copyright - "CHEMIA OGÓLNA - 2002-2006"
Chemia ogolna2
http://www.chemia.dami.pl/liceum/liceum14/organiczna2.htm
7 z 7
2012-01-22 22:11
Wyszukiwarka
Podobne podstrony:
izomeria zwiazkow organicznych
Izomeria związków organicznych
IZOMERIA ZWIĄZKÓW ORGANICZNYCH
izomeria zwiazkow organicznych
Izomeria związków organicznych
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
Analiza klasyczna związku organicznego I 2012
Identyfikacja zwiazkow organicznych
analiza zwiazkow organiczna id Nieznany (2)
chemia sprawdzian ze zwiazkow organicznych
Naturalne związki organiczne spotykane w życiu codziennym
Cw 8 Utlenianie zwiazkow organicznych
Analiza klasyczna związku organicznego II 2012
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ROZDZIELANIE ORAZ SYNTEZA ZWIĄZKÓW ORGANICZNYCH
Ferment alkohol to?ztlen niecałk rozkład związkó organic głównie utlenia cukrów
OCZYSZCZANIE ZWIĄZKU ORGANICZNEGO PRZEZ KRYSTALIZACJĘ
więcej podobnych podstron