
R.M. Siegoczyński 2007
1
Absorpcja i Fluorescencja
R.M. Siegoczyński 2007
2
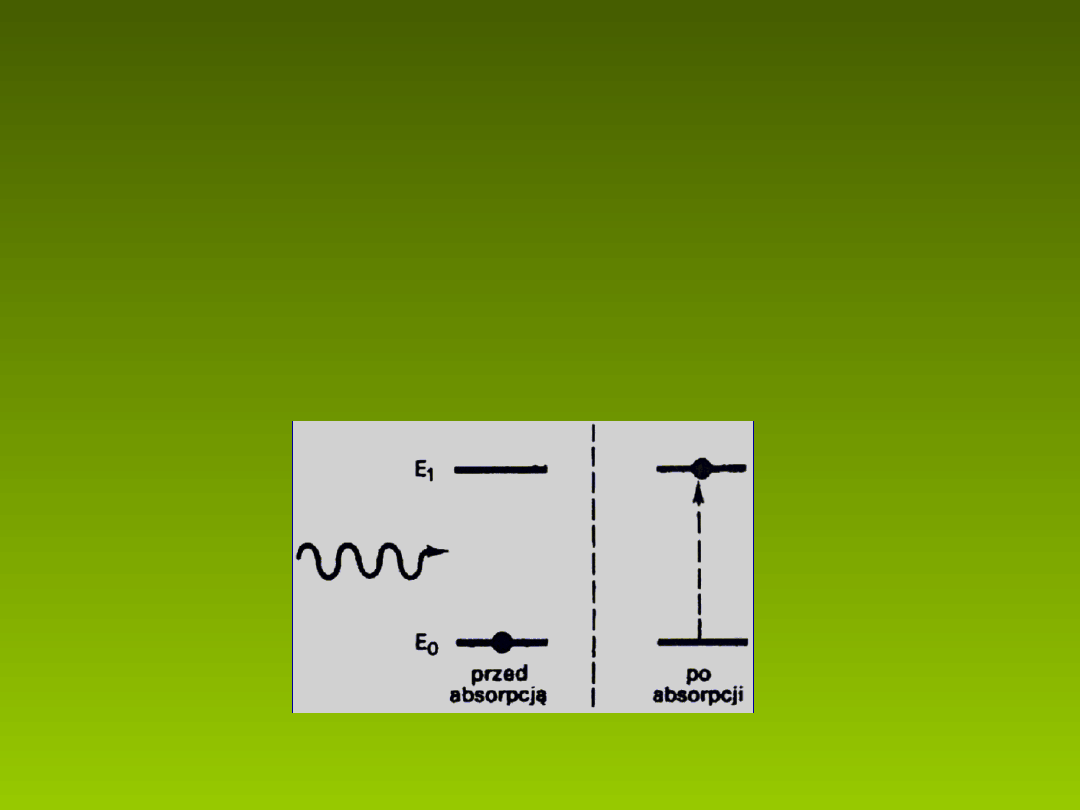
Absorpcja elektronowa
Z absorpcj mamy do czynienia wówczas, gdy jeden z fotonów
ą
wi zki wiat a przechodz cej przez o rodek oddzia uje z
ą
ś
ł
ą
ś
ł
napotkanym na swej drodze elektronem atomu, cz steczki … tego
ą
o rodka, co powoduje – z okre lonym prawdopodobie stwem -
ś
ś
ń
przeniesienie tego elektronu na wy szy poziom energetyczny
ż
atomu, cz steczki
ą
…tego o rodka (rys. 1).
ś
R.M. Siegoczyński 2007
3
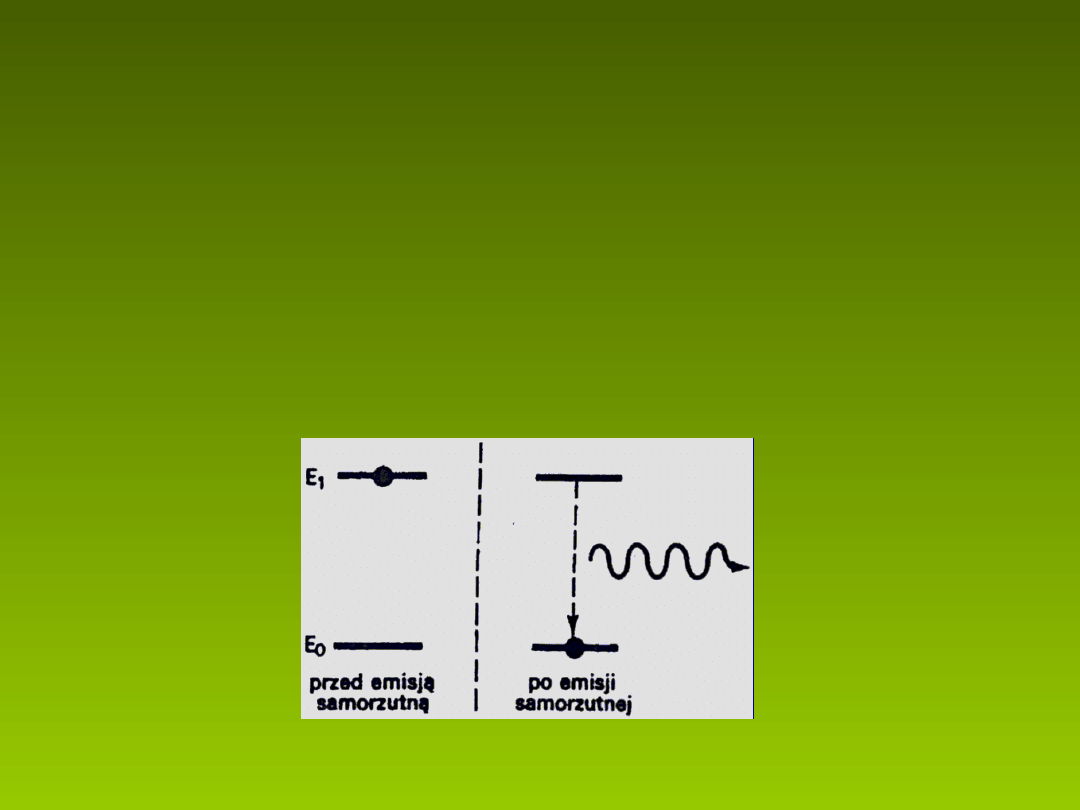
Luminescencja
– emisja promieniowania elektromagnetycznego
zachodz ca ze wzbudzonego stanu cz steczki (rys.2).
ą
ą
Luminescencja charakteryzuje si sko czonym czasem trwania emisji
ę
ń
tzn. nie zanika natychmiast po przerwaniu wzbudzenia.
Substancje luminezuj ce emituj promieniowanie w ultrafiolecie i
ą
ą
obszarze widzialnym.
R.M. Siegoczyński 2007
4
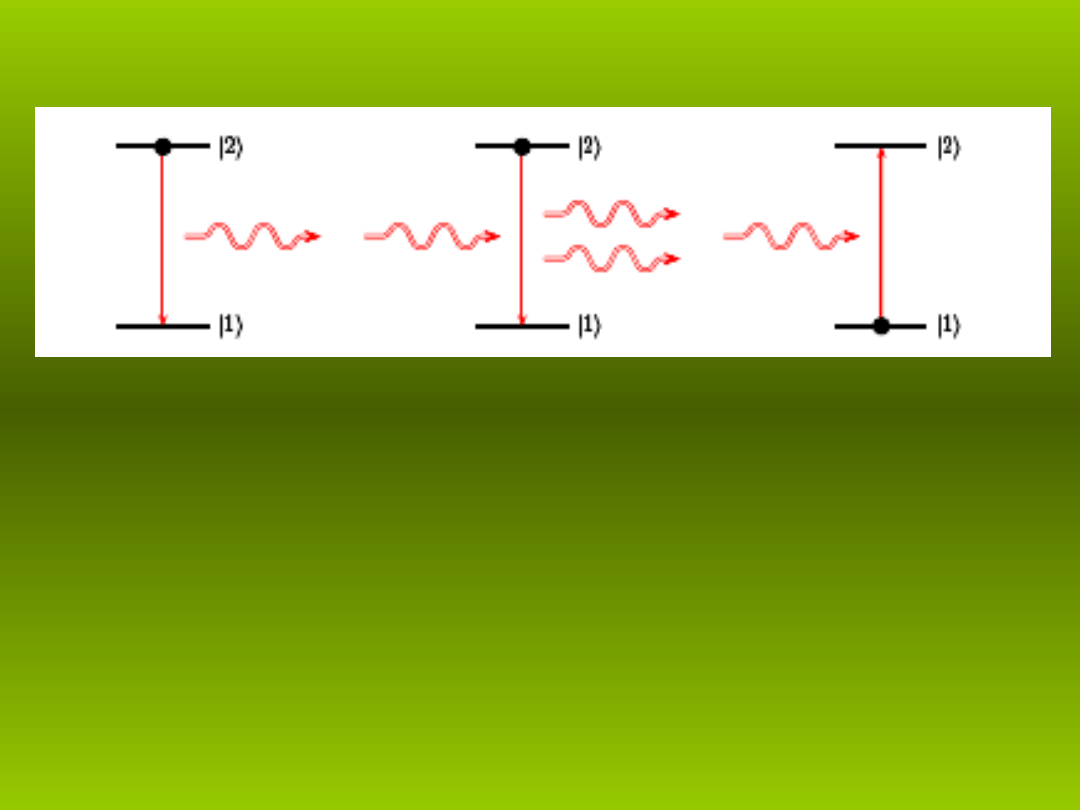
Trzy podstawowe procesy promieniowania:
emisja spontaniczna, emisja wymuszona i absorpcja

R.M. Siegoczyński 2007
5
Luminescencj
ę
mo emy wywo a wykorzystuj c ró ne
ż
ł ć
ą
ż
mechanizmy wzbudzenia:
Promienie X –
rentgenoluminescencja.
Pole elektryczne, pr d –
ą
elektroluminescencja.
Procesy chemiczne, zwykle utlenianie -
chemiluminescencja.
Utlenianiem nazywamy procesy polegaj ce na usuwaniu
ą
elektronu e- z atomu, Fe
2+
→ Fe
3+
+ e
–
Promieniowanie optyczne, niejonizuj ce –
ą
fotoluminescencja.
Tarcie –
tryboluminescencja.
W ten sposób otrzymujemy
wiecenie cukru mia d onego w ciemnym pomieszczeniu, czy
ś
ż ż
te rt ci przelewanej w rurze kwarcowej.
ż ę
R.M. Siegoczyński 2007
6
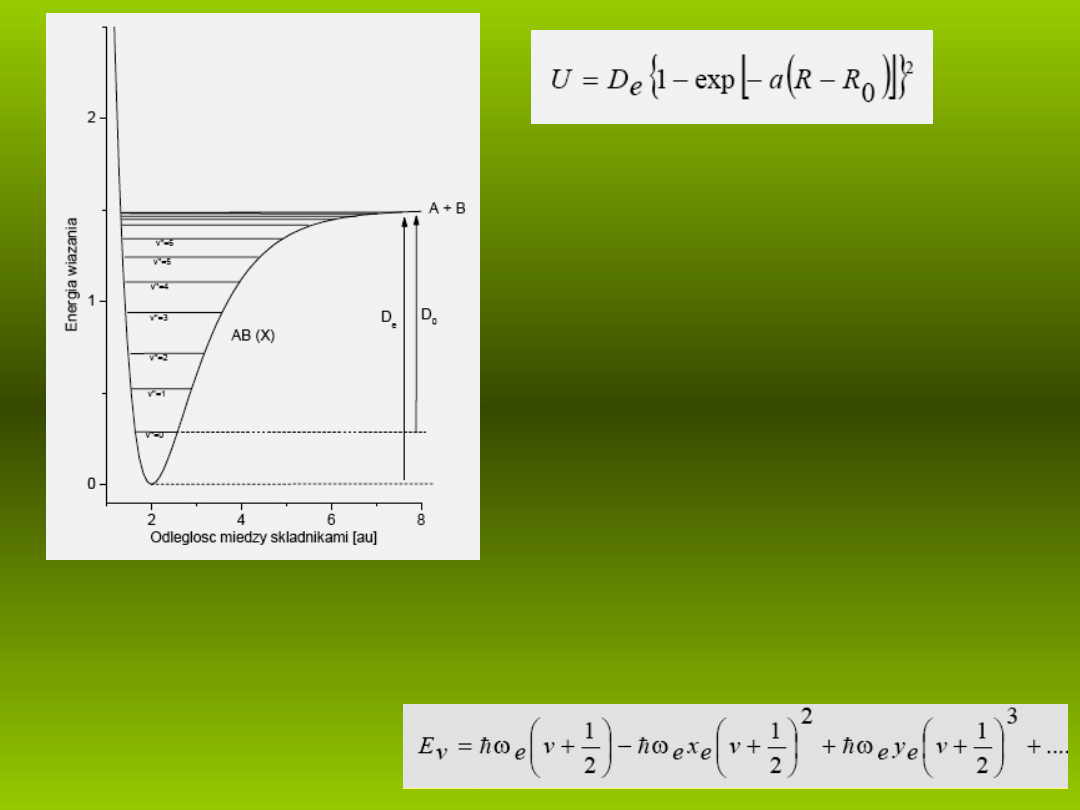
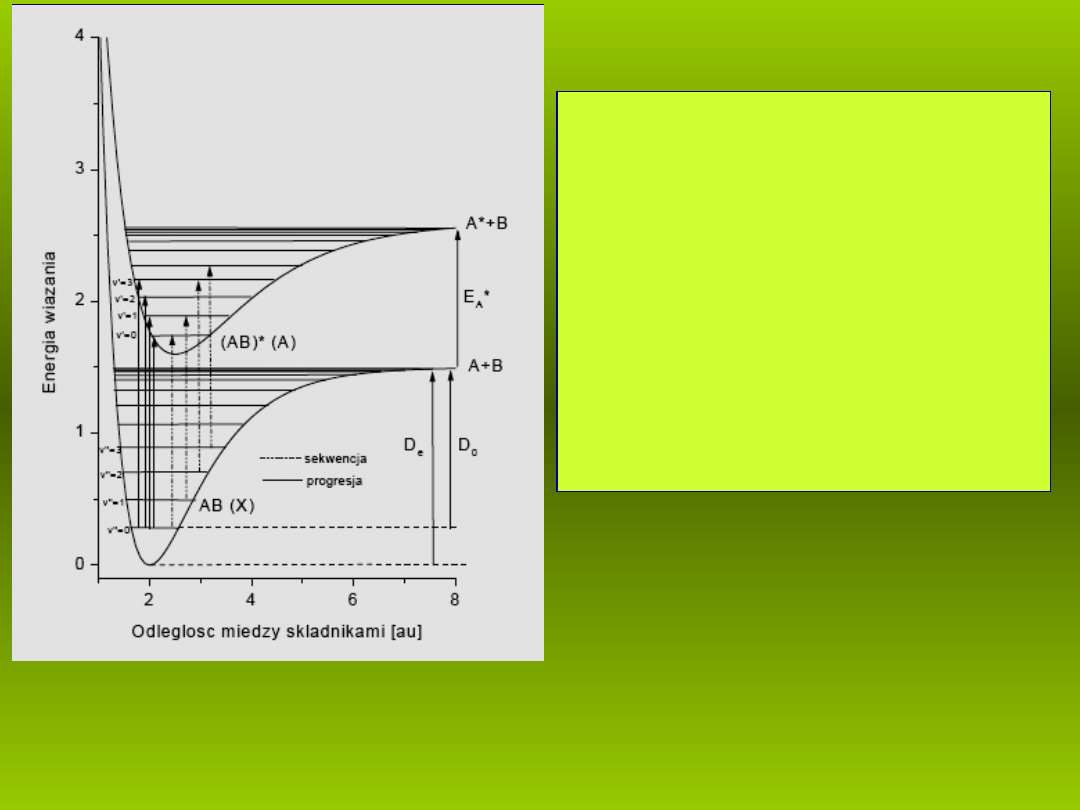
P.M. Mors, 1929
Wykres
U(R-R
0
)
jest przedstawiony na
Rys.3 . Jest to niesymetryczna studnia
potencja u o g boko ci
ł
łę
ś
D
e
i parametrze
a
odpowiadaj cym za jej szeroko . Taki
ą
ść
uk ad, po zaabsorbowaniu energii wi kszej
ł
ę
lub równej
D
e
ulegnie dysocjacji, czyli
rozpadowi.
Rys. 3. Studnia potencja u Morse’a
ł
hipotetycznej moleku y dwuatomowej AB z
ł
zaznaczonymi poziomami oscylacyjnymi.
D
0
–
energia dysocjacji,
D
e
– g boko studni
łę
ść
potencja u,
ł R
0
– po o enie równowagi
ł ż
R.M. Siegoczyński 2007
7
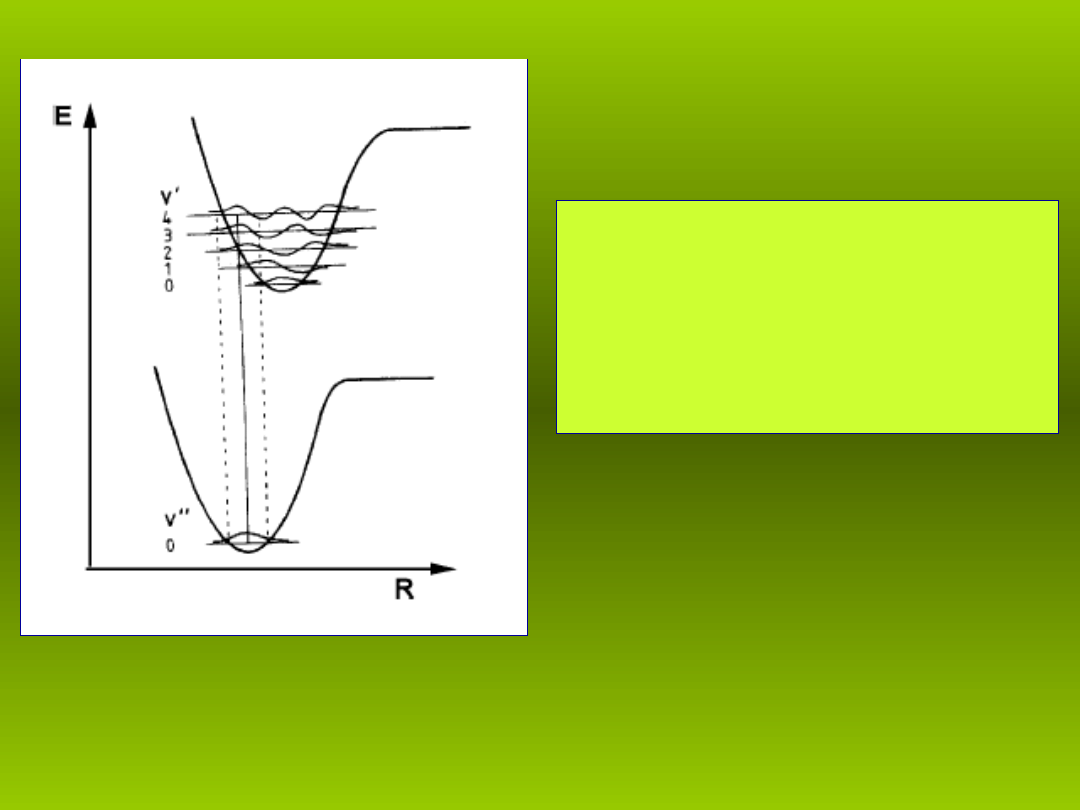
Rys. 4. Struktura oscylacyjnych stanów
energetycznych dla dwóch ró nych stanów
ż
elektronowych hipotetycznej moleku y
ł
dwuatomowej AB.
System oscylacyjnych stanów
kwantowych jest
charakterystyczny dla danego
poziomu elektronowego
moleku y. Wynika to z faktu, e
ł
ż
ró ne konfiguracje molekularnej
ż
pow oki elektronowej
ł
reprezentuj ró ne si y wi zania,
ą ż
ł
ą

R.M. Siegoczyński 2007
8
Prawdopodobie stwa przej elektronowo-oscylacyjnych –
ń
ść
zasada Francka-Condona
Przej ciami elektronowo-oscylacyjnymi nazywamy przej cia
ś
ś
pomi dzy stanami oscylacyjnymi nale cymi do ró nych stanów
ę
żą
ż
elektronowych moleku y.
ł
Tradycyjnie, oscylacyjne liczby kwantowe wy szego poziomu
ż
elektronowego oznaczamy przez v’, a poziomu ni szego przez v”.
ż
Progresj
ą nazywamy seri przej z jednego poziomu oscylacyjnego
ę
ść
do kolejnych stanów oscylacyjnych innego poziomu elektronowego.
Sekwencj
ą nazywamy przej cia pomi dzy dwoma poziomami
ś
ę
oscylacyjnymi ró nych stanów elektronowych, dla których v = const.
ż
Δ
Progresje i sekwencje przedstawiono na Rys. 4.

R.M. Siegoczyński 2007
9
Stosuj c przybli enie Borna otrzymujemy
ą
ż
gdzie
Wyra enie , to czynnik Francka – Condona.
ż
Wyra a ono stopie przekrywania si oscylacyjnych
ż
ń
ę
funkcji falowych górnego i dolnego poziomu.

R.M. Siegoczyński 2007
10
Ju w 1925 roku, tzn. jeszcze przed pojawieniem si mechaniki
ż
ę
falowej Schrödingera, Franck przedstawi podobne wyt umaczenie
ł
ł
rozk adów nat e linii przej oscylacyjno-elektronowych.
ł
ęż ń
ść
Traktuj c moleku jako oscylator klasyczny i uwzgl dniaj c fakt,
ą
łę
ę
ą
e j dra moleku y s o wiele ci sze od elektronu tzn. w czasie
ż ą
ł ą
ęż
przej cia oscylacyjno-elektronowego j dra moleku y nie zmieniaj
ś
ą
ł
ą
swego po o enia ani pr dko ci oraz, e oscylator klasyczny
ł ż
ę
ś
ż
najd u ej przebywa w punktach zwrotnych swego ruchu doszed do
ł ż
ł
wniosku, e:
ż
Przej cia elektronowe s “pionowo” na wykresach energii
ś
ą
potencjalnej.
Najbardziej prawdopodobne s przej cia
ą
ś
pomi dzy poziomami dla których punkty zwrotne ruchu
ę
oscylacyjnego maj takie samo po o enie.
ą
ł ż
R.M. Siegoczyński 2007
11
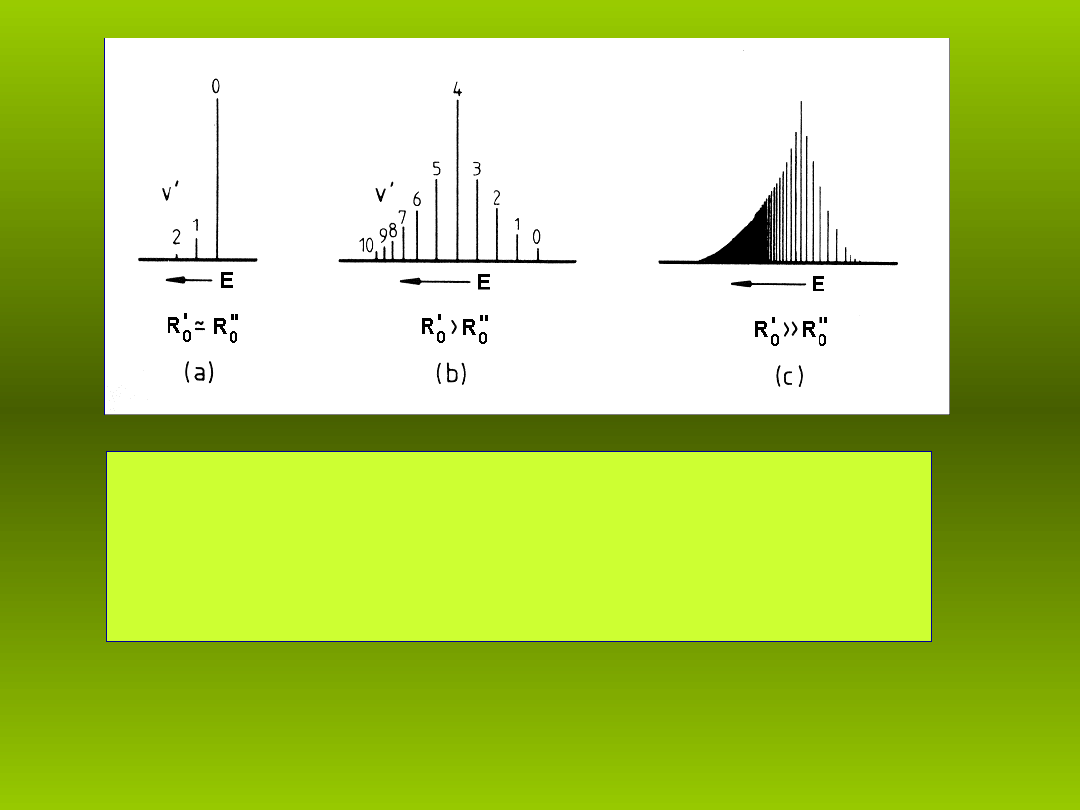
Rys. 5 Funkcje falowe ró nych stanów
ż
oscylacyjnych.
Rys. 5 przedstawia wykresy
funkcji falowych ró nych stanów
ż
oscylacyjnych dla dwóch
poziomów elektronowych, dla
których
R
0
'
jest wi ksze od
ę
R
0
''
.
R.M. Siegoczyński 2007
12
Rys. 6 przedstawia typowe rozk ady prawdopodobie stw
ł
ń
przej (wielko ci czynników Francka-Condona) dla 3.
ść
ś
ró nych wzajemnych po o e minimum potencja u
ż
ł ż ń
ł
górnego (
R
0
'
) i dolnego (
R
0
'‘
) stanu elektronowego.
R.M. Siegoczyński 2007
13
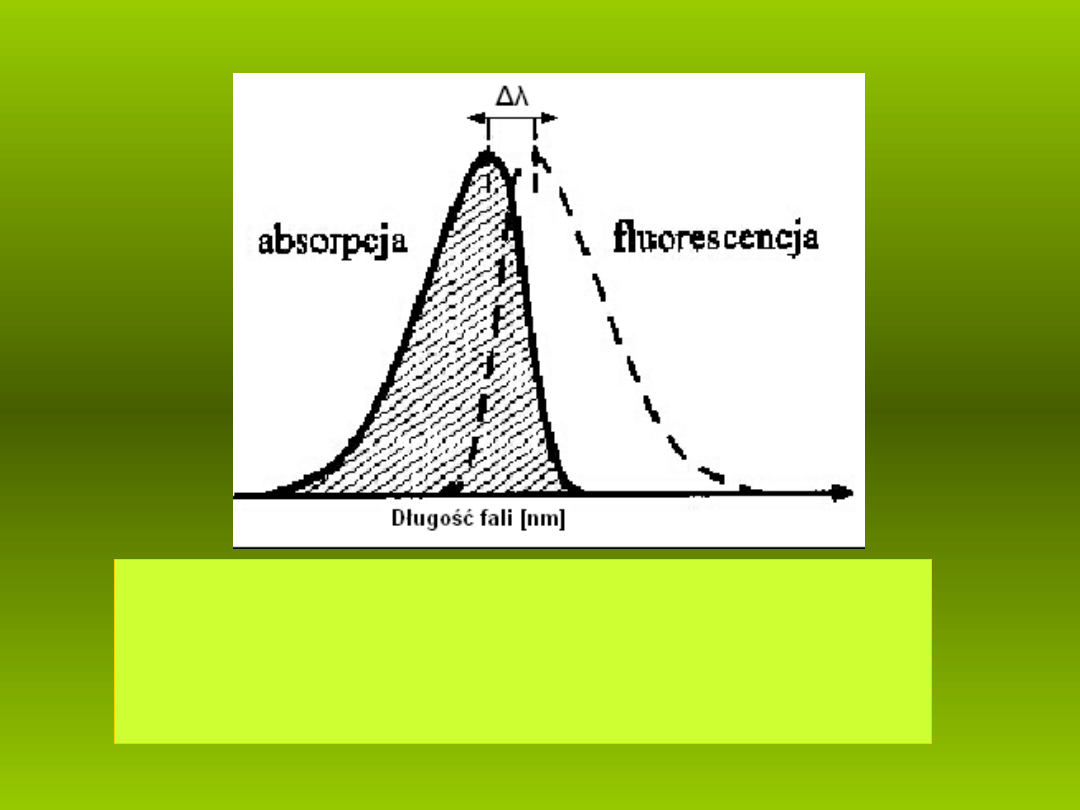
Rys. 8. Przesuni cie widm absorpcji i fluorescencji,
ę
czyli
- ró nica po o e ich maksimów,
ż
ł ż ń
tzw. przesuni cie Stockesa .
ę
R.M. Siegoczyński 2007
14
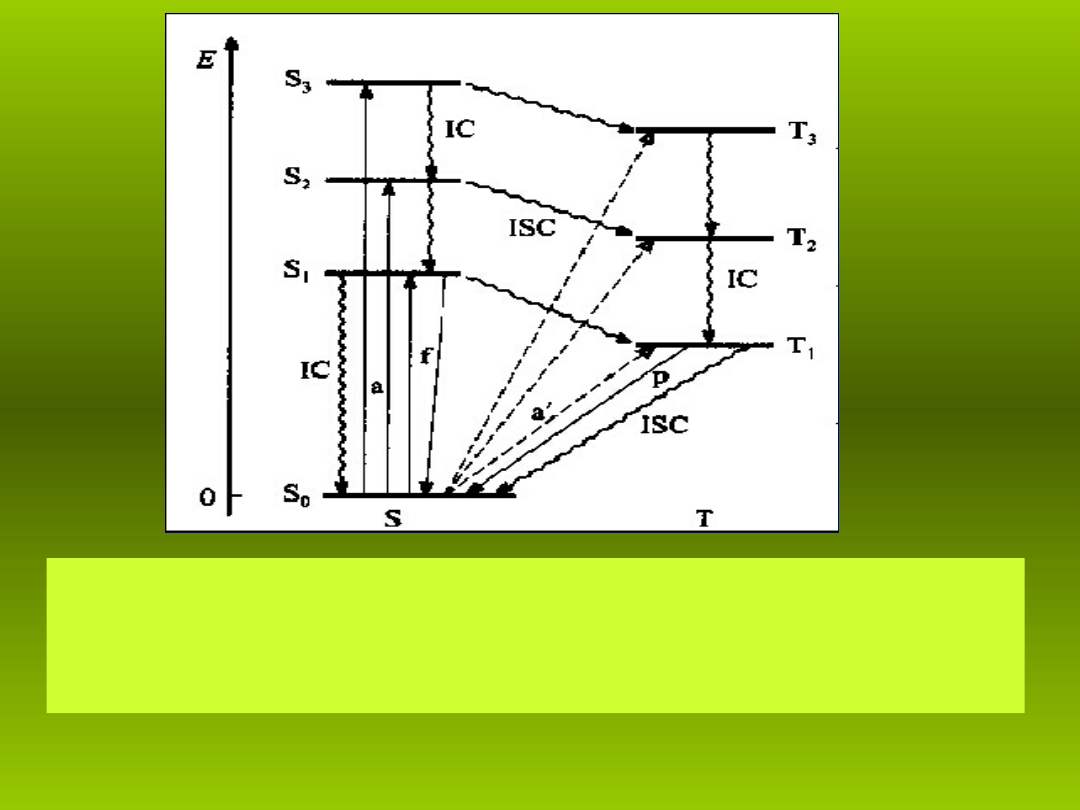
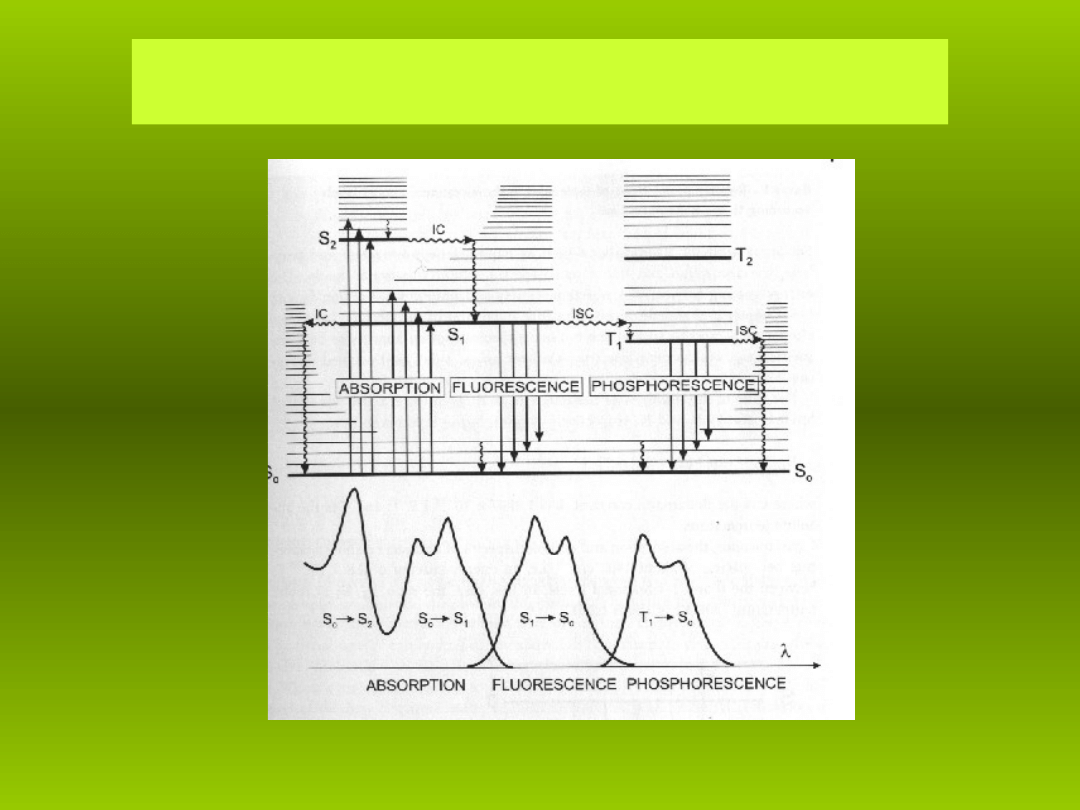
Rys. 7. Schemat poziomów energetycznych Jab o skiego
ł ń
Sn, Tn – poziomy energetyczne, odpowiednio, singletowe i trypletowe,
a – absorpcja, f – fluorescencja, p – fosforescencja, IC – konwersja
wewn trzna,
ę
ISC – przej cia mi dzysystemowe.
ś
ę
R.M. Siegoczyński 2007
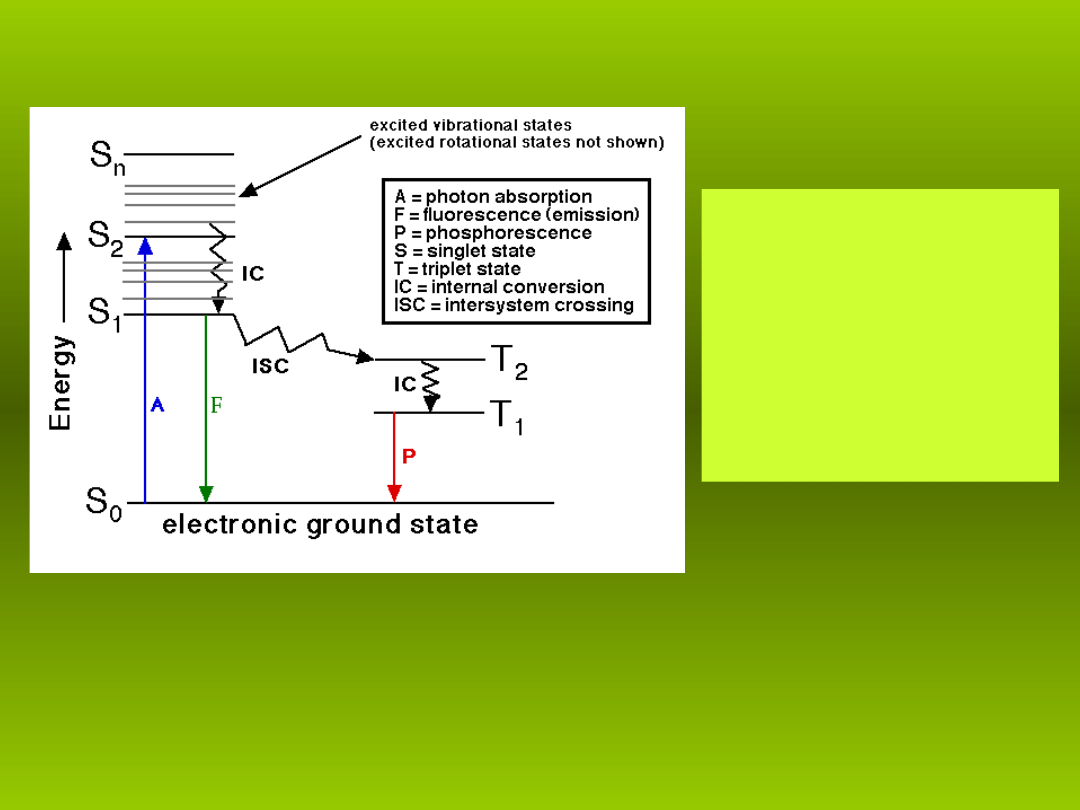
15
• S stany singletowe
• T stany trypletowe
• A absorpcja
• F fluorescencja
• P fosforescencja
• IC konwersja wewn trzna
ę
• ISC konwersja
interkombinacyjna
R.M. Siegoczyński 2007
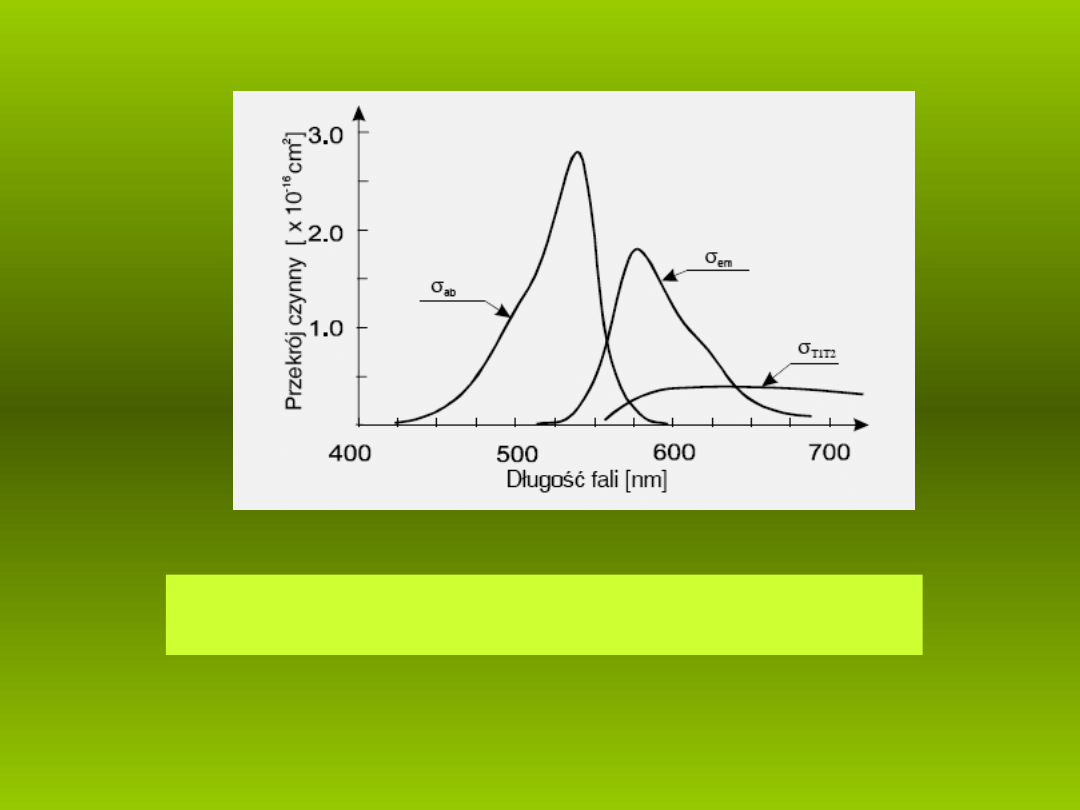
16
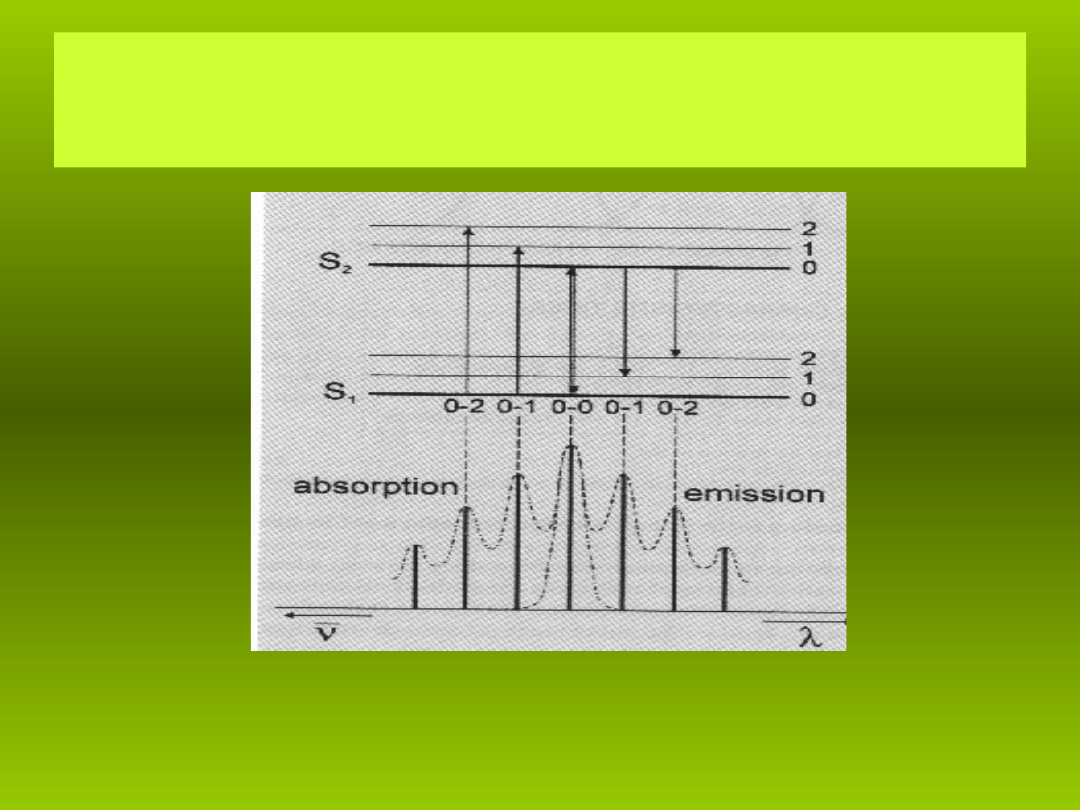
Absorpcja
S
0
→ S
1
, fluorescencja i absorpcja
T
1
→ T
2
roztworu
rodaminy 6G w wodzie (st enie 10
ęż
-4
M).
R.M. Siegoczyński 2007
17
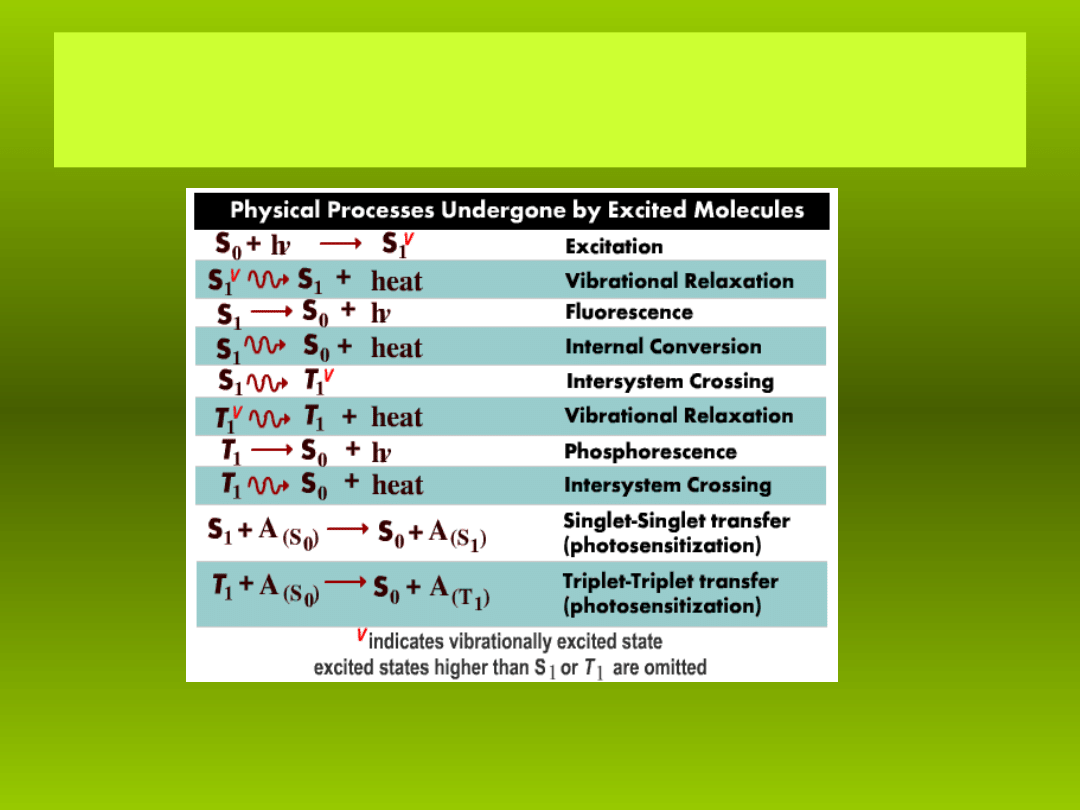
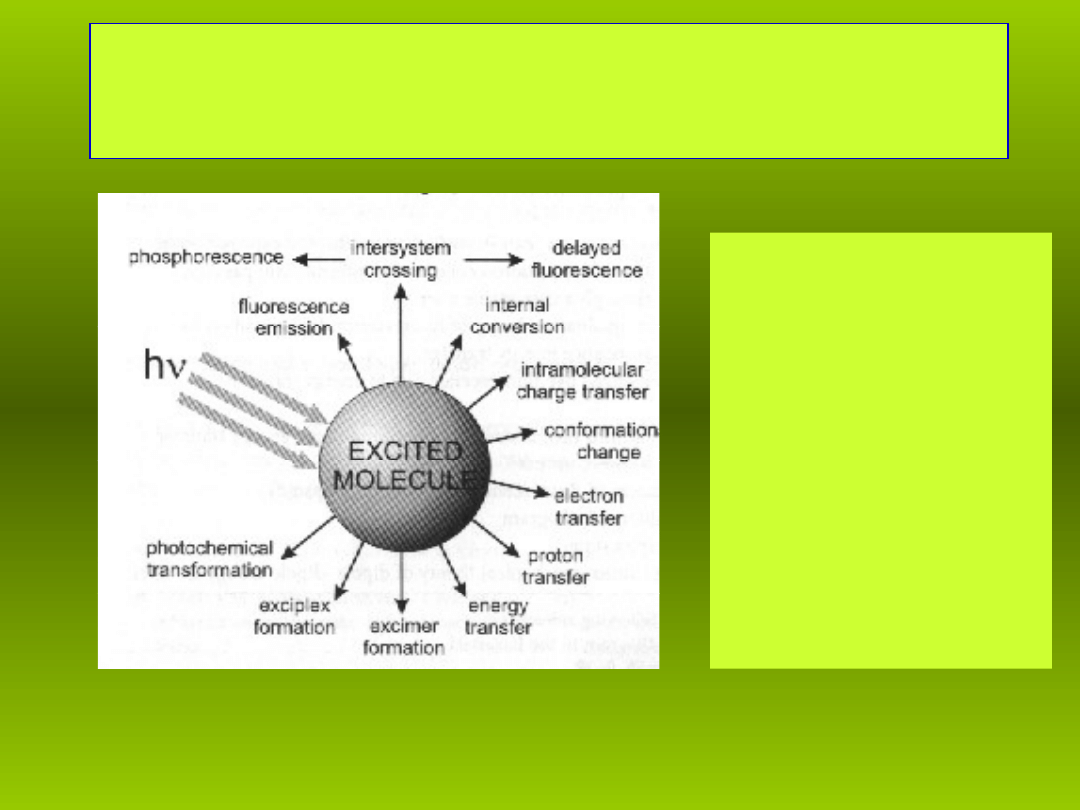
Procesy fizyczne zachodz ce podczas wzbudzenia
ą
R.M. Siegoczyński 2007
18
Procesy zachodz ce w czasie wzbudzenia cz steczki
ą
ą
• Przesuni cie adunku
ę
ł
• Konformacje
• Transfer elektronu
• Transfer protonu
• Transfer energii
• Tworzenie:
• ekscymerów,
ekscypleksów
• Fotochemiczne
transformacje
R.M. Siegoczyński 2007
19
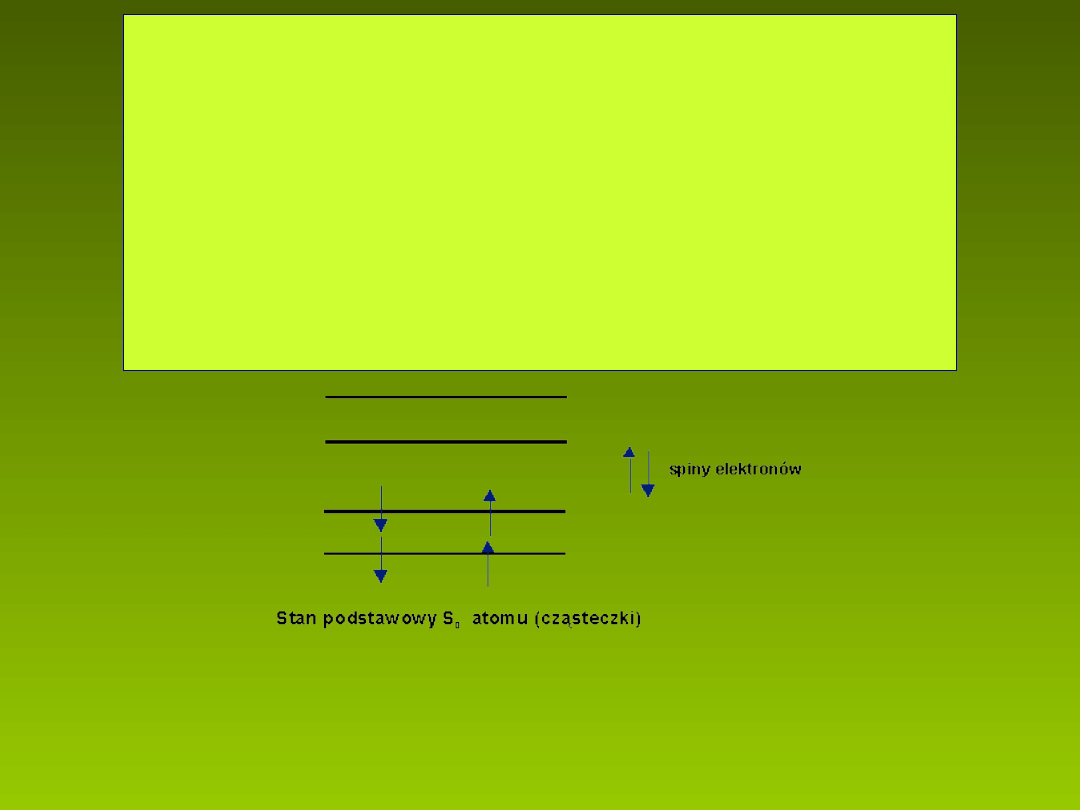
STANY SINGLETOWE. STANY TRYPLETOWE.
Zgodnie z prawami mechaniki kwantowej, dwa
elektrony znajduj ce si na tym samym orbitalu
ą
ę
musz mie przeciwnie skierowane spiny. W stanie
ą
ć
podstawowym atomu (cz steczki) mamy w a nie
ą
ł ś
tak sytuacj .
ą
ę
U o enie spinów elektronów w stanie podstawowym atomu (cz steczki).
ł ż
ą
R.M. Siegoczyński 2007
20
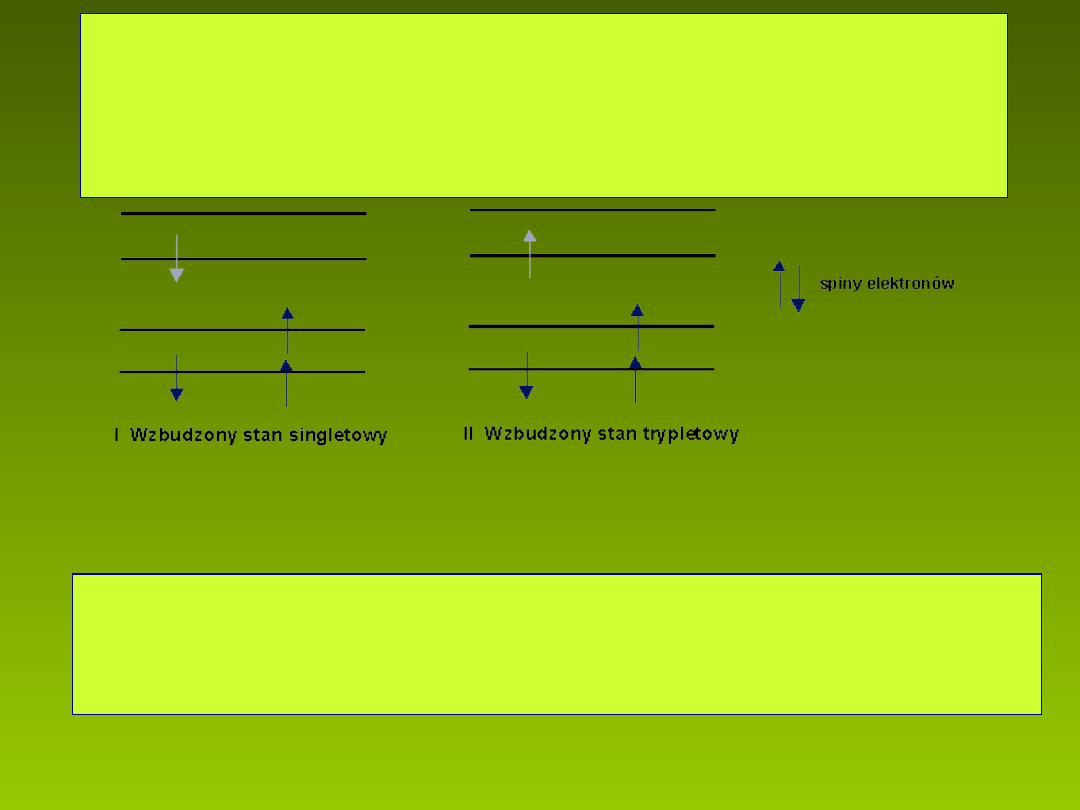
Gdy atom przejdzie na wy szy poziom energetyczny, jego spin
ż
mo e by skierowany równolegle (I) lub antyrównolegle (II) w
ż
ć
stosunku do spinu elektronu znajduj cego si w stanie
ą
ę
ni szym.
ż
Stan atomu (cz steczki) o spinach ustawionych antyrównolegle
ą
nazywamy stanem singletowym, równolegle - trypletowym.
Stany trypletowe i singletowe s stanami o ró nej multipletowo ci.
ą
ż
ś
U o enie spinów elektronów w stanie singletowym (I) i trypletowym (II)
ł ż

R.M. Siegoczyński 2007
21
Czas trwania procesu:
• Absorpcja - wzbudzenie 10
-15
s (femtosekundy)
2. Fluorescencja - 10
-9
s (nanosekundy)
3. Fluorescencja opó niona
ź
- 10
-6
s (od nanosekund do
mikrosekund)
4. Fosforescencja - 10
-6
s (mikrosekundy, sekundy i wi cej)
ę
5. Konwersja wewn trzna
ę
- 10
-12
s (pikosekundy)
R.M. Siegoczyński 2007
22
Schemat Jab o skiego
ł ń
R.M. Siegoczyński 2007
23
Wp yw poziomów oscylacyjnych na emisj i
ł
ę
absorpcj
ę

R.M. Siegoczyński 2007
24
Czynniki wp ywaj ce na emisj
ł
ą
ę
• Polarno
ść
• Obecno wi za
ść ą ń
wodorowych
• pH
• Ci nienie
ś
• Lepko
ść
• Temperatur
ę
• Wygaszanie
• Potencja elektryczny
ł
• Obecno jonów
ść

R.M. Siegoczyński 2007
25
4. Ró ne drogi dysocjacji
ż
Dostarczenie do uk adu energii wi kszej lub równej energii
ł
ę
dysocjacji nie zawsze prowadzi do fragmentacji. Elektronowe
stany wzbudzone i zwi zane z nimi systemy poziomów
ą
oscylacyjnych i rotacyjnych najcz ciej le powy ej granicy
ęś
żą
ż
dysocjacji poziomu podstawowego. Moleku a w takich stanach
ł
mo e by w dalszym ci gu uk adem zwi zanym, mimo e jej
ż
ć
ą
ł
ą
ż
energia wewn trzna jest wi ksza od
ę
ę
D
0
. Ka demu z takich
ż
stanów wzbudzonych odpowiada studnia potencja u o
ł
sko czonej g boko ci, która dla du ych
ń
łę
ś
ż
R
d y do
ąż
charakterystycznej dla danego stanu granicy dysocjacji. Inaczej
mówi c: dostarczaj c odpowiedniej energii mo emy
ą
ą
ż
doprowadzi do dysocjacji moleku y do ró nych stanów
ć
ł
ż
ko cowych -
ń
istnieje wiele sposobów dysocjacji. Powstaj ce
ą
fragmenty b d znajdowa si w ró nych energetycznie stanach
ę ą
ć ę
ż
wewn trznych.
ę

R.M. Siegoczyński 2007
26
• dla procesu dysocjacji stanu podstawowego (fragmenty nie
posiadaj energii kinetycznej):
ą
gdzie AB – moleku a dwuatomowa w stanie podstawowym, E
ł
1
energia dostarczona do
uk adu, E
ł
1
= D
0
– energia dysocjacji;
Symbolicznie procesy te mo emy zapisa :
ż
ć
Fragmenty pochodz ce z procesu wzbudzenia do
ą
granicy dysocjacji podstawowego stanu elektronowego
znajduj si w stanie podstawowym,
ą ę
W przypadku dysocjacji do granicy stanu
wzbudzonego, co najmniej jeden z fragmentów b dzie
ę
znajdowa si w stanie wzbudzonym.
ł ę

R.M. Siegoczyński 2007
27
• dla procesu dysocjacji ze wzbudzonego stanu elektronowego
gdzie przez * oznaczamy elektronowy stan wzbudzony, E
2
= D
0
+ A*, A* wyra a energi
ż
ę
atomu wzbudzonego A.
Podsumowuj c, kolejne energie dysocjacji z poszczególnych stanów
ą
elektronowych moleku y wynosz
ł
ą: D
0
+ energia wewn trzna
ę
produktów.

R.M. Siegoczyński 2007
28
Termiczne obsadzenie poziomów energetycznych
W danej temperaturze, w warunkach równowagi
termodynamicznej, bez oddzia ywania z zewn trznymi
ł
ę
polami, stosunek populacji uk adu w dwóch stanach
ł
energetycznych, o energiach
E
n
i
E
m
jest wyra ona
ż
wzorem
Boltzmanna:
gdzie
E = E
Δ
n
- E
m
, a
g
n
i
g
m
oznaczaj krotno degeneracji tych stanów.
ą
ść

R.M. Siegoczyński 2007
29
Barwniki – substancje o bardzo du ym
ż
prawdopodobie stwie absorpcji.
ń
Barwniki organiczne
—
nienasycony
zwi zek organiczny, który posiada
ą
podwójne wi zania skonjugowane.
ą
Wiele barwników wykazuje zjawisko
fluorescencji.
Do barwników zalicza si mi dzy innymi
ę ę
substancje fluoryzuj ce – luminofory.
ą
W praktycznych zastosowaniach
cz steczka barwnika powinna by
ą
ć
fotostabilna.

R.M. Siegoczyński 2007
30
Barwniki nieorganiczne charakteryzuj si du
ą ę żą
fotostabilno ci , poniewa ich zabarwienie jest wynikiem
ś ą
ż
przej atomowych, np. kolor rubinu zwi zany jest z jonem
ść
ą
Cr3+. Jednak e minera y s drogie, trudno dost pne i nie da
ż
ł ą
ę
si nimi barwi materia ów.
ę
ć
ł
Barwniki naturalne dzielimy na:
pochodzenia organicznego i nieorganicznego.

R.M. Siegoczyński 2007
31
Barwniki organiczne– atwiej dost pne.
ł
ę
Cz steczka barwnika musi zawiera grup chromoforow i
ą
ć
ę
ą
auksochromow podstawione do tego samego uk adu aromatycznego.
ą
ł
Grupa karbonylowa -
akceptor elektronu
i najbli sze grupy
ż
NH
2
i OH -
donory elektronu
s w nich utrzymywane razem przez
ą
wewn trzcz steczkowe wi zania wodorowe.
ą
ą
ą
Grupy – karbonylowa C=O, nitrowa NO
2
, azowa N=N s
ą
chromoforami, czyli
akceptorami elektronów π
.
Grupy aminowa NH
2
, hydroksylowa OH i metoksylowa OCH
3
s
ą
auksochromami, czyli
donorami elektronów π
.
Barwa tych barwników jest zwi zana z przej ciami elektronowymi typu
ą
ś
przeniesienia adunku – CT (
ł
Charge Transfer) o stosunkowo niskiej
energii, odpowiadaj cej absorpcji w obszarze widzialnym widma.
ą
R.M. Siegoczyński 2007
32
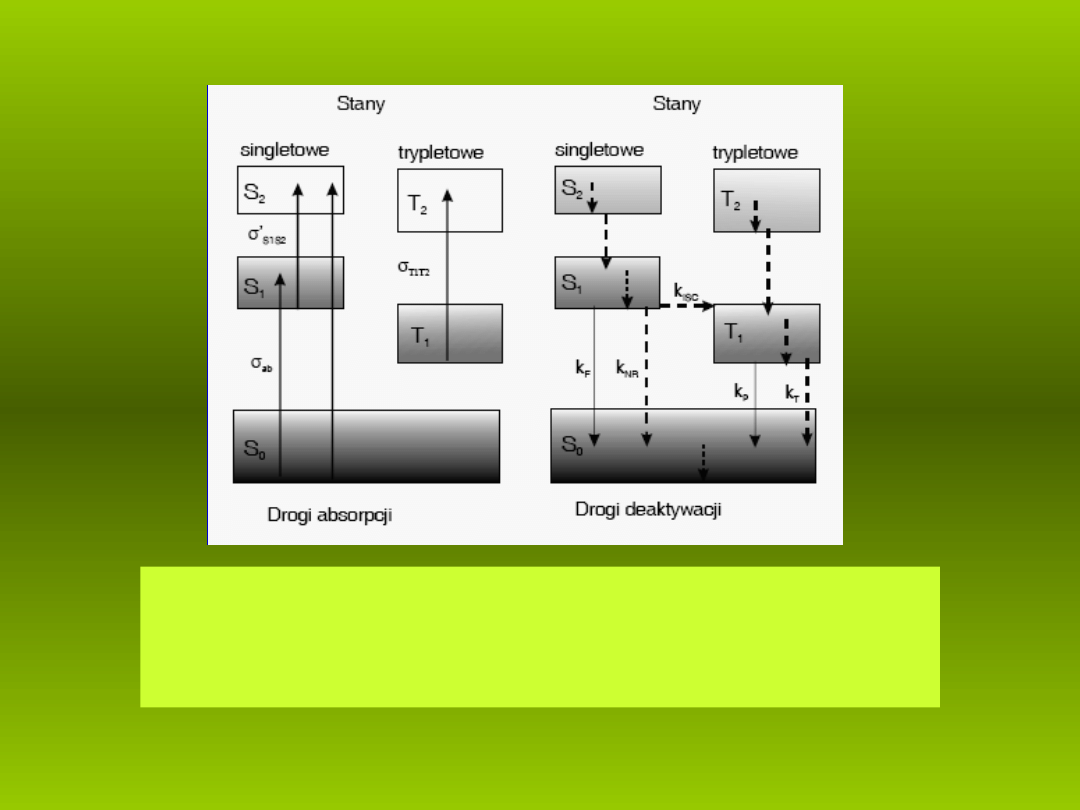
Diagram Jab o skiego z zaznaczonymi najwa niejszymi przej ciami
ł ń
ż
ś
promienistymi (strza ki ci g e) i bezpromienistymi (strza ki przerywane).
ł
ą ł
ł
Symbolem
σ oznaczone s przekroje czynne na absorpcj , a
ą
ę k - sta e
ł
szybko ci
ś
R.M. Siegoczyński 2007
33
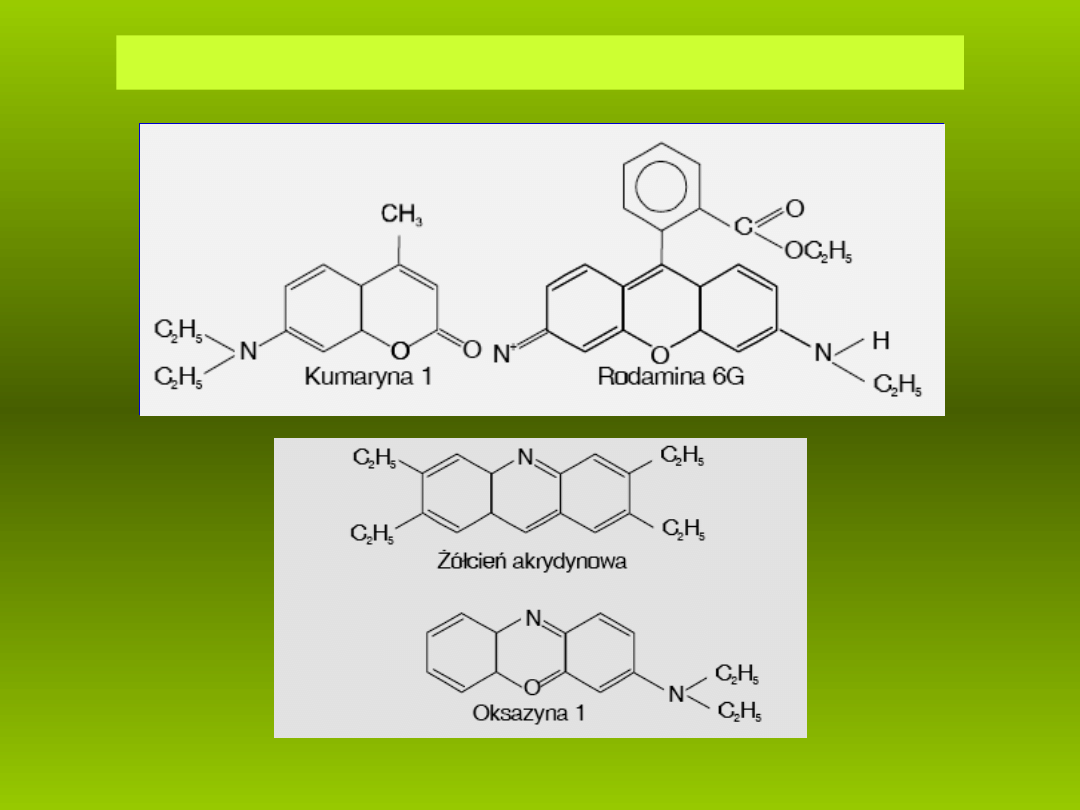
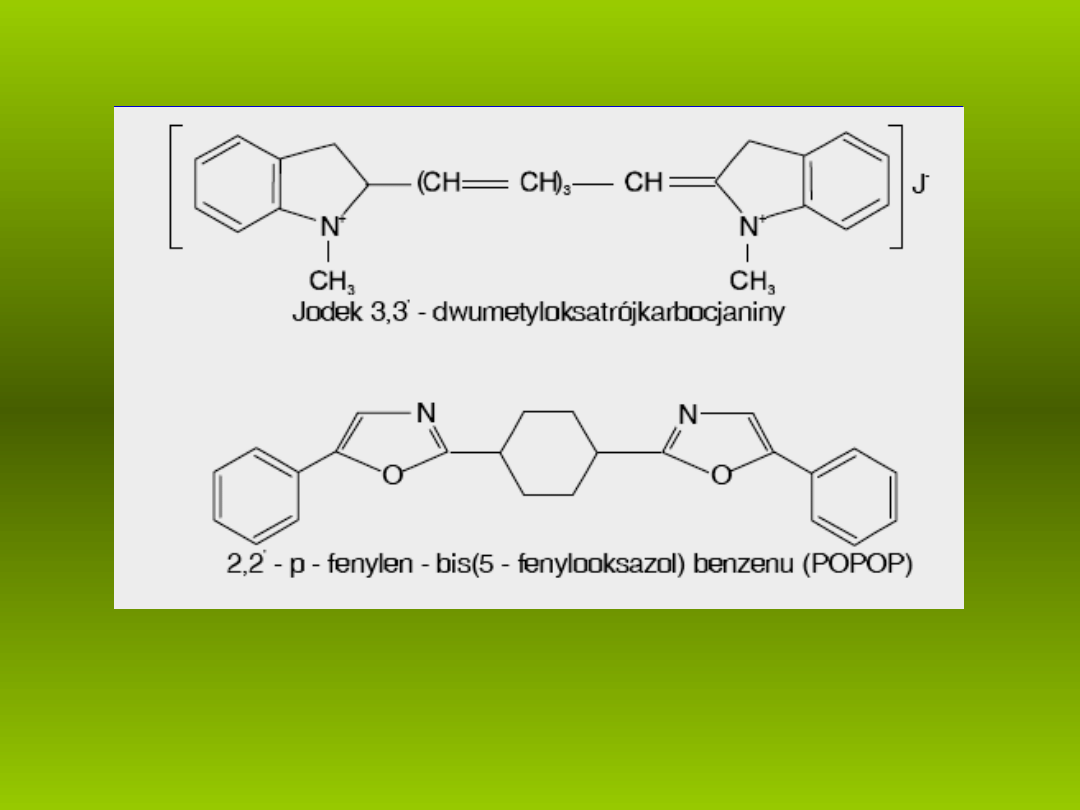
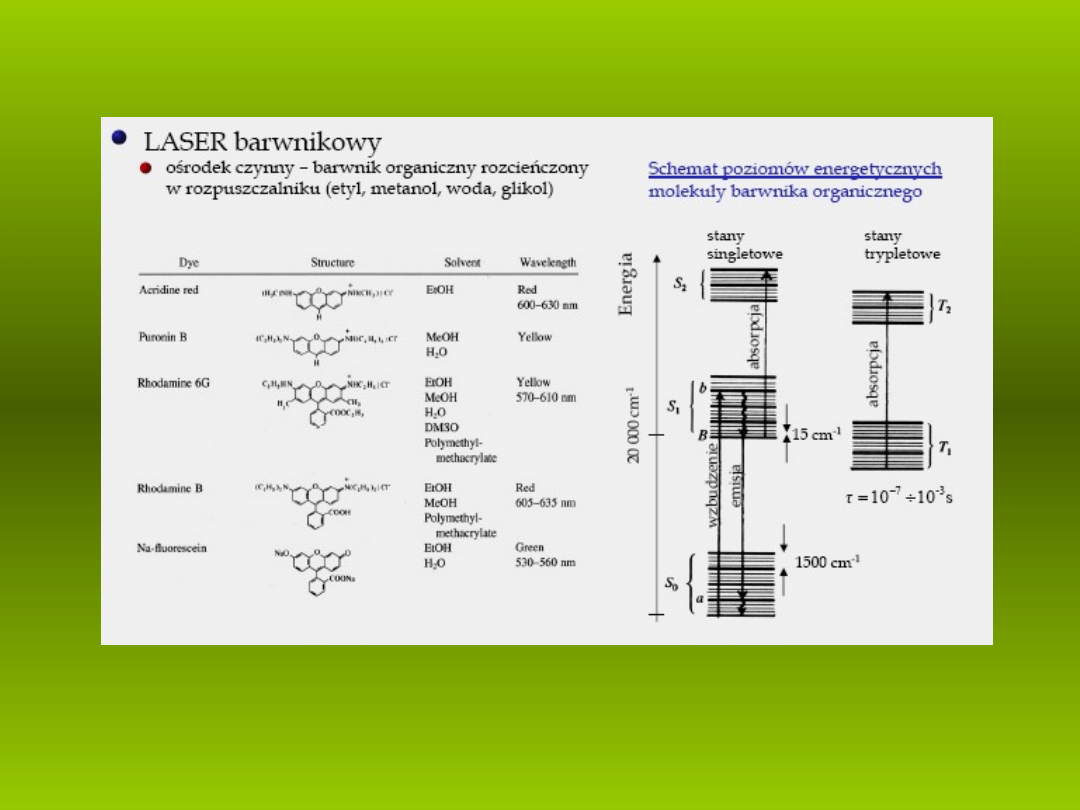
Wzory strukturalne wa niejszych barwników laseruj cych.
ż
ą
R.M. Siegoczyński 2007
34
R.M. Siegoczyński 2007
35
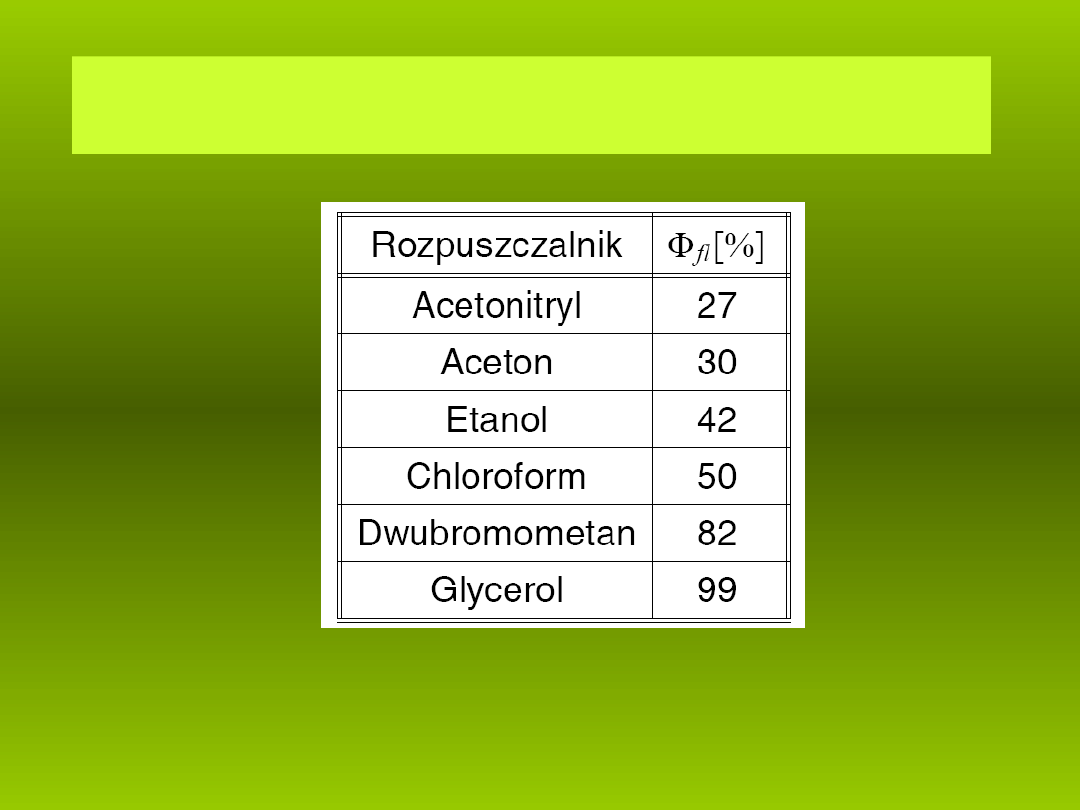
Wydajno kwantowa Rodaminy B w zale no ci od lepko ci
ść
ż ś
ś
rozpuszczalnika.
R.M. Siegoczyński 2007
36
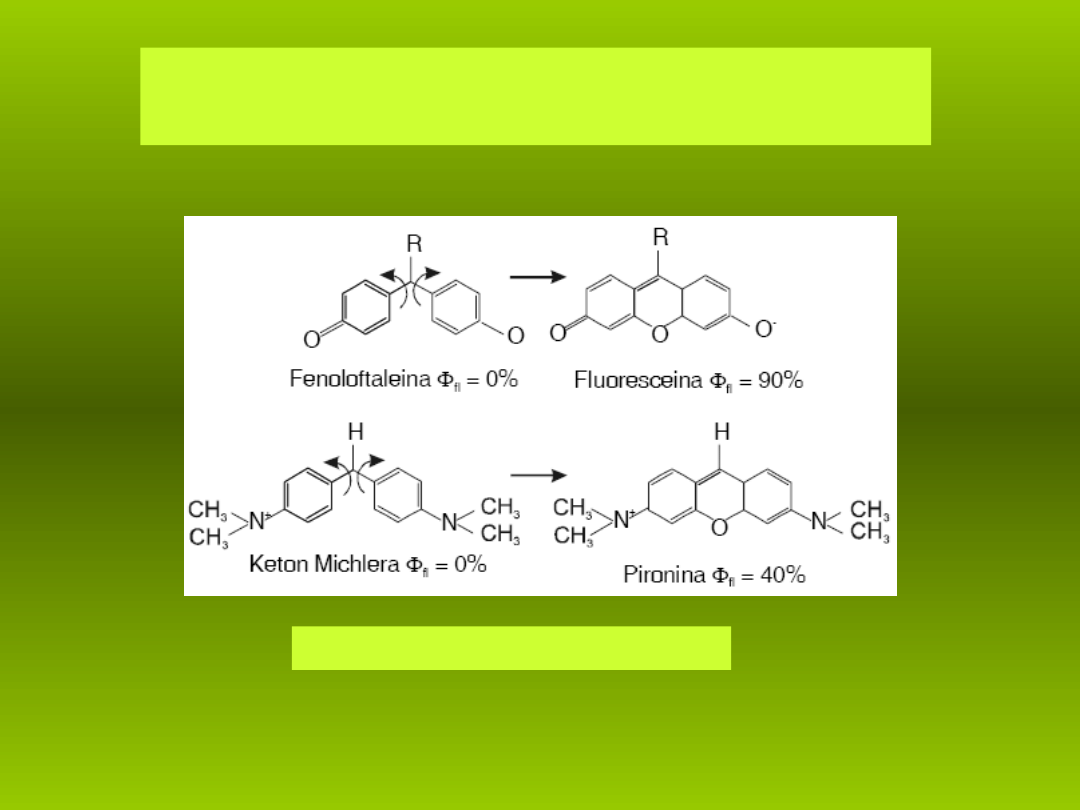
Sposób wbudowania mostka tlenowego
Unieruchomienie grup zwi ksza wydajno
ę
ść
kwantow
ą
R.M. Siegoczyński 2007
37
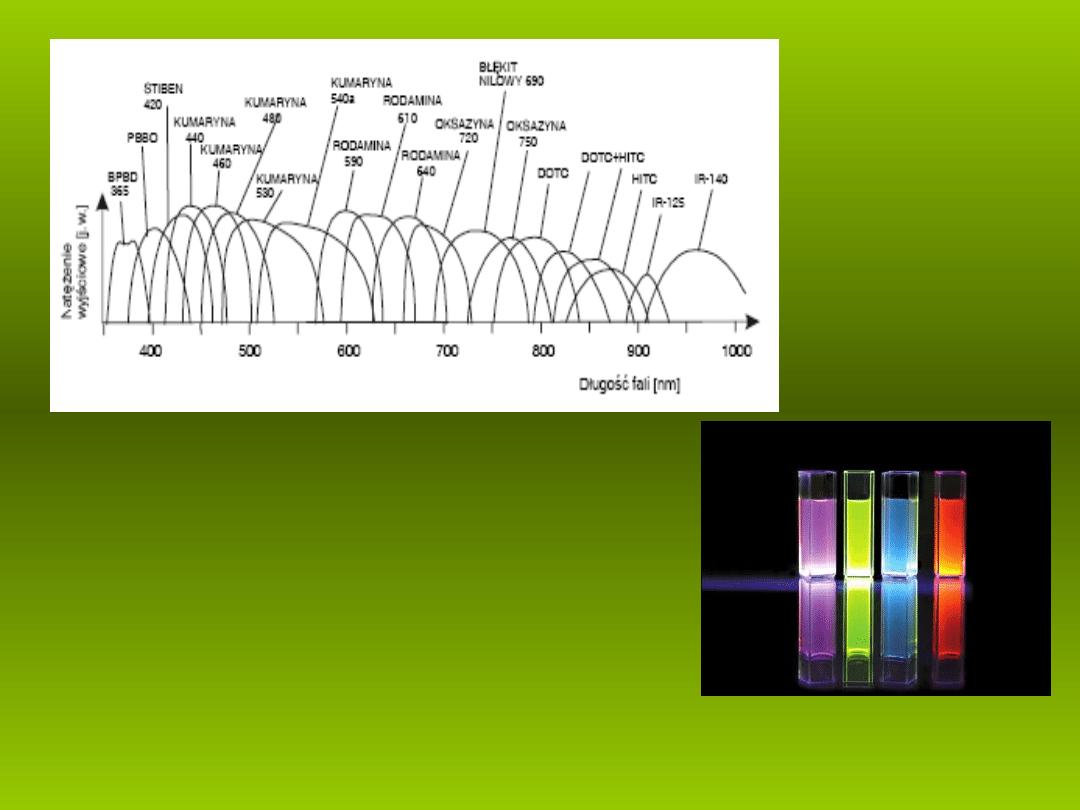
Widma
emisji
laserów
barwnikowych
R.M. Siegoczyński 2007
38
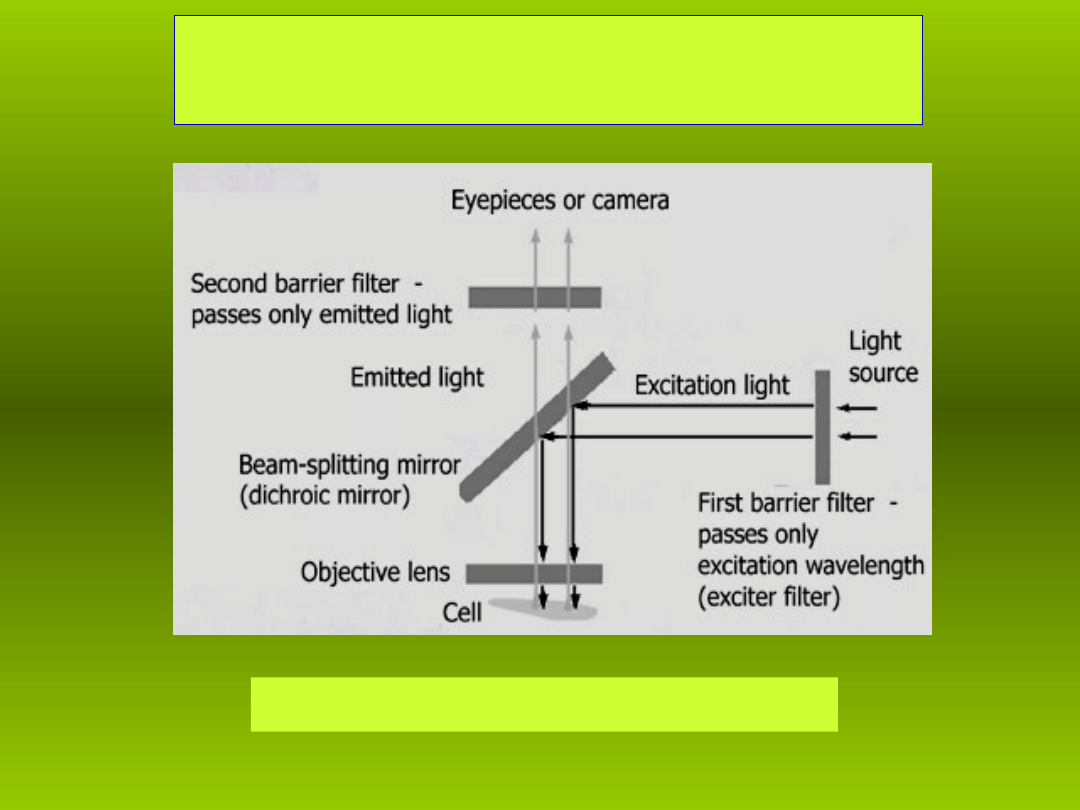
Obserwacja komórek
• Schemat mikroskopu fluorescencyjnego
R.M. Siegoczyński 2007
39
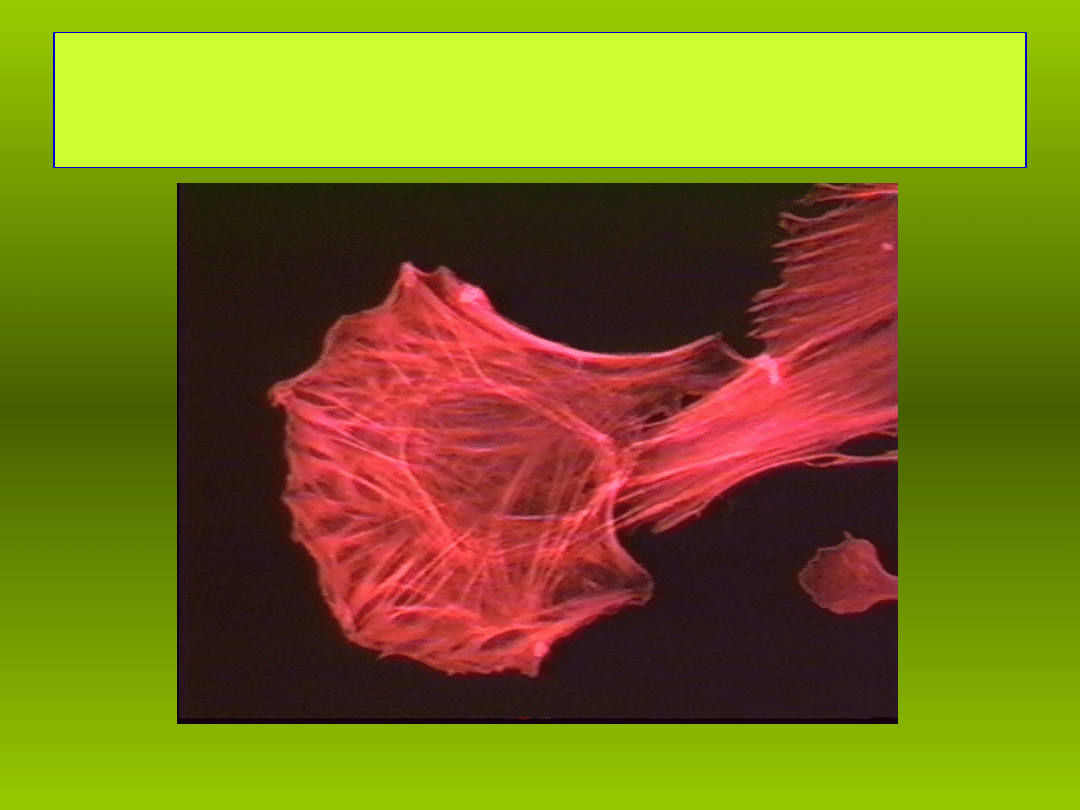
Aktyna w mi niu sercowym myszy
ęś

R.M. Siegoczyński 2007
40
R.M. Siegoczyński 2007
41
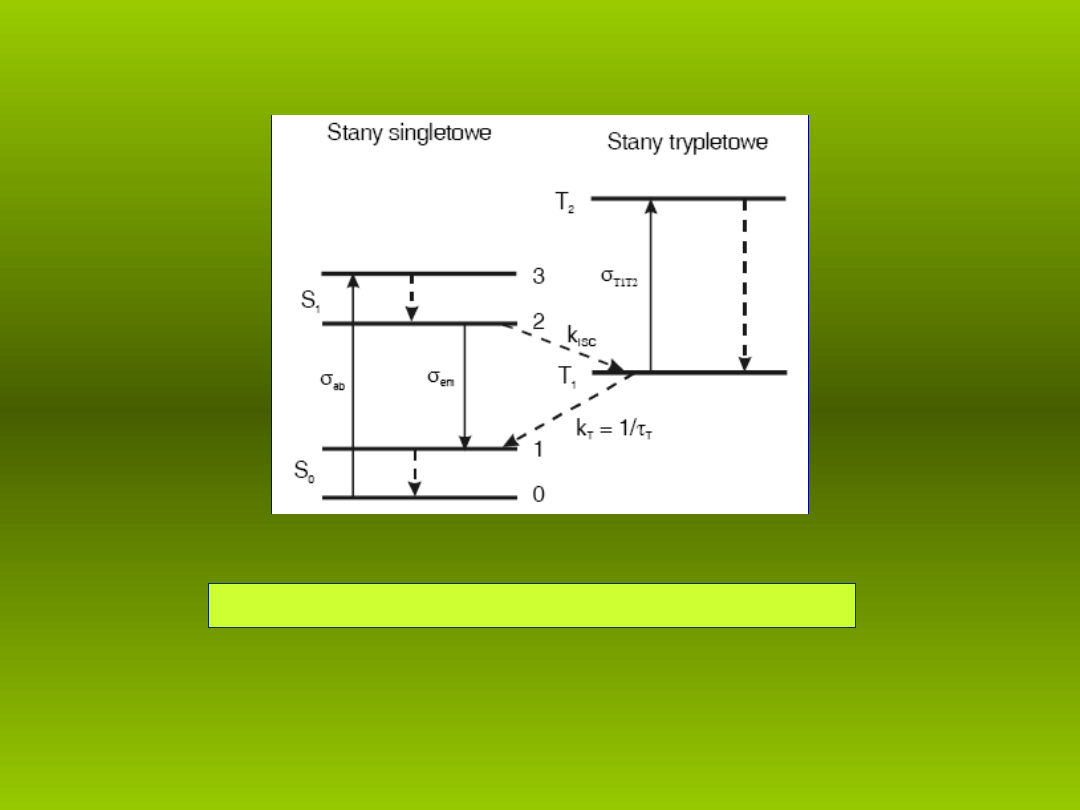
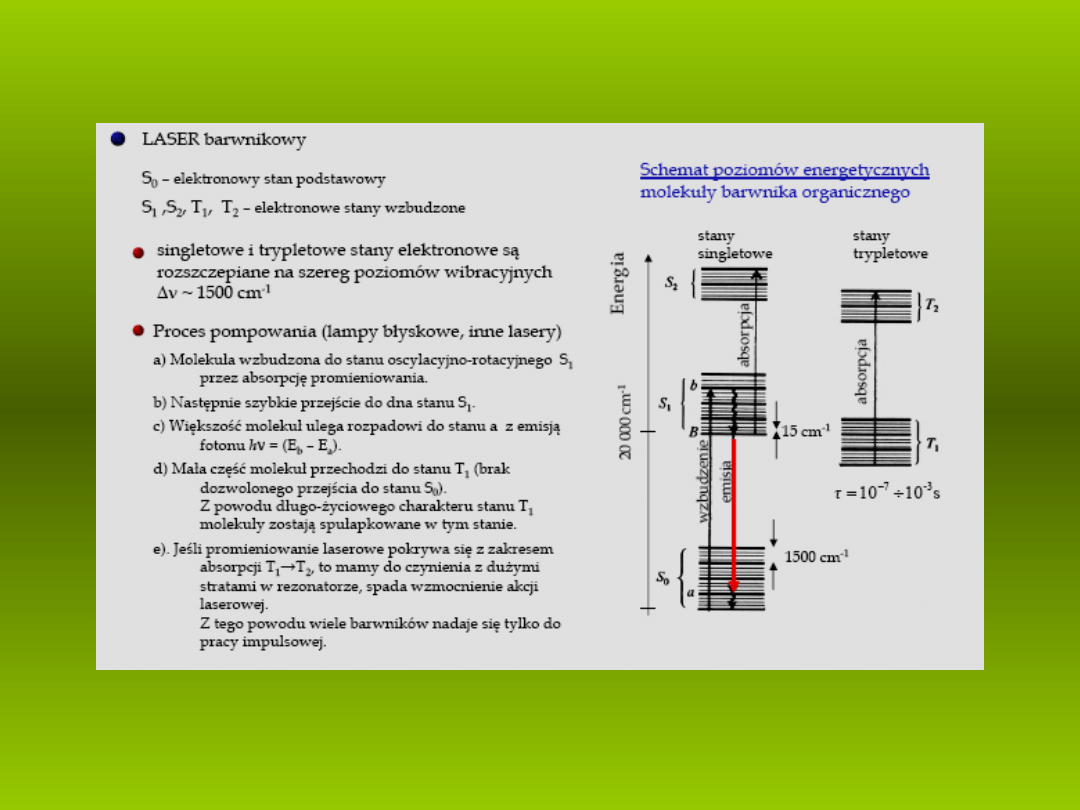
Uproszczony schemat poziomów energetycznych barwnika
R.M. Siegoczyński 2007
42
R.M. Siegoczyński 2007
43
R.M. Siegoczyński 2007
44
R.M. Siegoczyński 2007
45
Wyszukiwarka
Podobne podstrony:
Badanie widma absorpcji i fluorescencji, absorbcja i fluorescencja
Absorpcja
Fluorescencja chlorofilu
Kolumna absorpcyjna z wypelnieniem
Kolumna absorpcyjna
Mechanizmy absorpcji trucizn, TOKSYKOLOGIA, Toksykologia
laborka-absorpcja2, fizyka Laboratorium
Cw 33 badanie charakterystyk pracy chłodziarki absorpcyjne
Absorpcyjna Spektrofotometria czasteczkowa
ćw nr 2 badanie lamp fluorescencyjnych (2)
Techniki Fluorescencji w Analizie instrumentalnej, Analityka medyczna, Analiza instrumentalna
35 Widmo absorpcji liniowe i pasmowe
Absorpcja korpuskularnego promieniowania jonizującego
wyznaczenie optycznych widm emisyjnych i absorpcyjnych2, Szkoła, penek, Przedmioty, Fizyka, Laborki
Sodu fluorek cz
Cyny (II) fluorek
więcej podobnych podstron