
Fizyka statystyczna.
Parametry makroskopowe
Fizyka statystyczna
v
,
k
E
,
2
v
parametry makroskopowe
Rozważmy gaz jednoatomowy.
Dla każdej cząstki możemy określić: x , y , z , p
x
, p
y
, p
z
.
Jeżeli w pewnej chwili znamy dla każdej cząstki te współrzędne to mówimy, że znamy
stan mikroskopowy układu.
Określonemu makrostanowi układu odpowiada wiele mikrostanów.
Hipoteza Boltzmanna
Wszystkie mikrostany realizujące możliwe
makrostany są jednakowo prawdopodobne.
⇓
Liczbę mikrostanów odpowiadających danemu makrostanowi nazywamy
prawdopodobieństwem termodynamicznym danego makrostanu.
1
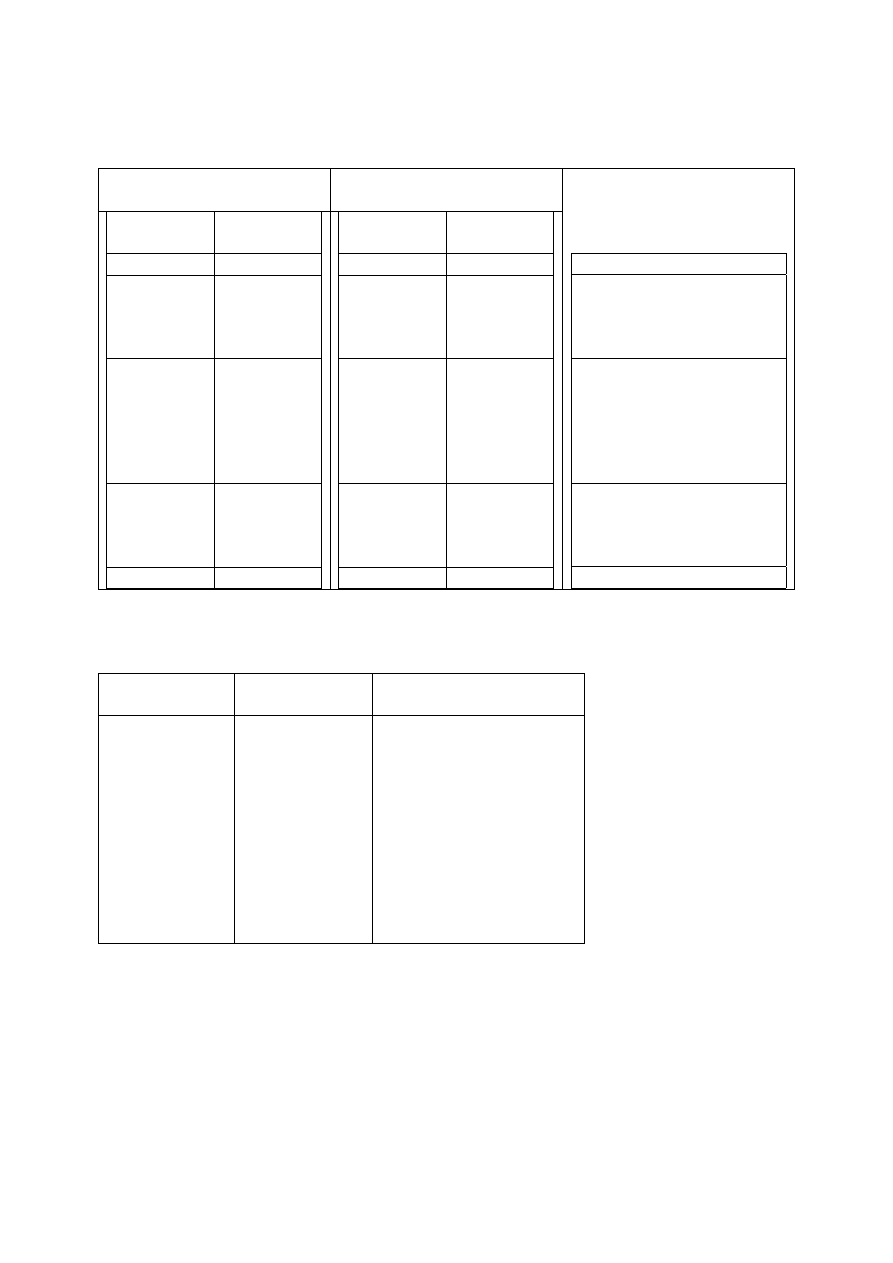
Rozważmy następującą sytuację:
N = 4 rozróżnialne cząstki w naczyniu podzielonym na dwie części, L i P.
Mikrostany Makrostany
Prawdopodobieństwo
termodynamiczne
Cząstki w L
Cząstki w P
---
1234
1
2
3
4
234
134
124
123
12
13
14
23
24
34
34
24
23
14
13
12
234
134
124
123
1
2
3
4
1234
---
Liczba
cząstek w L
Liczba
cząstek w P
0 4
1
3
2
2
3
1
4 0
1
4
6
4
1
Dla N = 1 0
Liczba
cząsteczek w L
Liczba
cząsteczek w p
Prawdopodobieństwo
termodynamiczne
0
1
2
3
4
5
6
7
8
9
10
10
9
8
7
6
5
4
3
2
1
0
1
10
45
120
210
252
210
120
45
10
1
Największe
prawdopodobieństwo
termodynamiczne mają
makrostany
odpowiadające
równomiernemu
rozkładowi cząstek
Stąd mamy 2
10
= 1024 możliwych mikrostanów.
Dla N = 40 mielibyśmy 2
40
≈ 10
12
możliwych mikrostanów i przy mikrostanach
zmieniających się co sekundę trzeba czekać ok. 35000 lat na fluktuację, w której jedna z
połówek naczynia byłaby pusta.
2

Rozważmy układ N rozróżnialnych cząstek, które dzielimy pomiędzy k komórek:
{
k
n
n ,...,
1
}
- makrostan.
Prawdopodobieństwo termodynamiczne jest określane następująco:
!
!...
!
!
2
1
k
n
n
n
N
P
=
Rozpatrzmy N cząstek gazu zamkniętych w naczyniu o objętości V.
V/k - układ dzielimy na k jednakowych komórek.
Szukamy takiego rozkładu, dla którego P = P
max
. Oczywiście wtedy dP = 0 . Wygodniej jest
rozważać ln P:
( )
∑
=
−
=
k
n
i
n
N
P
1
!
ln
!
ln
ln
N, n
i
bardzo duże, można przybliżyć silnię za pomocą wzoru Stirlinga:
x
x
x
x
−
= ln
)
!
ln(
(
)
∑
∑
−
−
−
=
i
i
i
n
n
n
N
N
N
P
ln
ln
ln
=
,
∑
−
i
i
n
n
N
N
ln
ln
∑
=
i
i
n
N
Mamy znaleźć d(lnP) = 0 , ale pod dodatkowym warunkiem stałości całkowitej liczby
cząstek:
(
) ∑
∑
=
=
=
0
i
i
dn
n
d
dN
(
) (
)
(
) (
)
[
]
(
)
(
)
∑
∑
∑
∑
−
=
+
−
=
=
+
−
=
−
=
i
i
i
i
i
i
i
i
i
i
i
i
i
i
dn
n
dn
n
n
dn
n
dn
n
n
d
n
n
n
d
N
N
d
P
d
ln
ln
ln
ln
ln
ln
ln
Mamy więc:
(
)
0
ln
=
−
∑
i
i
dn
n
i
0
=
∑
i
dn
Metoda mnożników Lagrange’a:
+
• α
Stąd otrzymujemy:
(
)
0
ln
=
−
∑
i
i
dn
n
α
Aby to równanie było spełnione dla dowolnych dn
i
, musi być spełniony warunek:
3

α
α
e
n
n
i
i
=
⇒
= ln
Normalizację można uzyskać z warunku:
α
ke
N
n
i
=
=
∑
Otrzymujemy:
k
N
n
i
=
Najbardziej prawdopodobny jest makrostan odpowiadający równomiernemu rozkładowi
cząstek gazu w całej objętości.
Ocena półszerokości maksimum rozkładu prawdopodobieństwa.
∑
∑
∆
∂
∂
+
∆
∂
∂
+
=
2
ln
ln
ln
ln
2
max
2
2
max
max
i
i
i
i
n
n
P
n
n
P
P
P
P – prawdopodobieństwo termodynamiczne makrostanu, w którym poszczególne liczby n
i
różnią się o
∆n
i
od swych wartości w stanie równowagi statystycznej ( dla P = P
max
).
Ze wzoru na ln P mamy:
i
i
n
n
P
1
ln
2
2
−
=
∂
∂
(*)
Z warunku na maksimum P dostajemy:
∑
=
∆
∂
∂
0
ln
max
i
i
n
n
P
(**)
Podstawiając (*) i (**) do wyrażenia na ln P oraz wprowadzając oznaczenie
i
i
i
n
n
∆
=
δ
,
dostajemy:
∑
−
=
2
max
2
1
ln
ln
i
i
n
P
P
δ .
Zatem:
−
=
∑
2
max
2
1
exp
i
i
n
P
P
δ
Jeśli założymy, że wszystkie
δ
i
są jednakowe tzn.
δ
i
=
δ, to wtedy:
−
=
−
=
∑
N
P
n
P
P
i
2
max
2
max
2
1
exp
2
1
exp
δ
δ
4

W 1 cm
3
gazu znajduje się około N=10
19
cząsteczek. Załóżmy, że rozkład cząstek różni się o
δ=10
-8
od rozkładu najbardziej prawdopodobnego. Wówczas:
500
max
16
19
max
10
10
2
1
exp
−
−
=
⋅
⋅
−
≈
e
P
P
P
!
Wynika stąd, że tylko mikrostany bardzo zbliżone do rozkładu najbardziej prawdopodobnego
mają prawdopodobieństwo wystąpienia znacząco różne od zera.
Entropia w fizyce statystycznej.
Boltzmann podał związek pomiędzy entropią a prawdopodobieństwem termodynamicznym:
P
S
ln
∝
. Planck wprowadził do tego wzoru współczynnik proporcjonalności k:
P
k
S
ln
=
,
K
J
k
23
10
38
,
1
−
⋅
=
.
Proporcjonalność S do lnP wynika z następującego rozumowania: rozważmy dwa układy
określone przez ich prawdopodobieństwa termodynamiczne oraz entropie: (P
a
, S
a
) i (P
b
, S
b
).
Załóżmy też, że entropia jest funkcją P: S=f(P). Ponieważ entropia jest parametrem
ekstensywnym:
,
b
a
b
a
S
S
S
+
=
+
oraz:
,
b
a
b
a
P
P
P
⋅
=
+
zatem po podstawieniu S=f(P) do pierwszej z tych równości mamy:
(
)
(
)
( ) (
.
b
a
b
a
b
a
P
f
P
f
P
P
f
P
f
+
=
⋅
=
+
)
Stąd wynika, że funkcją taką może być f(x)=ln(x).
5
Document Outline
Wyszukiwarka
Podobne podstrony:
Term 10
exam 10 I term
term 2009 III 10
W3 I zas term (15 10 15)
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
wyklad 10 MNE
Kosci, kregoslup 28[1][1][1] 10 06 dla studentow
10 budowa i rozwój OUN
10 Hist BNid 10866 ppt
POKREWIEŃSTWO I INBRED 22 4 10
Prezentacja JMichalska PSP w obliczu zagrozen cywilizacyjn 10 2007
Mat 10 Ceramika
więcej podobnych podstron