Proces adiabatyczny q = 0
dU = w
el
Praca objętościowa w odwracalnym
procesie
V
dV
nRT
pdV
w
el
V
dV
nRT
dU
dU = n c
V
dT
V
dV
RT
dT
c
V
2
1
2
1
V
V
T
T
V
V
dV
R
T
dT
c
1
2
1
2
V
V
V
ln
T
T
ln
R
c
2
1
R
c
1
2
V
V
T
T
V
Układ nie wymienia ciepła z otoczeniem
I ZASADA TERMODYNAMIKI
dU = q
el
+ w
el
rozdzielamy zmienne
całkujemy
delogarytmujemy
2
1
R
c
1
2
V
V
ln
T
T
ln
v
Proces adiabatyczny q = 0
2
1
R
c
1
2
V
V
T
T
V
nR
pV
T
2
1
R
c
1
1
2
2
V
V
V
p
V
p
V
V
c
R
2
1
1
1
2
2
V
V
V
p
V
p
1
γ
c
c
c
c
R
V
V
p
V
V
p
c
c
γ
1
γ
2
1
1
1
2
2
V
V
V
p
V
p
γ
1
1
γ
2
2
1
γ
1
1
1
1
γ
2
2
2
V
p
V
p
V
V
p
V
V
p
pV
= const
I ZASADA TERMODYNAMIKI
gdzie
Przemiana adiabatyczna q = 0
V
p
c
c
γ
const
pV
γ
= 1 pV = const
Proces izotermiczny
const
nR
T
p
p
p
nRT
p
γ
γ
γ
γ
const
p
T
const
p
T
γ
γ
1
γ
1
γ
const
pV
γ
Adiabatyczne rozprężanie gazu
doskonałego q=0
W sposób odwracalny
:
dU = -pdV
gdy q
el
= 0
V
dV
nRT
dT
nc
V
1
2
1
2
V
V
V
ln
T
T
ln
R
c
2
1
R
c
1
2
V
V
T
T
V
C
C
γ
V
V
T
T
V
p
1
γ
2
1
1
2
V
nRT
p
I ZASADA TERMODYNAMIKI
Temperatura koocowa gazu po rozprężaniu
adiabatycznym odwracalnym
Praca wykonana przez gaz podczas
odwracalnego rozprężania adiabatycznego
w =
U = n c
v
(T
2
- T
1
)
dU = n c
V
dT

Adiabatyczne rozprężanie gazu
doskonałego q=0
dU = -pdV
gdy q
el
= 0
W sposób nieodwracalny
przeciwko stałemu zewnętrznemu ciśnieniu:
p = p
z
= const.
1
1
2
2
z
1
2
V
1
2
z
1
2
V
V
V
z
T
T
V
z
V
p
nRT
p
nRT
p
)
T
(T
nc
)
V
(V
p
)
T
(T
nc
dV
p
dT
nc
dV
p
dT
nc
2
1
2
1
p
z
= p
2
R
c
p
p
R
c
T
T
p
p
RT
T
c
RT
T
c
V
1
z
V
1
2
1
z
1
1
V
2
2
V
Temperatura koocowa gazu po adiabatycznym
rozprężaniu przeciwko stałemu ciśnieniu zależy
od rodzaju gazu (c
v
).
I ZASADA TERMODYNAMIKI
Praca wykonana przez gaz podczas
nieodwracalnego rozprężania adiabatycznego
w =
U = n c
v
(T
2
- T
1
)
dU = n c
V
dT

I zasada termodynamiki
w przemianach gazu doskonałego
dU = q
el
+ w
el
c
p
– c
V
= R
dU = q
el
– pdV
H = U + pV
dU = dH – nRdT
dH = dU + d(pV)
dH = dU + d(nRT)
pV = nRT
dH = dU + nRdT
dU = nc
V
dT
dH = nc
p
dT
nc
V
dT = nc
p
dT - nRdT
c
V
= c
p
- R

I zasada termodynamiki
w przemianach gazu doskonałego
Proces izochoryczny, V = const.
dV = 0
dU = q
el
– pdV
dU = q
el
nc
V
dT = q
el
Jeżeli c
V
= const w zakresie temp. T
1
- T
2
to
∆ U = q
V
= nc
V
(T
2
– T
1
) ;
w = 0
const
T
p

I zasada termodynamiki
w przemianach gazu doskonałego
Proces izobaryczny, p = const, dp = 0
dU = q
el
– pdV
q
el
= dU + pdV = dH = nc
p
dT
Jeżeli c
P
= const w zakresie temp. T
1
- T
2
to
∆U = q
p
- p∆V,
q
p
= ∆H = n c
p
( T
2
– T
1
); w = - p ( V
2
– V
1
)
cons t
T
V

Proces izotermiczny
,
T = const
, dT = 0
pV = const
dU = q
el
– pdV
q
el
= pdV
I zasada termodynamiki
w przemianach gazu doskonałego
dU = nc
V
dT
dH = nc
p
dT
dH = 0
dU = 0
w = - n RT ln (V
2
/ V
1
) = n RT ln ( p
1
/ p
2
)
q = - w = n RT ln (V
2
/ V
1
) = n RT ln ( p
1
/ p
2
)

.
Proces adiabatyczny, q = 0
pV
= const,
= c
p
/c
V
dU = q
el
– pdV
dU = - pdV
n c
V
dT = - pdV
Jeżeli c
V
=const w zakresie temp. T
1
- T
2
to
∆ U = n c
V
(T
2
– T
1
)
w = n c
V
(T
2
– T
1
) = ( n c
V
/ nR )
( p
2
V
2
- p
1
V
1
)= 1 / (
- 1)
(p
2
V
2
– p
1
V
1
)
I zasada termodynamiki
w przemianach gazu doskonałego
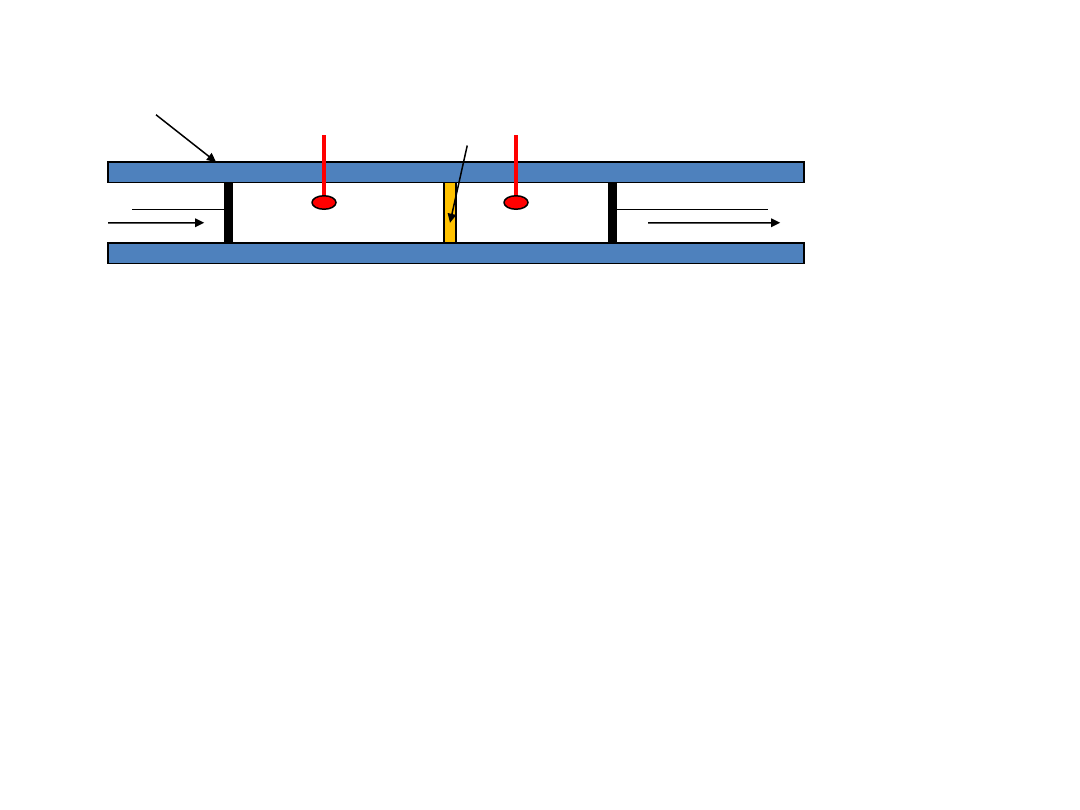
Doświadczenie Joule’a – Thompsona rozprężanie gazu przez zawór dławiący
T
1
T
2
p
1
p
2
Ścianki adiabatyczne
q = 0
porowata
przegroda
1
1
1
1
0
V
1
1
V
p
)
V
(0
p
dV
p
w
1
praca wykonana na gazie w lewej komorze
2
2
2
2
V
0
2
2
V
p
0)
(V
p
dV
p
w
2
praca wykonana przez gaz w prawej komorze
Praca układu w = w
1
+ w
2
Zmiana energii wewnętrznej układu: ∆U = w, bo q=0
U
2
– U
1
= p
1
V
1
- p
2
V
2
U
2
+ p
2
V
2
= U
1
+ p
1
V
1
H
2
= H
1
∆H=0
Cel doświadczenia – określenie zależności pomiędzy temperaturą i ciśnieniem podczas rozprężania gazu
przez zawór dławiący w termicznie izolowanym zbiorniku.
Gaz z lewej komory przetłaczany jest pod stałym wyższym ciśnieniem p
1
do komory prawej, która
zamknięta jest tłokiem pod stałym niższym ciśnieniem p
2
.
Izolacja termiczna uniemożliwia wymianę
ciepła z otoczeniem.
Temperatura gazu w komorze o niższym ciśnieniu była niższa.
Rozprężanie gazu przez zawór dławiący jest
procesem izoentalpowym
P
1
> P
2
Współczynnik Joule’a-Thomsona:
W eksperymencie J-T stwierdzono, że procesowi rozprężania gazu przez zawór dławiący towarzyszy
ochładzanie lub ogrzanie gazu.
0
dT
T
H
dp
p
H
dH
p
T
dp
p
H
dT
T
H
T
p
p
T
H
T
H
p
H
dp
dT
Współczynnik Joule’a - Thompsona
p
T
JT
c
p
H
μ
p
JT
T
c
μ
p
H
H
JT
dp
dT
μ
Wpływ temperatury i ciśnienia na entalpię gazu rzeczywistego:
H = f(T,p)
Izotermiczny współczynnik
Joule’a-Thomsona:
JT
p
T
T
μ
c
p
H
μ
Zmiana entalpii gazu
rzeczywistego dH = c
p
dT -
JT
c
p
dp
doskonałego dH = c
p
dT
dp
p
H
dT
T
H
dH
T
p
c
p
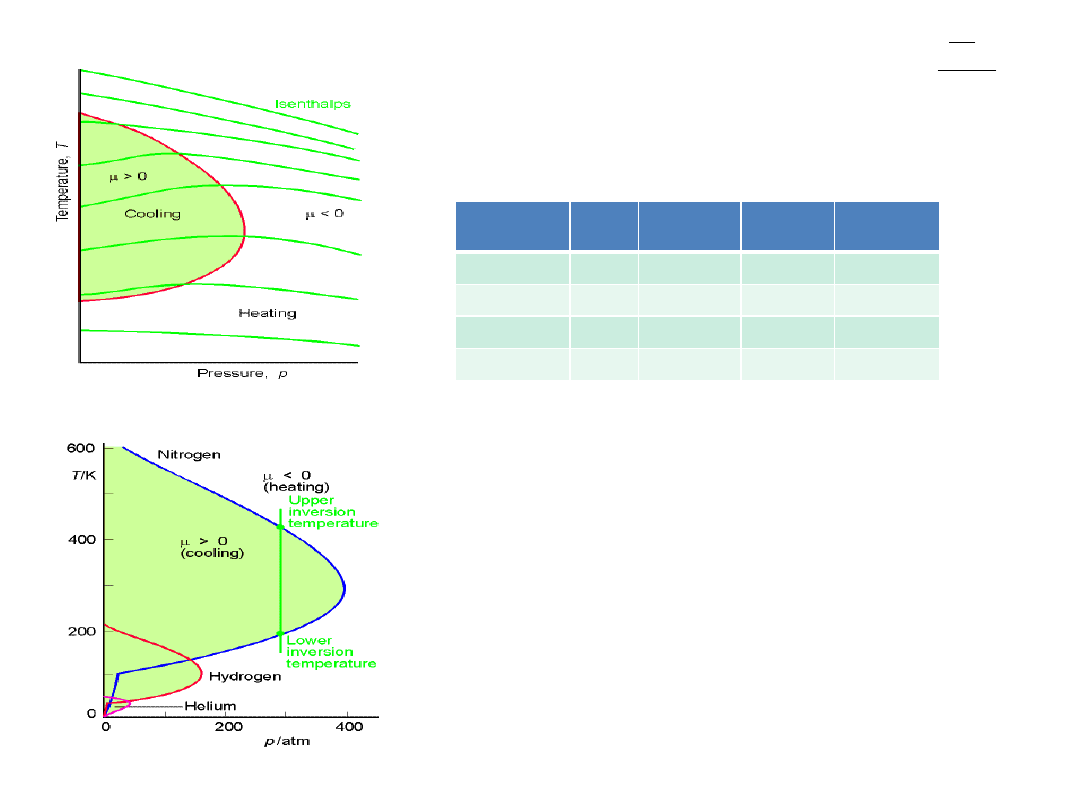
Współczynnik Joule’a-Thomsona zależy temperatury
rozprężanie ochładza gaz tylko wtedy, gdy temperatura
gazu leży pomiędzy dolną i górną temperaturą inwersji
Temperatury inwersji dla: azotu, wodoru i helu
gaz
T
inw
T
top
T
wrz
(
JT
)
298
Ar
723
83,8
87,3
CO
2
1500
197,7
1,11
He
40
4,2
-0,06
N
2
621
63,3
77,4
0,25
Efekt Joule’a – Thomsona -
ochładzanie się gazu podczas jego rozprężania jest
wykorzystywane w
procesie skraplania gazu
.
W skraplarce Lindego gaz rozpręża się kilkakrotnie w
zamkniętym obiegu, ochładzając w przeciwprądzie gaz
rozprężany. Kiedy jego temperatura spadnie poniżej
temperatury wrzenia następuje skroplenie
p
T
JT
c
p
H
μ
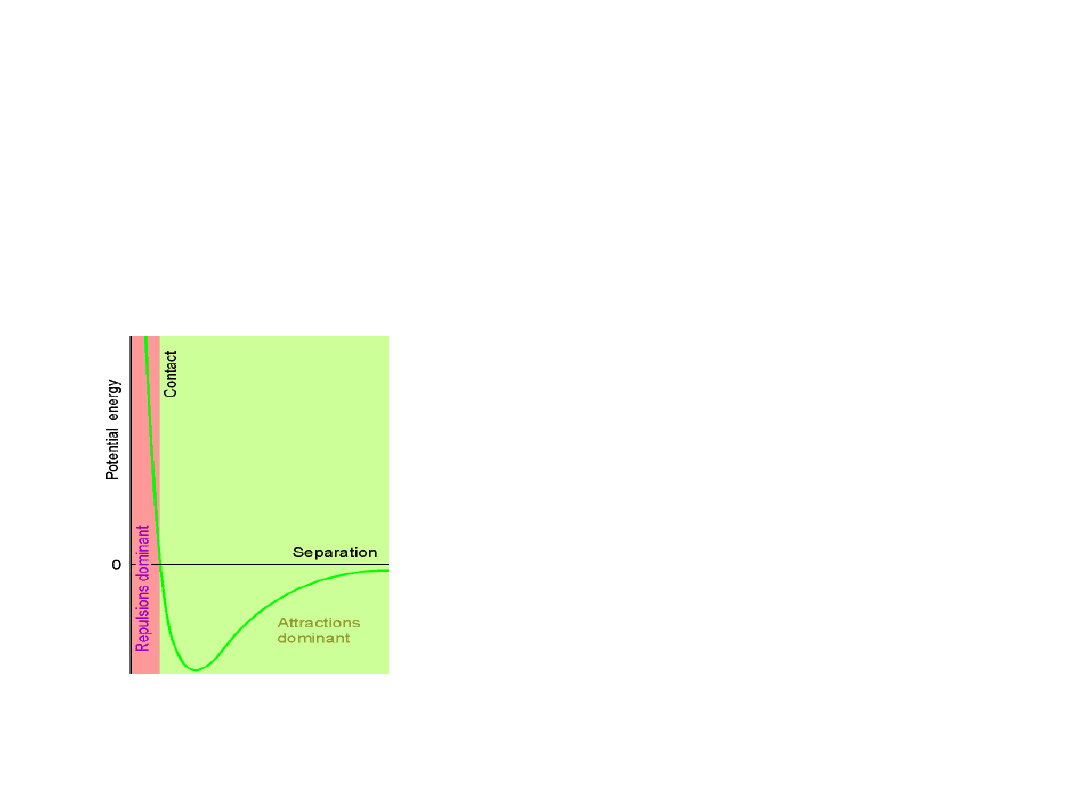
Gazy rzeczywiste
Różnice w zachowaniu się gazów rzeczywistych w porównaniu z gazem doskonałym
wynikają z:
oddziaływao międzycząsteczkowych
objętości własnej cząsteczek
Energia oddziaływao (energia potencjalna) dwóch cząsteczek gazu zależy od ich
wzajemnej odległości
Duża energia potencjalna występuje przy małych odległościach – dominują siły
odpychania
Ujemna energia potencjalna występuje przy odległościach pośrednich
– dominują siły przyciągania
Przy dużych odległościach energia potencjalna dąży do 0
-oddziaływania międzycząsteczkowe zanikają.
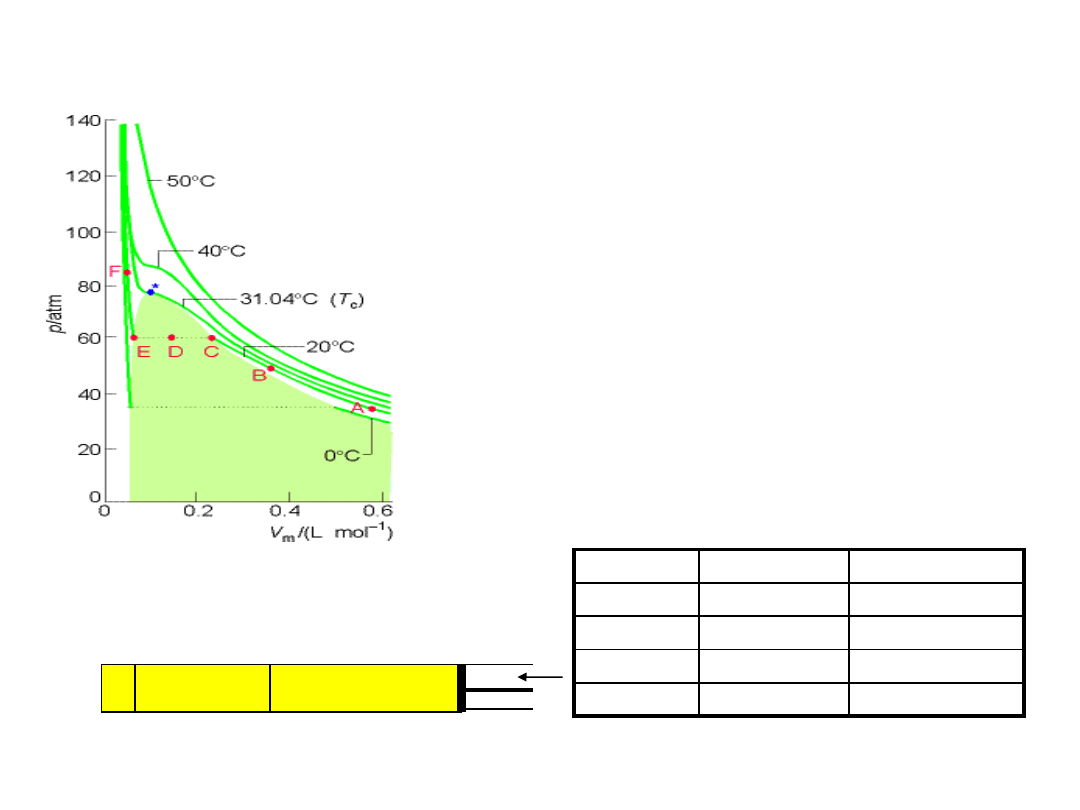
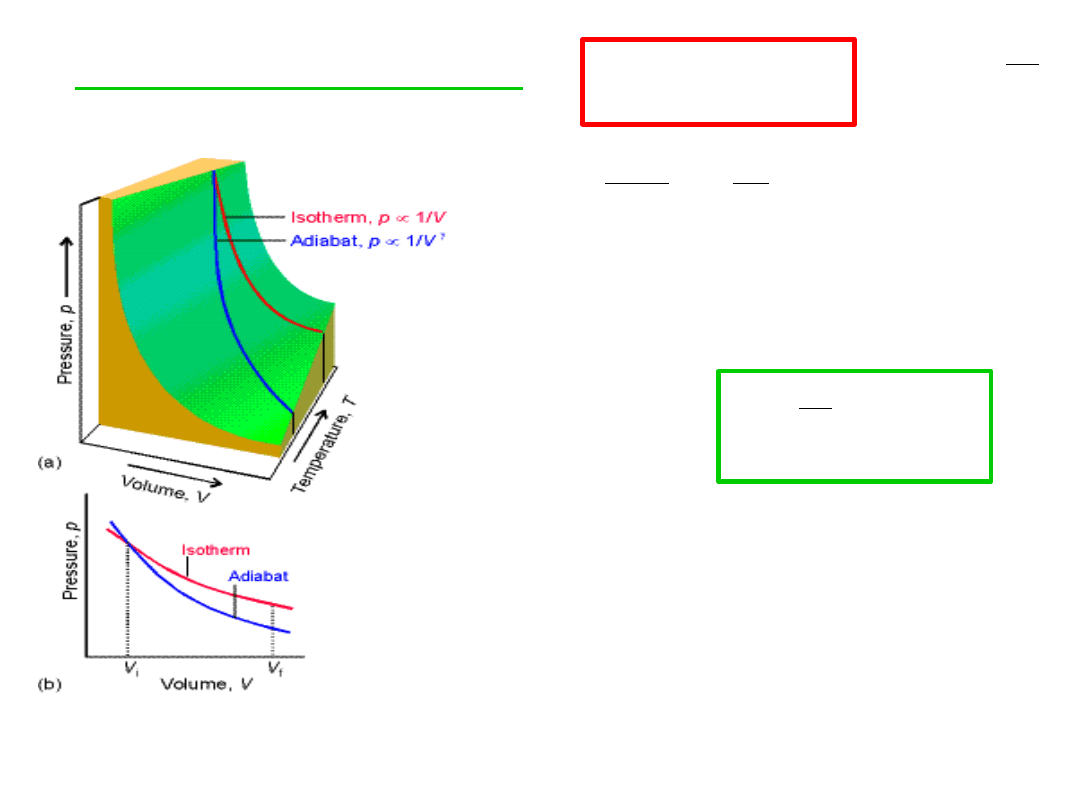
Doświadczalne izotermy CO
2
Odchylenia od równania stanu gazu doskonałego wzrastają gdy p↗ , T↘
1869 r Thomas Andrews
warunki krytyczne dla gazów (∗)
Doświadczalne izotermy CO
2
w zakresie temperatur 0-50
0
C
Temperatura krytyczna T
kr
Dla T >T
kr
gaz zachowuje się jak gaz doskonały, nie skrapla
się w czasie sprężania.
Tworzy się płynna
faza nadkrytyczna:
nie ciecz, bo nie
posiada powierzchni rozdziału od gazu; i nie gaz, bo jej
gęstośd jest porównywalna z gęstością cieczy.
Dla T<T
kr
skraplanie gazu
gaz
T
kr
[K]
p
kr
[Pa]
O
2
154,3
50,4 x 10
5
N
2
126,0
33,9 x 10
5
H
2
33,2
13,0 x 10
5
CO
2
304,19
74,0 x 10
5
Parametry krytyczne
F E D
C B A
gaz
skraplanie
ciec
z
Sprężanie CO
2
w temp. 20
0
C
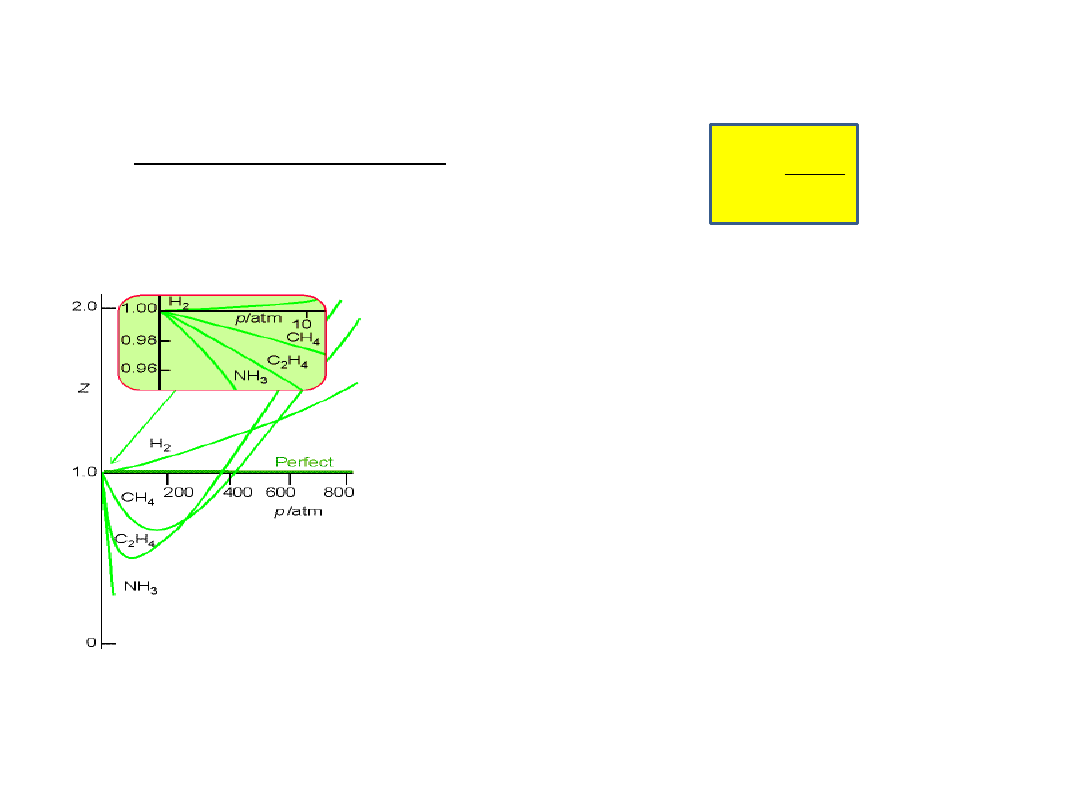
Gazy rzeczywiste
pV
m
= z RT
Współczynnik ściśliwości gazu charakteryzuje siły
oddziaływao międzycząsteczkowych i zależy od
rodzaju gazu, ciśnienia i temperatury.
RT
pV
z
m
dla gazów rzeczywistych z
1
z< 1 silne oddziaływania przyciągające,
V
rz
m
< V
m
gazu doskonałego.
z> 1 dominuje odpychanie cząsteczek,
V
rz
m
>V
m
gazu doskonałego.
dla gazu doskonałego z=1
1
lim
0
z
p
Zależnośd z = f(p) w temp.
273K
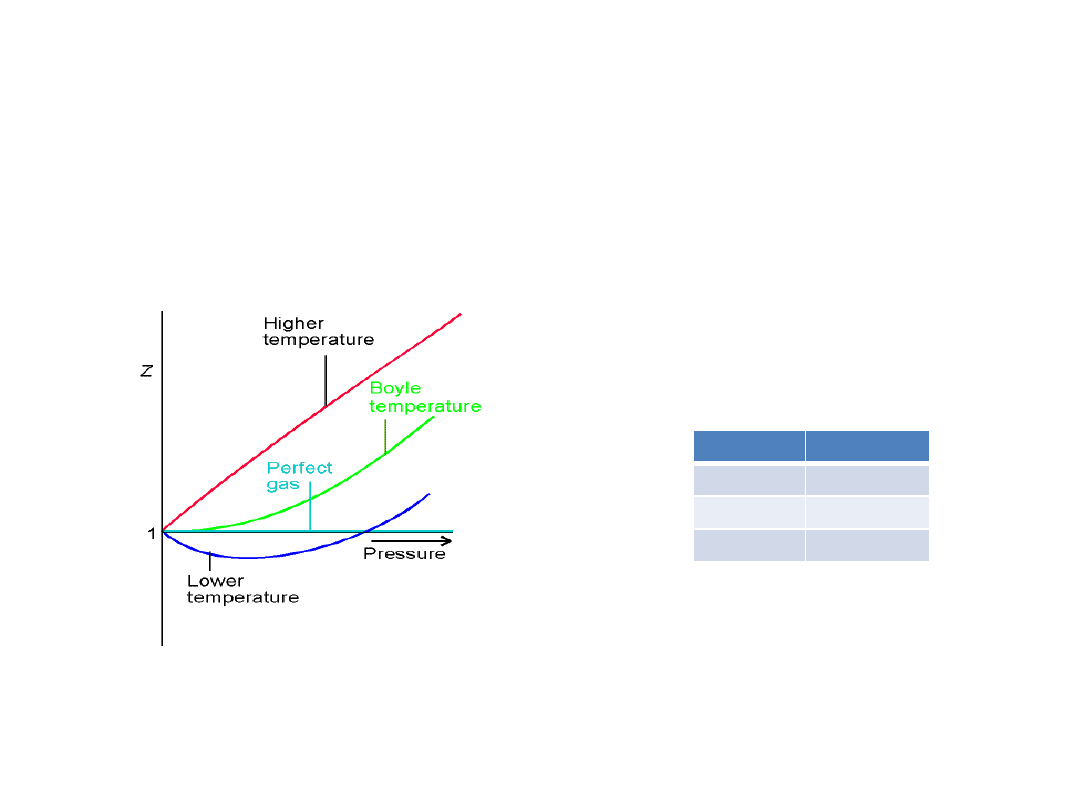
Gazy rzeczywiste
pV
m
= z RT
Dla gazów rzeczywistych
gdy p→ 0 to z →1 z różnym nachyleniem w zależności od temperatury.
W temperaturze Boyle’a T
B
właściwości gazów rzeczywistych zbliżają się do
właściwości gazu doskonałego w zakresie niskich ciśnieo.
Zależnośd z = f(p) w różnych temperaturach
gaz
T
B
[K]
Ar
411,5
CO
2
714,8
N
2
346,8

Równania stanu gazu rzeczywistego
Równanie wirialne (siłowe):
pV
m
= zRT
...)
p
C
p
B
RT(1
pV
2
'
'
m
...
V
C
V
B
1
RT
pV
2
m
m
m
B, B’, C, C’ ….
eksperymentalnie wyznaczane
współczynniki wirialne

Równania stanu gazu rzeczywistego
RT
b
V
V
a
p
m
2
m
Równanie van der Waalsa
Współczynniki van der Waalsa można obliczyd z parametrów krytycznych gazu :
V
m,kr
= 3b
zr
zr
2
zr
zr
8T
1
3V
V
3
p
Równie van der Waalsa w postaci zredukowanej
nRT
nb
V
V
n
a
p
2
cząsteczki gazu posiadają określoną objętośd i kształt –
parametr b = objętośd wyłączona 1 mola cząsteczek gazu
b = 4(4/3
r
3
) N
A
między cząsteczkami występują siły oddziaływania proporcjonalne (parametr a) do kwadratu
stężenia molowego gazu
2
kr
27b
a
p
27bR
8a
T
kr
Jeżeli parametry stanu gazu podzielimy przez odpowiednie parametry krytyczne otrzymamy tzw.
parametry zredukowane:
T
zr
= T / T
kr
, p
zr
= p / p
kr
,
V
zr
= V
m
/ V
m
,
kr
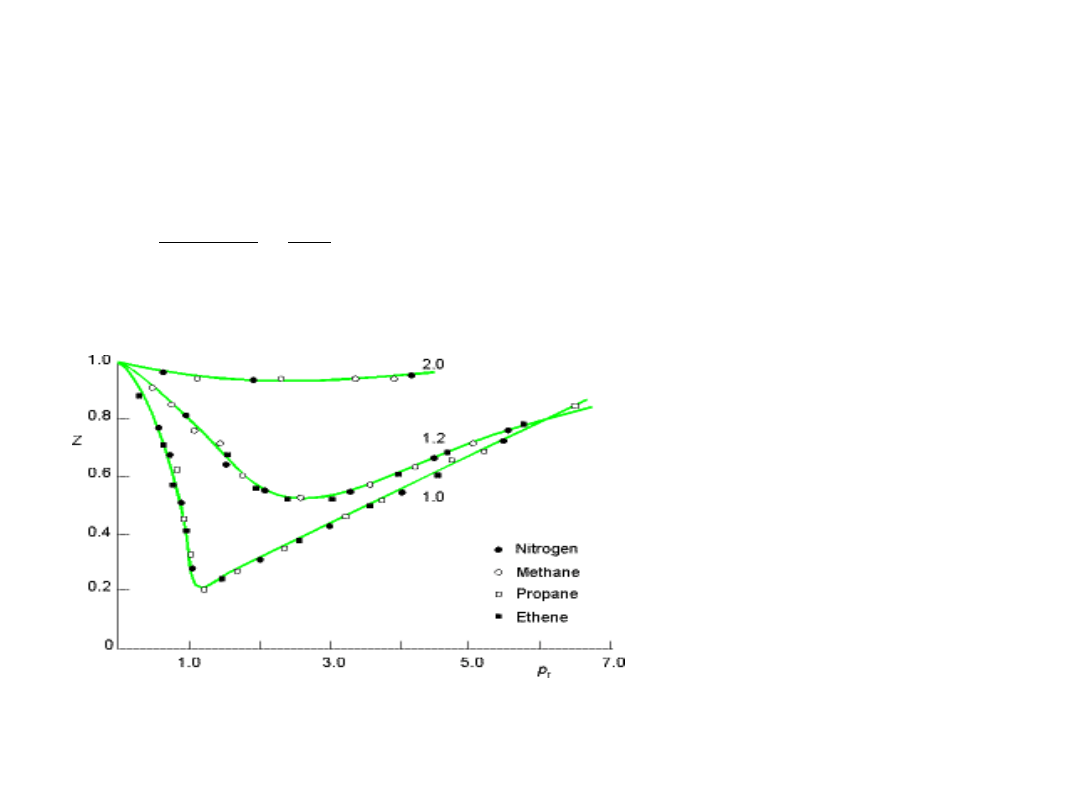
Zasada stanów odpowiadających sobie
Różne gazy wykazują zbliżone właściwości fizyczne, gdy znajdują się pod tym
samym zredukowanym ciśnieniem i w tej samej zredukowanej temperaturze .
2
zr
zr
zr
zr
V
3
1
3V
8T
p
Zredukowane równanie van der Waalsa
wyraża ciśnienie w funkcji objętości
niezależnie od rodzaju gazu.
Zależnośd współczynników ściśliwości z od zredukowanego ciśnienia p
zr
dla różnych temperatur zredukowanych
N
2
CH
4
CH
3
–CH
2
–CH
3
CH
2
=CH
2
Wyszukiwarka
Podobne podstrony:
W5 II zas termod(29 10 15)
OT c5 bb 1 term 15
zas stab 15
I zas term, U, H
15 10 2010 Polityka przemysłowa i polityka wspierania konkurencjiid 16086 ppt
10 Wykład (15 12 2010)
10 15
Elektrorafinacja 16 10 15
Ćwiczenie 1 2 09 15 10 2011
krajowa strategia bhp na lata 2009 2012 15 10 08
loveparade 2010 anlage 15 protokoll szenarioworkshop 08 07 10
15 10,22 10 2013 Sapa Internetid 16087
10 (15)
03 Immunologia prelekcja 10 15 2007id 4167 (2)
OWI Wykład 2 (15 10 2011)
KPF w Neurologii wiczenia 2 (15 11 10)
15 10 13 i" 10 13 [Co to jest prawo]
Koszykówka atak szybki 02 10 15
15 10
więcej podobnych podstron