
www.think.wsiz.rzeszow.pl
, ISSN 2082-1107,
Nr 4 (12) 2012, s. 75-86
O
TRZYMYWANIE
B
EZWODNIKA
O
CTOWEGO
M
ETODĄ
U
TLENIANIA
A
LDEHYDU
O
CTOWEGO
Aleksandra Wójtowicz
Uniwersytet Ekonomiczny we Wrocławiu
Streszczenie
Bezwodnik octowy to organiczny związek chemiczny znajdujący zastosowanie w wielu gałęziach
przemysłu. Największe jego ilości stosuje się do otrzymywania kwasu acetylosalicylowego. Korzysta
z niego również przemysł włókienniczy, który wykorzystuje go do produkcji włókien sztucznych, głów-
nie octanu i polioctanu winylu. Ze względu na zastosowanie bezwodnika octowego do otrzymywania
materiałów wybuchowych oraz narkotyków, znajduje się on na liście substancji objętych obrotem
kontrolowanych. W artykule dokonano przeglądu literaturowego istniejących rozwiązań technolo-
gicznych oraz szczegółowo omówiono proces produkcji bezwodnika octowego metod utleniania alde-
hydu octowego.
Wstęp
Bezwodnik octowy należy do klasy bezwodników kwasów karboksylowych o wzorze (CH
3
CO)
2
O. Naj-
ważniejsze właściwości bezwodnika octowego zestawiono w Tabeli 1.

Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
76
Tabela 1: Właściwości fizykochemiczne bezwodnika octowego
Źródło: opracowanie własne na podstawie:
http://www.poch.com.pl/wysw/utworz_pdf.php?nr_karty=840
1. Przegląd literaturowy istniejących rozwiązań technologicznych
1.1. Metody oparte na acetylenie
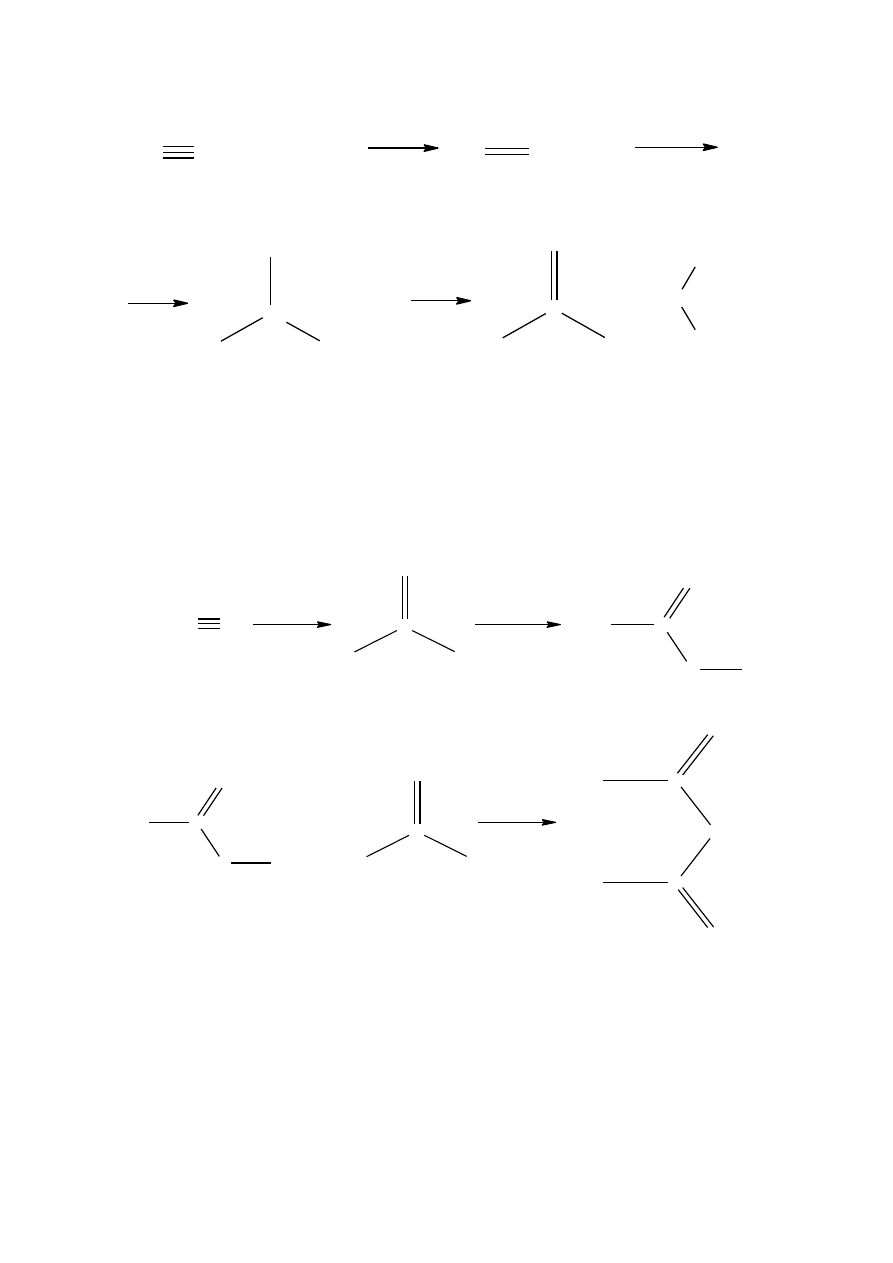
Do przemysłowej produkcji bezwodnika octowego stosuje się są metody ekonomiczne, oparte na
acetylenie jako materiale wyjściowym, a mianowicie
1
:
1. Ogrzany do temperatury 60-85
o
C acetylen wprowadza się do bezwodnego (lodowatego) kwasu
octowego. Jako katalizatory stosuje się octan rtęci (II) i siarczan rtęci (II). W wyniku takiego pro-
cesu powstaje dioctan etylidenu, który rozkłada się do bezwodnika octowego przez destylację
w obecności 3% ZnCl
2
.
1
B. Bobrański, Chemia organiczna, Wydawnictwo Naukowe PWN, Warszawa 1992, s. 239.
Stan skupienia
Ciecz
Masa cząsteczkowa
102, 09 g/mol
Barwa
Bezbarwna
Zapach
Ostry, gryzący, owocowo – eterowy
Temperatura topnienia
-123,5
o
C
Temperatura wrzenia
139,5
o
C
Gęstość
1,08 g/cm
3
Gęstość par względem powietrza
3,5
Prężność par
5 hPa
Rozpuszczalność w wodzie
Częściowo rozpuszczalny
Rozpuszczalność w innych substancjach
Rozpuszcza się w alkoholu, chloroformie, glicerolu i
eterze
Temperatura zapłonu
49
o
C
Temperatura samozapłonu
389
o
C
Wartość pH 10 g/l/20
o
C
ok. 3
Toksyczność
Zatrucia, podrażnienie błon śluzowych, oczu, głów-
nie na skutek wdychania par, oparzenia skóry
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
77
CH
C
H
+
HOOCCH
3
C
H
2
CHOOCCH
3
OOCCH
3
CH
C
H
3
OOCCH
3
+
COCH
3
O
COCH
3
O
C
C
H
3
H
+HOOCCH
3
acetylen
octan winylu
dioctan etylidenu
aldehyd octowy
bezwodnik octowy
C
H
CH
H
2
0
katalizator
O
3
C
H
3
C
O
O
OH
+
C
H
3
C
C
H
3
C
O
O
O
+
O
H
2
OH
O
C
C
H
3
O
O
C
H
3
C
H
O
C
H
3
C
H
acetyl en
aldehyd octowy
kwas nadoctowy
kwas nadoctowy
aldehyd octowy
bezwodnik octowy
2. Acetylen rozpuszcza się w kwasie octowym, jako katalizator stosuje się 2% Mn(OOCCCH
3
)
2.
Do tak
sporządzonego roztworu wprowadza się powietrze o temperaturze 50-70
o
C pod ciśnieniem 6
MPa. Reakcja przebiega według następującego schematu:
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
78
C
H
3
C
O
OH
+
O
C
CH
2
C
H
3
C
C
H
3
C
O
O
O
keten
kwas octowy
bezwodnik octowy
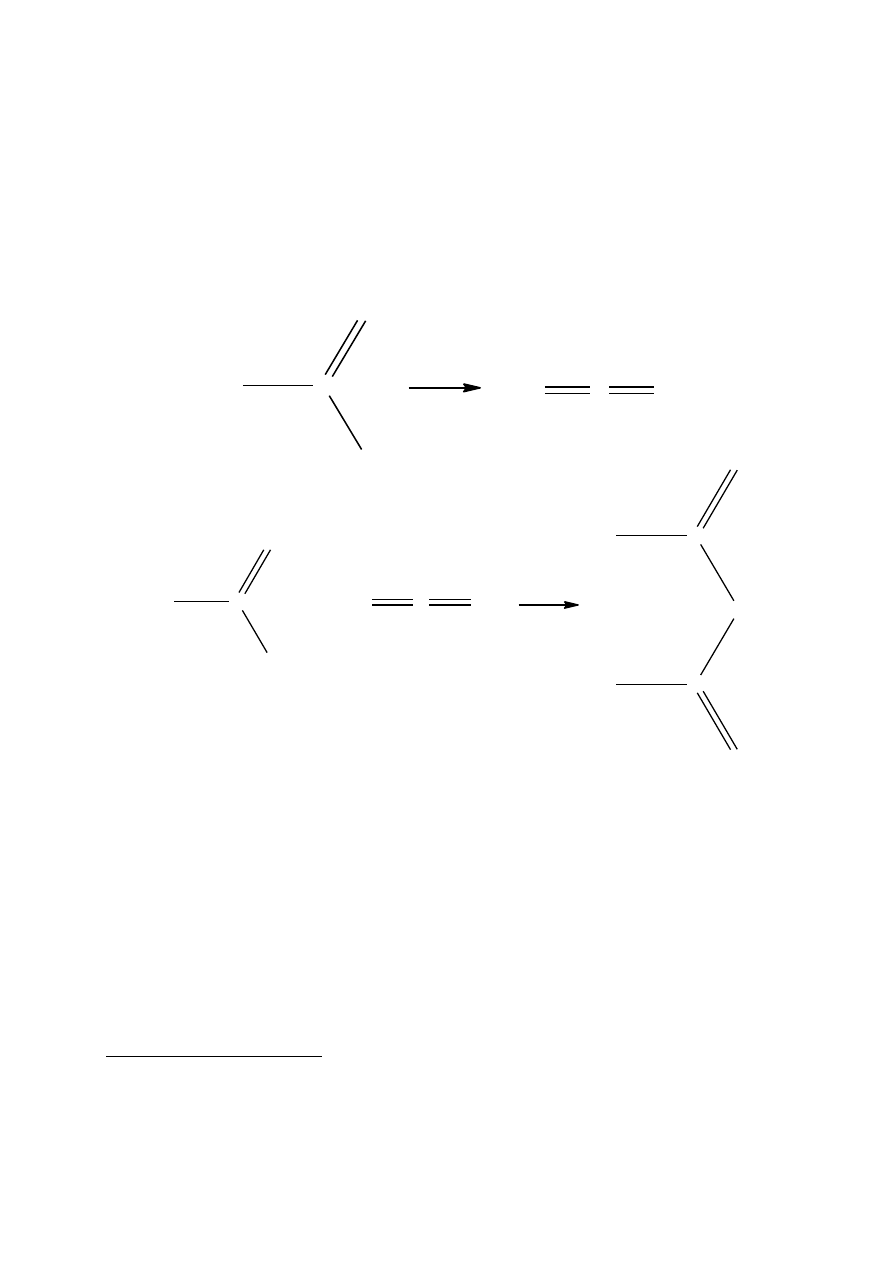
1.2. Otrzymywanie bezwodnika octowego z kwasu octowego
Bezwodnik kwasu octowego produkuje się również na skalę przemysłową z kwasu octowego. Pary
kwasu octowego zawierające 1-3% kwasu fosforowego albo pirydyny prowadzi się pod ciśnieniem 47
Pa przez rurę węglową ogrzaną do 800
o
C
2
. W tych warunkach kwas octowy jest pirolitycznie odwad-
niany do ketenu, który reaguje z następną cząsteczką kwasu octowego, tworząc bezwodnik
3
.
Rozkład kwasu octowego przeprowadza się w piecach rurowych. Produktami takiego rozkładu są
głównie keten i woda z domieszką produktów ubocznych (metan, węglowodory nienasycone, tlenek
węgla). Dodaje się do nich małą ilość amoniaku. Rola amoniaku polega na zobojętnieniu utworzonego
w czasie procesu z fosforanu trietylowego kwasu fosforowego, który katalizuje proces powstawania
kwasu octowego z ketenu
4
. Produkty reakcji chłodzone są w chłodnicy, a następnie poddawane są
absorpcji i rektyfikacji.
Zastosowanie tej metody pozwala na otrzymanie bezwodnika kwasu octowego z wydajnością około
95%.
2
Tamże, s. 240.
3
E. Białecka-Florjańczyk, J. Włostowska, Chemia organiczna, Wydawnictwa Naukowo-Techniczne, Warszawa
2007, s.243.
4
S. Ropuszyński, Chemia i technologia podstawowej syntezy organicznej, Wydawnictwo Politechniki Wrocław-
skiej. Wrocław 1993, s. 327
C
H
3
C
O
OH
-H
2
O
C
H
2
C
O
keten

Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
79
1.3. Otrzymywanie bezwodnika octowego z gazu syntezowego
Tę metodę otrzymywania bezwodnika octowego wprowadziła w latach osiemdziesiątych firma Hal-
con. Produktami pośrednimi w procesie są metanol i kwas octowy otrzymane na bazie gazu syntezo-
wego. Wytwarza się z nich ester – octan metylu, który następnie poddaje się karbonylowaniu w reak-
cji z tlenkiem węgla:
Karbonylowanie przebiega w temperaturze 150-220
o
C, pod ciśnieniem 2,5-7,5 MPa, w obecności
homogenicznego katalizatora rodowego aktywowanego jodkiem metylu
5
.
2. Właściwości chemiczne oraz kierunki zastosowania bezwodnika octowego
Produkcja acetylocelulozy – acetylocelulozę otrzymuje się w wyniku wyczerpującej estryfikacji
celulozy bezwodnikiem octowym. Reakcja przebiega według schematu:
Reakcja zachodzi w temp. 10-40
o
C, w środowisku lodowatego kwasu octowego, wobec kwasu
siarkowego jako katalizatora. Acetyloceluloza ma następujące zastosowanie:
56-58% do produkcji folii technicznych,
54,5% do produkcji włókna octanowego – jedwabiu octanowego,
52-54% do produkcji tworzywa sztucznego – octanu celulozy,
50-52% do produkcji farb i lakierów,
44-48% do produkcji farb drukarskich
6
.
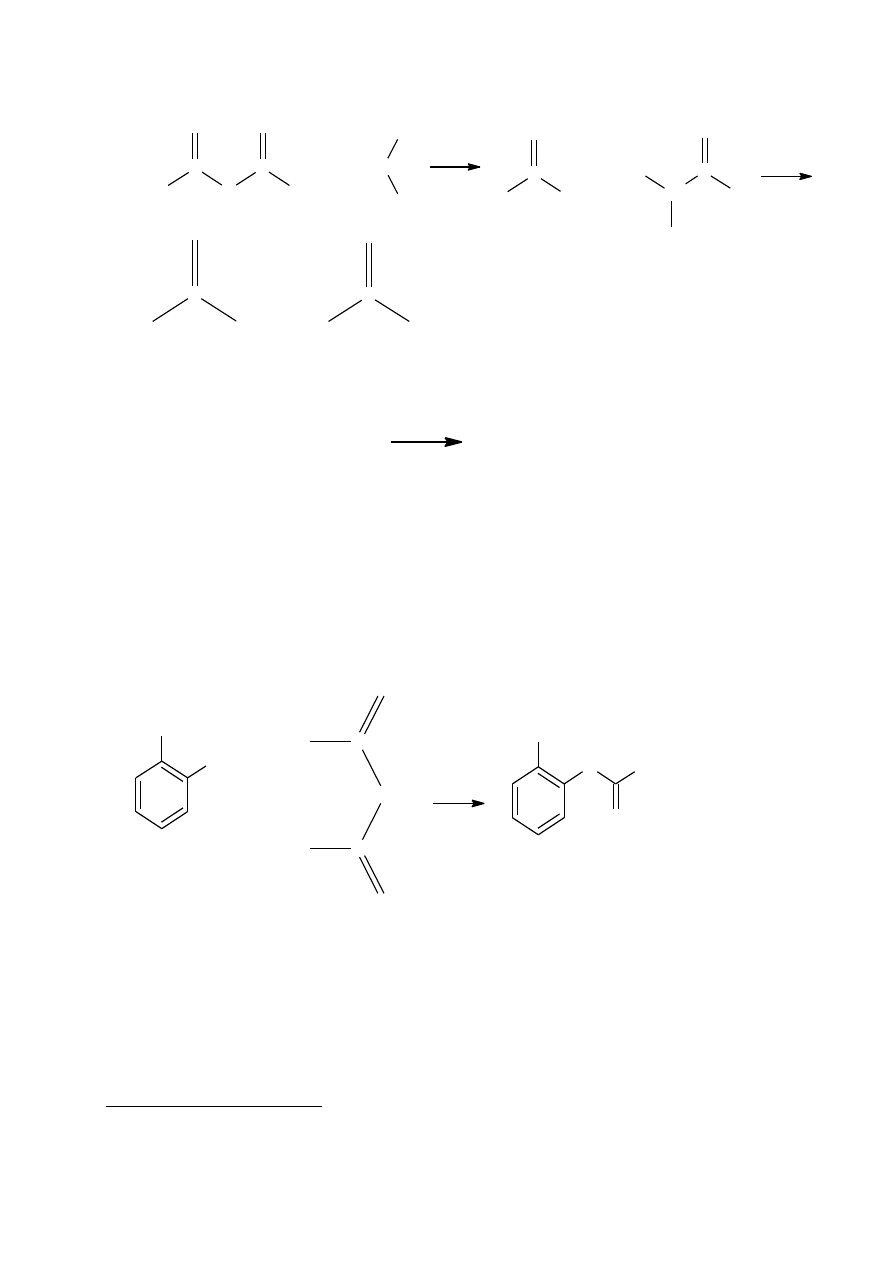
Produkcja estrów – bezwodnik octowy w reakcji z alkoholami tworzy estry – octany. Nie jest to
jednak wydajny sposób otrzymywania estrów, ponieważ połowa cząsteczki bezwodnika jest
„marnowana” – jako produkt uboczny wydziela się w postaci kwasu octowego. Bezwodnik
octowy jest jednak powszechnie stosowany, gdyż jest tani i wygodniejszy w użyciu niż chlorki
kwasowe. Reakcja hydrolizy jest katalizowana zarówno przez kwasy, jak i zasady i przebiega we-
dług schematu
7
.
5
R. Bogoczek, E. Kociołek-Balawejder, Technologia chemiczna organiczna. Surowce i półprodukty, Wyd. Aka-
demii Ekonomicznej we Wrocławiu, Wrocław 1992.
6
Tamże, s. 410-412.
http://tczew.net.pl/~mgrmisiek/Technologia%20Chemiczna/BEZWODNIKI%20I%20H%20A%20L%20O%20G%2
0E%20N%20K%20I%20%20%20K%20W%20A%20S%20O%20W%20E.pdf
CH
3
COOCH
3
+
CO
(CH
3
CO)
2
O
[C
6
H
7
O
2
(OH)
3
]
n
+
3n (CH
3
CO)
2
O
[C
6
H
7
O
2
(OCOCH
3
)
3
]
n
+
3n CH
3
COOH
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
80
(CH
3
CO)
2
O
+
Cl
H
CH
3
COCl
+
CH
3
COOH
Otrzymywanie chlorku acetylu – powstaje on w wyniku reakcji bezwodnika octowego z chloro-
wodorem:
Chlorek acetylu jest bezbarwną, łatwo palną cieczą o temp. wrzenia 51
o
C. Na powietrzu dymi,
ma gryzący zapach i drażni błony śluzowe. W kontakcie z wodą rozkłada się. W syntezie orga-
nicznej wykorzystuje się go jako czynnik acetylujący
8
.
Otrzymywanie kwasu acetylosalicylowego (aspiryny) – otrzymuje się go działając bezwodni-
kiem octowym na kwas salicylowy. Synteza przebiega w następujący sposób:
Kwas acetylosalicylowy jest powszechnie stosowanym lekiem przeciwgorączkowym i przeciwbó-
lowym. Stanowi również składnik następujących leków: asprocol, calcipiryna, polopiryna C, po-
lopiryna S, tabletki przeciw grypie, tabletki od bólu głowy
9
.
8
R. Bogoczek, E. Kociołek-Balawejder, Technologia..., dz. cyt., s. 413.
9
Tamże.
COOH
OH
+
C
H
3
C
C
H
3
C
O
O
O
CH
3
O
CH
3
O
+
(CH
3
COOH)
O
O
R
C
O
C
R
+
O
H
R'
R
C
O
-
O
+
R
O
+
C
R
O
H
R
C
O
OH
+
R'O
C
R
O
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
81
O
H
+
C
H
3
C
C
H
3
C
O
O
O
H
H
OH
O
+
CH
3
COOH
Otrzymywanie acetanilidu – powstaje on w reakcji bezwodnika octowego z aniliną:
Acetanilid (N-acetyloanilina) jest bezbarwną, krystaliczną substancją o temp. topnienia 114
o
C.
Stosowany jest w lecznictwie, szczególnie w weterynarii, jako lek przeciwgorączkowy (antyfe-
bryna). Służy ponadto do produkcji syntetycznej kamfory, licznych środków farmaceutycznych
(np. sulfonamidów) i barwników stanowi również stabilizator nadtlenku wodoru
10
.
Otrzymywanie kwasu cynamonowego (reakcja Perkinsa) – powstaje on w reakcji bezwodnika
octowego z aldehydem benzoesowym:
Jest to krystaliczne ciało stałe o słabym zapachu cynamonu, o temp. topnienia 133
o
C. Jest lotny
z parą wodną. Stanowi półprodukt do otrzymywania syntetycznych środków zapachowych. Kwas
cynamonowy i jego estry łatwo dyfundują przez skórę i są bardzo skutecznymi środkami prze-
ciwświerzbowymi
11
.
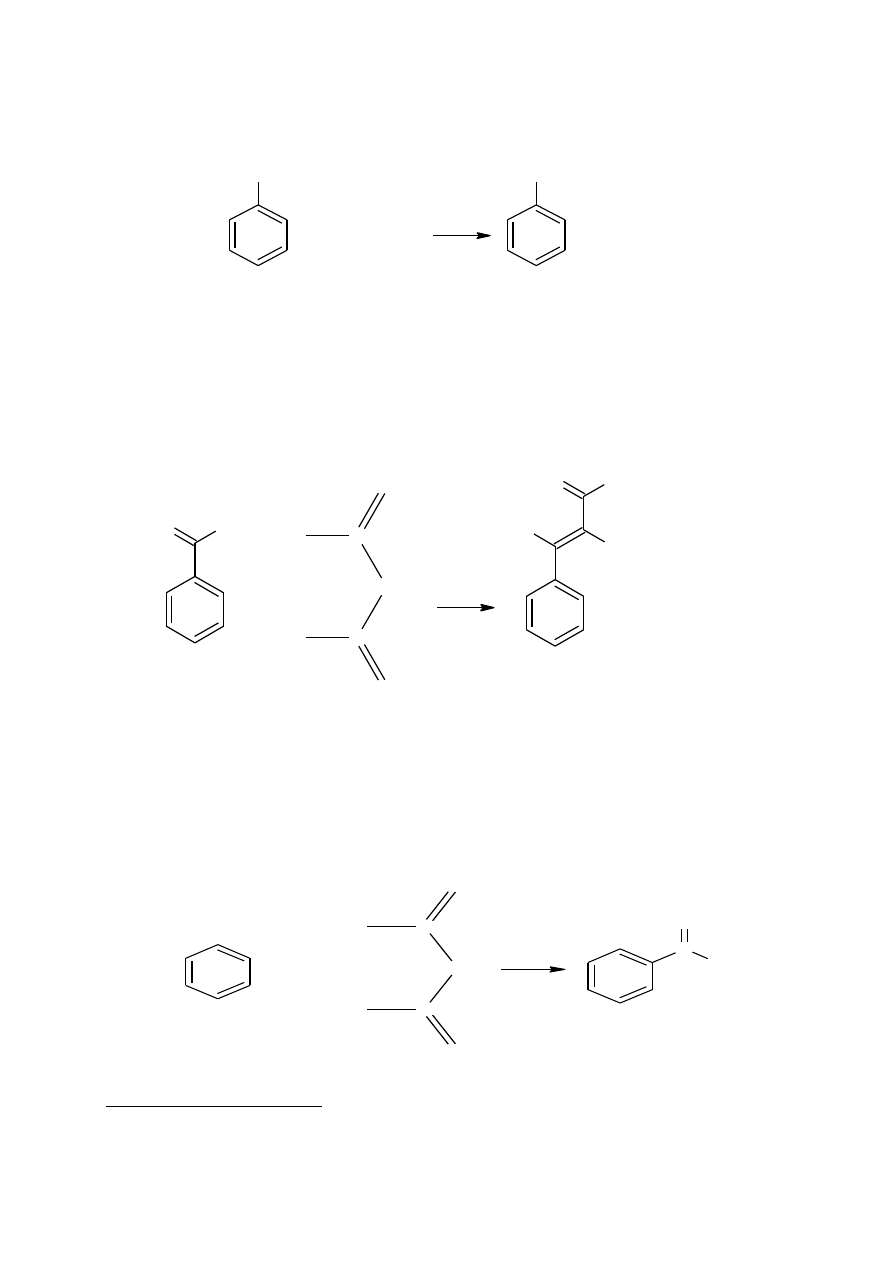
Otrzymywanie acetofenonu (keton fenylowo-metylowy) – powstaje w wyniku reakcji bezwod-
nika octowego z benzenem:
10
Tamże.
11
Tamże.
NH
2
+
(CH
3
CO)
2
O
NHCOCH
3
+
CH
3
COOH
C
H
3
C
C
H
3
C
O
O
O
+
C
CH
3
O

Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
82
Acetofenon jest bezbarwną substancją o temp. topnienia 19,5
o
C i temp. wrzenia 202
o
C. Stosuje
się go jako rozpuszczalnik estrów celulozy i innych żywic, jako substancję zapachową (np. do
aromatyzowania tytoniu), a także jako środek nasenny (hypnon)
12
.
3. Opis procesu technologicznego [na podstawie
13
]
W mieszalniku sporządza się mieszaninę jednej objętości aldehydu octowego, dwóch objętości octa-
nu etylu oraz 1% katalizatora (w stosunku do ilości aldehydu octowego), którą za pomocą pompy
tłoczy się do kolumny utleniającej 3. Tlen z 10% nadmiarem oraz wodę chłodzącą wprowadza się do
kolumny utleniającej na kilku wysokościach za pomocą aparatów bełkotkowych. Proces utleniania
przebiega w temperaturze 50
o
C pod ciśnieniem 0,2MPa. Mieszaninę parowo-gazową, składającą się
głównie z dwutlenku węgla oraz azotu, po wymyciu, wypuszcza do atmosfery.
Ciekły produkt reakcji zawiera 50% octanu etylu, 4-5% wody, 1-2% nie przereagowanego aldehydu
octowego, 1-2% związków nadtlenkowych, resztę stanowi bezwodnik kwasu octowego i kwas octowy
w stosunku uzależnionym od warunków prowadzenia procesu. Produkt ten bezpośrednio z kolumny
utleniającej tłoczy się do kolumny destylacyjnej, gdzie w temperaturze 70,4
o
C oddestylowuje
azeotrop składający się z octanu etylu i wody.
Pary azeotropu kondensuje się w chłodnicy, otrzymany kondensat rozdziela się w rozdzielaczu floren-
tyńskim. Zasadniczą jego część wprowadza się do kolumny stabilizacyjnej. W kolumnie tej z octanu
etylu odpędza się aldehyd octowy, a pary porwanego z nim estru kondensuje się w chłodnicy. Alde-
hyd octowy po skondensowaniu w chłodnicy solankowej zawraca się do mieszalnika. Octan etylu jako
środowisko reakcji krąży stale w instalacji, jest wykorzystywany praktycznie bez strat, są one tak ma-
łe, że można je pominąć.
Pozostałość z kolumny destylacyjnej 6 wprowadza się do wyparki i tam pod ciśnieniem 0,05MPa od-
destylowują kwas i bezwodnik kwasu octowego. Pozostały w wyparce roztwór katalizatora jest za-
wracany do mieszalnika 1.
Mieszaninę kwasu i bezwodnika kwasu octowego rozdestylowuje się w kolumnie destylacyjnej.
Z dołu kolumny odbiera się produkty.
W wyniku omówionego procesu utleniania aldehydu octowego otrzymuje się ok. 30% kwasu octowe-
go i 50% bezwodnika kwasu octowego. Stosunek obu składników w dużej mierze zależy od umiejęt-
ności prowadzenia procesu.
12
Tamże.
13
S. Ropuszyński, Chemia..., dz. cyt.
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
83
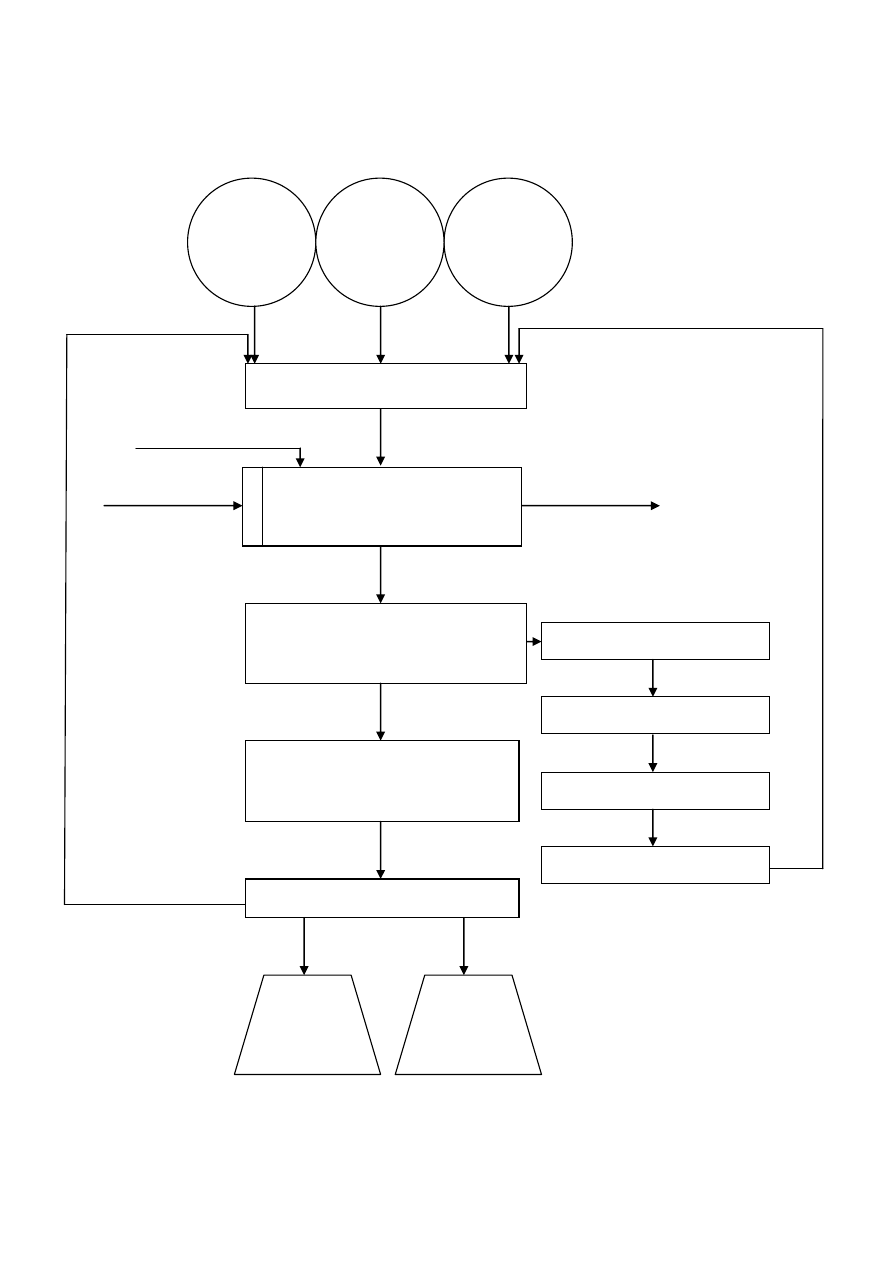
4. Schemat ideowy otrzymywania bezwodnika octowego
Źródło: opracowanie własne
K
at
al
iz
at
o
r
woda chłodząca
woda chłodząca
UTLENIANIE
Temp. 50
o
C, ciśnienie 0,2 MPa
Katalizator
Aldehyd
octowy
Octan
etylu
MIESZANIE
tlen
DESTYLACJA
Temp. 70,4
o
C
DESTYLACJA
Ciśnienie 0,05 MPa
DESTYLACJA
KONDENSACJA
ROZDZIELANIE
STABILIZACJA
KONDENSACJA
50%
Bezwodnik
octowy
30 %
Kwas
octowy
A
ld
e
h
yd
o
ct
o
w
y

Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
84
5. Zestawienie maszyn i urządzeń, materiały konstrukcyjne, ochrona przed korozją
Najważniejsze maszyny i urządzenia zastosowane w procesie produkcji bezwodnika octowego przed-
stawiono w Tabeli 2.
Tabela 2: Zestawienie maszyn i urządzeń
Zastosowane maszyny i urządzenia
Opis
Mieszalnik
Sporządza się w nim mieszaninę jednej objętości aldehy-
du octowego, dwóch objętości octanu etylu oraz 1% kata-
lizatora. Stosuje się mieszalnik mechaniczny. Mieszanie
zachodzi na skutek ruchu mieszadła.
Pompa
Stosowana jest do transportu cieczy na poszczególne eta-
py procesu technologicznego.
Kolumna utleniająca
Przebiega w niej utlenianie aldehydu octowego. Jest to
wieża o wysokości ok. 10-12 metrów. Wewnątrz kolumny
znajduje się wężownica do przeponowego chłodzenia
środowiska reakcyjnego. Do kolumny na kilku wysoko-
ściach wprowadza się tlen, może być zatem wyposażona
w perforowane półki znajdujące się na różnych jej wyso-
kościach.
Aparat bełkotkowy
Służy do doprowadzenia tlenu do kolumny utleniającej.
Kolumna destylacyjna
W kolumnie destylacyjnej następuje rozdzielenie miesza-
niny ciekłej – surówki na poszczególne składniki. W celu
otrzymania jak najbardziej czystych strumieni destylację
można powtarzać kilkakrotnie. Kolumna destylacyjna
składa się z ogrzewanego zbiornika cieczy, skraplacza
(chłodnicy) oraz zbiornika destylatu.
Wyparka
W wyparce oddestylowują kwas octowy oraz bezwodnik
kwasu octowego. Składa się ona z łaźni grzejnej, najczę-
ściej wodnej, ogrzewanej elektrycznie. U dołu wyparki
znajduje się odbieralnik służący do zbierania oddestylo-
wanej cieczy.
Źródło: opracowanie własne
Wszystkie elementy aparatury muszą być wykonane szczelnie, aby nie dopuścić to wycieków powsta-
jących produktów. Ze względu na środowisko utleniające w kolumnie utleniającej, powinna być ona
wykonana ze stali odpornej na korozję w takim środowisku. Może to być na przykład stal chromowa.
Szybkość korozji można obniżyć poprzez stałą kontrolę wprowadzanego do procesu tlenu, tempera-
tury, utrzymywanie odpowiedniego ciśnienia. Szczególnie niebezpieczna dla urządzeń wydaje się być
Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
85
korozja międzykrystaliczna, ponieważ może ona powodować naruszenie całej struktury metalu, co
prowadzić może do poważnych awarii aparatury. Biorąc pod uwagę odporność korozyjną zapropo-
nowanego materiału oraz wpływ temperatury na szybkość korozji oszacowano, że szybkość korozji
dla stali chromowej, z której zbudowana jest kolumna utleniająca wynosi ok. 0,01 mm/rok, czyli jest
to materiał bardzo odporny na korozję
14
.
6. Bezpieczeństwo i higiena pracy
Głównym zagrożeniem jakie może wystąpić w omawianym procesie technologicznym jest wyciek
surowców czy powstałych produktów z aparatury. Należy więc stale kontrolować szczelność aparatu-
ry, aby nie dopuścić do niepożądanych wycieków. Stosowane do produkcji bezwodnika octowego
surowce mogą powodować podrażnienie skóry, zaczerwienienia, ból głowy, zawroty głowy, kaszel
oraz szereg innych działań niepożądanych. Miejscem, w którym należy zachować szczególną ostroż-
ność jest napełnianie mieszalnika. Osoby wykonujące tę czynność powinny być wyposażone w odzież
ochronną wykonaną z materiałów powlekanych (np. vitonem), rękawice ochronne powlekane (np.
vitonem lub kauczukiem naturalnym), obuwie ochronne całotworzywowe lub całogumowe, gogle
chroniące przed kroplami cieczy, sprzęt ochrony układu oddechowego: półmaskę lub maskę
15
. Do-
kładne informacje dotyczące toksyczności surowców oraz produktów i ich wpływu na zdrowie czło-
wieka, przedstawiono w Tabeli 3.
Tabela 3: Toksyczność surowców oraz produktów w procesie otrzymywania bezwodnika octowego
Źródło: opracowanie własne na podstawie: http://www.ciop.pl/3809.html,
http://www.zpb-innowacje.pl/files/karty_charakterystyk/Kwas_octowy_80.pdf,
http://www.poch.com.pl/wysw/utworz_pdf.php?nr_karty=840
14
L. Synoradzki, J. Wisialski, Projektowanie procesów technologicznych, Oficyna Wydawnicza Politechniki War-
szawskiej, Warszawa 2006, s. 134.
, dostęp 15.07.2012
Aldehyd octowy
Substancja szkodliwa, drażniąca, w dużym stężeniu działa szkodliwie na ośrod-
kowy układ nerwowy. Powoduje ból i zaczerwienienie spojówek oczu oraz uczu-
cie pieczenia w gardle i kaszel. Może wystąpić duszność, ból i zawroty głowy,
mdłości. Kontakt ze skórą powoduje zaczerwienienie, może prowadzić do opa-
rzeń.
Kwas octowy
Substancja drażniąca i żrąca. Pary kwasu octowego powodują ból i łzawienie
oczu, przekrwienie spojówek, kaszel, ból gardła, błony śluzowej nosa, duszności.
Kontakt ze skórą powoduje oparzenia, przebarwienia, stany zapalne. Dawka
śmiertelna wynosi 60-70 ml kwasu octowego lodowatego.
Bezwodnik
octowy
Substancja szkodliwa, drażniąca. Pary bezwodnika octowego powodują podraż-
nienie błon śluzowych, uszkodzenie oczu, dróg oddechowych. Spożycie powodu-
je oparzenia przełyku, błon śluzowych, żołądka. Kontakt ze skórą powoduje
przebarwienia, kontakt z oczami – oparzenia oraz ryzyko utraty wzroku.

Otrzymywanie bezwodnika octowego metodą utleniania aldehydu octowego
86
Zakończenie
Bezwodnik octowy to ważny produkt przemysłu organicznego. W przemyśle występuje kilka metod
jego otrzymywania. Do najważniejszych z nich należą metody oparte na acetylenie, otrzymywanie
bezwodnika z kwasu octowego oraz z gazu syntezowego. Jednak największe ilości bezwodnika octo-
wego otrzymuje się w wyniku utleniania aldehydu octowego. W wyniku takiego procesu otrzymuje
się ok. 30% kwasu octowego oraz 50% bezwodnika kwasu octowego. Stosunek obu produktów
w dużej mierze zależy od parametrów prowadzenia procesu technologicznego, dlatego bardzo ważna
jest stała kontrola ilości wprowadzanych do procesu surowców oraz parametrów na poszczególnych
etapach (temperatura, ciśnienie).
Bibliografia
1. Białecka-Florjańczyk E., Włostowska J., Chemia organiczna, Wydawnictwa Naukowo – Technicz-
ne, Warszawa 2007
2. Bobrański B, Chemia organiczna, Wydawnictwo Naukowe PWN, Warszawa 1992
3. Bogoczek R., Kociołek-Balawejder E., Technologia chemiczna organiczna. Surowce i półprodukty,
Wyd. Akademii Ekonomicznej we Wrocławiu, Wrocław 1992
4. Ropuszyński S., Chemia i technologia podstawowej syntezy organicznej, Wydawnictwo Politech-
niki Wrocławskiej. Wrocław 1993
5. Synoradzki L., Wisialski J., Projektowanie procesów technologicznych, Oficyna Wydawnicza Poli-
techniki Warszawskiej, Warszawa 2006.
7.
http://www.poch.com.pl/wysw/utworz_pdf.php?nr_karty=840
8.
http://eurlex.europa.eu/LexUriServ/LexUriServ.do?uri=CONSLEG:2004R0273:20090420:PL:PDF
9.
http://www.zpb-innowacje.pl/files/karty_charakterystyk/Kwas_octowy_80.pdf
http://www.poch.com.pl/wysw/utworz_pdf.php?nr_karty=840
Wyszukiwarka
Podobne podstrony:
Otrzymywanie kwasu i bezwodnika octowego
Janiak, chemia fizyczna, Badanie szybkości reakcji hydrolizy bezwodnika octowego metodą pomiaru prze
09 Praktyczne metody otrzymywania polimerówid 7774
ćw 1 Otrzymywanie tlenku glinowego metodą Grzymka
Otrzymywanie proszków metali metodami elektrochemicznymi
ćw 1. Otrzymywanie tlenku glinowego metodą Grzymka
Otrzymywanie tlenku glinu metoda grzymka
09 Praktyczne metody otrzymywania polimerówid 7774
Aretha Franklin 09 Think
09 THINK Skoczowski Funkcjonowanie i kompetencje pracownikow centrow zarzadzania kryzysowego na przy
000 ksiazka 2011 calosc 09 Lukijaniuk B Metoda aktywnego wzmacniania stalowych dzwigarow sprezonych
09 Utlenianie 2005id 8028 Nieznany (2)
Krwiodawstwo 9.KONCENTRAT KRWINEK PŁYTKOWYCH OTRZYMANY METODĄ AFEREZY
19 Warstwy powierzchniowe otrzymywane metodami chemicznymi i elektrochemicznymi
09 b Grupowanie metoda k srednich
Otrzymywanie metali metodami elektrochemicznymi
Krwiodawstwo 16.KONCENTRAT GRANULOCYTARNY OTRZYMANY METODĄ AFEREZY (KG)
więcej podobnych podstron