
Laboratorium Fizjologii
WYZNACZANIE PUNKTU KOAGULACJI BIAŁEK
SPOWODOWANYCH OBECNOŚCIĄ SOLI
3
1.
CEL DOŚWIADCZENIA
Zapoznanie się z metodą wyznaczania punktu koagulacji białek opartej na pomiarze zmętnienia
roztworów metodą turbidymetryczną w roztworach soli o różnym przewodnictwie.
2.
TEORIA
„Wysalaniem białek nazywamy proces wytrącenia z roztworu białek rozpuszczalnych w wodzie przez
wysokie stężenie soli. Stosuje się w tym celu sole, których jony łatwo tworzą wodziany. Zjawisku wysalania
sprzyjają te aniony, które tworzą wiązania wodorowe lub mają dużą elektroujemność. Elektrolity
wielowartościowe działają silniej od jednowartościowych. Sole wiążące wodę pozbawiają białka płaszcza
wodnego, sprzyjając ich asocjacji w większe agregaty o zmniejszonej rozpuszczalności, które wypadają z
roztworu. Stężenie soli potrzebne do wysalania białek zależy od ich właściwości oraz pH środowiska.
Najłatwiej wysolić białko w jego punkcie izoelektrycznym, ponieważ cząsteczki na zewnątrz obojętne łatwo
asocjują w większe agregaty wypadające z roztworu. Do wysalania najczęściej stosuje się (NH
4
)
2
SO
4
,
Na
2
SO
4
, MgSO
4
. Wysalanie białek jest procesem odwracalnym, usunięcie soli, np. przez dializę, sprawia, że
wytrącone białko ponownie rozpuszcza się i wykazuje swe biologiczne właściwości. Wysalanie stosuje się
do wstępnego frakcjonowania białek, również osocza. Z osocza wytrąca się fibrynogen przy 25% nasyceniu
siarczanem amonu, większość globulin osocza wytrąca się przy 50% nasyceniu siarczanem amonu,
natomiast albuminy i dobrze rozpuszczalne globuliny wysalane są dopiero przy 80% nasyceniu siarczanem
amonu.”[1]
3.
MATERIAŁY, ODCZYNNIKI, URZĄDZENIA:
Spektrofotometr
2 kuwety polistyrenowe
0,5% r-r żelatyny
Siarczan amonu
Kolba miarowa 100 ml
Woda destylowana
Waga
12 falkonów
Pipeta Pasteura
Pipeta 100-1000 µl
Pipeta szklana 25 ml
Gruszka do pipety
Końcówki do pipety (niebieskie)
Konduktometr
Elektroda konduktometryczna
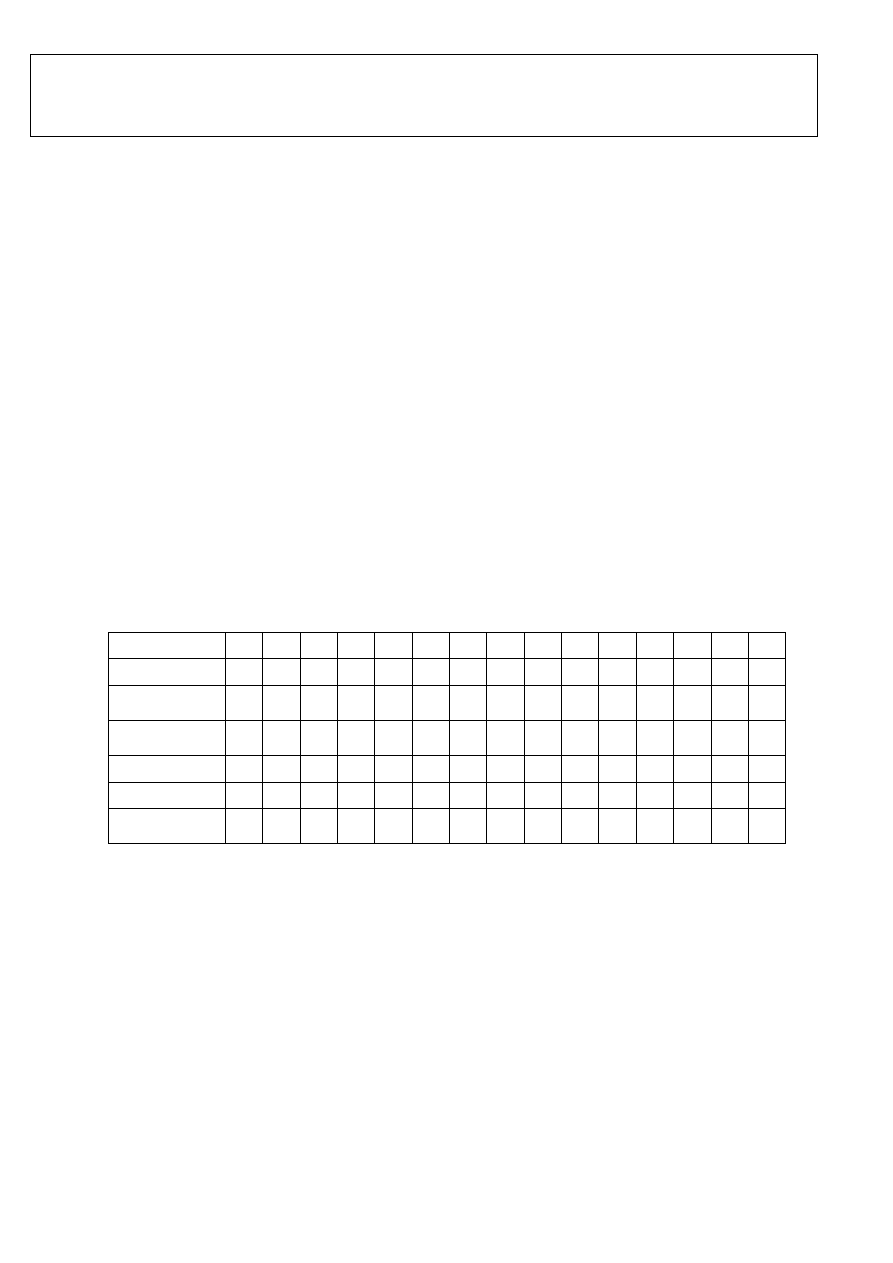
Laboratorium Fizjologii
WYZNACZANIE PUNKTU KOAGULACJI BIAŁEK
SPOWODOWANYCH OBECNOŚCIĄ SOLI
3
4.
PRZEBIEG DOŚWIADCZENIA
a) Włączanie spektrofotometru:
Włączyć spektrofotometr przełącznikiem znajdującym się z boku obudowy. Następnie
odczekać co najmniej 15 minut na rozgrzanie się lampy. W tym czasie przygotować roztwory
do pomiarów zgodnie z punktami b-d.
UWAGA! Podczas inicjalizacji spektrofotometru nie podnosić pokrywy komory pomiarowej!
Jeśli spektrofotometr jest włączony należy się upewnić czy był włączony, przez co najmniej
15min.
b) Na wadze elektronicznej do pustej kolby miarowej odważyć 32 (±2%) g siarczanu amonu i
dopełnić wodą do kreski. Wynik zapisać. Roztwór wymieszać. Obliczyć stężenie siarczanu
amonu w otrzymanym roztworze.
Należy najpierw dodać taką objętość wody by łatwo rozpuścić większość soli a dopiero później
dodać resztę wody.
c) Przygotowanie roztworów do pomiarów zmętnienia:
Do ponumerowanych falkonów wlewamy za pomocą pipet (szklanej lub automatycznej)
wodę destylowaną i r-r siarczanu amonu w ilościach podanych w tabeli 1, a następnie do
każdego falkonu po 2 ml roztworu białka. Roztwór mieszamy i po 3 min pobieramy 3 ml
(pipetą Pasteura) do kuwety polistyrenowej i mierzymy jego zmętnienie (patrz punkt d).
Równolegle dokonujemy pomiaru przewodnictwa roztworów. Wyniki notujemy w zeszycie
laboratoryjnym.
Tabela 1. Przygotowanie roztworów do pomiarów zmętnienia i przewodnictwa.
Nr
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
H
2
O [ml]
10,0 9,7 9,3 9,0 8,7 8,3 8,0 7,7 7,3 7,0 6,7 6,3 6,0 5,7 5,3
Siarczan amonu
[ml]
4,0 4,3 4,7 5,0 5,3 5,7 6,0 6,3 6,7 7,0 7,3 7,7 8,0 8,3 8,7
0,5% r-r żelatyny
[ml]
2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0 2,0
Absorbancja
Transmitancja
Przewodnictwo
roztworu*
* wpisać wartość odczytaną z konduktometru
d) Pomiar zmętnienia:
1. Wstawić do komory pomiarowej spektrofotometru kuwetę napełnioną 3 ml wody
destylowanej – jest to próbka referencyjna, następnie zamknąć pokrywę.
2. Nastawić długość fali na 500 nm. postępując zgodnie z instrukcją obsługi urządzenia.
Zmierzyć w ten sposób próbę ślepą w trybie absorbancja.
3. Włożyć kuwetę napełnioną 3 ml roztworu białka, zamknąć pokrywę pomiarową,
następnie dokonać pomiaru.
4. Całość powtórzyć dla trybu transmitancji.
e) Po wykonaniu całej serii pomiarów dodać kolejne 2 ml białka i powtarzamy pomiary.
5.
PRZEDSTAWIENIE WYNIKÓW:

Laboratorium Fizjologii
WYZNACZANIE PUNKTU KOAGULACJI BIAŁEK
SPOWODOWANYCH OBECNOŚCIĄ SOLI
3
1. W tabeli przedstawić: stężenia siarczanu amonu i białka; odczytane wartości absorbancja
i transmitancji oraz odpowiadające im wartości przewodnictwa.
2. Sporządzić wykres absorbancji [a.u.] w funkcji przewodnictwa roztworu.
3. Z wykresów wyznaczyć minimalną przewodność r-r siarczanu amonu potrzebną do
wysolenia 50, 80 i 95% mierzonego białka. Czy zwiększenie stężenia białka ma wpływ
na te punkty?
Bibliografia:
http://biochigen.sum.edu.pl/praktikum/012.pdf
Opracował:
mgr. inż. Jan Procek
Wyszukiwarka
Podobne podstrony:
Instrukcja cw 4 wysalanie
Instrukcja cw 4 wysalanie
instrukcje cw z chemii
Instrukcja Ćw 5
Instrukcja Ćw 4
Instrukcja cw 3 Metody biotechnologii
Instrukcja ćw 2, technologia żywności, chłodnictwo
instrukcja cw 1, II rok, II semestr, Chemia wody i powietrza
FIZYKA - instrukcja, cw 9, WYŻSZA SZKOŁA INŻYNIERII DENTYSTYCZNEJ
INSTRUKCJE, Ćw nr 12. Bilans cieplny, Instrukcja wykonawcza
Instrukcja cw 3 PI id 216486 Nieznany
INSTRUKCJE, Ćw nr 5. I-U, Ćwiczenie 7
instrukcja cw 1 trawienie
Instrukcja cw 2 Metody biotechnologii
instrukcja cw 20 id 216489 Nieznany
Instrukcja cw 3
Instrukcja Cw 5
instrukcja 4 cw 6
8 Zalacznik do polecenia pisemnego 2, Politechnika Lubelska, Elektrotechnika mgr EE, Semestr 2, Pomi
więcej podobnych podstron