Biochemia: Ćw. – Kwasy nukleinowe
1
K
WASY NUKLEINOWE
Wyciąg z kart charakterystyki substancji niebezpiecznych:
amoniak
– C, N
azotan srebra
– C, N
błękit metylenowy
– Xn
chlorek żelaza
– Xn
difenyloamina
– T
etanol, 96%, 70%
– F
kwas azotowy(V),65% – C
kwas ortofosforowy
– C
kwas octowy, 96%
– C
kwas siarkowy, 95% – C
kwas solny
– C
wodorotlenek sodu
– C
siarczan dodecylu sodu – Xn
siarczan miedzi
– Xn
W komórkach organizmów eukariotycznych obecne są dwa typy kwasów nukleinowych:
- DNA (kwas deoksyrybonukleinowy, ang. deoxyribonucleic a
cid) zawiera cukier deoksyrybozę; przechowuje
informację genetyczną, występuje głównie w jądrze komórkowym, ponadto w mitochondriach i chloroplastach,
- RNA (kwas rybonukleinowy, ang. ribonucleic acid),
w skład którego wchodzi ryboza; bierze udział w translacji
białek; obecny w cytoplazmie (rRNA – rybosomalny kwas rybonukleinowy, ang. ribosomal RNA i tRNA –
transportujący kwas rybonukleinowy, ang. transfer RNA) oraz mRNA (matrycowy/informacyjny kwas
rybonukleinowy, ang. messenger RNA) prze
noszący informację o budowie białek z jądra do cytoplazmy.
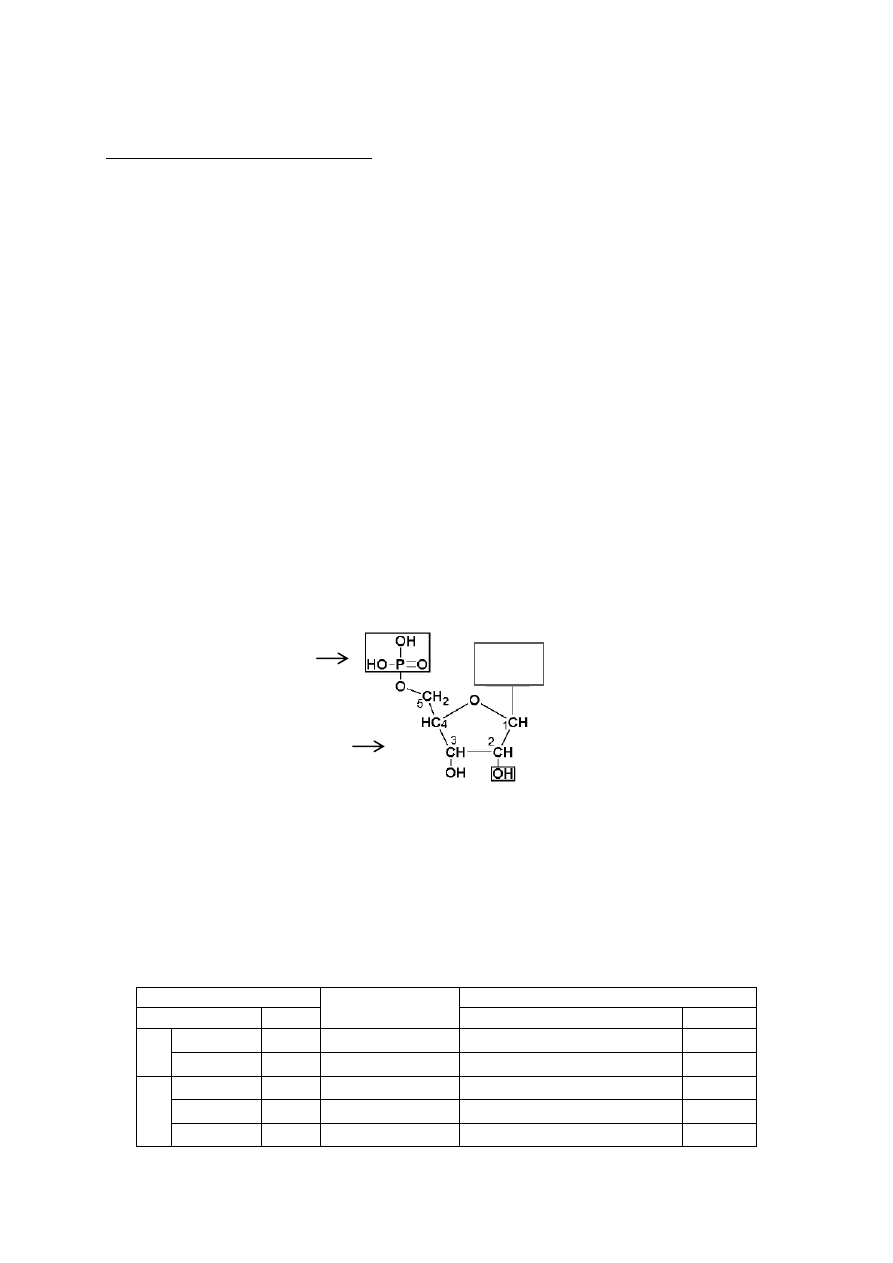
Kwasy nukleinowe są biopolimerami nukleotydów połączonych wiązaniami fosfodiestrowymi w łańcuch
polinukleotydowy. Nukleotyd,
stanowiący jednostkę monomeryczną DNA i RNA, składa się z cząsteczki cukru,
zasady azotowej (purynowej: adeniny, guaniny lub pirymidynowej: cytozyny, tyminy, uracylu) oraz reszty
fosforanowej (Rys. 1).
Rys. 1. Struktura rybonukleotydu.
Nukleotydy to mono
fosforany nukleozydów; w tabeli 1 zebrano nazwy nukleozydów i nukleotydów. W organizmie
człowieka nukleotydy są składnikami kwasów nukleinowych, jak również występują w postaci wolnej, pełniąc
szereg ważnych funkcji w przemianach metabolicznych.
Tab. 1. Nomenklatura nukleozydów i nukleotydów kwasów nukleinowych.
* tymidyna występuje wyłącznie w DNA, więc zwyczajowo nie dodaje się przedrostka deoksy
zasady azotowe
nazwy nukleozydów
nukleotydy
nazwa
symbol
nazwa
symbol
pu
ry
ny
adenina
A
(deoksy)adenozyna
(deoksy)adenozynomonofosforan
(d)AMP
guanina
G
(deoksy)guanozyna
(deoksy)guanozynomonofosforan
(d)GMP
pi
ry
m
id
yn
y
cytozyna
C
(deoksy)cytydyna
(deoksy)cytydynomonofosforan
(d)CMP
tymina
T
tymidyna *
tymidynomonofosforan *
TMP *
uracyl
U
urydyna
urydynomonofosforan
UMP
zasada
azotowa
ortofosforan
cukier
Biochemia: Ćw. – Kwasy nukleinowe
2
1.
B
ADANIE WŁAŚCIWOŚCI FIZYKOCHEMICZNYCH KWASÓW NUKLEINOWYCH
1.1.
R
OZPUSZCZALNOŚĆ KWASÓW NUKLEINOWYCH
Kwasy nukleinowe, dzięki zawartości reszt kwasu fosforowego, wykazują odczyn kwasowy. Rozpuszczają się
dobrze w środowisku zasadowym, trudniej w wodzie i rozcieńczonych kwasach. W roztworach wodnych tworzą
układy koloidalne, z których można je wytrącić za pomocą czynników odwadniających, np. etanolu, izopropanolu.
Wykonanie
: Przygotować dwie szklane, krótkie probówki. Do pierwszej dodać 1 ml 0.5% roztworu RNA
a następnie 2 – 3 krople 2 M HCl. Wytraca się biały osad RNA. Po dodaniu 200 – 300
l 10% roztworu NaOH
osad ulega rozpuszczeniu. Do drugiej probówki dodać 1 ml 1% RNA, 200
l 3M CH
3
COONa oraz 1 ml 96%
etanolu (temp. -
20°C) – roztwór mętnieje, ponieważ wytrąca się osad RNA.
1.2.
T
WORZENIE KOMPLEKSÓW KWASÓW NUKLEINOWYCH Z BARWNIKAMI
W środowisku kwaśnym kwasy nukleinowe wiążą barwniki zasadowe, tworząc połączenia typu soli, co
wykorzystuje się m.in. do wizualizacji jąder komórkowych w metodach histochemicznych.
Wykonanie:
Do szklanej krótkiej probówki dodać 0.5 ml 0.5% RNA a następnie 150 µl 1 M CH
3
COOH oraz 2-3
kropli 0.1% błękitu metylenowego (używając pipety do 100
l). Zawartość szklanej probówki przenieść do
probówki o pojemności 1.5 ml i zwirować. Po wirowaniu widoczny jest niebieski osad kompleksów RNA z błękitem
metylenowym.
1.3.
T
WORZENIE KOMPLEKSÓW KWASÓW NUKLEINOWYCH Z BIAŁKAMI
Kwasy nukleinowe tworzą z białkami zasadowymi oraz niektórymi białkami obojętnymi połączenia kompleksowe.
Do oddzielenia białka od kwasu nukleinowego stosuje się nasycone roztwory NaCl.
Wykonanie:
Do szklanej krótkiej probówki dodać 1 ml 0.5% RNA oraz 300
l 1 M CH
3
COOH a następnie 100
l
3% roztworu BSA. Wytrąca się osad kompleksowego połączenia białka z RNA. W celu rozpuszczenia osadu
dodać 1 ml nasyconego roztworu NaCl.
2.
I
ZOLACJA I HYDROLIZA
KWASÓW NUKLEINOWYCH
Każda ze znanych metod izolacji kwasów nukleinowych wymaga zniszczenia błon lipidowych, prowadzącego do
lizy komórki oraz oddzielania izolowanej cząsteczki kwasu od pozostałych składników komórki. Ważnym
elementem preparatyki jest inaktywacja nukleaz
– enzymów odpowiedzialnych za degradację kwasów
nukleinowych.
W celu rozbicia błon biologicznych oraz jednocześnie denaturacji białek (w tym nukleaz) stosuje
się detergenty, np. silny anionowy detergent siarczan dodecylu sodu (SDS). Działanie inaktywujące nukleazy
mają również wersenian dwusodowy (EDTA), cytrynian sodu oraz fluorek sodu. Pozostałości komórek
i wytrącone białka usuwa się przez wirowanie. W kolejnym etapie uwolniony do roztworu kwas nukleinowy
zagęszcza się przez precypitację schłodzonym etanolem lub izopropanolem. Kolejne wirowanie pozwala na
pozbycie się dużej objętości rozpuszczalnika i zwiększenia jego stężenia przez rozpuszczenie w mniejszej
objętości.
Analiza poszczególnych komponentów cząsteczki kwasu nukleinowego wymaga jego hydrolizy, czyli rozerwania
wszystkich wiązań obecnych w tej makrocząsteczce. W przypadku DNA pierwszym etapem jest zniszczenie
wiązań wodorowych łączących komplementarne zasady. Zniszczeniu podczas hydrolizy ulegają również wiązania
fosfodiestrow
e łączące nukleotydy oraz glikozydowe pomiędzy zasadą azotową a cukrem. Kwasy nukleinowe
podczas gotowania (100ºC) z kwasami mineralnymi (np. 1 M HCl, 10% H
2
SO
4
, 60% HClO
4
) ulegają stopniowej
hydrolizie do
nukleotydów a przy wystarczająco długo prowadzonym ogrzewaniu w hydrolizacie uzyskujemy
wolne zasady azotowe, pentozy i kwas fosforowy.

Biochemia: Ćw. – Kwasy nukleinowe
3
2.1.
I
ZOLACJA
RNA
Z DROŻDŻY
Opisana poniżej metoda izolowania RNA polega na rozbiciu komórek drożdży, usunięciu z roztworu białek i DNA
za
pomocą anionowego detergentu – siarczanu dodecylu sodu (SDS) a następnie zagęszczeniu RNA przez
wytrącenie za pomocą etanolu.
Wykonanie: W
probówce wirowniczej o poj. 15 ml ogrzać do wrzenia w łaźni wodnej 5 ml 5% roztworu SDS.
D
odać 1 g dokładnie rozdrobnionych drożdży piekarskich i ogrzewać przez 10 min mieszając bagietką. Probówkę
ochłodzić w zlewce z zimną wodą a następnie zwirować (3000 RCF*, 10 min, 4
C). Nadsącz zebrać do
schłodzonej w lodzie probówki wirowniczej o poj. 15 ml i dodać 96% etanolu (temp. -20ºC) w stosunku 1:1. Po
piętnastominutowej precypitacji w lodzie roztwór zwirować (3000 RCF, 10 min, 4
C).
A następnie usunąć
dokładnie supernatant (do pojemnika do utylizacji), natomiast osad wytraconego RNA rozpuścić w 5 ml 1 M
NaOH
(długa szklana próbówka).
*RCF (ang. relative centrifugal force)
– względna siła odśrodkowa wyrażająca wartość przyśpieszenia stosowaną do wirowania
próbek
2.2.
H
YDROLIZA KWASOWA
RNA
Wykonanie: Do
roztworu RNA wyizolowanego z drożdży dodać 10% H
2
SO
4
w stosunku 1:1. Po wymieszaniu
podzi
elić roztwór do dwóch probówek (tak, by podczas hydrolizy poziom roztworów był na wysokości wody
w łaźni) i ogrzewać we wrzącej łaźni wodnej przez 30 min. Po ostudzeniu w zlewce z zimną wodą hydrolizat RNA
przefiltrować a następnie przeprowadzić na nim reakcje pozwalające na identyfikację poszczególnych składników
(pkt. 2.3).
2.3.
W
YKRYWANIE
SKŁADNIKÓW HYDROLIZATU
RNA
2.3.1.
W
YKRYWANIE PENTOZY
–
REAKCJA
T
OLLENSA
W obecności stężonych kwasów mineralnych z pentozy powstaje z furfural (patrz: Ćw.8 Analiza
mon
osacharydów), który kondensując z floroglucyną (fenol) tworzy związek barwy czerwonej. Reakcja Tollensa,
podobnie jak próba Taubera, służy do odróżniania pentoz od heksoz.
Wykonanie:
Przygotować dwie długie szklane probówki. Do pierwszej dodać 1 ml hydrolizatu RNA a do drugiej
1 ml 1% roztworu glukozy. Następnie do obydwu po 1 ml stężonego HCl i kilka kryształków floroglucyny.
Roztwory
ogrzać do wrzenia w łaźni wodnej. Hydrolizat RNA zawierający pentozy zabarwia się na czerwono
a
roztwór glukozy na żółtobrunatno.
2.3.2. W
YKRYWANIE RESZTY FOSFORANOWEJ
Obecny w hydrolizacie RNA kwas fosforowy reaguje z molibdenianem amonu w obecności HNO
3
, co prowadzi do
powstania żółtego osadu fosfomolibdenianu amonu.
Wykonanie:
Przygotować dwie krótkie szklane probówki. 0.5 ml hydrolizatu RNA zobojętnić amoniakiem (150 –
200
l, kontrolować papierkiem wskaźnikowym). Dodać 0.5 ml stęż. HNO
3
oraz 2 ml 2.5% molibdenianu
amonowego. Zawartość probówki ogrzać do wrzenia w łaźni wodnej. Powstający fosfomolibdenian amonowy
wytrąca się przy większym stężeniu w postaci żółtego osadu. Równocześnie wykonać kontrolę z 5% kwasem
ortofosforowym.
2.3.3.
W
YKRYWANIE ZASAD AZOTOWYCH
Zasady obecne w kwasach nukleinowych
są heterocyklicznymi związkami pierścieniowymi zawierającymi atomy
azotu. R
eagują z jonami metali Ag
+
lub Cu
+
tworząc nierozpuszczalne sole kompleksowe.

Biochemia: Ćw. – Kwasy nukleinowe
4
Wykonanie:
Przygotować dwie krótkie szklane probówki. Do pierwszej dodać 1 ml hydrolizatu RNA oraz
stężonego amoniaku do uzyskania słabo alkalicznego odczynu (kontrolować papierkiem wskaźnikowym). Jeżeli
roztwór nie jest klarowny, należy go przesączyć. Następnie do klarownego przesączu dodać 0.5 ml 1% AgNO
3
.
Wytrąca się delikatny osad nierozpuszczalnych soli srebrowych puryn (oglądać w świetle lampki). Równocześnie
wykonać kontrolę z 0.1% roztworem adeniny (z pominięciem alkalizacji roztworu).
Identyfikację składników hydrolizatu RNA wykonujemy na gotowych hydrolizatach. Po przygotowaniu własnego
hydrolizatu należy wykonać przynajmniej jedną z reakcji weryfikującą skuteczność preparatyki i hydrolizy RNA.
3.
O
DRÓŻNIANIE
RNA
OD
DNA
Opisane poniżej reakcje pozwalające zidentyfikować i odróżnić roztwór RNA od DNA bazują na obecności
różnych cukrów w cząsteczkach tych kwasów nukleinowych. Ryboza obecna w cząsteczce RNA w odróżnieniu
od deoksyrybozy
występującej w DNA zawiera grupę hydroksylową przy węglu C2.
3.1.
M
ETODA ORCYNOWA
–
PRÓBA
B
IALA
Próba Biala jest reakcją kondensacyjną, w której pentozy (wolne oraz związane w nukleozydach purynowych)
ogrzewane ze stężonym HCl ulegają cyklizacji do furfuralu (patrz: Ćw. 8 Analiza monosacharydów). Furfural
w obecności jonów Fe
3+
kondensuje z orcyną, tworząc związek barwy zielonej. Deoksyryboza również reaguje
z oryną, ale 10-krotnie słabiej, dlatego przyjmuje się, że DNA w próbie Biala daje wynik ujemny.
Wykonanie:
Bezpośrednio przed użyciem zmieszać: 0.4 ml roztworu A (6% orcyna w 96% etanolu) oraz 5.6 ml
roztworu B (10% FeCl
3
w stężonym HCl). Uzyskujemy objętość wystarczającą do przeprowadzenia 6 reakcji (dla
3
podgrup). Następnie przygotować dwie, długie szklane probówki. Do pierwszej dodać 1 ml 0.1% RNA, do
drugiej 1 ml 0.1% DNA oraz po 1 ml odczynnika orcynowego
do każdej. Probówki umieścić we wrzącej łaźni
wodnej na 10
min. Roztwór RNA barwi się na oliwkowozielono.
3.2.
M
ETODA Z DIFENYLOA
MINĄ
–
PRÓBA
D
ISCHEGO
Deoksyryboza (wolna i związana w nukleotydach purynowych) w środowisku kwaśnym tworzy z difenyloaminą
związek barwny. RNA zawierający rybozę oraz deoksyryboza związana w nukleotydach pirymidynowych dają
wynik ujemny w tej reakcji.
Wykonanie:
Przygotować dwie długie szklane probówki. Do pierwszej dodać 1 ml 0.1% RNA, do drugiej – 1 ml
0.1 % DNA, a następnie do każdej po 1 ml 1% odczynnika difenyloaminowego (1% difenyloamina w roztworze
lodowatego CH
3
COOH zawierającym stężony H
2
SO
4
) i um
ieścić probówki we wrzącej łaźni wodnej na 10 minut.
Roztwór DNA barwi się na niebiesko.
4.
W
IDMA ABSORPCYJNE ZASAD AZOTOWYCH
I NUKLEOTYDÓW
Kwasy nukleinowe absorbują światło z zakresu ultrafioletu dzięki obecności w ich cząsteczkach heterocyklicznych
zasad azotowych
zawierających sprzężone wiązania podwójne. Każda z zasad posiada charakterystyczne dla
siebie widmo z maksimum absorbancji
przypadającym przy danej długości fali. Długość fali, przy której dana
zasada absorbuje najmocniej UV zmienia się w zależności od pH roztworu. Maksimum absorbancji dla kwasów
nukleinowych (260 nm)
jest wypadkową absorbancji budujących go zasad azotowych. Zdolność absorpcji
ultrafioletu przez kwasy nukleinowe wykorzystywana jest do wyznaczania ich stężenia oraz czystości metodą
spektrofotometryczną.
Wykonanie:
Dokona
ć pomiarów absorbancji roztworów adeniny, tyminy oraz adenozyno-5'-trifosforanu (ATP)
w 0.1M HCl
względem rozpuszczalnika w zakresie widma 230-290 nm zmieniając długość fali co 5 nm. Następnie

Biochemia: Ćw. – Kwasy nukleinowe
5
zmierzyć OD roztworu adeniny w 0.1M NaOH względem rozpuszczalnika. Pomiary wykonać w spektrofotometrze
przeznaczonym
do mikroobjętości Thermo Scientific Nano-Drop 2000 umieszczając 2
l roztwor
ów na statywie
pomiarowym pomiędzy dwoma włóknami światłowodowymi. Wyniki wprowadzić do tabeli 2.
Tab. 2
. Dane pomiarowe do wykreślenia widm absorpcyjnych zasad azotowych i nukleotydu.
LP
[nm]
adenina
w
tymina
w
0.1M HCl
ATP
w
0.1M HCl
0.1M HCl
0.1M NaOH
1.
230
2.
235
3.
240
4.
245
5.
250
6.
255
7.
260
8.
265
9.
270
10.
275
11.
280
12.
285
13.
290
Na wspólnym wykresie narysować krzywe absorbancji adeniny (w różnym pH roztworu), tyminy i ATP. Na
podstawie wykre
ślonych widm:
-
porównać ich kształt oraz intensywność pochłaniania UV przez zasadę purynową i pirymidynową a także
zasadę azotową wolną i w postaci nukleotydu,
- wyzn
aczyć długości fali, przy których obserwuje się maksima absorpcji dla badanych związków,
- p
rzeprowadzić dyskusję uzyskanych wyników w kontekście danych literaturowych.
Zalecana literatura:
"Biochemia" J.M. Berg, J.L.Tymoczko, L. Stryer, PWN, W-wa 2005;
rozdział pt. "DNA, RNA i przepływ informacji
genetycznej" (lub odpowiedni rozdział we wcześniejszych lub późniejszych wydaniach)
"Biochemia Harpera" R.J. Murray, D.K. Granner, V.W. Rodwell, PZWL, W-wa 2008;
rozdział dot. nukleotydów
oraz struktury i funkcji
kwasów nukleinowych
Wyszukiwarka
Podobne podstrony:
cw 11 kwasy nukleinowe
kwasy nukleinowe
13 Kwasy nukleinowe
wpływ leków na kwasy nukleinowe
kwasy nukleinowe
Biochmia 12 Kwasy nukleinowe
BW13 KWASY NUKLEINOWE id 95709 Nieznany
pkt1 kwasy nukleinowe-biochemia, Biochemia, Zagadnienia na kolokwia
kwasy nuklein
sprawozdanie kwasy nukleinowe
wszystko wyjście kwasy nukleinowe
kwasy nukleinowe opracowanie
Kwasy nukleinowe
KWASY NUKLEINOWE I STRUKTURA
pkt.4-kwasy nukleinowe- biochemia, Biochemia, Zagadnienia na kolokwia
więcej podobnych podstron