
Tomasz H. Wierzba
WPROWADZENIE
DO
FIZJOLOGII KRWI
SKRYPT
DLA STUDENTÓW GDAŃSKIEGO UNIWERSYTETU MEDYCZNEGO
Gdańsk, styczeń 2012
Skrypt jest przeznaczony do użytku własnego dla studentów Gdańskiego
Uniwersytetu Medycznego. Skrypt może być drukowany, kopiowany i
nieodpłatnie rozpowszechniany w środowisku akademickim. Bez pisemnej zgody
autora skrypt w całości i we fragmentach nie powinien być przetwarzany do
wersji elektronicznej i rozpowszechniany w mediach elektronicznych poza
wewnętrzną siecią (ekstranetem) Gdańskiego Uniwersytetu Medycznego, co
stanowiłoby rażące naruszenie prawa autorskiego.

2
Spis treści:
str. 3
Skład krwi
5 Funkcje
krwi
6 Krwinki
czerwone
8
Hemoglobina i jej rola w przenoszeniu tlenu
11
Mechanizmy transportu dwutlenku węgla
13 Wskaźniki czerwonokrwinkowe
16 Krwinki
białe
18 Mechanizmy
odpornościowe
20 Odporność nieswoista
22 Odporność swoista
25 Układy grupowe krwi
25 Układ grupowy AB0
26 Układ grupowy Rh
27 Niezgodność i konflikt serologiczny
28 Próba
krzyżowa
30
Odczyny antyglobulinowe Coombsa
32
Koncepcja uniwersalnego biorcy i dawcy krwi
33 Hemostaza
34 Fazy hemostazy miejscowej
35 Hemostaza
płytkowa
36 Hemostaza
osoczowa
42
Czynnik von Willebranda (vWF)
43 Fibrynoliza
3
Skład krwi
Krew jest lepką zawiesiną, zawierającą osocze i zawieszone w nim komórki: krwinki
czerwone (erytrocyty), krwinki białe (leukocyty) i płytki krwi (trombocyty; Tab.1).
Krew stanowi przeciętnie od 1/11 do 1/13 masy ciała. U osoby o masie ciała 70 kg,
objętość krwi wynosi przeciętnie około 5,5 l.
Zabarwienie krwi zależy od wysycenia tlenem. Krew tętnicza, o dużej zawartości
tlenu jest jasnoczerwona. Krew żylna jest ciemniejsza, a jej odcień zmienia się od
barwy wiśniowej, w standardowych warunkach spoczynkowych, do sinofioletowej,
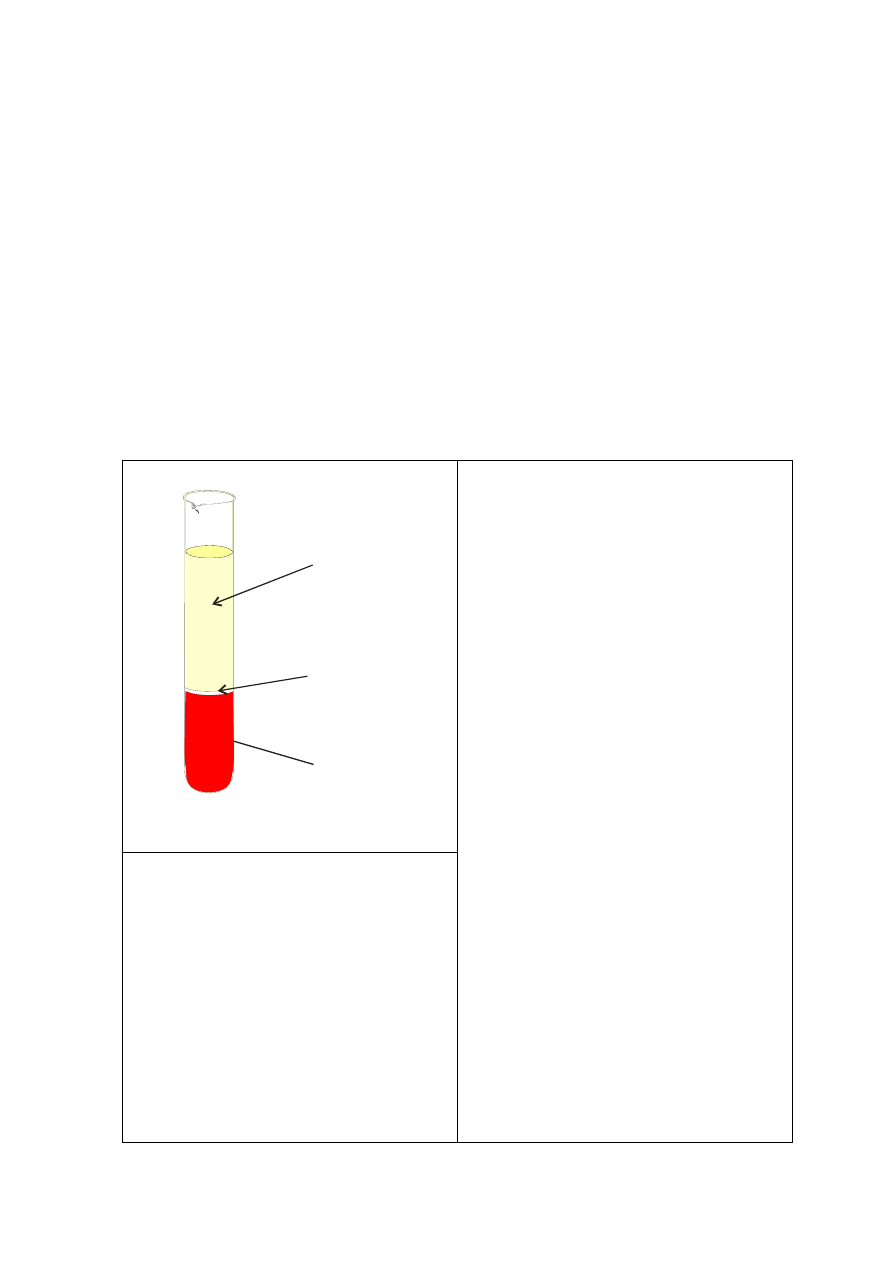
przy bardzo niskiej zawartości tlenu. Ciężar właściwy krwi wynosi przeciętnie 1,050–
1,060 g/cm
3
, przy czym krwinki są nieco cięższe (1,088-1,090 g/cm
3
) od osocza
(1,027-1,030 g/cm
3
), co umożliwia ich odseparowanie od osocza podczas wirowania,
pod wpływem przyspieszenia kątowego.
Tab. 1. Podstawowe składniki krwi
KRWINKI
ERYTROCYTY: ♀ 5,2 ± 0,8 [mln/μl]
♂ 4,7 ± 0,7 [mln/μl]
LEUKOCYTY: 4000 – 11000 ml
-1
Granulocyty
- obojętnochłonne (neutrofile): 50-70%
- kwasochłonne (eozynofile): 2-4 %
- zasadochłonne (bazofile): < 1%
Limfocyty: 20-40%
Monocyty: 3-8%
PŁYTKI KRWI 180 000–400 000/μl
OSOCZE
WODA: 90-92%
BIAŁKA: 60-84 g/l
Albuminy: 60%
Globuliny: 35%
Fibrynogen 4%
Enzymy, hormony 1%
ELEKTROLITY
Na
+
: 135-145 mmol/l
K
+
: 3,5-5,5 mmol/
Cl
-
: 90-110 mmol/l
HCO
3
-
: 25 mmol/l
Inne: Ca
2+
, Mg
2+
, PO
4
3-
, HPO
4
-
, SO
4
2-
WĘGLOWODANY
Glukoza: 60-100 mg/dl
(3,4-5,6 mmol/l)
LIPIDY
Cholesterol, kwasy tłuszczowe
INNE ZWIĄZKI ORGANICZNE
Aminokwasy
Polipeptydy
Metabolity:
Bilirubina, Mocznik, Kreatynina, Jony
amonowe Kwasy organiczne, w tym:
Kwas mlekowy, Kwas moczowy
Osocze
Lipidy
Leukocyty
P
łytki krwi
Erytrocyty

4
W krwiobiegu występują niemal wyłącznie dojrzałe postaci krwinek, które powstały
w szpiku kostnym w wyniku kolejnych przeobrażeń komórek prekursorowych. Pewnym
wyjątkiem są limfocyty, których końcowe różnicowanie i namnażanie zachodzi w
obwodowych narządach limfatycznych i grasicy. Zespół mechanizmów czynnościowych,
które zapobiegają uwalnianiu do krwiobiegu niedojrzałych postaci krwinek określa się
mianem bariery szpikowej.
Osocze jest przeźroczystą, opalizującą cieczą, zawierającą 90-92% wody i
rozpuszczone składniki: nieorganiczne (w większości w formie zjonizowanej) i
organiczne (Tab.1). Trzy główne rodzaje białek osocza pełnią odmienne funkcje.
1. Albuminy mają znaczący potencjał osmotyczny – przyciągają wodę. Pomiędzy
osoczem i płynami tkankowymi istnieje gradient stężeń: albuminy występują w
znikomej ilości w płynie tkankowym. Ciśnienie osmotyczne wywierane przez
albuminy, zwane ciśnieniem onkotycznym, odgrywa kluczową rolę w zachowaniu
prawidłowych proporcji między objętością osocza i płynu tkankowego. Albuminy
osoczowe absorbując wodę warunkują resorpcję płynu tkankowego i tkankowych
produktów przemiany materii w naczyniach włosowatych. Przy niedoborze albumin,
w tkankach pozostaje nadmiar niezresorbowanej wody, co może prowadzić do
powstawania obrzęków. Ponadto, albuminy pełnią funkcję nośników niektórych
hormonów, kwasów tłuszczowych, barwników żółciowych i leków, a także wykazują
zdolność buforowania zaburzeń równowagi kwasowo-zasadowej, wiążąc jony
wodorowe i niewielkie ilości dwutlenku węgla.
2. Globuliny, które oprócz osocza są rozpowszechnione w komórkach i tkankach,
mają zróżnicowaną budowę i znaczenie czynnościowe. Immunoglobuliny
uczestniczą zjawiskach odpornościowych pełniąc funkcję przeciwciał.
Apolipoproteiny wiążą trójglicerydy, a po związaniu z kwasami tłuszczowymi
tworzą lipoproteidy. Metaloproteiny wiążą jony metali, a inne globuliny są
wyspecjalizowane w swoistym wiązaniu hormonów.
3. Fibrynogen jest prekursorem włóknika (fibryny), podstawowego białka
warunkującego krzepnięcie krwi.
Większość białek osocza jest wytwarzana w wątrobie, a jej uszkodzenie skutkuje
zaburzeniami ilościowymi (hipoproteinemia) lub jakościowymi (dysproteinemia).
Immunoglobuliny są syntezowane przez zaktywowane limfocyty typu B (plazmocyty),
w makrofagach powstają niektóre białka układu dopełniacza – jednego z głównych
elementów odporności nieswoistej, apolipoproteiny są wytwarzane przez komórki
nabłonka jelitowego, a komórki śródbłonka są źródłem niektórych białek układu
krzepnięcia. Skład diety ma istotne znaczenie dla syntezy białek osoczowych.
Zrównoważona synteza białek osoczowych wymaga dostarczenia 10 podstawowych
aminokwasów. Białka pokarmowe pochodzenia zwierzęcego sprzyjają syntezie
albumin, zaś pochodzenia roślinnego – globulin.
5
Krew jest niezbędnym składnikiem życia organizmów wyższych, spełniając
różnorodne funkcje (Tab.2).
Tab. 2. Funkcje krwi
TRANSPORTOWE
i
ODŻYWCZE
-
gazy oddechowe
- substraty energetyczne i budulcowe
- produkty przemiany materii
- witaminy
- hormony
- jony
- kwasy żółciowe
REGULACYJNE
-
utrzymanie izohydii (pH = const.) i izojonii
płynu tkankowego
- stabilizacja temperatury ciała
PROTEKCYJNE
-
obrona przed patogenami i toksynami
Przy określaniu nieprawidłowej liczby krwinek białych zwyczajowo stosuje się
nazewnictwo medyczne (Tab. 3).
Tab. 3
Rodzaj krwinek
Liczba w mm
3
↓ normy
↑ normy
Erytrocyty
♀ 4,7 ± 0,7 mln
♂ 5,2 ± 0,8 mln
Niedokrwistość
Anaemia
Nadkrwistość
Czerwienica
Policytaemia
Poliglobulia
Płytki krwi
180 000 - 400 000 Trombocytopenia
Nadpłytkowość
Trobocytoza
Leukocyty
4 000 – 11 000
Leukopenia Leukocytoza
Granulocyty obojętnochłonne
2 000 – 7 700
Neutropenia Neutrofilia
Granulocyty kwasochłonne
150 - 450
Eozynopenia Eozynofilia
Granulocyty zasadochłonne <
100
-
Bazofilia
Limfocyty
1 500 – 4 000
Limfopenia Limfocytoza
Monocyty
300 - 800
Monocytopenia Monocytoza

6
Krwinki czerwone
Erytrocyty, które są najliczniejszymi elementami morfotycznymi krwi, mają kształt
okrągłych dwuwklęsłych dysków, o średnicy 6-9 μm (przeciętnie 7,5 μm) i średniej
grubości 2 μm, przy czym minimalna grubość krwinki w jej centralnej części nie
przekracza 0,9 μm, a maksymalna – w części obwodowej wynosi około 2,8 μm (ryc. 1a,
1b).
0,9 µm
7,5 µm
2,8 µm
7,5 µm
a)
b)
c)
d)
e)
Ryc. 1 Krwinki czerwone
a) erytrocyt schematyczny obraz mikroskopowy – widok z góry
b) kształt erytrocytu – widok z boku
c) odkształcenie pojedynczego erytrocytu przy przepływie przez drobne naczynie krwionośne
d) pakiet krwinek czerwonych w tętniczkach
e) schematyczny widok erytrocytu przepływającego przez najdrobniejsze naczynia włosowate w śledzionie
Oryginalny kształt erytrocytów i duża elastyczność błony komórkowej:
1. zapewniają wysoki stosunek powierzchni krwinki do jej objętości, co ułatwia
absorbcję tlenu;
2. zapewniają krwinkom giętkość (ryc. 1c) i ułatwiają ich odkształcanie, co warunkuje
przepływ przez naczynia włosowate o średnicy mniejszej od standardowej średnicy
krwinki. Erytrocyty, rozciągnięte do 13-19 μm, skutecznie przeciskają się przez

7
naczynia włosowate śledziony o średnicy 4 μm (ryc. 1e), a łatwość odkształcania
umożliwia ich przepływ przez rozwidlenia naczyniowe o złożonej geometrii, a także
przez zwężenia naczyniowe spowodowane np. blaszkami miażdżycowymi;
3. sprzyjają tworzeniu pakietów krwinek. Przemieszczanie krwinek w naczyniach
tętniczych w postaci zwartej znacznie zmniejsza opór przepływu i redukuje pracę
serca niezbędną do przetłoczenia krwi do tkanek (ryc. 1 d);
4. zabezpieczają przed pękaniem błony komórkowej i dezintegracją krwinek w
środowisku umiarkowanie hipotonicznym (przewodnienie hipotoniczne, naczynia
włosowate przewodu pokarmowego), w którym do krwinek wnika woda, powodując
ich pęcznienie.
W 1 mikrolitrze krwi znajduje się przeciętnie około 5 mln erytrocytów u mężczyzn i
nieco mniej, około 4,6 mln u kobiet. Krew określa się często jako płynną tkankę.
Szacunkowo, w całym organizmie znajduje się 30 bilionów krwinek czerwonych (3 x
10
13
), co stanowi około 1/3 wszystkich komórek ustroju.
Niedobór erytrocytów, lub ich głównego składnika hemoglobiny, nosi nazwę
niedokrwistości (anaemia).
Rzadziej występuje nadmiar erytrocytów, co określa się jako nadkrwistość
(poliglobulia, policytaemia) lub w przypadkach bardziej zaawansowanych,
proliferacji nowotworowej, jako czerwienica (purpura).
U ludzi dorosłych, erytropoeza, czyli tworzenie krwinek czerwonych z komórek
progenitorowych i ich różnicowanie do postaci dojrzałej – erytrocytu, zachodzi w
szpiku kostnym, głównie kości płaskich i w nasadach kości długich, zaś w rozwoju
płodowym funkcję krwiotwórczą spełnia wątroba.
Dojrzałe erytrocyty występujące w krwiobiegu są komórkami wysoce
wyspecjalizowanymi - przystosowanymi do efektywnego przenoszenia tlenu i
dwutlenku węgla, przy niskim wydatku energetycznym. Nie posiadają organelli
występujących w innych komórkach ustrojowych: jądra komórkowego, mitochondriów,
aparatu Golgiego, lizosomów. Ubogie wyposażenie krwinek czerwonych warunkuje
niskie tempo przemian metabolicznych, oparte o przemiany beztlenowe i zaledwie
kilkumiliwoltowy potencjał spoczynkowy. Erytrocyty żyją w krwiobiegu przeciętnie
120 dni. W warunkach standardowych każdego dnia ulega rozpadowi około 250
miliardów krwinek. Warunkiem pełnego odtworzenia tej puli jest wytworzenie w
przybliżeniu 2 milionów erytrocytów w ciągu sekundy.
Czynnikiem stymulującym wytwarzanie krwinek czerwonych jest hormon –
erytropoetyna (EPO), wydzielany krwiobiegu przez nerki (85%) i wątrobę (15%).
Niedokrwistość i niedobór tlenu we krwi (hipoksemia – niska prężność tlenu we krwi
tętniczej; hipoksja – niska prężność tlenu w płynie tkankowym i krwi żylnej)
stymulują uwalnianie EPO. Erytropoetyna i jej pochodne są nielegalnie
wykorzystywanie w sporcie, jako środki dopingujące. Nadmierny przyrost liczby
erytrocytów zwiększa lepkość krwi i sprzyja jej wykrzepianiu wewnątrznaczyniowemu,
zwiększając ryzyko nagłego zgonu.

8
W miarę starzenia zmniejsza się aktywność enzymatyczna erytrocytów i dochodzi
do usztywnienia błony komórkowej. Krwinki o zmniejszonej odkształcalności
pękają z uwolnieniem barwnika – hemoglobiny (hemoliza), przy przeciskaniu się przez
drobne naczynia śledziony.
Przy zaistnieniu konfliktu serologicznego w zakresie czynnika Rh, dochodzi do
masywnego niszczenia krwinek czerwonych noworodka i, zwykle w mniejszym stopniu,
płodu. Błona komórkowa krwinek „zaimpregnowana” przeciwciałami staje się na tyle
sztywna, że dochodzi do ich przyspieszonej destrukcji. Niszczenie krwinek rozpoczyna
się w okresie płodowym, ale ulega dramatycznemu nasileniu po urodzeniu noworodka.
Bezpośrednia przyczyną nasilenia hemolizy po urodzeniu jest zmiana warunków
krążenia krwi: w dużych tętnicach krążenia dużego noworodka ciśnienie krwi jest
kilkakrotnie wyższe niż u płodu, co przenosi się na siły rozciągające krwinki
przepływające przez najdrobniejsze naczynia śledziony. Prawidłowa odkształcalność
krwinek nie zawsze zapobiega przez ich zniszczeniem. Przykładowo, po
kilkugodzinnym biegu na twardym podłożu, w obuwiu o sztywnym podbiciu, często
dochodzi do obniżenia liczby erytrocytów we krwi o 2 do 6 % (100 do 300 tysięcy na
mikrolitr). Wynika to z nadmiernego ucisku mechanicznego wywieranego na
erytrocyty i ich hemolizy przy przepływie przez drobne naczynia krwionośne
podeszwowej części stopy.
Hemoglobina i jej rola w przenoszeniu tlenu
Hemoglobina, która stanowi 95% białek erytrocytu i 1/3 jego masy, odpowiada za
podstawową funkcję krwinek czerwonych, którą jest dostarczanie tlenu do tkanek i
przenoszenie dwutlenku węgla do płuc. Cząsteczki hemoglobiny są zbudowane z
dwóch par łańcuchów peptydowych, tworzących globinę, z których każdy związany
jest z jedną grupą hemową. Centralnym składnikiem hemu jest atom
dwuwartościowego żelaza (Fe
2+
), który posiada zdolność odwracalnego wiązania
cząsteczki tlenu, czemu towarzyszą zmiany konformacyjne w obrębie globiny.
Łańcuchy polipeptydowe globiny wykazują polimorfizm, polegający na odmiennym
składzie aminokwasów. W życiu płodowym początkowo występują warianty
hemoglobiny embrionalnej, wśród których około 3 miesiąca życia dominuje wariant Hb
Gower2, składający się z dwóch łańcuchów peptydowych typu α i dwóch ε (Hbα
2
ε
2
).
W dalszym okresie rozwoju płodowego jej miejsce zajmuje hemoglobina płodowa
(HbF; Hbα
2
γ
2
), która po urodzeniu zastępowana jest przez hemoglobinę A (Hbα
2
β
2
).
W kilkudziesięciu dotąd opisanych hemoglobinopatiach uwarunkowanych genetycznie
występują także inne nieprawidłowe postacie hemoglobiny. Poszczególne rodzaje
hemoglobiny różnią się pod względem czynnościowym, przede powinowactwem do
tlenu, czyli zdolnością jego wiązania.
Powinowactwo jest odwrotnie proporcjonalne do zdolności oddawania
(oddysocjowania) tlenu. Hemoglobiny płodowe charakteryzuje większe powinowactwo
do tlenu w porównaniu do HbA, co jest korzystnym przystosowaniem do wiązania

9
tlenu w środowisku łożyskowym, o niskim jego stężeniu, jakkolwiek utrudnia
oddawanie tlenu.
Tlen przenikający do krwi we włośniczkach pęcherzyków płucnych jest niemal
natychmiast absorbowany przez atom żelaza hemowego (Fe
2+
). Interakcja żelaza z
tlenem prowadzi do powstania słabego wiązania koordynacyjnego, w którym żelazo
nie oddaje elektronów, czyli nie zmienia swojej wartościowości.
Hemoglobinę z przyłączonym kowalencyjnie tlenem określa się mianem
hemoglobiny utlenowanej lub oksyhemoglobiny.
Termin hemoglobina utleniona określa cząsteczkę, w której w wyniku reakcji z
tlenem doszło do utlenienia atomu żelaza.
Methemoglobina, zawierająca żelazo utlenione (Fe
3+
), nie dostarcza tlenu do
tkanek, z uwagi na silne wiązanie Fe
3+
-O
2
. Methemoglobina, stanowi około 2%
hemoglobiny występującej fizjologicznie we krwi. Po spożyciu znacznej ilości
azotanów zawartych w warzywach pochodzących z upraw obficie wspomaganych
nawozami syntetycznymi lub w wodzie pochodzącej z ujęć powierzchniowych w
otoczeniu pól uprawnych, odsetek methemoglobiny może niebezpiecznie wzrastać,
szczególnie u noworodków.
Jedna cząsteczka hemoglobiny wiąże 4 cząsteczki tlenu. Kooperacyjny charakter
wiązania tlenu przez hemoglobinę sprawia, że kinetyka wiązania tlenu jest
nierównomierna, a krzywa wysycenia hemoglobiny tlenem w zależności od prężności
tlenu, nazywana krzywą dysocjacji hemoglobiny, ma charakter nieliniowy (ryc. 2).
Przyłączenie cząsteczki tlenu do jednego hemu powoduje zmianę struktury
przestrzennej całego tetrameru. Przyczyną jest wsunięcie atomu żelaza w
płaszczyznę pierścienia hemu po połączeniu z tlenem. Wsunięcie atomu żelaza
pociąga związaną z nim tzw. histydynę proksymalną, co powoduje przemieszczenie
sąsiednich aminokwasów globiny. Doprowadza to w rezultacie do pęknięcia wiązań
poprzecznych pomiędzy końcami karboksylowymi wszystkich czterech cząstek globiny.
Konformacja, w której hemoglobina jest odtlenowana, określana jest jako stan T (ang.
tight - naprężony), zaś konformacja całkowicie utlenowanej hemoglobiny po
wykonaniu obrotu o 15° – jako stan R (ang. relaxed - rozluźniony). Hemoglobina w
stanie R wykazuje większe powinowactwo do tlenu aniżeli w stanie T. Każde
przyłączenie w płucach cząstki tlenu do hemoglobiny ułatwia przyłączanie następnych
cząsteczek tlenu (tzw. wiązanie kooperacyjne), zaś odszczepienie każdej cząsteczki
tlenu w tkankach ułatwia uwalnianie kolejnych cząstek tlenu. Wiązanie kooperacyjne
sprzyja maksymalizacji wysycania tlenem hemoglobiny w płucach oraz oddawania
przez nią tlenu w tkankach. Każde przyłączenie cząsteczki tlenu do hemoglobiny
ułatwia przyłączanie następnych, co sprzyja maksymalizacji wysycania tlenem
hemoglobiny w płucach oraz umożliwia spełnianie przez hemoglobinę funkcji
krótkotrwałego buforu tlenowego.
10
0
25
50
75
100
0
25 40
70
100
HbO %
2
PaO [mmHg]
2
↑
↓
↑
↑
temp
pH
CO
2,3-DPG
2
↓
↑
↓
↓
temp
pH
CO
2,3-DPG
2
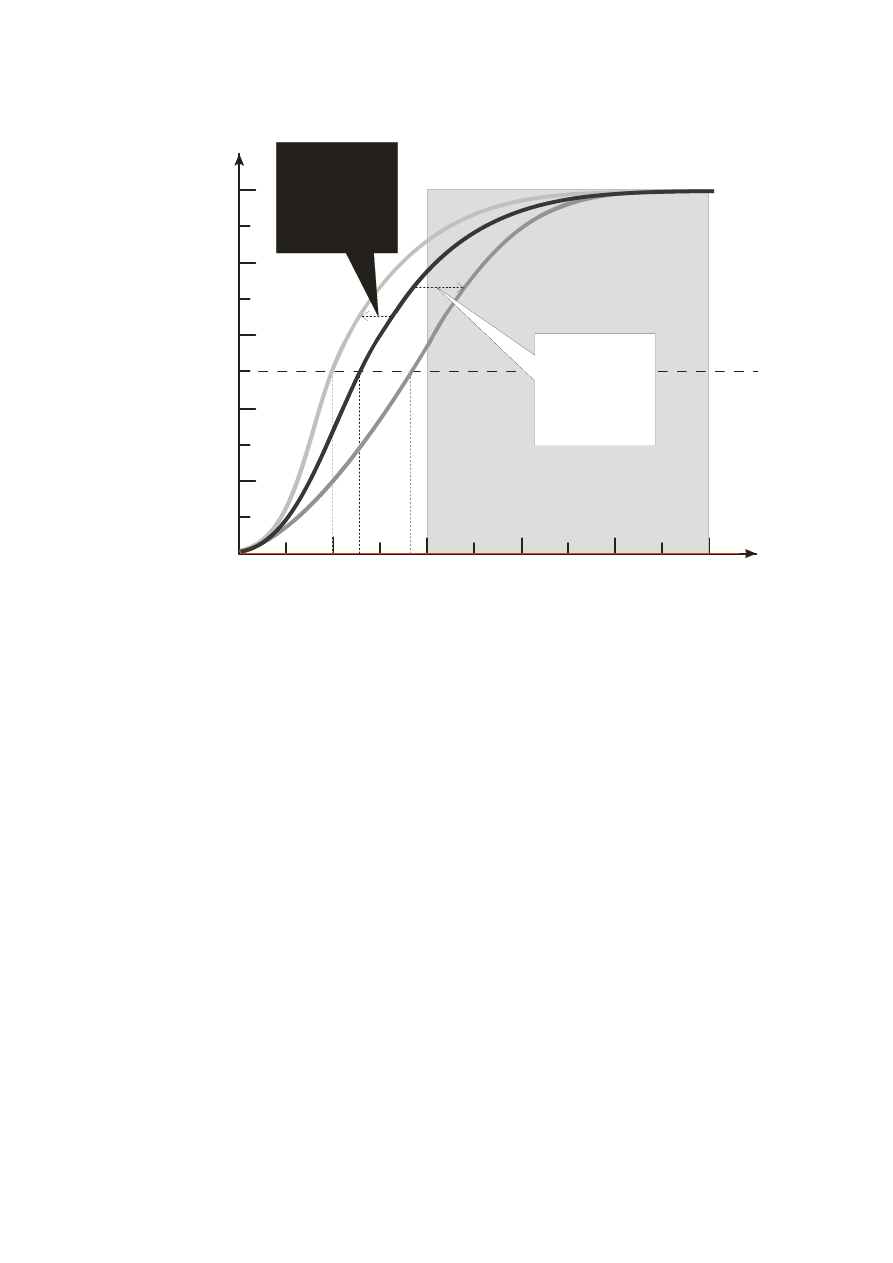
Rycina 2 Krzywa dysocjacji hemoglobiny
Hb0
2
% - odsetek cząsteczek hemoglobiny związanych z tlenem
Pa0
2
– prężność tlenu (ciśnienie parcjalne tlenu rozpuszczonego we krwi)
Zakres prężności tlenu (PaO
2
) odpowiadający warunkom spoczynkowym został zaznaczony kolorem jasno szarym.
Zacieniowane pole odpowiada przeciętnemu zakresowi prężności tlenu we krwi (100 mm Hg krew tętnicza - 40 mm
Hg – krew żylna).
Pionowe linie punktowe – odpowiadają PaO
2
przy 50% wysyceniu Hb tlenem. 2,3-DPG: 2,3-difosfoglicerynian
W krwi tętniczej, przy prężności tlenu (PaO
2
) zbliżonej do 100 mmHg, hemoglobina
jest całkowicie wysycona tlenem (HbO
2
% = 100%). W krwi żylnej, w standardowych
warunkach spoczynkowych, w której PaO
2
spada dwuipółkrotnie do 40 mmHg, nadal
75% cząsteczek hemoglobiny wiąże tlen. Dopiero przy ekstremalnym wysiłku lub w
stanach chorobowych, przy PaO
2
około 25 mmHg, odsetek cząsteczek hemoglobiny
wysyconych tlenem (HbO
2
%) spada do 50%.
Powinowactwo hemoglobiny do tlenu w istotnym stopniu zależy od warunków
środowiskowych i metabolizmu erytrocytu. Do czynników obniżających powinowactwo
hemoglobiny do tlenu należą (ryc. 2):
1. ↑temperatury
2. ↓ pH
3. ↑ prężności CO
2
4. ↑ stężenia 2,3-difosfoglicerynianu (2,3-DPG).

11
W tkankach, a zwłaszcza w pracujących mięśniach, temperatura jest wyższa od
temperatury powietrza wypełniającego pęcherzyki płucne bezpośrednio po wdechu.
Warunki tkankowe (względnie wysoka temperatura, wysoka prężność CO
2
, niskie pH)
sprzyjają oddawaniu tlenu (ryc.2; krzywa prawostronna). Zjawisko polegające na
zmniejszaniu powinowactwa hemoglobiny do tlenu w warunkach obniżonego pH nosi
nazwę efektu Bohra.
Przy hipotetycznie identycznej PaO
2
w krwi wypływającej z płuc i dopływającej do
tkanki, wysycenie hemoglobiny tlenem w tkance jest niższe, wskutek ułatwionego
oddysocjowywania tlenu. Z kolei upały letnie, które kojarzą się z utrudnionym
oddychaniem i duchotą, nie sprzyjają wykonywaniu wysiłku fizycznego o dużej
intensywności i uzyskaniu dobrego wyniku sportowego w dyscyplinach typu
wytrzymałościowego, opartych o metabolizm tlenowy. Dzieje się tak dlatego, że przy
względnie wysokiej temperaturze powietrza docierającego do pęcherzyków płucnych,
szybkość wysycania hemoglobiny tlenem jest obniżona. Chłodne powietrze otoczenia
ma charakter orzeźwiający, bo w chłodnym środowisku krzywa dysocjacji
hemoglobiny jest przesunięta w lewo – hemoglobina łatwiej wiąże tlen (ryc.2 krzywa
lewostronna). Metabolitem krwinkowych przemian glukozy jest 2,3-difosfoglicerynian
(2,3-DPG; synonim: 2,3-BPG, 2,3-bisfosfoglicerynian).
Stężenie 2,3-DPG w krwinkach istotnie spada przy długotrwałym przechowywaniu
preparatów krwi ex vivo, co utrudnia oddawanie tlenu. Dlatego po przetoczeniu takiej
krwi poprawa samopoczucia występuje nie od razu, a dopiero po kilkunastu godzinach,
po zregenerowaniu krwinkowego 2,3-DPG.
Prawidłowe stężenie hemoglobiny wynosi przeciętnie 160 ± 20 g/l u mężczyzn i 140
± 20 g/l u kobiet. Przy pełnym wysyceniu hemoglobiny tlenem i objętości krwi
krążącej 5 l, całkowita zawartość tlenu we krwi, określana mianem pojemności
tlenowej krwi, wynosi nieco ponad 1 litr. Odpowiada to spoczynkowemu
zapotrzebowaniu organizmu na tlen w ciągu 4–5 min. Za 97% pojemności tlenowej
krwi odpowiada oksyhemoglobina, a tlen rozpuszczony w osoczu odgrywa marginalną
rolę.
Mechanizmy transportu dwutlenku węgla
Odłączenie tlenu od hemoglobiny, prowadzące do powstania deoksyhemoglobiny
(hemoglobina odtlenowana), ułatwia wiązanie dwutlenku węgla przez grupy aminowe
globiny z wytworzeniem karbaminohemoglobiny (Hb-CO
2
). Zjawisko to określane jest
jako efekt Haldane’a. Około 200-krotnie większe powinowactwo do hemoglobiny
wykazuje bezwonny i toksyczny gaz, tlenek węgla (CO), który po związaniu z globiną
tworzy trwałą karboksyhemoglobinę (Hb-CO). Związanie hemoglobiny z CO utrwala
konformację T globiny, przy której przyłączenie tlenu jest niemożliwe, a hemoglobina
traci zdolność przenoszenia tlenu.

12
W spoczynku PaCO
2
wynosi przeciętnie 40 mmHg w krwi tętniczej i 46 mmHg w krwi
żylnej, co odpowiada, odpowiednio 490 i 530 ml CO
2
rozpuszczonego w litrze krwi.
Kluczową rolę w transporcie CO
2
odgrywa enzym krwinkowy - anhydraza węglanowa,
która katalizuje odwracalną reakcję powstawania anionu HCO
3
-
z dwutlenku węgla i
wody (ryc. 3). W tkankach, w krwi żylnej, anhydraza węglanowa przekształca CO
2
w
aniony HCO
3
-
, natomiast w płucach, w miarę dyfundowania CO
2
do powietrza
pęcherzykowego, kierunek przemian jest odwrotny, co pozwala na odtwarzanie i
usuwanie nadmiaru CO
2
.
CO
2
Cl-
Hb CO
2
CO
2
+ H
2
O
HCO
3
- H
+
+
Cl-
HCO
3
-
CO
2
7 - 10 %
60 - 70%
20 - 30%
w osoczu:
rozpuszczony
i związany
z albuminami
-
HCO
3
-
anhydraza
węglanowa
z tkanek
w osoczu
Rycina 3 Rola erytrocytów w przenoszeniu dwutlenku węgla
Produktami krwinkowej anhydrazy węglanowej są jony wodorowęglanowe (HCO
3
-
) i protony (H
+
). Większość
protonów jest wiązana (buforowana) przez hemoglobinę, natomiast nadmiar jonów HCO
3
-
jest, zgodnie z gradientem
stężeń, usuwany z krwinki i dalej przenoszony przez osocze do płuc. Zgodnie z gradientem elektrycznym, w zamian
za aniony HCO
3
-
, do krwinki wnikają aniony chlorkowe Cl
-
(wymiana Hamburgera). Chlorki, które są mniejszymi
jonami od cząsteczek HCO
3
-
mają większy potencjał osmotyczny i przyciągają do krwinki wodę. W efekcie
hematokryt krwi żylnej jest zwykle o 1-2% większy od krwi tętniczej.

13
W osoczu rozpuszczone są aniony wodorowęglanowe (przeciętnie 24 mmol/l), które
są głównym elementem zasobu zasad osocza i z których, w wyniku reakcji z jonami
wodorowymi H
+
, może powstawać dwutlenek węgla. Nadwyżka CO
2
powstająca w
tkankach:
1. jest w 60-70% przekształcana w jony HCO
3
-
,
2. w 20-30% wiąże się z hemoglobiną (karbaminohemoglobina),
3. w 5-10% dociera do płuc w osoczu (ryc.3): w postaci rozpuszczonej (1/3) i
nietrwale związanej z albuminami (2/3).
Wskaźniki czerwonokrwinkowe
W diagnostyce niedokrwistości określa się wskaźniki czerwonokrwinkowe (Tab. 4, 5).
Do podstawowych wskaźników czerwonokrwinkowych należą: stężenie hemoglobiny
we krwi (Hb), liczba erytrocytów przypadających na jednostkę objętości krwi (Erys;
RBC, red blood count), hematokryt (Htk, Hct ) – czyli stosunek objętości erytrocytów
do objętości pełnej krwi, średnia objętość krwinki (MCV; mean corpuscular volume),
średnie stężenie hemoglobiny w krwince (MCHC; mean corpuscular hemoglobin
concentration) i średnia masa hemoglobiny w krwince (MCH; mean corpuscular
hemoglobin).
Tab. 4 Podstawowe wskaźniki czerwonokrwinkowe
Stężenie hemoglobiny we krwi (Hb)
Norma:♀ 115 – 160 g/l (11,5 – 16 g%); przeciętnie PL 14 g%
♂ 125 – 180 g/l (12,5 – 18 g%); przeciętnie PL 16g%
Noworodki 142 – 196 g/l (14,2 – 19,6g%)
Hematokryt
(wskaźnik hematokrytowy) - stosunek objętości erytrocytów
do objętości pełnej krwi
Norma: ♀ 37 – 47 % (0,37 – 0,47); przeciętnie PL 38 - 40%
♂ 42 – 52 % (0,40 – 0,52); przeciętnie PL 42 - 44%
Liczba erytrocytów (RBC; Erys)
Norma: ♀ 4 000 000 – 5 400 000 / μl ; przeciętnie PL 4 700 000 / μl
♂ 4 500 000 - 6 000 000 / μl ; przeciętnie PL 5 000 000 / μl

14
Tab. 5 Wskaźniki czerwonokrwinkowe – pochodne parametrów podstawowych
MCV
(ang. mean corpuscular volume), Średnia objętość krwinki
Norma: 80 – 92 μm
3
; (> 92 μm
3
– makrocytoza; < 80 μm
3
– mikrocytoza)
MCH
(ang. mean cell hemoglobin; mean corpuscular hemoglobin),
Średnia masa hemoglobiny w krwince
Norma: 27 – 33 (35) pg / krwinkę
MCHC
(ang. mean corpuscular hemoglobin concentration)
Średnie stężenie hemoglobiny w krwince
Norma: 31 – 37 g/dl (inaczej: g%; g/100ml)
>37 g/dl – hiperchromia (nadbarwliwość) < 31 g/dl – hipochromia (niedobarwliwość)
Wskaźnik barwny (INDEX)
Termin coraz bardziej historyczny. Określa „wybarwienie” krwinek hemoglobiną. Obliczany
tradycyjnie odnosi się do wartości normatywnych dla danej populacji
gdzie %Hb i % Erys - określają odpowiednio jaki procent standardowej normy stanowi oznaczona wartość
hematokrytu i liczby krwinek czerwonych.
Norma: 0,85 -1,15.
< 0,85 = hipochromia (niedobarwliwość); 1,15 – hiperchromia, (nadbarwliwość)
Niekiedy Index jest obliczany z ilorazu stężenia Hb i liczby erytrocytów wyrażonych w g/l i mln/mm
3
.
MCD (ang. mean cell diameter); Średnia średnica erytrocytu
Przeciętnie od 7,2 do 7,8 μm (> 8 μm – makrocytoza; < 7,2 μm – mikrocytoza)
RDW (ang. red cell distribution width) – wskaźnik anizocytozy; wskaźnik rozkładu objętości
erytrocytów – jest odchyleniem standardowym objętości populacji krwinek czerwonych,
wyrażonym jako odsetek MCV
Norma: 11,5 -14,5% > 14,5% anizocytoza
Krwinki o prawidłowej objętości określa się jako normocyty, o zmniejszonej –
mikrocyty, o zwiększonej – makrocyty. Niskie MCHC lub MCH określa się jako
hipochromia lub niedobarwliwość, zaś wysokie – hiperchromia lub nadbarwliwość.
Przykładowo, przy niedokrwistości spowodowanej niedoborem żelaza dominują
hipochromiczne mikrocyty, zaś przy niedoborze kwasu foliowego lub witaminy B
12
przeważają makrocyty.
10
]
3
[mln/mm
Erys
[%]
Htk
MCV
∗
=
]
3
[mln/mm
Erys
[g/L]
Hb
MCH
=
10
[%]
Htk
[g/L]
Hb
MCHC
∗
=
Erys
%
Hb
%
INDEX
=
15
Zautomatyzowane analizatory krwi obliczają wskaźniki różnorodności populacji
krwinek. Najczęściej stosowanym wskaźnikiem jest RDW, który jest odchyleniem
standardowym objętości badanej puli krwinek czerwonych. Wysokie RDW występuje
często w niedokrwistościach niedoborowych spowodowanych niedoborem żelaza,
witaminy B
12
lub kwasu foliowego. RDW zwykle wzrasta w początkowym okresie
skutecznego leczenia tych niedokrwistości, gdyż w miarę uzupełniania brakującego
czynnika, do populacji erytrocytów o nieprawidłowej objętości dołączają się
nowowytworzone prawidłowe krwinki. Odpowiednikiem graficznym RDW jest krzywa
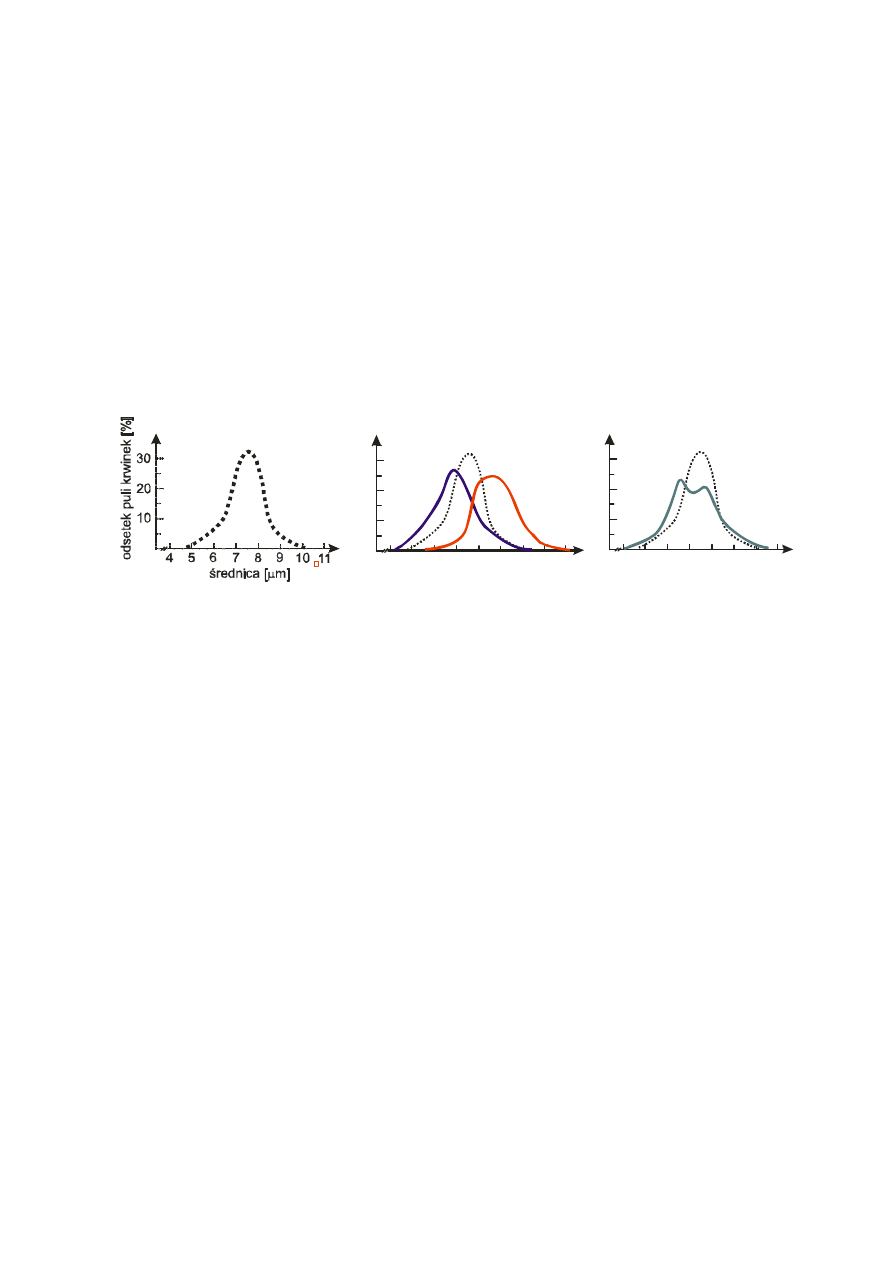
Price-Jonesa, która określa rozkład średnicy erytrocytów (Ryc. 4).
średnica [ m]
μ
10
20
30
4 5 6
7 8 9 10 11
średnica [ m]
μ
10
20
30
4 5 6
7
8 9 10 11
12
a) standardowa krzywa
Price-Jonesa
mikrocytoza
makrocytoza
regeneracja
b) przykładowe krzywe
w niedokrwistościach
niedoborowych
c) dwuszczytowa krzywa
Price-Jonesa w trakcie
podczas leczenia (Fe 2+)
Ryc. 4 Ukształtowanie krzywych Price-Jonesa w warunkach prawidłowych (a)
i w niedokrwistościach niedoborowych (b,c).
a) Standardowa krzywa Price-Jonesa, przy średniej średnicy krwinki (MCD) – 7,5
μm, ma kształt zbliżony do krzywej
rozkładu normalnego, z nieznacznym przesunięciem w lewo (nieco większy odsetek ekrwinek bardzo małych w
stosunku do bardzo dużych.
b) Przy niedoborze żelaza występuje często niedokrwistość mikrocytarna. Szczyt krzywej Price-Jonesa jest obniżony
i przesunięty w lewo, przy rozsuniętych ramionach krzywej, co koresponduje z wysokimi wartościami RDW,
charakterystycznymi dla anizocytozy. Przy niedoborze witaminy B12 lub kwasu foliowego krzywa jest przesunięta
w prawo (makrocytoza). Obniżony szczyt krzywej z rozsuniętymi ramionami odpowiada anizocytozie.
c) modelowa krzywa Price-Jonesa podczas skutecznego leczenia niedokrwistości z niedoboru żelaza. Nierzadko
obserwowane dwa szczyty krzywej odpowiadają dwóm pulom krwinek: „starej” sprzed leczenia, kiedy dominowały
krwinki małe (mikrocyty) i nowej - uwolnionej do krwiobiegu po uzupełnieniu żelaza, w których średnica jest
prawidłowa
Erytrocyty odgrywają istotną rolę w utrzymaniu równowagi kwasowo-zasadowej
ustroju. Podstawowym buforem osocza, zależnym od anhydrazy węglanowej
erytrocytów, jest układ HCO
3
-
/CO
2
, który odpowiada za ponad 50% pojemności
buforowej krwi, natomiast krwinkowy układ deoksy-/oksy- hemoglobina stanowi o
pozostałych 35-45% tej pojemności.

16
Krwinki białe
Leukocyty, których liczba we krwi wynosi przeciętnie od 4000 do 11000/μl
(Tab. 1 ),
dzielą się na krwinki posiadające wyraźne ziarnistości w cytoplazmie – granulocyty i
agranulocyty, które ich nie posiadają. Wśród agranulocytów wyróżnia się limfocyty i
monocyty. Limfocyty przeważają wśród krwinek białych krwi do 4 roku życia, później
przewagę liczebną uzyskują granulocyty. Do granulocytów należą: neutrofile
(granulocyty obojętnochłonne), które dominują po 4 roku życia, eozynofile
(granulocyty kwasochłonne) i bazofile (granulocyty zasadochłonne), które stanowią
najmniejszą pulę leukocytów. W przeciwieństwie do erytrocytów, leukocyty posiadają
jądro komórkowe i charakteryzują się znaczną aktywnością metaboliczną.
Najważniejszą funkcją krwinek białych jest niszczenie patogenów, które wniknęły do
ustroju.
Krwinki białe wykazują kilka cech wspólnych:
1. są przyciągane do miejsca infiltracji patogenów lub uszkodzenia tkanek przez
specyficzne bodźce chemiczne; cecha ta jest określana mianem chemotaksji
2. w odróżnieniu od erytrocytów, pobudzone leukocyty przenikają z naczyń
krwionośnych do tkanek docelowych (migracja leukocytów), przeciskając się przez
pory w ścianie naczyń włosowatych (diapedeza)
3. wykazują zdolność ruchów ślizgowych, co jest szczególnie widoczne u monocytów
i neutrofili; właściwość ta umożliwia przenikanie krwinek pomiędzy komórkami
śródbłonka naczyniowego
4. neutrofile, monocyty i eozynofile wykazują zdolność fagocytozy, czyli pochłaniania
patogenów, pozostałości po obumarłych komórkach lub po procesie zapalnym.
Neutrofile i eozynofile są określane jako mikrofagi, zaś do makrofagów zalicza się
monocyty krążące we krwi i powstałe z nich komórki, które osiadły w tkankach.
Granulocyty obojętnochłonne (neutrofile, neutrocyty) są okrągłymi krwinkami,
większymi od erytrocytów, o średnicy od 10 do 14 μm. Pobudzone potrafią zmieniać
kształt i formować wypustki (filopodia). Młode neutrofile posiadają zwarte owalne
jądro (granulocyty pałeczkowate, stanowiące do 5% leukocytów), które z wiekiem
dzieli się na luźno połączone segmenty, zwykle od 2 do 6 (granulocyty segmentowane).
W warunkach standardowych, we krwi obwodowej najwięcej jest granulocytów o 3
segmentach jądra (30-40%).
Wzrost odsetka granulocytów z jednym lub dwoma segmentami jądra określa się
jako „przesunięcie w lewo” i jest w przypadku infekcji objawem rokowniczo
korzystnym, gdyż młode granulocyty wykazują większą zdolność zwalczania
patogenów. Po wytworzeniu w szpiku kostnym, w ilości ok. 100 milionów na dobę,
przedostają się do krwi, skąd przenikają do tkanek. Neutrofile wykazują zdolność
szybkiego gromadzenia się w miejscu uszkodzenia tkanek. Ich czas życia w krwiobiegu
jest bardzo krótki. Połowa krwinek ginie po 6 godz. Przeciętnie około 50% neutrofili
znajdujących się w naczyniach krwionośnych przepływa z krwią (pula krążąca).

17
Pozostałe krwinki przylegają do ścian naczyń lub są uwięzione w naczyniach
włosowatych o znikomym przepływie krwi (pula marginalna; przyścienna).
Przyspieszenie strumienia krwi, np. przy intensywnym wysiłku lub w układzie
trawiennym po spożyciu posiłku, uruchamia pulę marginalną, przez co liczba neutrofili
może przejściowo wzrosnąć z poziomu 4 000 – 11 000/μl nawet do 30 000/μl.
Fagocytujące neutrofile potrafią pochłonąć nawet do kilkunastu bakterii w ciągu
kilku minut, czemu towarzyszy dramatyczne przyspieszenie przemian tlenowych.
Oglądając preparaty mikroskopowe można ocenić zdolności fagocytarne neutrofili.
Średnia liczba bakterii znajdująca się wewnątrz neutrofila, czyli średnia liczba
bakterii przypadajaca na jeden fagocyt nosi nazwę indeksu fagocytarnego. Wysoka
wartość indeksu fagocytarnego świadczy o wysokiej aktywności bakteriobójczej
fagocytów. W wyniku tzw. wybuchu tlenowego, powstają reaktywne postaci tlenu o
silnych właściwościach utleniających: anionorodnik ponadtlenkowy (O
2
·-
), nadtlenek
wodoru (H
2
O
2
) i kwas podchlorawy (HOCl), które współdziałają w unicestwieniu
sfagocytowanych komórek.
Granulocyty kwasochłonne (eozynofile, eozynocyty) mają średnicę 10-15 μm i
dwupłatowe jądro. Ich nazwa pochodzi od ziarnistości występujących w cytoplazmie,
które wybarwiają się barwnikami o odczynie kwaśnym. Eozynofile zwalczają pasożyty
i uczestniczą w reakcjach alergicznych, a ich liczba wzrasta przy infekcjach
pasożytniczych i niekiedy w alergiach.
Granulocyty zasadochłonne (bazofile) mają średnicę 7-10 μm i stanowią przeciętnie
mniej niż 1% populacji leukocytów krwi krążącej. Nazwa wywodzi się od gęsto
rozmieszczonych ziarnistości występujących w cytoplazmie, które wybarwiają się
barwnikami o odczynie alkalicznym. Bazofile krążą we krwi kilka godzin, po czym
przenikają do tkanek. Nie wykazują zdolności do fagocytozy. Przy pobudzeniu
uwalniają ze swoich ziarnistości różnorodne czynniki, w tym: heparynę, o działaniu
przeciwkrzepliwym, histaminę i serotoninę, cytokiny. Uczestniczą w reakcjach
alergicznych, dzięki zdolności wiązania na swojej powierzchni immunoglobulin klasy E.
Profil działania eozynofilów jest zbliżony do komórek tucznych, które rozmieszczone
są w tkankach.
Monocyty są największymi leukocytami krwi obwodowej. Mają najczęściej kształt
owalny o przeciętnej średnicy 14-18 μm i duże jądro o nerkowatym kształcie.
Monocyty są odpowiedzialne za usuwanie zdegenerowanych komórek,
zdenaturowanych białek, kompleksów antygen-przeciwciało, niektórych bakterii, a
także uczestniczą w tzw. prezentacji antygenów, czyli w przetwarzaniu antygenów do
postaci rozpoznawalnych przez limfocyty. Monocyty migrują ruchem ślizgowym z krwi
do tkanek, gdzie przekształcają się w makrofagi tkankowe lub komórki dendrytyczne.
Limfocyty stanowią niejednorodną subpopulację krwinek białych. Większość, 80-90%,
stanowią limfocyty małe, o średnicy 7-11 μm, na które składają się dwa czynnościowo
odrębne typy komórek, morfologicznie nierozróżnialne w mikroskopie świetlnym:
limfocyty B i limfocyty T, z których każdy posiada zdolność swoistego rozpoznawania

18
antygenów. Wśród limfocytów dużych, o średnicy 11-15 μm dominują limfocyty NK.
W przeciwieństwie do innych krwinek białych, limfocyty przemieszczają się nie tylko z
krwiobiegu do tkanek, ale również w kierunku przeciwnym. Liczba limfocytów
krążących we krwi jest znacznie mniejsza od puli tkankowej. Część limfocytów B i T
pełni funkcję nośników pamięci immunologicznej.
Limfocyty B – są odpowiedzialne za odporność swoistą typu humoralnego, której
istotą jest wytwarzanie przeciwciał. Po uwolnieniu do krwi, limfy lub płynu
tkankowego, przeciwciała wiążą się swoiście z określonymi antygenami, co prowadzi
do eliminacji antygenów lub zniszczenia komórek zawierających te antygeny.
Po opuszczeniu szpiku przez niedojrzałe limfocyty B, ich dalsze różnicowanie
przebiega w obwodowych tkankach limfatycznych: węzłach chłonnych, śledzionie,
migdałkach podniebiennych, grudkach chłonnych przewodu pokarmowego.
Limfocyty T – są odpowiedzialne za odporność swoistą typu komórkowego. Ich
populacja jest czynnościowo heterogenna.
• Limfocyty cytotoksyczne (Tc) niszczą komórki obce,
• Limfocyty pomocnicze (Th) - wspomagają odpowiedź odpornościową -
stymulują limfocyty B do namnażania,
• Limfocyty regulatorowe (Treg; zwane też limfocytami supresorowymi Ts)
hamują odpowiedź odpornościową. Limfocyty regulatorowe są odpowiedzialne
za zjawisko tolerancji immunologicznej, polegającej na zahamowaniu
odpowiedzi odpornościowej w stosunku do niektórych obcych antygenów.
Limfocyty T powstają w szpiku kostnym, różnicują się i wstępnie dojrzewają w grasicy,
po czym kolonizują wydzielone obszary węzłów chłonnych, gdzie ostatecznie
dojrzewają i namnażają się.
Limfocyty NK (natural killer) nie wykazują swoistości działania, dlatego zaliczane
są do czynników odporności nieswoistej. Ich podstawowe znaczenie polega na
eliminacji komórek nowotworowych i komórek zainfekowanych przez wirusy.
Mechanizmy odpornościowe
Odporność jest to zdolności do rozpoznawania, unieczynniania i eliminacji obcych
cząstek, które mogą być zagrożeniem dla organizmu. Mechanizmy odpornościowe nie
tylko zabezpieczają przed inwazją patogenów, ale także eliminują zniekształcone
cząstki własne o cechach odbiegających od zaprogramowanych standardów. W
zależności od kryteriów można wyróżnić różne rodzaje odporności (Tab. 6).

19
Tab. 6 Rodzaje odporności
Kryterium Rodzaje
odporności
nieswoista swoista
Ukierunkowanie
niespecyficzna specyficzna
Geneza
powstawania
wrodzona nabyta
Sposób
powstawania
bierna czynna
Sposób
działania
humoralna komórkowa
Mechanizmy odpornościowe mogą być wybiórczo ukierunkowane na określony
czynnik (antygen) i jest to odporność swoista, mogą też nie wykazywać
ukierunkowania i taką odporność określa się mianem nieswoistej.
Mechanizmy odporności nieswoistej są wrodzone i ich występowanie nie zależy od
pobudzenia z zewnątrz, natomiast większość mechanizmów odporności swoistej ma
charakter nabyty – jest indukowana przez kontakt z konkretnym antygenem. Do
mechanizmów swoistej odporności wrodzonej należy układ grupowy krwi ABO, którego
elementy są uwarunkowane genetycznie i nie zależą od pobudzenia zewnętrznego.
Mechanizmy obrony, zarówno swoistej, jak i nieswoistej, które realizują się przez
czynniki uwolnione do krwiobiegu, limfy lub płynu tkankowego, noszą nazwę
odporności humoralnej. Alternatywnym sposobem działania jest bezpośredni
destrukcyjny wpływ na komórki, co określa się jako odporność komórkową.
Jeżeli organizm sam wytwarza czynniki humoralne lub komórkowe niszczące
patogeny, to odporność ma charakter czynny (odporność czynna). Natomiast
odporność uzyskana w wyniku podania gotowych przeciwciał lub komórek
20
odpornościowych nosi nazwę odporności biernej. Procesy odpornościowe
zainicjowane przez naturalne czynniki środowiskowe lub endogenne należą do
odporności naturalnej, natomiast odporność sztuczna wynika z podawania z
zewnątrz gotowych preparatów (ryc. 5).
Ryc. 5. Rodzaje odporności swoistej
Odporność nieswoista (łac. resistentio)
Nieswoiste mechanizmy odpornościowe stanowią pierwszą, najstarszą
filogenetycznie linię obrony organizmu przed inwazją patogenów. Składają się na nie
bariery o charakterze mechanicznym (np. trudna do przeniknięcia powierzchnia skóry),
chemicznym (np. agresywne środowisko treści żołądkowej), biologicznym (zasiedlenie
skóry i śluzówek przez bakterie saprofityczne, które tworzą nieprzyjazne środowisko
dla egzogennych bakterii chorobotwórczych), także mechanizmy humoralne,
komórkowe i regulacyjne (Tab. 7).
ODPORNOŚĆ SWOISTA
NATURALNA
SZTUCZNA
CZYNNA
BIERNA
NATURALNA SZTUCZNA
Przebyte infekcje
Szczepienia:
Patogeny
(osłabione lub
nieaktywne)
Przeciwciała matki:
Przenikanie przez łożysko,
Karmienie piersią
Podawanie
surowic ze
specyficznymi
przeciwciałami
21
Tab. 7 Charakterystyka mechanizmów odporności nieswoistej
Charakter
odporności
nieswoistej
Mechanizm odpornościowy Efekt
mechaniczne:
np. powierzchnia skóry
uniemożliwienie wnikania patogenów
chemiczne
- kwaśne pH treści żołądkowej
- kwaśne pH skóry
- lizozym w łzach
niszczenie patogenów
biologiczne
Bakterie saprofityczne:
- skóry,
- układu oddechowego,
- przewodu pokarmowego
konkurencja w stosunku do bakterii
chorobotwórczych
Bariera
czynnościowe
- kichanie
- kaszel
- ruchy nabłonka
migawkowego
dróg oddechowych
- ruchy perystaltyczne jelit
usuwanie patogenów
interferony
zwiększenie odporności komórek na
wirusy
Humoralna
układ dopełniacza i inne białka
osocza (np. tzw. białka ostrej fazy)
- uszkadzanie ścian komórkowych
- przyciąganie fagocytów
- wyzwalanie odczynu zapalnego
komórki fagocytujące:
neutrofile
eozynofile
komórki tuczne (tkanki)
monocyty
komórki dendrytyczne
makrofagi tkankowe
- eliminacja patogenów
- przetwarzanie antygenów
- aktywacja limfocytów
Komórkowa
komórki cytotoksyczne
limfocyty NK
nadzór immunologiczny:
- usuwanie nieprawidłowych
komórek
odczyn zapalny
neutrofile,
makrofagi,
komórki tuczne
cytokiny
- zlokalizowanie i ograniczenie
obszaru zagrożenia
- eliminacja patogenów
Regulacyjna
gorączka
cytokiny
reakcje odruchowe
- zwiększenie aktywności metabolicznej
- eliminacja patogenów
- kaszel, kichanie, wymioty, biegunka

22
Odporność swoista (łac. immunitas)
Swoista odpowiedź odpornościowa (immunologiczna) wynika ze zdolności
rozróżniania czynników immunogennych – antygenów i zależy od skoordynowanej
odpowiedzi, ukierunkowanej na wyeliminowanie antygenu, w której uczestniczą
limfocyty T i B.
Antygen jest to substancja zdolna do pobudzenia układu odpornościowego i
wywołania odpowiedzi skierowanej swoiście przeciw sobie. Antygen posiada dwie
cechy: immunogenność, czyli zdolność do swoistego pobudzenia układu
odpornościowego oraz antygenowość, czyli zdolność do swoistego łączenia się z
przeciwciałami rozpuszczonymi we krwi i płynach tkankowych lub stanowiącymi
receptory limfocytów.
Antygeny są najczęściej białkami lub polisacharydami.
Lipidy,
kwasy nukleinowe, polipeptydy, a także niektóre związki nieorganiczne mogą
wykazywać immunogenność po związaniu z nośnikiem białkowym lub
polisacharydowym.
Hapteny są substancjami, które wykazują antygenowość, natomiast nie mają
zdolności wywoływania odpowiedzi immunologicznej (nie są immunogenne). Jednakże
po połączeniu z nośnikiem białkowym, hapteny mogą nabyć cech immunogennych,
stając się pełnowartościowym antygenem. W wyniku reakcji haptenów z białkami
ustrojowymi nierzadko dochodzi do wyzwalania odpowiedzi immunologicznej o typie
nadwrażliwości (alergia), o różnorodnym przebiegu klinicznym. Reakcje
immunologiczne indukowane przez hapteny nie zawsze można przewidzieć, gdyż
każdy organizm posiada swoisty zestaw białek, które po połączeniu z haptenem mogą
utworzyć unikalną cząsteczkę o właściwościach immunogennych.
Przeciwciała, zwane też immunoglobulinami (w skrócie: Ig), są wytwarzane przez
zaktywowane limfocyty B. Występują w stanie niezwiązanym w osoczu i płynach
tkankowych, gdzie wiążą antygeny, przyczyniając się do ich eliminacji, a także na
powierzchni limfocytów, gdzie pełnią funkcję receptorów rozpoznających konkretne
antygeny. Podstawową strukturę immunoglobulin tworzą dwie pary łańcuchów
białkowych: jedna para łańcuchów ciężkich i jedna lekkich.
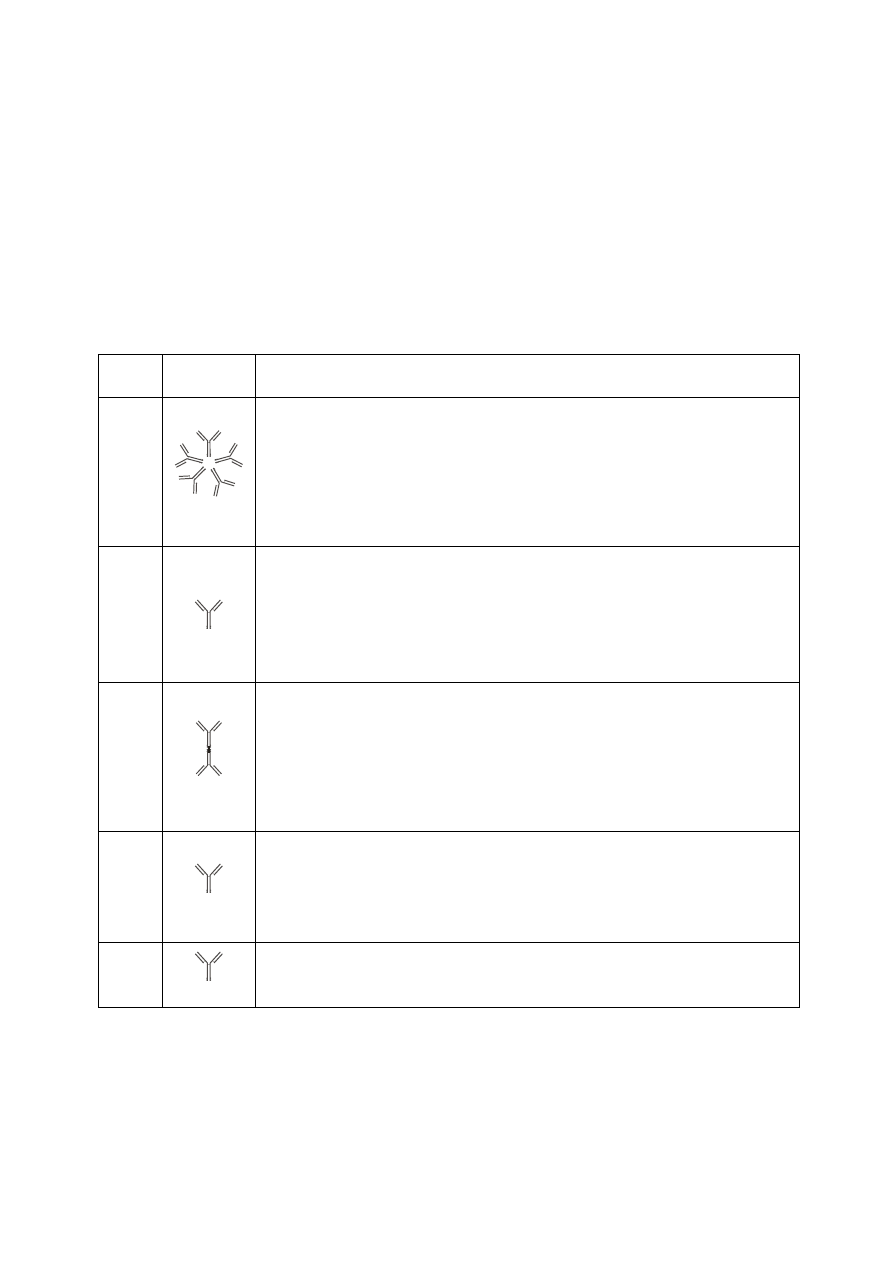
Wyróżnia się pięć klas immunoglobulin (Tab. 8): IgM, IgG, IgA, IgE oraz IgD.
Poszczególne klasy immunoglobulin różnią się od siebie budową: IgG, IgE i IgD
występują w ustroju w postaci pojedynczych cząstek – monomerów, IgA – tworzą
układy złożone z dwóch cząstek – dimery, zaś IgM występują w postaci kompleksów
pięciu cząsteczek (pentamery), przez co mają największe rozmiary i praktycznie nie
przenikają przez łożysko podczas ciąży. Immunuglobuliny IgG i IgM występują w
osoczu w postaci wolnej, podczas gdy większość cząsteczek pozostałych klas
immunuglobulin jest zaabsorbowana na powierzchni komórek, wpływając na ich
funkcję.
W osoczu znajdują się tysiące przeciwciał o zbliżonej budowie strukturalnej,
odpowiadającej danej klasie immunoglobulin, które różnią się od siebie zdolnością
specyficznego reagowania z konkretnymi antygenami. Przeciwciała osocza różnią się
23
od siebie stężeniem oraz aktywnością, której przejawem jest dynamika reakcji
z antygenem i nasilenie wywoływanej odpowiedzi immunologicznej.
Miano przeciwciał, które oznacza najmniejsze rozcieńczenie surowicy zawierającej
przeciwciała, przy którym występuje wykrywalna w warunkach laboratoryjnych
reakcja danych przeciwciał ze swoistym antygenem, jest powszechnie stosowanym
wskaźnikiem, który stanowi wypadkową stężenia i aktywności testowanych
przeciwciał.
Tab. 8 Klasy przeciwciał i ich właściwości
Klasa Budowa
Właściwości
IgM
pentamer
− są uwalniane w pierwszej kolejności po kontakcie z antygenem;
− są kompleksem 5 pojedynczych cząstek, co ułatwia wiązanie
antygenów w kompleksy antygen-przeciwciało;
− występują jako przeciwciała naturalne układu grupowego krwi AB0
− wykazują wysoką aktywność w niskim zakresie temperatur
(4 -20°C), choć większość wykazuje także aktywność w
temperaturze ciała (37 – 40°C)
IgG
monomer
− stanowią większość przeciwciał występujących w krwiobiegu
− jako
jedyne
przeciwciała mogą przenikać przez łożysko do płodu
− tworzą przeciwciała anty-Rh, odpowiedzialne za najczęstszą postać
konfliktu serologicznego u noworodków
− zwykle
wykazują największą aktywność w temperaturze ciała
(37 – 40°C)
IgA
dimer
− odgrywają istotną rolę w zwalczaniu bakterii w błonach śluzowych
dróg oddechowych i przewodu pokarmowego
− po zaabsorbowaniu z krwi są związane przez komórki sekrecyjne
nabłonka
− są uwalniane do śluzu; występują w wydzielinach śluzowych
(w ślinie, wydzielinie śluzowej dróg oddechowych, łzach, nasieniu)
− wiążą antygeny jeszcze przed ich zetknięciem z komórkami
IgE
monomer
− uczestniczą w reakcjach alergicznych i w zwalczaniu pasożytów
− są przytwierdzone do powierzchni granulocytów zasadochłonnych i
komórek tucznych, po związaniu z antygenem pobudzają te komórki
do wydzielania: histaminy, heparyny, serotoniny i cytokin o profilu
prozapalnym
IgD
monomer
− występują na powierzchni limfocytów B i uczestniczą w ich aktywacji
Funkcje limfocytów T i B uzupełniają się. Limfocyty Th ułatwiają aktywację
limfocytów B. Limfocyt T nie są pobudzane przez antygeny rozpuszczone w osoczu
i płynach tkankowych, natomiast rozpoznają antygeny komórkowe. Z kolei, krążące
we krwi przeciwciała, wytworzone przez limfocyty B, nie przylegają do błon

24
komórkowych i nie przenikają przez błony, co ogranicza spektrum ich działania do
wiązania antygenów swobodnie dostępnych w płynie pozakomórkowym.
Odporność swoistą charakteryzują 4 cechy:
1. wszechstronność, która przejawia się zdolnością do reagowania na najbardziej
różnorodne antygeny. Pojedynczy osobnik napotyka na znacznie mniejszą liczbę
antygenów, niż cała populacja, a jednak każdy osobnik jest w stanie wytworzyć w
razie potrzeby odpowiednie przeciwciała.
2. specyficzność, czyli zdolność wytworzenia odpowiedzi selektywnie ukierunkowanej
przeciw konkretnemu antygenowi.
3. pamięć immunologiczna, która umożliwia przyspieszenie i nasilenie odpowiedzi
antygen, przy powtórnej ekspozycji. Istotą pamięci immunologicznej jest
namnożenie subpopulacji limfocytów, które nie są aktywowane przy pierwotnym
kontakcie z antygenem, ale ulegają natychmiastowemu pobudzeniu i rozmnożeniu
przy ekspozycji wtórnej. Komórki pamięci charakteryzuje względna
długowieczność – potrafią przetrwać przez wiele miesięcy, a nawet lat.
4. tolerancja, w wyniku której antygeny własne nie pobudzają odpowiedzi
immunologicznej. Za tolerancję odpowiada selekcja limfocytów B w szpiku
kostnym i limfocytów T w grasicy. Podczas różnicowania, komórki o
właściwościach potencjalnie autodestrukcyjnych są niszczone.
Dynamika i czas trwania odpowiedzi immunologicznej zależy od tego, czy układ
odpornościowy napotkał antygen po raz pierwszy, czy też doszło do kolejnej
ekspozycji (ryc. 6). Odpowiedź pierwotna, charakteryzuje się stosunkowo powolnym
rozwojem. Impet i nasilenie odpowiedzi wtórnej są znacznie, zwykle wielokrotnie,
większe. Odpowiedź wtórna zanika znacznie wolniej, czego wyznacznikiem jest
długotrwałe utrzymywanie się we krwi wysokiego miana swoistych przeciwciał.
IgM
IgG
1
2
3
4
Odpowiedź wtórna
IgG
IgM
1
2
3
4
Czas [tyg.]
Odpowiedź pierwotna
M
ia
no
p
rz
e
ci
w
ci
a
l
M
ia
no
p
rz
ec
iw
ci
al
Czas [tyg.]
Ryc. 6 Dynamika i natężenie odpowiedzi immunologicznej pierwotnej i wtórnej.
Miano przeciwciał jest to największe rozcieńczenie surowicy, w którym można zaobserwować reakcję
immunologiczną. Miano przeciwciał jest wypadkową ilości przeciwciał (stężenia w surowicy) i ich
aktywności – zdolności reagowania ze swoistymi antygenami.

25
Na powierzchni błon komórkowych występuje od 50 do 200 cząsteczek białkowych,
zwanych antygenami zgodności tkankowej (HLA; human leukocyte antigen), które
posiadają genetycznie zdeterminowaną strukturę, charakterystyczną dla każdego
osobnika. Cząsteczki te, które początkowo wykryto na powierzchni leukocytów, a
później na powierzchni większości komórek somatycznych, określają odrębność
osobniczą tkanek. Niezgodność w zakresie tych antygenów pomiędzy poszczególnymi
osobnikami stwarza zasadnicze problemy przy transplantacji narządów.
Układy grupowe krwi
Na powierzchni krwinek czerwonych rozlokowane są antygeny zdolne do wywołania
specyficznej odpowiedzi immunologicznej prowadzącej do zniszczenia krwinek.
Antygeny krwinkowe tworzą kombinacje genetycznie zakodowanych układów
grupowych, z których najważniejsze znaczenie praktyczne mają: układ grupowy AB0 i
układ Rh. Przy transfuzjach krwi niepożądane odczyny były także udziałem układów:
MN, Kell, Duffy, Lewis i ponad dwudziestu innych sporadycznie występujących
antygenów. Układy grupowe antygenów charakteryzuje wewnątrzgrupowy polimorfizm.
Układ grupowy ABO
Antygeny układu ABO są glikoproteidami, których determinanty antygenowe różnią się
obecnością i układem przyłączonych cząsteczek: fukozy, galaktozy i
N-acetylogalaktozaminy. Istnieją 4 podstawowe warianty grupowe układu AB0 (Tab.9).
Antygenem prekursorowym układu ABO jest antygen H, który występuje w grupie krwi
0, zaś u osób grupy krwi A, B i AB uległ glikozylacji do antygenów A lub B.
Tab. 9 Antygeny i przeciwciała układu grupowego AB0
Grupa
krwi
Antygeny
krwinkowe
(
Aglutynogeny
)
Przeciwciała w
osoczu
(
Aglutyniny
)
A
A anty-B
B
B anty-A
AB
A i B
brak
0
brak
anty-A i anty-B
Osoba o grupie krwi A posiada na powierzchni krwinek antygen A, o grupie B –
antygen B, grupy AB – oba antygeny: A i B, a osoba grupy krwi 0 nie posiada

26
antygenów A lub B. Z układem antygenów sprzężone są przeciwciała, które są
rozpuszczone w osoczu. Zasada jest prosta: w osoczu występują przeciwciała swoiste
dla antygenu, którego osobnik nie posiada. I tak, w osoczu osoby grupy krwi A
występują przeciwciała anty-B, grupy B – przeciwciała anty-A, grupy 0 – oba rodzaje
przeciwciał: anty-A i anty-B, zaś osoba grupy AB nie posiada przeciwciał układu AB0.
Antygeny układu ABO noszą nazwę aglutynogenów, zaś przeciwciała aglutynin, gdyż
po związaniu antygenu A lub B z odpowiednim przeciwciałem dochodzi do zlepiania
(aglutynacji) krwinek, co zapoczątkowuje ich zniszczenie. Reakcje aglutynacji
zachodzące w krwiobiegu mają często bardzo gwałtowny i fatalny przebieg, ponieważ
agregaty krwinek tworzące się w małych naczyniach krwionośnych, skutecznie je
zatykają, uniemożliwiając dopływ krwi do obszarów o kluczowym znaczeniu dla
podtrzymania życia.
Aglutyniny układu AB0 należą do przeciwciał naturalnych, gdyż ich wytwarzanie
jest zakodowane genetycznie i nie zależy od wcześniejszego kontaktu z antygenem.
Większość przeciwciał naturalnych należy do klasy IgM, które w warunkach
fizjologicznych nie przenikają przez łożysko podczas ciąży i dlatego pomimo
statystycznie dużego prawdopodobieństwa występowania niezgodności serologicznej
w układzie AB0 między matką i płodem, niezwykle rzadko dochodzi do wytworzenia
odpowiedzi immunologicznej, czyli do powstania konfliktu serologicznego.
Antygeny A wykazują heterogenność związaną z odmiennym składem glikolipidów,
których szczegółowa budowa jest nadal przedmiotem badań (L. Svensson i wsp.: Vox
Sanguis; 2009, 64, nr 1, 56-61). Fenotypy A
1
i A
2
występują najczęściej (odpowiednio
w 80 i 20% populacji). Antygeny: A
2
, A
3
, A
x
, A
m
wykazują mniejszą immunogenność
(zdolność wytwarzania przeciwciał anty-B) od antygenu A
1
i nie wykazują swoistej
immunogenności w jego obecności. Osoby o grupach A
2
, A
3
, A
x
, A
m
mogą wytwarzać
przeciwciała odpornościowe skierowane przeciw antygenowi A
1,
ale zjawisko to ma
charakter sporadyczny. U nielicznych osób o fenotypie A
2
, które wielokrotnie
otrzymywały krew, stwierdzono występowanie niezbyt wysokiego miana przeciwciał
anty-A
1
. Antygen B również wykazuje heterogenność, ale nie ma ona znaczenia
praktycznego.
Układ grupowy Rh
W układzie grupowym Rh, którego nazwa wywodzi się od małpy Rhesus, występują
trzy antygeny grupowe C, D i E, przy czym w obecności antygenu D ekspresja
pozostałych antygenów jest wytłumiona. Antygeny Rh są polipeptydami, których
biosynteza jest zależna od dwóch sprzężonych genów leżących na krótszym ramieniu
chromosomu 1. Jeden z tych genów koduje antygen D, a drugi antygeny C, c, E, i e. W
Polsce około 83% populacji należy do grupy Rh(+) (Rh plus), gdyż posiada na
powierzchni krwinek antygen D.
Przynależność do grupy Rh(+) oznacza w praktyce niezdolność do wytwarzania
przeciwciał skierowanych przeciw antygenom układu Rh. Zdecydowana większość osób

27
Rh(-), która nie zetknęła się w antygenem D nie posiada przeciwciał naturalnych
anty-D. Natomiast w wyniku kontaktu z antygenem D (np. po przetoczeniu krwi
zawierającej ten antygen lub podczas ciąży, gdy płód ma antygen D, a matka go nie
posiada) zazwyczaj dochodzi do wytworzenia przeciwciał odpornościowych klasy IgG.
W surowicy osób Rh(+), które wielokrotnie otrzymywały krew, jedynie sporadycznie
stwierdzano marginalne miano przeciwciał anty-C lub anty-E. Wiązało się to z brakiem
antygenów C lub E i było zapewne skutkiem wielokrotnej ekspozycji na te antygeny,
przy nieprecyzyjnie określonych antygenach układu Rh krwi dawcy. Natomiast, u osób
nie posiadających antygenu D i jednego lub obydwu z pozostałych antygenów układu
Rh (C lub/i E), odpowiedź immunologiczna na podanie krwi zawierającej antygeny C
lub E, której skutkiem jest wytworzenie istotnego miana przeciwciał, występuje dość
często. Zatem samo wykluczenie obecności antygenu D u dawcy krwi nie zabezpiecza
biorcy przed ryzykiem niepożądanej reakcji odpornościowej. Dlatego, u osoby która
nie posiada antygenu D, ale posiada antygen C lub E, przyjęto następujące określenie
przynależności grupowej w układzie Rh: „jako biorca Rh(-), jako dawca Rh(+)”. Osoby,
które nie posiadają zarówno antygenu D, jak i antygenów C i E są określane jako
posiadający grupę krwi Rh(-) (Rh minus).
Niezgodność i konflikt serologiczny
Niezgodność serologiczna, czyli występowanie odmiennych antygenów
krwinkowych u różnych osób jest zjawiskiem powszechnym, związanym z
występowaniem licznych układów antygenów w krwinkach i licznych wariantów
antygenowych. Układy grupowe krwi są w miarę możliwości diagnostycznych
szczegółowo analizowane przez przetoczeniem krwi.
Idealnym rozwiązaniem w jest podawanie preparatów krwi o składzie antygenowym
dokładnie odpowiadającym biorcy, ale sprawdzenie wszystkich kombinacji układów
grupowych jest w praktyce niemożliwe. Dlatego przetaczanie preparatów krwi jest
zawsze związane z ryzykiem wystąpienia niebezpiecznych powikłań, nawet przy
pełnej staranności poprzedzających badań analitycznych. Stąd konieczność
skrupulatnego przestrzegania procedur: począwszy od prawidłowego zidentyfikowania
testowanych układów grupowych krwi biorcy i dawcy, dokładnego sprawdzania danych
ewidencyjnych próbek krwi, wykonania prób krzyżowych potwierdzających
w warunkach in vitro brak niezgodności serologicznej między krwią biorcy i dawcy,
właściwego przechowywania i przygotowania (temperatura) preparatu krwi przed jego
podaniem pacjentowi. Istotną procedurą redukującą rozmiar powikłań jest wykonanie
próby biologicznej w pierwszych minutach podawania preparatu krwi, czyli jego
początkowe podawanie z najmniejszą szybkością i obserwowanie ewentualnych
niekorzystnych następstw.
Niezgodność serologiczna pomiędzy matką i płodem w zakresie układu AB0 jest
powszechna, natomiast zależna od tej niezgodności istotna odpowiedź
immunologiczna (konflikt serologiczny), z wytworzeniem przeciwciał skierowanych
przeciw antygenom (krwinkom) płodu występuje ponad 300-krotnie rzadziej niż

28
w zakresie układu Rh i ma zwykle łagodniejszy przebieg. Podstawową, choć nie jedyną,
przyczyną braku odpowiedzi odpornościowej jest znaczny rozmiar immunoglobulin
anty-A i anty-B, praktycznie uniemożliwiający ich przenikanie przez łożysko. Konflikt
serologiczny w zakresie układu AB0 występuje częściej u matek grupy 0, gdyż, po
kontakcie z obcym dla siebie antygenem A lub B, około 50% kobiet tej grupy wytwarza
znaczące miano przeciwciał anty-A lub anty-B, należących do immunoglobulin klasy
IgG o stosunkowo małych rozmiarach i znaczącej zdolności penetracji łożyska.
W przypadku konfliktu serologicznego w układzie Rh rozwijającego się w ciąży,
krwinki Rh(+) płodu po przeniknięciu przez łożysko do krwi matki indukują skierowaną
przeciw sobie odpowiedź immunologiczną, z wytworzeniem przeciwciał anty-D.
Przeciwciała te mogą przechodzić przez łożysko i wiązać się z antygenami na
powierzchni krwinek płodu. W odróżnieniu od aglutynin anty-A lub anty-B,
immunoglobuliny anty-D najczęściej nie wywołują natychmiastowej aglutynacji
krwinek. Jednakże po oblepieniu przeciwciałami anty-D, błona komórkowa krwinek
traci elastyczność i łatwo pęka z uwolnieniem hemoglobiny na zewnątrz.
Objawy konfliktu serologicznego, zależnego od przeciwciał anty-D, ujawniają się
często bezpośrednio po urodzeniu dziecka, kiedy w wyniku wzrostu ciśnienia
tętniczego i przyspieszenia strumienia krwi, krwinki ulegają masowej hemolizie przy
przeciskaniu się przez drobne naczynia narządów miąższowych, głównie śledziony.
Prawdopodobieństwo wystąpienia niezgodności serologicznej, która może skutkować
powstaniem konfliktu serologicznego wynosi około 1:12.
Próba krzyżowa
Charakterystyczną cechą krwinek czerwonych jest osobnicza różnorodność
antygenowa, której przejawem jest występowanie antygenów o charakterze
nieregularnym, z których tylko część zalicza się do antygenów grupowych krwi.
Jeszcze większa różnorodność cechuje przeciwciała osoczowe, zwłaszcza typu
odpornościowego, z których część może reagować nie tylko z antygenem, który
pobudził ich wytwarzanie, ale także, na zasadzie reakcji krzyżowej, opartej o
podobieństwo strukturalne cząstek, z wybranymi antygenami krwinek. Dlatego przy
skojarzeniu krwinek i osocza pochodzącego od dwóch różnych osób, u których nie
ujawniono niezgodności serologicznej w zakresie testowanych antygenów i przeciwciał,
nie można wykluczyć rozwoju odpowiedzi odpornościowej, skutkującej aglutynacją
lub hemolizą krwinek.
W celu ograniczenia prawdopodobieństwa wystąpienia nieoczekiwanej odpowiedzi
odpornościowej u biorcy, który otrzymał preparat krwi (roztwór krwinek, krew pełną,
surowicę), przed podaniem odpowiedniego preparatu bezwzględnie zaleca się
wykonanie próby zgodności serologicznej biorcy i dawcy, powszechnie określanej
mianem próby krzyżowej.
29
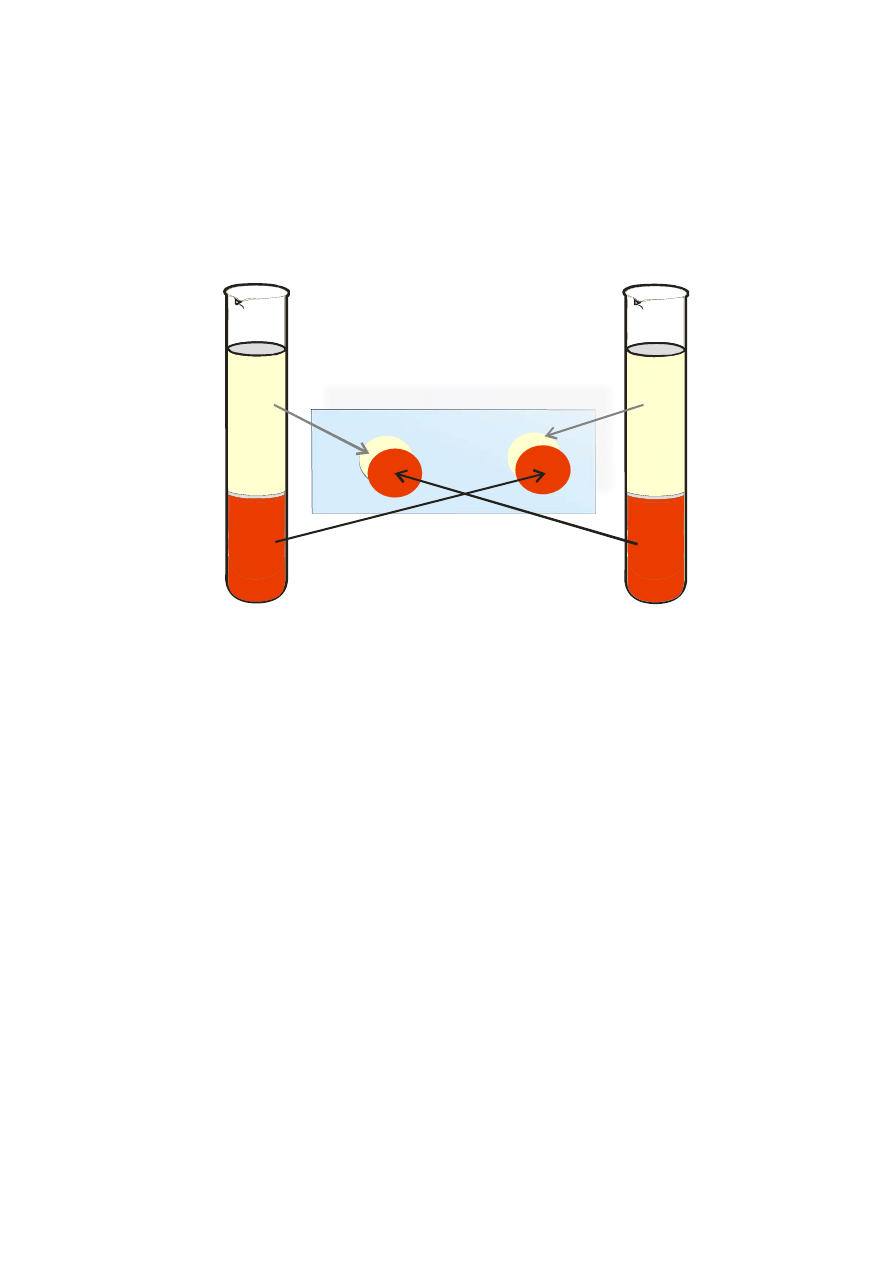
Istotą próby krzyżowej jest wykluczenie aglutynacji krwinek lub hemolizy po
zmieszaniu (Ryc.7):
a) zawiesiny krwinek dawcy z surowicą biorcy;
b) zawiesiny krwinek biorcy z surowicą dawcy.
Surowica (S)
Krwinki (K)
Krew dawcy (D)
Krew biorcy (B)
S
D
K
D
S
B
K
B
Surowica (S)
Krwinki (K)
Ryc. 7 Uproszczony schemat próby krzyżowej
Szczegółowe zalecenia dotyczące warunków laboratoryjnych wykonywania próby
krzyżowej zmieniały się wielokrotnie w ostatnich kilkudziesięciu latach. Aktualnie
przyjmuje się, że próba krzyżowa powinna być wykonana dwukrotnie – w odmiennych
warunkach środowiska. W próbie krzyżowej wykonywanej w środowisku solnym,
(elektrolitowym), w temperaturze pokojowej, na płytkę szklaną wprowadza się kilka
kropli testowanej surowicy (Ryc.7; S
D
lub S
B
). Następnie dodaje się kilka roztworu
odpowiednich krwinek (dawcy lub biorcy: Ryc. 7 K
D
, K
B
), które po przepłukaniu zostały
zawieszone w roztworze 0,9%NaCl. Po wymieszaniu i odczekaniu 30 min, ocenia się
ewentualne wystąpienie aglutynacji lub hemolizy. Izotoniczny roztwór NaCl sprzyja,
na zasadzie oddziaływań elektrostatycznych, odwracalnej rulonizacji krwinek, która
może imitować aglutynację, dlatego zamiast 0,9%NaCl zaleca się stosowanie
roztworów izotonicznych o obniżonej zawartości jonów. Z kolei, w próbie krzyżowej
wykonywanej w środowisku koloidowym, w temperaturze 37ºC, krwinki są zawieszone
we własnej surowicy z dodatkiem surowicy antyglobulinowej Coombsa.
Wynik próby krzyżowej ma charakter jakościowy. Wynik próby może być:
ujemny, czyli krew dawcy nadaje się do przetoczenia biorcy (krew zgodna; nie
stwierdzono aglutynacji lub hemolizy), lub dodatni (krew niezgodna, czyli krwi dawcy

30
nie można podać biorcy). Jakkolwiek przeciwciała naturalne wykazują optimum
działania w niskiej temperaturze, a przeciwciała odpornościowe w temperaturze 37 –
40 ºC, to dodatni wynik próby krzyżowej nie daje podstaw do wnioskowania o naturze
zaobserwowanej reakcji. Przyczynę nieoczekiwanego wyniku dodatniego można
ustalić dopiero w wyniku ukierunkowanych testów diagnostycznych z użyciem
antygenów wzorcowych lub/i wzorcowych przeciwciał.
Odczyny antyglobulinowe Coombsa
W diagnostyce reakcji immunologicznych z udziałem przeciwciał odpornościowych
klasy IgG, w tym przeciwciał układu Rh, wykorzystuje się odczyny antyglobulinowe,
które po raz pierwszy zostały opisane przez Coombsa. W odróżnieniu od reakcji
zachodzących z udziałem przeciwciał naturalnych klasy IgM, takich jak aglutyniny
anty-A lub anty-B, związanie przeciwciał typu odpornościowego z antygenami
krwinkowymi nie wywołuje widocznej reakcji w warunkach laboratoryjnych in vitro.
Tradycyjnie przeciwciała takie nazywano przeciwciałami niekompletnymi, w
odróżnieniu przeciwciał kompletnych, które po związaniu z antygenami krwinkowymi
wywoływały zlepianie krwinek i tworzenie widocznych zlepów lub grudek
(aglutynacja; Ryc.8).
Ryc. 8 Schemat reakcji odpornościowych z udziałem antygenów krwinkowych
przeciwciał niekompletnych typu odpornościowego (IgG) i kompletnych (IgM).
a) model krwinki z antygenami na jej powierzchni;
b) z antygenami krwinkowymi związały się przeciwciała niekompletne, np anty-D; brak aglutynacji
c) z antygenami krwinkowymi związały się przeciwciała kompletne, np anty-A lub anty-B; aglutynacja
Przy detekcji przeciwciał niekompletnych rozpuszczonych w osoczu lub
opłaszczonych na powierzchni komórek wykorzystywano zjawisko odrębności
gatunkowej białek. Po podaniu zwierzęciu surowicy ludzkiej, w sposób naturalny
zawierającej liczne przeciwciała, układ odpornościowy zwierzęcia rozpozna te
a)
b)
c)
a)
b)
c)

31
przeciwciała jako obce białka – obce antygeny, co uruchomi wytwarzanie przez
zwierzę przeciwciał. Zwierzęta takie jak: królik lub owca wytwarzają przeciwciała
klasy IgM (kompletne) przeciw licznym białkom surowicy ludzkiej. Po uzyskaniu
surowicy od tych zwierząt, nazwanej surowicą antyglobulinową Coombsa, stosuje się
ją do wykrywania „ukrytych” dotąd – niekompletnych przeciwciał ludzkich. Surowica
Coombsa ma charakter poliwalentny – zawarte w niej przeciwciała mogą reagować z
wieloma białkami ludzkim
.
W ostatniej dekadzie, zostały wprowadzone do użytku
diagnostycznego wysoce specyficzne przeciwciała monoklonalne anty-D, anty-C i anty-
E, uzyskiwane od odpowiednio modyfikowanych genetycznie myszy.
Jeżeli krwinki ludzkie są opłaszczone przeciwciałami niekompletnymi, np anty-D,
które to przeciwciała nie wywołują aglutynacji, a jedynie mogą usztywnić błonę
komórkową krwinki (Ryc. 9a), to dodanie do roztworu tych krwinek lub do pełnej krwi
surowicy antyglobulinowej, zawierającej przeciwciała kompletne (Ryc. 9b),
spowoduje powstanie kompleksów antygen-przeciwciało, które zlepiają krwinki
(aglutynacja; Ryc 9c). Funkcję antygenu pełnią w tej reakcji przeciwciała anty-D
wcześniej przytwierdzone do krwinkowych antygenów D (Ryc. 8b, Ryc. 9a),
a przeciwciałami tworzącymi kompleks antygen-przeciwciało zdolny do wywołania
aglutynacji są przeciwciała anty-D (kompletne, klasy IgM) zawarte w surowicy
antyglobulinowej.
Ryc.9 Schemat bezpośredniego odczynu antyglobulinowego Coombsa
a) krwinka opłaszczona przeciwciałami niekompletnymi, które związały się z antygenami krwinkowymi; np.
przeciwciała anty-D z antygenami D na jej powierzchni - brak aglutynacji
b) dodanie przeciwciał kompletnych (klasy IgM) dla których przeciwciała uprzednio związane z antygenami
krwinkowymi pełnią funkcję antygenu; przeciwciala takie zawiera surowica antyglobulinowa Coombsa
c) w wyniku reakcji przeciwciał z surowicy antyglobulinowej z przeciwciałami opłaszczonymi na powierzchni krwinek
dochodzi do zlepienia – aglutynacji krwinek
Procedura polegająca na dodaniu surowicy antyglobulinowej do roztworu
zawierającego komórki opłaszczone przeciwciałami niekompletnymi (nie
wykazującymi zdolności do samoistnego zlepiania tych komórek) nosi nazwę odczynu
bezpośredniego Coombsa. Jeżeli komórkami badanymi nie są krwinki, ale np.
+
=
a)
b)
c)
+
=
a)
b)
c)

32
drobnoustroje, to ich zlepienie spowoduje zmętnienie roztworu z ewentualnym
wytworzeniem osadu (precypitacja). Odczyn bezpośredni Coombsa wykorzystuje się
przy diagnostyce konfliktu serologicznego po urodzeniu noworodka. Materiałem jest
krew pobrana z pępowiny. W przypadku występowania w krwi pępowinowej krwinek
opłaszczonych przeciwciałami, dodanie surowicy antyglobulinowej spowoduje
aglutynację krwinek.
Przy podejrzeniu konfliktu serologicznego w zakresie układu Rh, rozwijającego się
przed urodzeniem noworodka, wykonuje się odczyn pośredni Coombsa. Materialem
badanym jest surowica uzyskana od matki. Do krwinek wzorcowych Rh(+) (Ryc. 9a)
dodaje się badaną surowicę, co w przypadku konfliktu serologicznego, prowadzi do
wytworzenia kompleksu antygen-przeciwciało na powierzchni krwinek wzorcowych
(Ryc. 8b, Ryc.9a). Następnie dodaje się surowicę antyglobulinową (Ryc. 9b), która w
przypadku konfliktu serologicznego, wywołuje aglutynację. Największe rozcieńczenie
surowicy (miano przeciwciał), w którym aglutynację daje się zaobserwować jest
wyznacznikiem nasilenia odpowiedzi odpornościowej skierowanej przeciw krwinkom
płodu. W diagnostyce laboratoryjnej odczyn pośredni Coombsa wykorzystywany jest
także do wykrywania obecności wybranych antygenów występujących w komórkach, w
stosunku do których posiadamy swoiste przeciwciała wzorcowe o charakterze
przeciwciał niekompletnych. Po dodaniu do zawiesiny testowanych komórek,
przeciwciał wzorcowych (etap pośredni), a następnie surowicy antyglobulinowej,
obserwuje się ewentualne wystąpienie zmętnienia roztworu (precypitacji),
świadczącego o obecności poszukiwanego antygenu.
Dodanie surowicy antyglobulinowej do mieszaniny testowanych mieszanin surowicy
i krwinek (dawcy/biorcy) podczas wykonywania próby krzyżowej, poprzedzającej
podawanie krwi, ułatwia wykrycie nierozpoznanego wcześniej niekorzystnego
skojarzenia antygenów i przeciwciał dawcy i biorcy.
Koncepcja uniwersalnego biorcy i dawcy
Funkcjonuje pojęcie uniwersalny biorca, które oznacza osobę grupy AB, która nie
posiada przeciwciał anty-A i anty-B oraz uniwersalny dawca, czyli osoba o grupie krwi
0, której krwinki nie zawierają antygenów układu ABO. Okazało się jednak, że
przetaczanie krwi niezgodnej serologicznie w ramach zasady uniwersalnego biorcy lub
dawcy wiązało się z wystąpieniem znaczącego odsetka niebezpiecznych powikłań.
Dlatego, według aktualnych zaleceń dawca i biorca krwi powinni mieć identyczną
grupę krwi w układzie ABO i Rh. Wyjątek stanowią okoliczności nadzwyczajne, kiedy
przewiduje się nagłe zapotrzebowanie na znaczna ilość krwi, w czasie krótszym od
możliwości szybkiej diagnostyki. W niektórych krajach Bliskiego Wschodu pojazdy
pierwszej pomocy medycznej zostały wyposażone w preparaty osocza grupy AB
(uniwersalnego) i krwinek grupy 0 (uniwersalnych), co stwarza szansę na
zabezpieczenie możliwie dużej liczby potencjalnych ofiar działań wojennych lub
terrorystycznych. Postęp technik biotechnologicznych, umożliwiający uzyskanie
oczyszczonych przeciwciał monoklonalnych przeciw konkretnemu antygenowi A lub B
33
oraz coraz tańsze możliwości (komercyjnie opłacalne) dokonywania modyfikacji
biochemicznej ex vivo glikoprotein determinujących antygeny grupowe krwi,
umożliwiają wyprodukowanie krwi uniwersalnej, zawierającej krwinki grupy 0,
zawieszone w środowisku niezawierającym przeciwciał anty-A, anty-B, anty-D, anty-C
i anty-E.
Hemostaza
W krwioobiegu nieustannie zachodzi proces krzepnięcia, który polega na
wytrącaniu nierozpuszczalnych, lepkich nici włóknika (fibryny), w wyniku
ograniczonej proteolizy prekursora rozpuszczonego w osoczu – fibrynogenu. Nici
fibryny, pokrywają od wewnątrz nieszczelności ścian naczyniowych, szczególnie
włośniczek, zapobiegając przed przenikaniem krwi poza naczynie. Równocześnie z
krzepnięciem aktywowana jest fibrynoliza, której istotą jest enzymatyczny rozkład
fibryny i fibrynogenu katalizowany przez plazminę. Plazmina powstaje z nieaktywnego
prekursora – plazminogenu pod wpływem aktywatorów (Ryc.10).
KRZEPNIĘCIE
PŁYNNOŚĆ KRWI
BRAK KRZEPNIĘCIA
OSOCZE
PŁYTKI KRWI
TKANKI
ŚRÓDBŁONEK
ŚRÓDBŁONEK
FIBRYNOLIZA
ANTYKOAGULANTY
Czynniki krzepnięcia
Fosfolipidy
PAI-1
Prostacyklina
Tlenek azotu (NO)
Plazmina
Aktywatory plazminogenu
:
- t-PA
- urokinaza
- czynnik XIIa
Heparyna
Antytrombina III
Ryc.10 Uproszczony schemat czynników sprzyjających i przeciwdziałających
krzepnięciu krwi in vivo

34
Hemostaza jest zespołem procesów fizjologicznych, które zapewniają utrzymanie
krwi krążącej w obrębie łożyska naczyniowego.
Hemostaza miejscowa ogranicza krwawienie po przerwaniu ciągłości ściany
naczyniowej.
Hemostaza ciągła zapewnia płynność krwi krążącej i szczelność łożyska
naczyniowego.
Sprawne funkcjonowanie hemostazy jest wypadkową precyzyjnie skoordynowanego
działania płytek krwi, osocza, śródbłonka naczyniowego, czynników tkankowych i
humoralnych.
Przewaga procesów krzepnięcia prowadzi do powstania zakrzepów (skrzeplin) i
zatrzymania przepływu krwi. Przy względnej przewadze fibrynolizy może rozwijać się
skaza krwotoczna, której przejawem jest zwiększona skłonność do krwawień. W
warunkach fizjologicznych równowagę hemostatyczną zapewnia idealne zestrojenie
wielopoziomowych układów aktywatorów i inhibitorów regulujących hemostazę
(Ryc.10).
Fazy hemostazy miejscowej
Przy uszkodzeniu ściany naczynia dochodzi do aktywacji trzech mechanizmów
hemostatycznych, określanych często mianem faz hemostazy miejscowej (Tab. 10).
Tab. 10 Fazy hemostazy miejscowej
HEMOSTAZA
KOLEJNA
FAZA HEMOSTAZY
KOŃCOWY EFEKT
Naczyniowa Obkurczenie
naczynia
PIERWOTNA
Płytkowa
Wytworzenie czopu płytkowego
WTÓRNA
Osoczowa
Wytworzenie nici fibryny
i ostatecznego skrzepu

35
Najszybciej dochodzi do obkurczenia uszkodzonego naczynia a nierzadko także do
odruchowego obkurczenia tętniczek i tętnic doprowadzających krew do obszaru
uszkodzenia (hemostaza naczyniowa). W rezultacie dochodzi do ograniczenia
wypływu krwi. Niekiedy mechanizm ten jest niezwykle żywy i doprowadza do
całkowitego zamknięcia tętnicy, najczęściej krótkotrwałego.
Hemostaza płytkowa
Do odpowiedzi naczyniowej dołącza się hemostaza płytkowa, w której przebiegu
można wyróżnić cztery kolejne etapy:
1. adhezję - do miejsca uszkodzenia zaczynają przylegać płytki krwi
2. aktywację, która przebiega z uwolnieniem z płytek licznych czynników
ułatwiających krzepnięcie (reakcja uwalniania), w tym: serotoniny, ADP,
tromboksanu i jonów wapniowych.
3. agregację, w której dochodzi do gromadzenia płytek krwi i ich zlepiania
4. wytworzenie czopu płytkowego
Uwolnienie z tkanek tzw. czynnika tkankowego (TF, czynnik III), a także kontakt
osocza z kolagenem wyeksponowanym przy uszkodzeniu naczynia, pobudzają
kaskadowy cykl reakcji enzymatycznych (hemostaza osoczowa), w wyniku którego,
dochodzi do wytworzenia nici fibryny w obrębie czopu płytkowego i do utworzenia
skrzepu. Płytki krwi wywierają znaczące piętno na każdej z faz hemostazy, a ich
niedobór lub dysfunkcja są często związane z zaburzeniami krzepnięcia.
Podstawowymi efektami pobudzenia płytek są:
1. potęgowanie skurczu naczyniowego – głównym czynnikiem jest serotonina
2. wytworzenie czopu płytkowego
3. ułatwianie krzepnięcia osoczowego – przez:
a) udostępnienie matrycy fosfolipidowej, która przyspiesza aktywację osoczowych
czynników krzepnięcia;
b) uwalnianie niektórych czynników krzepnięcia (I, V, XI)
4. konsolidację skrzepu – uwalniany z płytek czynnik XIIIa powoduje obkurczenie
(retrakcję) skrzepu, w wyniku czego wzrasta wytrzymałość skrzepu.
Płyn wypływający ze skrzepu podczas jego retrakcji to surowica. W odróżnieniu
od osocza surowica nie zawiera fibrynogenu i większości czynników krzepnięcia.
Prawidłowy śródbłonek naczyniowy nie sprzyja adhezji płytek. Przy dysfunkcji
śródbłonka, zachodzącej pod wpływem czynników metabolicznych i środowiskowych
(np. hiperlipidemia, hipercholesterolemia, cukrzyca, palenie tytoniu) płytki krwi
znacznie łatwiej przylegają do ściany naczyniowej, ulegają aktywacji, stymulują
lokalne wykrzepianie i lokalny odczyn zapalny, co toruje drogę do tworzenia blaszek
miażdżycowych.

36
Hemostaza osoczowa
Przemiana płynnej krwi w postać o konsystencji galaretowatej, wskutek wytrącenia
nici fibryny, tworzących gęsto upakowaną sieć, jest zwieńczeniem hemostazy
osoczowej i warunkuje wytworzenie skrzepu
.
Krzepnięcie jest procesem złożonym, w
którym uczestniczy 14 czynników krzepnięcia (Tab. 11).
Tab. 11 Nomenklatura czynników krzepnięcia osoczowego
Nazwa
liczebnikowa
Nazwa własna Skróty,
Synonimy
I Fibrynogen
II Protrombina
III Tromboplastyna
tkankowa TF
czynnik tkankowy
IV Jony
Ca
2+
V
Proakceleryna *
czynnik chwiejny*; ac-globulina*
VI
Akceleryna *
aktywny czynnik V
VII
Prokonwertyna *
czynnik stabilny*
VIII
Czynnik antyhemofilowy A
AHG
globulina antyhemofilowa
IX
Czynnik antyhemofilowy B
PTC
tromboplastyczny składnik osocza *
X
Czynnik Stuarta i Prowera
XI
Czynnik antyhemofilowy C
PTA
czynnik Rosenthala
prekursor tromboplastyny osoczowej*
XII
Czynnik Hagemana
czynnik kontaktu
XIII Czynnik
stabilizujący skrzep
FSF
czynnik stabilizujący fibrynę
czynnik Laki-Loranda
- Prekalikreina
czynnik
Fletchera
- Kininogen
wielkocząsteczkowy
HMWK
Czynnik Fitzgeralda
* nazwy archaiczne, praktycznie nie stosowane
37
Jakkolwiek każdy z tych czynników ma swoją nazwę lub nazwy własne, powszechnie
przyjęto nazewnictwo oparte o liczebniki alfabetu rzymskiego. Uzupełniająca litera
„a” oznacza czynnik w postaci zaktywowanej. Wyjątkami, które nie mają określeń w
postaci liczebników są: prekalikreina i kininogen wielkocząteczkowy (HMWK). Często
stosowanymi synonimami czynników krzepnięcia są: I – fibrynogen, Ia – włóknik
(fibryna), II – protrombina, IIa – trombina, III – czynnik tkankowy (TF), IV – jony Ca
2+
.
Czynniki krzepnięcia można podzielić na kategorie (Tab.12): efektor – fibrynogen,
prekursorzy enzymów (zymogeny) i kofaktory.
Tab. 12 Rola czynników krzepnięcia w osoczowych kompleksach enzymatycznych
KOMPLEKS FAZY KONTAKTOWEJ (kompleks cz XIIa)
Proenzymy
XII, XI, prekalikreina
Kofaktory
HMWK (kininogen wielkocząsteczkowy)
KOMPLEKS CZYNNIKA TKANKOWEGO (kompleks TF-VIIa)
Proenzymy VII
Kofaktory
TF (III), PL (fosfolipidy płytkowe), jony Ca
2+
KOMPLEKS TENAZY kompleks czynnika IXa)
Proenzym IX
Kofaktory
VIII, PL (fosfolipidy płytkowe), jony Ca
2+
KOMPLEKS PROTROMBINAZY (kompleks czynnika Xa)
Proenzymy X,
V
Kofaktory
PL (fosfolipidy płytkowe), jony Ca
2+
Czynniki krzepnięcia fazy efektorowej
Proenzymy
II, I, XIII
Kofaktory
jony Ca
2+
W krążeniu czynniki krzepnięcia występują zasadniczo w postaci nieaktywnej –
proenzymów. Uczynnienie czynników krzepnięcia następuje w kolejnych reakcjach
enzymatycznych, w których wcześniej zaktywowane czynniki ulegają przekształceniu
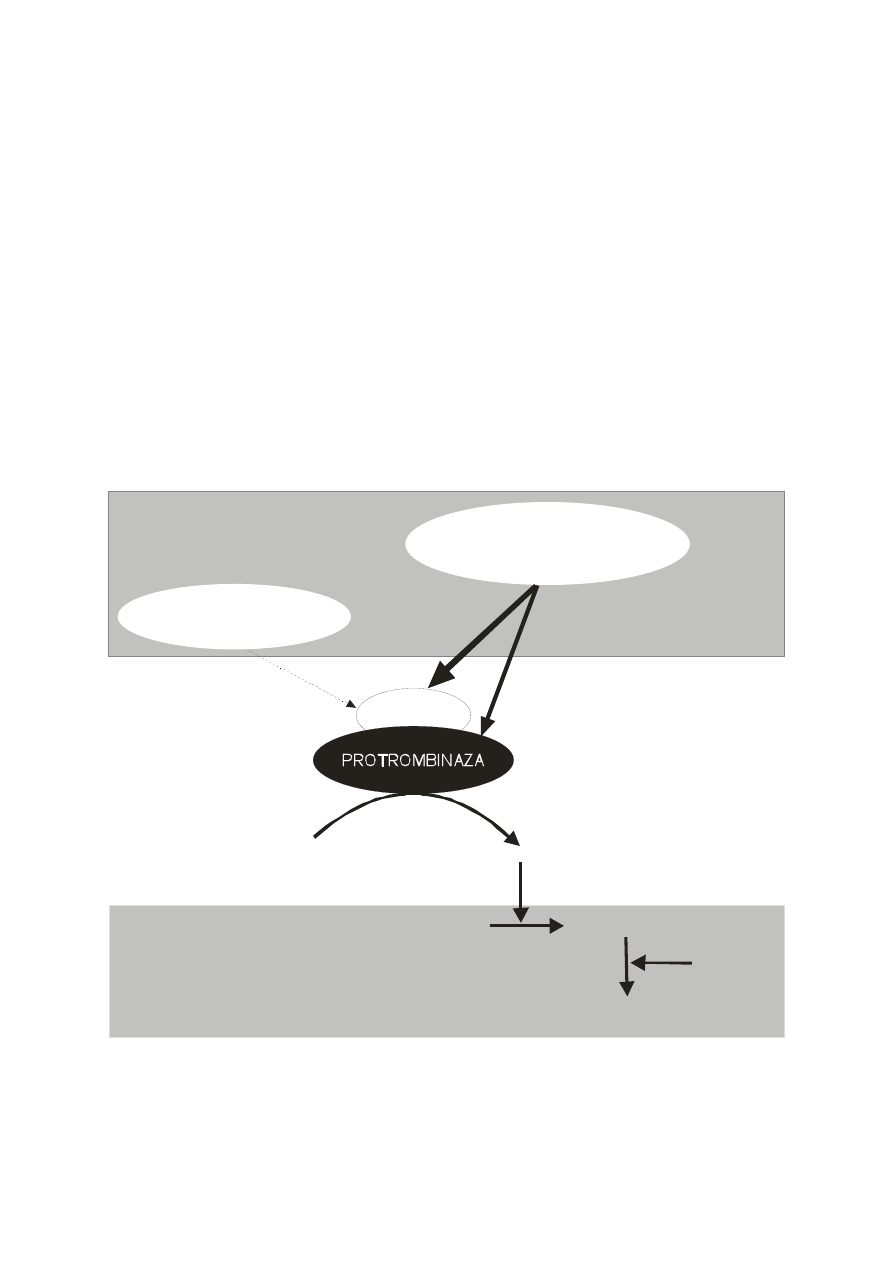
38
do postaci aktywnych enzymów proteolitycznych. Kofaktorami są jony Ca
2+
,
glikoproteidy zakotwiczone w fosfolipidach błon komórkowych płytek krwi (czynnik V
i czynnik VII), a także innych komórek (TF) oraz kininogen wielkocząsteczkowy
(HMWK), który jest białkiem o wybitnych właściwościach adhezyjnych. Według
współczesnych poglądów, zasadniczym mechanizmem krzepnięcia jest sekwencyjne
tworzenie aktywnych kompleksów enzymatycznych (Ryc.11): kompleksu czynnika
tkankowego (kompleks TF-VIIa), tenazy i protrombinazy.
Funkcjonują dwa modele osoczowego krzepnięcia krwi. Według współczesnych
poglądów w przebiegu krzepnięcia można wyróżnić 3 kolejne etapy (Ryc.11)
1. fazę indukcji;
2. fazę wzmocnienia
3. fazę efektorową
Protrombina (cz. II)
Trombina (cz.II a)
Fibrynogen (cz. I)
Fibryna (cz. I a)
Retrakcja skrzepu
cz. XIII a
FAZA INDUKCJI
FAZA WZMOCNIENIA
FAZA EFEKTOROWA
KOMPLEKS
FAZY KONTAKTOWEJ
TENAZA
KOMPLEKS
CZYNNIKA TKANKOWEGO
Ryc. 11 Etapy osoczowego krzepnięcia krwi
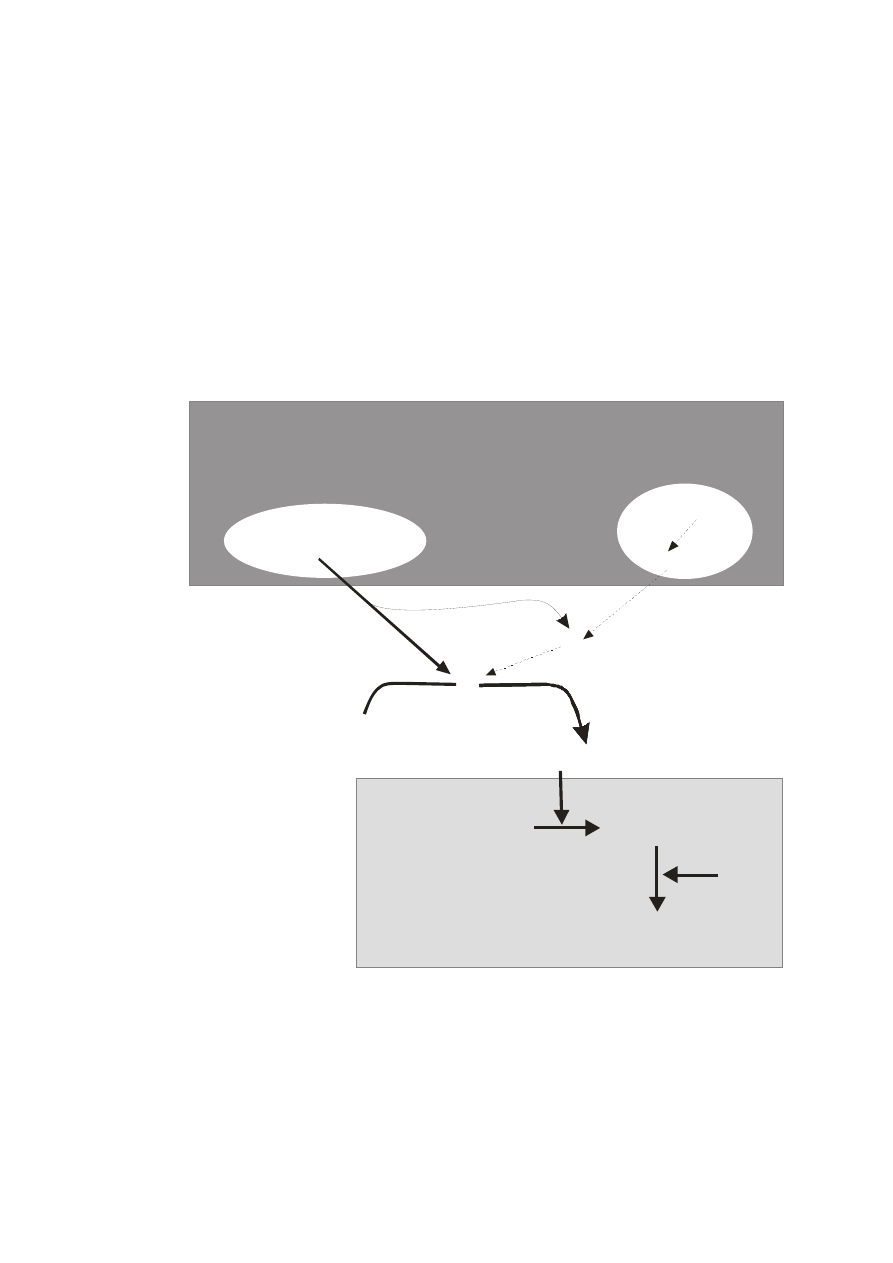
39
W naczyniach krwionośnych faza indukcji może być inicjowana dwutorowo: od
aktywacji TF, co dawniej określano mianem aktywacji zewnątrzpochodnego toru
krzepnięcia, i od aktywacji fazy kontaktowej, inicjowanej aktywacją czynnika XII, co
tradycyjnie określano jako aktywację wewnątrzpochodnego toru krzepnięcia
(Ryc.12).
Schemat krzepnięcia oparty o tradycyjną koncepcję opracowaną przez Waalera w
1957 roku ilustruje rycina 12. Przez wiele lat (Mac Farlane, 1964) dominował pogląd,
że aktywacja krzepnięcia w torze wewnątrzpochodnym odgrywa dominującą rolę w
osoczowych mechanizmach hemostazy, jakkolwiek obie drogi aktywacji krzepnięcia
mogły funkcjonować niezależnie od siebie.
Protrombina (II)
Trombina (II a)
Fibrynogen (I)
Fibryna (Ia)
Retrakcja skrzepu
XIIIa
Faza
indukcji
Faza
wzmocnienia
Faza
efektorowa
TF (III)
XII
X
TOR
zewnątrzpochodny
TOR
wewnątrzpochodny
VII
XI
Ca
2+
PL
PL
VIII
IX
PL
V
Ca
2+
Ca
2+
Ca
2+
Ca
2+
Ryc. 12. Tradycyjny model krzepnięcia osoczowego z wyróżnieniem dwóch,
początkowo niezależnych szlaków aktywacji krzepnięcia: toru
wewnątrzpochodnego i toru zewnątrzpochodnego
Enzymy krzepnięcia opisano czcionka czarną, kofaktory – szarą.
Cyfry rzymskie odpowiadają czynnikom krzepnięcia.
PL – fosfolipidy płytkowe. Faza kontaktowa krzepnięcia (aktywacja czynników XII i XI) nie wymaga udziału
jonów Ca
2+
i PL. Czynniki: XII, TF, IX i X tworzą kompleksy enzymatyczne z udziałem kofaktorów
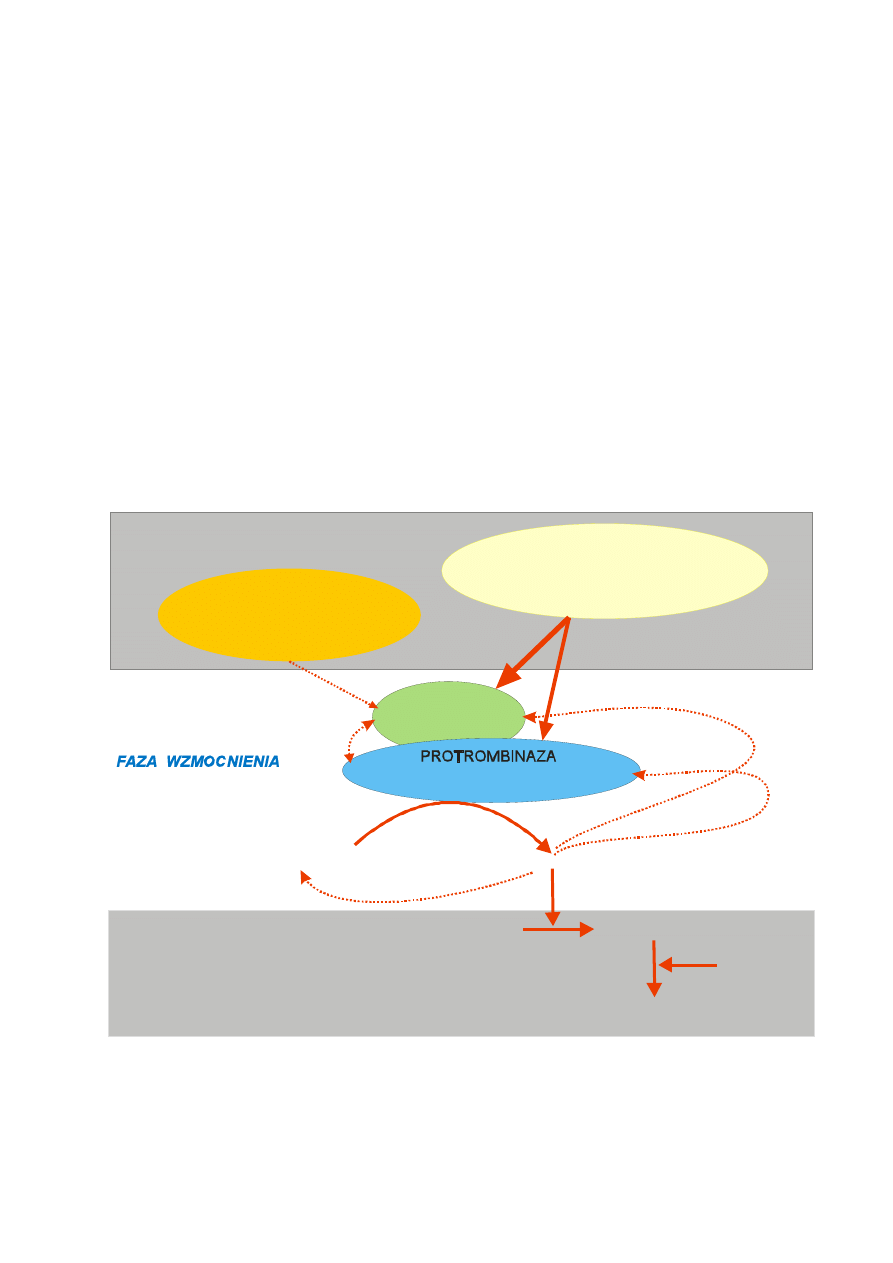
40
Według historycznej już koncepcji McFarlane’a, krzepnięcie w torze
wewnątrzpochodnym jest w sposób toniczny, w umiarkowanym stopniu aktywowane,
zabezpieczając przed wynaczynieniem osocza lub pełnej krwi z nieszczelnych naczyń
krwionośnych. Aktywacja tego toru, w wyniku uszkodzenia ściany naczyniowej,
prowadzi do powstania skrzepliny, która zapobiega wypływowi krwi z uszkodzonego
naczynia.
Zakładano, że układ zewnątrzpochodny pełni jedynie funkcję wentyla
bezpieczeństwa, znacznie przyspieszając tworzenie nici włóknika. Krzepnięcie w
torze zewnątrzpochodnym miało być aktywowane przede wszystkim w wyniku
uszkodzenia tkanki i uwolnienia do krwi tromboplastyny tkankowej, a jego
podstawową rolą miało być szybkie zahamowanie upływu krwi wywołanego urazem.
Tradycyjny model Waalera i McFarlane został zakwestionowany w latach 1980-tych.
Zgodnie z aktualną wiedzą (ryc. 13), podstawową rolę w utrzymaniu hemostazy
ciągłej – w utrzymywaniu krwi w nieuszkodzonym łożysku naczyniowym odgrywa
czynnik tkankowy (TF, cz. III).
Protrombina (cz. II)
Trombina (cz.II a)
Fibrynogen (cz. I)
Fibryna (cz. I a)
Retrakcja skrzepu
cz. XIII a
FAZA INDUKCJI
FAZA EFEKTOROWA
KOMPLEKS
FAZY KONTAKTOWEJ
KOMPLEKS
CZYNNIKA TKANKOWEGO
XII, XI, prekalikreina
, HMWK
TF (III),
, PL, Ca
2+
VII
TENAZA
IX
,VIII, PL, Ca
2+
X, V,
PL, Ca
2+
Ryc. 13 Osoczowe krzepnięcie krwi
Enzymy krzepnięcia opisano czcionka czerwoną, kofaktory – fioletową., Cyfry rzymskie odpowiadają czynnikom
krzepnięcia. PL – fosfolipidy płytkowe.
Linie przerywane zakończone strzałkami odpowiadają dodatkowym szlakom aktywacji krzepnięcia

41
Czynnik tkankowy (TF, czynnik III) jest w niewielkiej ilości nieustannie uwalniany
do krwiobiegu, z uszkodzonych komórek śródbłonka i z płynu tkankowego, a jego
uwalnianie do krwiobiegu wzrasta przy uszkodzeniu tkanek.
Po związaniu TF z czynnikiem VII w obecności jonów Ca
2+
powstaje kompleks TF-
VIIa (kompleks czynnika tkankowego; Tab. 12). Wytworzony kompleks inicjuje fazę
wzmocnienia aktywując czynnik IX i katalizując tworzenie protrombinazy (kompleks
czynnika Xa). Tenaza, która jest kompleksem czynnika IXa, istotnie przyspiesza
aktywację czynnika X i tworzenie kompleksu protrombinazy.
Kompleks TF-VIIa systematycznie, choć w sposób ograniczony, pobudza krzepnięcie
w warunkach fizjologicznych, a zależny od niego tor krzepnięcia pełni dominującą
rolę w hemostazie ustrojowej.
Ostatni w sekwencji utworzonych kompleksów, protrombinaza, przekształca
protrombinę (czynnik II) do aktywnej proteazy serynowej – trombiny (czynnik IIa), co
inicjuje fazę efektorową krzepnięcia. Trombina rozszczepia fibrynogen (czynnik I)
rozpuszczony w osoczu tworząc gęstą sieć nierozpuszczalnych nici fibryny (czynnik Ia),
które następnie ulegają obkurczeniu przy udziale czynnika XIIIa uwalnianego z płytek.
W wyniku retrakcji skrzepu wzrasta jego wytrzymałość i stabilność. Trombina działa
na zasadzie sprzężenia zwrotnego dodatniego pośrednio i bezpośrednio przyspieszając
aktywację protrombiny.
Bezpośredni kontakt osocza z kolagenem i innymi białkami tkanki łącznej,
określanymi zbiorczo mianem czynników kontaktu, aktywuje czynnik XII, co prowadzi
do powstania kompleksu czynnika XIIa, zwanego kompleksem fazy kontaktowej.
Przy nieuszkodzonym naczyniu krew nie styka się z czynnikami kontaktu, ale przy
mechanicznym lub metabolicznym uszkodzeniu ściany naczyniowej (miażdżyca)
dochodzi do interakcji i do wytworzenia kompleksu fazy kontaktowej, który katalizuje
powstanie kompleksu tenazy.
Krzepnięcie inicjowane przez kompleks fazy kontaktowej ma charakter
wspomagający główny tor krzepnięcia, zależny od czynnika tkankowego, ale przy
nadmiernej ekspozycji kolagenu, np. w dysfunkcji śródbłonka naczyniowego i w
przebiegu miażdżycy jego rola może znacząco wzrosnąć.
In vivo krzepnięcie jest regulowane przez liczne, wzajemnie uzupełniające się
układy enzymatyczne. Do podstawowych czynników regulacyjnych należą:
• inhibitory proteaz serynowych (np. antytrombina III);
• układ białka C aktywowany przez trombinę
• śródbłonek naczyniowy i komórki krwi, zwłaszcza płytki krwi
• układ fibrynolizy

42
Istotną rolę regulacyjną spełniają inhibitory krzepnięcia:
1. naturalne: antytrombina III (AT III), α
2
-makroglobulina (α
2
-MG), heparyna,
prostacyklina (PGI
2
)
2. progresywne (ulegające aktywacji podczas krzepnięcia): AT III, białko C,
pretrombina;
3. TFPI – inhibitor toru krzepnięcia zależnego od czynnika tkankowego (TF, cz. III).
Funkcję inhibitorów krzepnięcia pełni wiele leków, takich jak: heparyna, pochodne
dikumarolu (zaburzające syntezę białek zależnych od witaminy K)
W warunkach in vitro skutecznie hamują krzepnięcie: heparyna, czynniki wiążące
jony wapniowe np. cytrynian, EDTA, EGTA.
Czynnik von Willebranda
Czynnik von Willebranda (vWF) odgrywa strategiczną rolę w krzepnięciu krwi in
vivo, warunkując kooperację między elementami ściany naczynia, płytkami krwi i
osoczowymi czynnikami krzepnięcia.
Czynnik von Willebranda (vWF) jest glikoproteiną występującą w osoczu, a także
przytwierdzoną do ścian naczyń krwionośnych jako składnik glikokaliksu. vWF jest
wytwarzany i wydzielany do krwi w postaci nieaktywnych monomerów (2050
aminokwasów) przez megakariocyty i płytki krwi, komórki śródbłonka naczyniowego
oraz komórki podśródbłonkowej tkanki łącznej. vWF posiada w swojej strukturze
domeny wiążące się z różnorodnymi czynnikami krwi i ścian naczyń krwionośnych, w
tym z: płytkami krwi (gł. receptor GPIb i integrynami płytkowymi), heparyną,
kolagenem. Po związaniu z glikokaliksem tworzy olbrzymie polimery składające się z
od 80 do 250 podjednostek (łącznie nawet ponad 500 000 aminokwasów), które pełnią
rolę receptorów adhezyjnych.
Znaczenie vWF:
• krążący vWF tworzy kompleks z czynnikiem VIII, zabezpieczając ten czynnik przez
szybkim rozkładem. Znaczny niedobór vWF wiąże się z niedoborem czynnika VIII
(hemofila A), gdyż czynnik VIII w stanie niezwiązanym jest nietrwały w środowisku
krwi. Czynnik VIII oddysocjowuje od kompleksu z vWF pod wpływem trombiny
(cz. IIa).
• vWF wiąże się z kolagenem wyeksponowanym przy uszkodzeniu środbłonka
naczyniowego
• vWF pełni funkcję receptora adhezyjnego płytek. Wykazuje zdolność silnego
wiązania z glikoproteidami płytkowymi (GPIb; kompleksami glikoproteidów: GPIb-
V-IX; GPIIb-IIIa), co umożliwia adhezję płytek w miejsca uszkodzenia ściany
naczyniowej, zachodzącą nawet przy szybkim strumieniu przepływającej krwi i
wysokim tarciu przepływającej krwi o ścianę naczyniową (napięcie ścinające; ang.
shear stress)
43
• wiązanie vWF z płytkami krwi zwiększa się przy aktywacji krzepnięcia osoczowego,
gdyż trombina aktywuje dodatkowe glikoproteidy płytkowe, które po aktywacji
wykazują wybitne powinowactwo do vWF.
Deficyt vWF lub jego dysfunkcja (związana najczęściej z nieprawidłową
polimeryzacją), zwiększa tendencję do wynaczyniania krwi (skaza krwotoczna),
zwłaszcza z tętniczek, w których krew przepływa szybko, a tarcie przepływu (shear
stress) jest wysokie. Nadekspresja vWF w śródbłonku naczyniowym sprzyja
powstawaniu lokalnych ognisk wykrzepiania, które mogą skutkować tworzeniem
niebezpiecznych powikłań zatorowych i blaszek miażdżycowych.
Fibrynoliza
Przeciwwagą dla krzepnięcia jest fibrynoliza, która w warunkach prawidłowych
ma zasadniczo zasięg lokalny – jest aktywowana przede wszystkim w miejscach, w
których gromadzą się nici fibryny. Istotą fibrynolizy jest enzymatyczny rozkład nici
fibryny i jej prekursora fibrynogenu przez plazminę (Ryc. 14). Plazmina jest enzymem
niespecyficznym o szerokiej swoistości substratowej. Rozkłada między innymi:
fibrynogen, fibrynę, czynniki: V, VIII, XIII, von Willebranda (vWf), glikoproteiny
płytkowe.
Plazminogen
Plazmina
Fibryna
Fibrynogen
Aktywatory
Inhibitory
Aktywatory
Inhibitory
Ryc. 14. Uproszczony schemat fibrynolizy

44
Mechanizmy fibrynolizy tworzą złożony system wzajemnych powiązań, zwany niekiedy
układem fibrynolizy. Czynnikami warunkującymi fibrynolizę są:
1. plazminogen (nieaktywny prekursor plazminy)
2. plazmina
3. liczne aktywatory i inhibitory
Plazminogen jest glikoproteiną wytwarzaną w wątrobie, eozynofilach i nerkach.
Jego okres połowicznego zaniku we krwi wynosi około 50 godzin. Aktywacja układu
fibrynolitycznego prowadzi do powstania plazminy z plazminogenu.
Do przekształcania plazminogenu w plazminę dochodzi pod wpływem aktywatorów:
a) osoczowych (aktywacja wewnętrzna) : czynnik XIIa, trombina,
b) tkankowych (aktywacja zewnętrzna): czynniki uwalniane ze ścian naczyń
i z tkanek: urokinaza, tPA (tissue – type plasminogen activator)
Uogólnieniu fibrynolizy na skalę ogólnoustrojową, co wiązałoby się z
proteolitycznym rozkładem nie tylko nici fibryny, ale także krążącego fibrynogenu,
przeciwdziałają liczne inhibitory, które neutralizują plazminę i jej aktywatory.
Wyróżnia się inhibitory fibrynolizy fibrynolizy:
1. hamujące aktywację plazminogenu: PAI-1 (Plasminogen Activator Inhibitor)
2. hamujące plazminę: α
2
-antyplazmina, α
2
-makroglobulina, antytrombina III
3. aktywatory inhibitorów plazminogenu
4. TAFI (aktywowany przez trombinę inhibitor fibrynolizy; zależny od śródbłonka –
aktywowany przez trombomodulinę)
Wyszukiwarka
Podobne podstrony:
01 WPROWADZENIE DO FIZJOLOGII CZŁOWIEKA ppt
01 Wprowadzenie Do Fizjologiid 2989 ppt
WPROWADZENIE DO FIZJOLOGII
01 WPROWADZENIE DO FIZJOLOGII CZŁOWIEKA ppt
Wprowadzenie do fizjologii
WPROWADZENIE DO FIZJOLOGII CZŁOWIEKA
Wykład 1 inżynierskie Wprowadzenie do zarządzania operacyjnego
Wprowadzenie do medycyny rozwojowej 1
PD W1 Wprowadzenie do PD(2010 10 02) 1 1
Wprowadzenie do psychologii
Wprowadzenie do filozofii
(1) Wprowadzenie do nauki o finansach 1id 778 ppt
wprowadzenie do systemu win i podst sieci
wprowadzenie do psychologii społecznej
Wprowadzenie do cw1A
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
więcej podobnych podstron