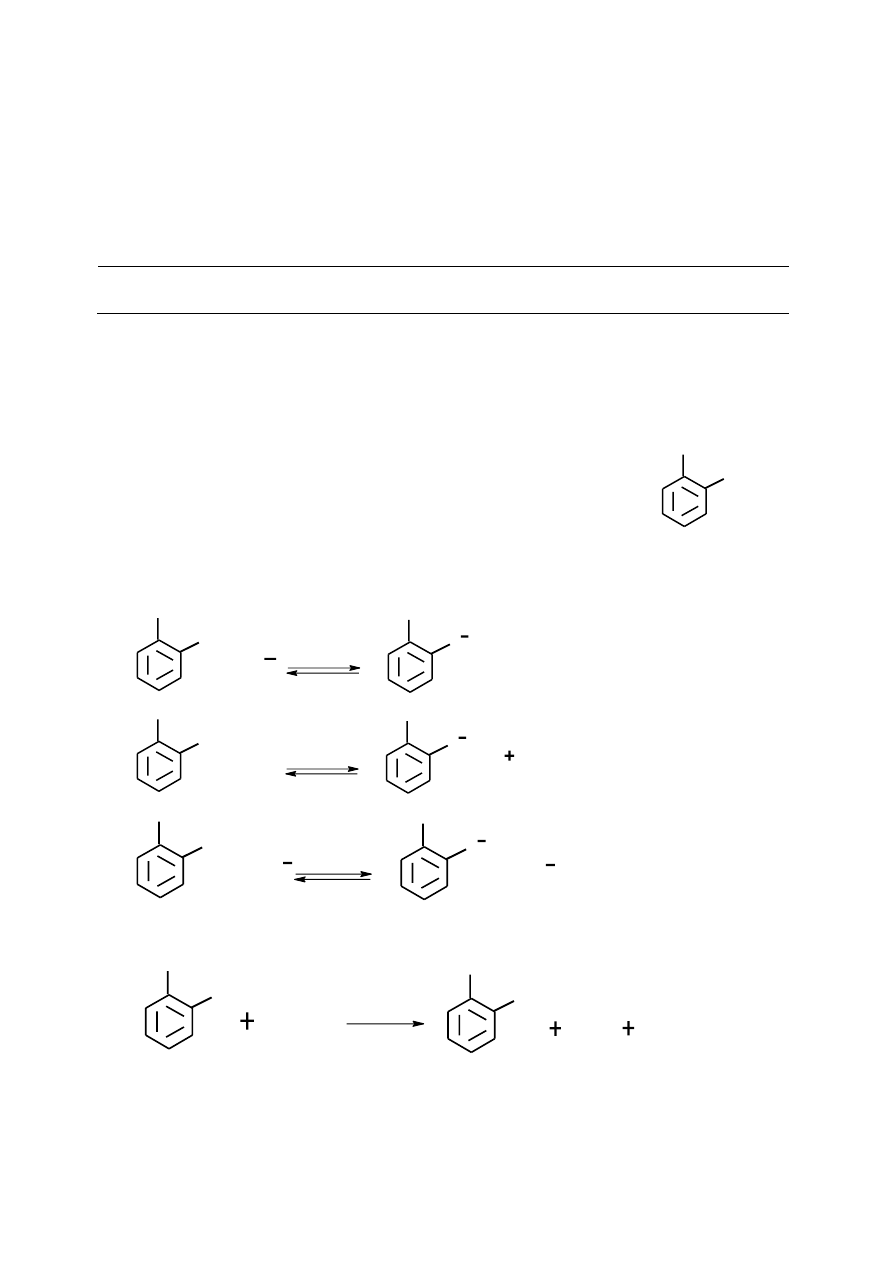
1
Schemat rozwiązań zadań z I etapu 51 Ogólnoopolskiego Konkursu
Chemicznego im. prof. A. Swinarskiego
Zad.A (20 pkt)
Klucz odpowiedzi:
1
2
3
4
5
6
7
8
9
10
c
b
c
d
b
b
b
c
c
c
Każda poprawna odpowiedź – 2 pkt
ZAD. B (20pkt)
1.(3pkt)
C
7
H
7
NO
2
, amid kwasu 2-hydroksybenzenokarboksylowego(amid kwasu
salicylowego, amid kwasu 2-hydroksybenzoesowego, amid kwasu
o-hydroksybenzoesowego)
2. (1pkt)
amid aromatycznego hydroksykwasu; amid fenolokwasu
3. (3pkt)
4. (1pkt)
CONH
2
OH
CONH
2
OH
COONa
ONa
2NaOH
NH
3
H
2
O
CONH
2
OH
+
OH
O
+ H
2
O
CONH
2
CONH
2
OH
+
CO
3
2
O
+ HCO
3
CONH
2
CONH
2
OH
+
NH
3
O
+ NH
4
CONH
2
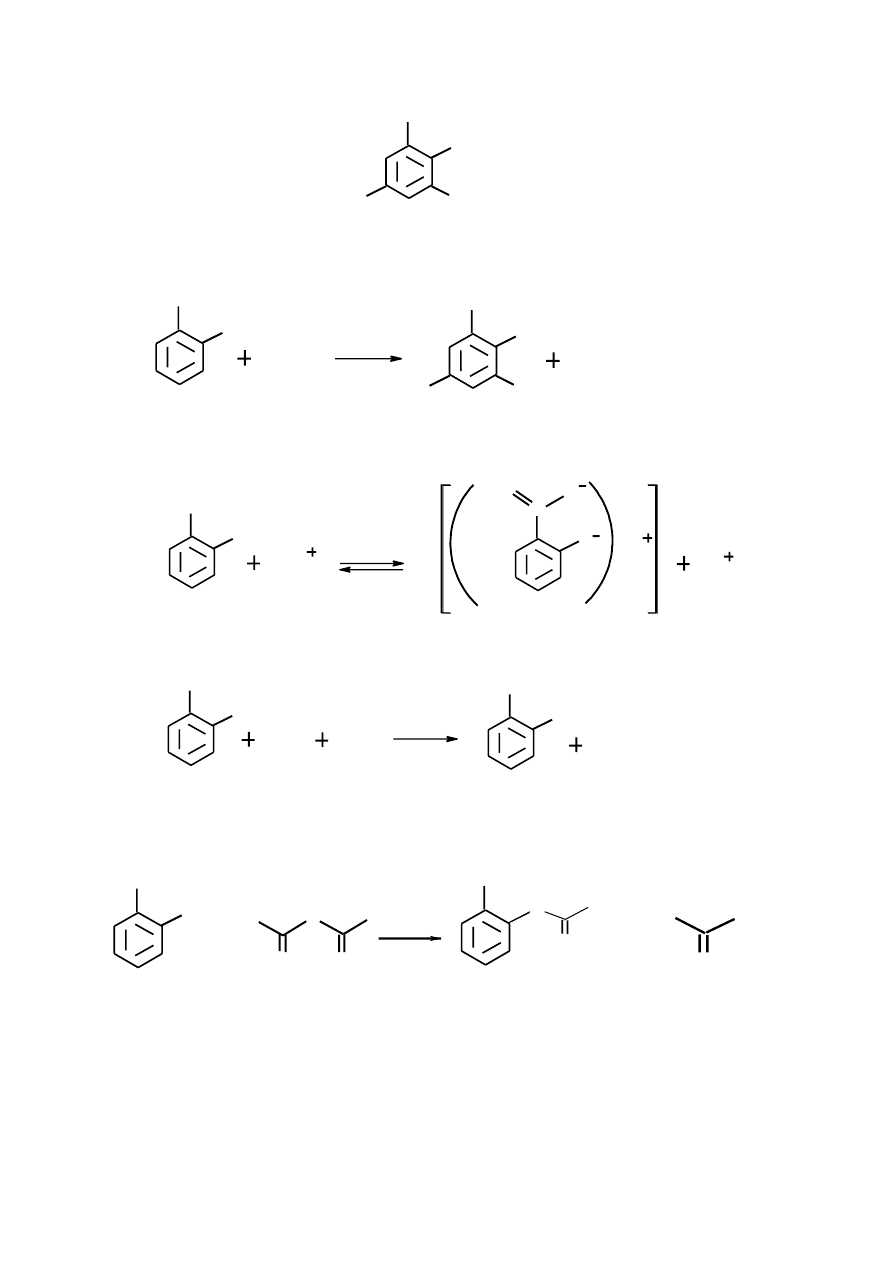
2
5. (5pkt)
C
7
H
5
Br
2
NO
2
;
amid kwasu 3,5-dibromo-2-hydroksybenzenokarboksylowego
6.
(1pkt)
7.
(3pkt)
B
związek B – kwas 2-hydroksybenzenokarboksylowy (kwas salicylowy)
8. (3pkt)
kwas acetylosalicylowy (aspiryna)
Zastosowanie – jako lek przeciwgorączkowy, przeciwzapalny i przeciwbólowy.
CONH
2
OH
Br
Br
CONH
2
OH
CONH
2
OH
Br
Br
2Br
2
2HBr
CONH
2
OH
HCl
H
2
O
OH
COOH
NH
4
Cl
COOH
OH
C
H
3
O
CH
3
O
O
CH
3
COOH
O
O
+
+
H
3
C
OH
O
O
3
CONH
2
OH
Fe
3
3
C
HN
O
Fe
3
3
-
6H

3
ZADANIE C (15 pkt)
a) i)
Fe + 2H
+
+SO
4
2-
Fe
2+
+ SO
4
2-
+ H
2
Fe + H
2
SO
4
FeSO
4
+ H
2
1
ii)
5Fe
2+
+ MnO
4
-
+ 8H
+
5Fe
3+
+ Mn
2+
+ 4H
2
O
10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
5Fe
2
(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+8H
2
O
2
iii) 5H
2
C
2
O
4
+ 2MnO
4
-
+ 6H
+
10CO
2
+ 2Mn
2+
8H
2
O
5C
2
O
4
2-
+ 2MnO
4
-
+ 16H
+
10CO
2
+ 2Mn
2+
8H
2
O
5H
2
C
2
O
4
+ 2KMnO
4
+ 3H
2
SO
4
10CO
2
+K
2
SO
4
+ 2MnSO
4
+ 8H
2
O
2
b)
n (H
2
C
2
O
4
) = 0,05 mol/dm
3
· 0,010 dm
3
= 0,0005 mola
1
z równania (iii) wynika, że 2 mole KMnO
4
reagują z 5 mol. H
2
C
2
O
4
stąd:
n (KMnO
4
) = 0,0005 · 2 / 5 = 0,0002 mola
2
stężenie:
c(KMnO
4
) = 0,0002 mol / 0,00976 dm
3
= 0,0205 mol/dm
3
.
2
c)
n (KMnO
4
) w reakcji (ii) = 0,0205 mol/dm
3
· 0,02008 dm
3
= 0,000411 mol
1
z równania (ii): n (Fe
2+
) = 5 · n (KMnO
4
) = 0,002057 moli
1
M
Fe
= 55,85 g/mol
m
Fe
= 0,002057 mol · 55,85 g/mol = 0,1149 g
1
Zawartość Fe w żyletce:
0,1149g / 0,1331g · 100% = 86,33%
2
ZAD. D (15 pkt)
a)
2NOCl (g) = 2 NO (g) + Cl
2
(g)
2 pkt
b)
NOCl
NO
Cl
2
przed reakcją
2,5 mola
0 moli
0 moli
w równowadze
2,5 mola – x
mola
x mola
0,5x mola
w równowadze
1,7 mola
0,8 mola
0,4 mola
2 pkt
2 pkt
x=0,8 mola (z warunków zadania)

4
c)
3 pkt
[NO]=0,86 mol/15 dm
3
= 0,0573 M
0,5 pkt
[NOCl]=1,90 mol/15 dm
3
= 0,1267 M
0,5 pkt
[Cl
2
]=(K
c
[NOCl]
2
)/[NO]
2
= (7,4 10
-3
(0,1267)
2
)/(0,0573)
2
= 0,0362 M
1 pkt
n(Cl
2
) = [Cl
2
] M 15 dm
3
= 0,543 mola
1 pkt
d) 3 pkt
Zgodnie z regułą przekory, jeżeli na układ znajdujący się w stanie równowagi chemicznej
zadziała się czynnikiem wytrącającym go z tego stanu, to nowy stan równowagi ustala się
w taki sposób, by nastąpiło osłabienie czynnika zaburzającego.
Zgodnie z równaniem reakcji (punkt a), z 2 moli substratów powstają 3 mole produktów,
co prowadzi do wzrostu ciśnienia. Z tego powodu, dwukrotne podwyższenie ciśnienia
w układzie spowoduje przesunięcie równowagi reakcji w kierunku substratów, dlatego
też wydajność procesu rozkładu chlorku nitrozylu spadnie.
Zależność stałej równowagi K
x
od ciśnienia przedstawia równanie:
(
)
∑
W warunkach zadania ∑
stąd K
x
(p
2
)/K
x
(p
1
)=(p
1
/p
2
). Oznacza to, że dwukrotny wzrost ciśnienia spowoduje dwukrotny
spadek wartości stałej równowagi K
x
.
ZAD. E (15pkt)
1. (2pkt)
C
7
H
7
NO
2
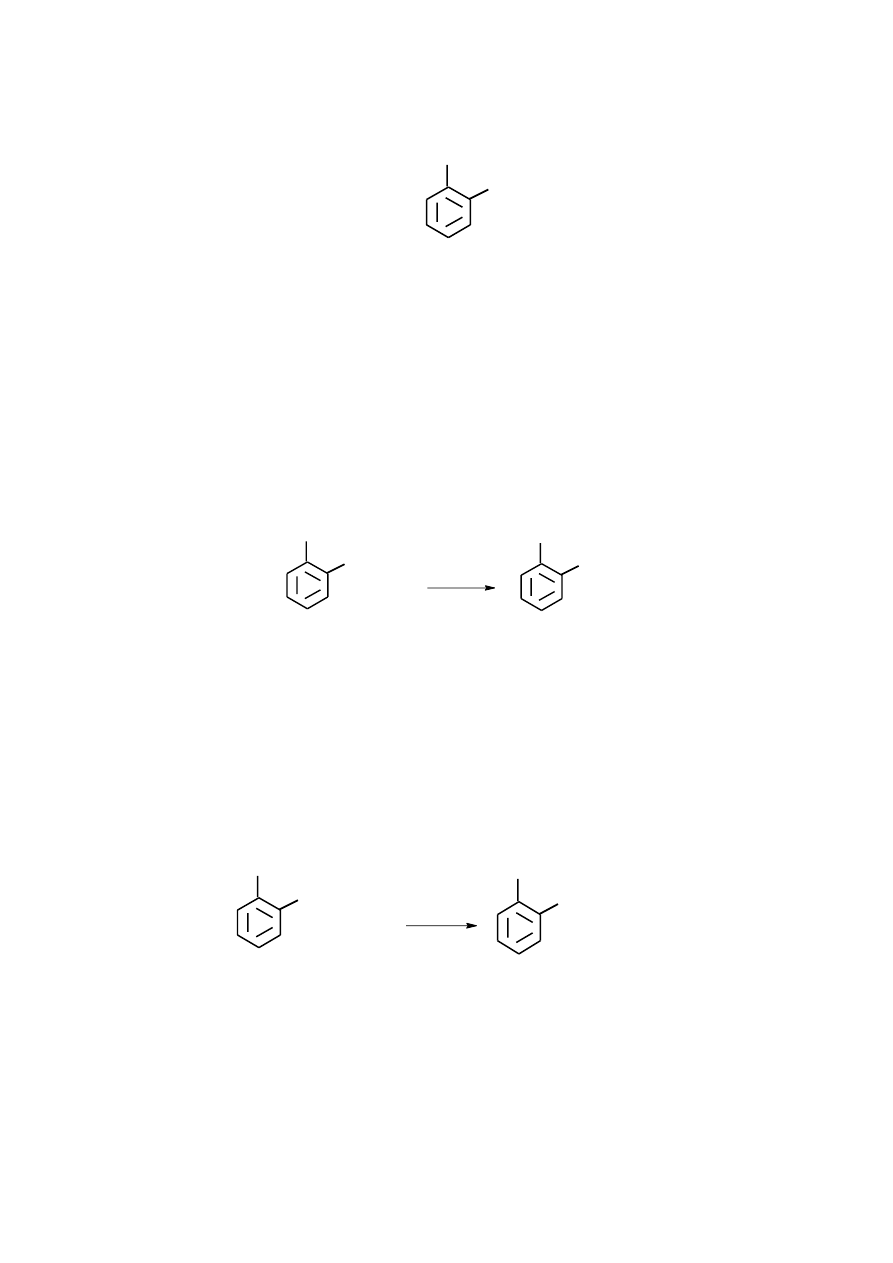
5
2. (3pkt)
tylko ten związek posiada wyliczony wzór sumaryczny, jest aromatyczny, 1,2-
podstawiony i ulega hydrolizie do kwasu z grupą fenolową, której obecność
potwierdza reakcja z roztworem chlorku żelaza(III).
3. (1pkt) amid kwasu 2-hydroksybenzenokarboksylowego (amid kwasu 2-
hydroksybenzoesowego, amid kwasu salicylowego)
4. (1pkt)
5. (1pkt)
kwas 2-hydroksybenzenokarboksylowy (kwas 2-hydroksybenzoesowy, kwas
salicylowy)
6. (1pkt)
7. (1pkt) np. spirytus salicylowy
8. (2pkt) dowolna przemiana charakterystyczna dla grupy hydroksylowej połączonej
z pierścieniem aromatycznym, karboksylowej lub pierścienia aromatycznego
z poprawnym równaniem reakcji
CONH
2
OH
CONH
2
OH
COOH
OH
+ H
2
O
+ NH
3
OH
COONa
OH
+ NaHCO
3
COOH
+
H
2
O + CO
2
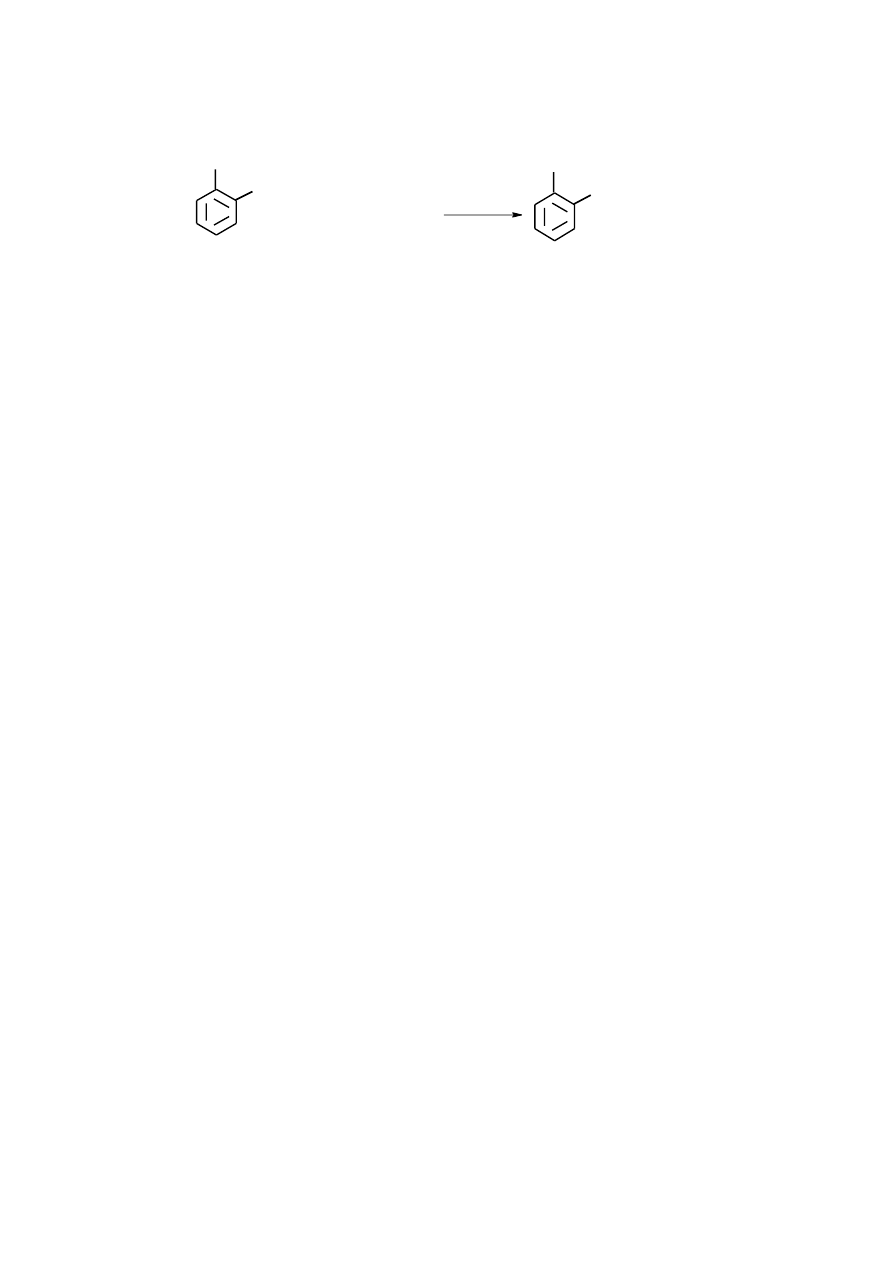
6
9. (3pkt)
aspiryna kwas octowy
(kwas acetylosalicylowy)
OH
COOH
OC(O)CH
3
+
COOH
+
CH
3
C(O)OC(O)CH
3
CH
3
COOH
Wyszukiwarka
Podobne podstrony:
51 Konkurs etap II
51 konkurs etap 1 zadania
iv test szkolny , IV Konkurs - etap szkolny
AAA Test III OWH - II etap z odpowiedziami!!!!!!!!!, Olimpiada Hotelarska
Konkurencja doskonala odpowiedzi do zadan XII-2011, Mikroekonomia I, Garbicz, mikro I Garbicz Dzierz
Zadania konkursowe, etap ustny 2009
Prawo konkurencji i konsumenta - odpowiedzi na pytania
12.ELIMINACJE DO KONKURSU 'DZIEJE STAROŻYTNYCH GREKÓW I RZYMIAN', Kwalifikacje do konkursu o Antyku.
Zadania konkursowe, etap ustny 2008, Zadanie 1
Klasaa V (pati 89), SZKOLNY KONKURS + KARTA ODPOWIEDZI 2010 -2011
Informatyka 51 różnych pytań i odpowiedzi
geografia konkurs etap szkolny 10 11
Księga Wyjścia Konkurs etap klasowy 2
Konkurs historyczny SP etap rejonowy
Etap podstawowy XXV Olimpiady Wiedzy Ekologicznej ODPOWIEDZI
Konkurs historyczny GIM etap szkolny 2
odpowiedzi etap wojewodzki zsz
konkurs V 2007 etap II, edu, Konkurs Gliwice
więcej podobnych podstron