
Choroba refluksowa przełyku
Tomasz Marek
Anna Dziurkowska-Marek
Choroba refluksowa przełyku (gastro-esophageal reflux disease, GERD) staje się
jednym z najbardziej istotnych problemów gastroenterologii. Stanowią o tym: częstość jej
występowania, znaczne obniżenie komfortu życia będące następstwem dokuczliwych
objawów oraz niebezpieczne powikłania, z gruczolakorakiem przełyku włącznie.
Objawy refluksu żołądkowo-przełykowego w społeczeństwach wysoko rozwiniętych
występują codziennie u około 4 - 9% i raz na tydzień u około 20% populacji. Endoskopowe
rozpoznanie zapalenia przełyku stawia się u około 10% wszystkich endoskopowanych; sądzi
się, że występuje ono u około 2% ludzi. Co więcej, GERD u ludzi dorosłych nie jest chorobą
"uleczalną". U znacznej większości chorych dolegliwości nawracają, wymagając
długotrwałego leczenia farmakologicznego lub chirurgicznego. O wadze, jaką przywiązuje się
obecnie do choroby refluksowej i jej następstw w postaci przełyku Barretta i gruczolakoraka
przełyku świadczy to, że Europejskie Towarzystwo Endoskopowe (ESGE) wybrało chorobę
refluksową (oraz raka jelita grubego) na temat "Public Awareness Campaign" – programu
mającego na celu szerzenie oświaty zdrowotnej w społeczeństwach Europy, a Amerykańskie
Towarzystwo Endoskopii Trawiennej (ASGE) wraz z Narodowym Instytutem Zdrowia (NIH)
wybrały przełyk Barretta jako jedną z trzech dziedzin, w której w najbliższej przyszłości
powinny być prowadzone najbardziej intensywne badania naukowe.
Definicje
Choroba refluksowa przełyku to zespół typowych dolegliwości i/lub towarzyszących
zmian zapalnych błony śluzowej dystalnego docinka przełyku, wywołanych powtarzalnymi
epizodami refluksu żołądkowo-przełykowego.
Refluks żołądkowo-przełykowy to zarzucanie zawartości żołądka do przełyku z powodu
niewydolności dolnego zwieracza przełyku (lower esophageal sphincter, LES), powodujące
spadek pH przełyku do wartości < 4.0 przy refluksie kwaśnym i wzrost pH przełyku do
wartości > 7.0 przy refluksie alkalicznym.
Refluksowe zapalenie przełyku (reflux esophagitis, RE): to obecność w błonie śluzowej
przełyku zmian zapalnych, stwierdzanych makroskopowo (endoskopia) lub histologicznie
(biopsja). RE może przebiegać bezobjawowo.

Choroba refluksowa przełyku z negatywnym wynikiem endoskopii (endoscopy negative
reflux disease, ENRD) to występowanie typowych dla GERD dolegliwości (przynajmniej 2
epizody zgagi o dużym nasileniu tygodniowo) przy prawidłowym obrazie endoskopowym
przełyku.
Przełyk Barretta (Barrett's esophagus, BE) to pokrycie błony śluzowej przełyku
metaplastycznym, wyspecjalizowanym nabłonkiem walcowatym, przypominającym nabłonek
jelitowy z obecnością komórek kubkowych.
Patogeneza
Jak wynika z definicji choroby, istotą GERD jest występowanie refluksu treści
żołądkowej do przełyku. Trzeba zdać sobie jednak sprawę z faktu, że refluks występuje u
większości zdrowych osób. Ten tzw. refluks fizjologiczny charakteryzuje się krótkim czasem
trwania i występuje głównie w okresach poposiłkowych, nie występując natomiast w czasie
snu. Refluks fizjologiczny z reguły nie powoduje objawów. Refluks patologiczny
charakteryzuje się zwiększeniem liczby i długości trwania jego epizodów, które mogą
występować tak w ciągu dnia, jak i w nocy, niezależnie od posiłków. To zwiększenie liczby i
czasu trwania epizodów refluksu prowadzi do sumarycznego zwiększenia czasu narażenia
błony śluzowej przełyku na kwaśną treść żołądkową, co w konsekwencji powoduje powstanie
zmian zapalnych i/lub dolegliwości.
Przyczyną występowania refluksu patologicznego jest dysfunkcja LES. W warunkach
prawidłowych LES stanowi barierę pomiędzy wysokim ciśnieniem wewnątrzżołądkowym
i niskim ciśnieniem wewnątrzprzełykowym, ulegając rozluźnieniu w trakcie połykania.
Spoczynkowe ciśnienie LES ulega zmianom także w trakcie oddychania, ruchów i zmian
pozycji ciała, wędrującego kompleksu motorycznego.
Przez długi okres czasu sądzono, że przyczyną występowania refluksu jest obniżone
spoczynkowe napięcie LES. Obecnie uważa się, że zjawisko to występuje głównie w bardziej
zaawansowanych (późnych) stadiach choroby. Natomiast we wczesnych okresach GERD
dominującym czynnikiem patogenetycznym są tzw. samoistne (nie związane z połykaniem),
przemijające relaksacje LES (transient lower esophageal sphincter relaxations, TLESRs).
TLESRs występują oczywiście także i ludzi zdrowych, jednak u chorych z GERD występują
znacznie częściej (głównie w okresach poposiłkowych i w nocy) i charakteryzują się
przedłużonym czasem trwania. TLESRs wywoływane są przede wszystkim rozciągnięciem
proksymalnej części żołądka. Mniej fizjologicznym bodźcem prowokującym występowanie
TLESRs jest drażnienie receptorów tylnej ściany gardła.
Zmniejszenie perystaltyki przełyku i skrócenie przełyku wydają się mieć znaczenie
dopiero w zaawansowanych stadiach GERD; zjawiska te są prawdopodobnie wtórne do
zmian zapalnych. Przepuklina rozworu przełykowego przepony przyczynia się do rozwoju

GERD poprzez separację obu części zwieracza (właściwego, wewnętrznego – LES i
zewnętrznego – odnóg przepony) i stworzenie rezerwuaru dla soku żołądkowego, z którego
jest on łatwo zarzucany do przełyku.
Pewną rolę w patogenezie GERD może odgrywać też zmniejszona wrażliwość błony
śluzowej przełyku na kwas. Stan ten, przez brak objawów GERD, prowadzi do znacznego
opóźnienia w rozpoznaniu i podjęciu leczenia, często dopiero w fazie powikłań choroby.
Objawy kliniczne przełykowe i pozaprzełykowe
Najczęstsze objawy kliniczne GERD zestawia tabela 1.
Głównym objawem GERD jest zgaga, opisywana jako uczucie palenia lub pieczenia
w dołku podsercowym. Piekący ból promieniuje z okolicy wyrostka mieczykowatego za
mostek, niekiedy aż do gardła. Nasilenie tego podstawowego objawu GERD może wahać się
od nieznacznego, występującego sporadycznie po błędach dietetycznych, aż do stałych i
ostrych, palących bólów, uniemożliwiających choremu prowadzenie normalnego trybu życia.
Wśród czynników nasilających zgagę wymienia się: posiłki z dużą zawartością tłuszczu lub
bardzo słodkie, używki (alkohol, czekolada, kofeina, nikotyna), soki z owoców cytrusowych,
schylanie się lub przyjmowanie pozycji leżącej, zwłaszcza po posiłku. Choć objaw ten jest
znacznie częstszy u chorych ze współistniejącymi zmianami zapalnymi śluzówki przełyku niż
u chorych z ENRD, pojawienie się zgagi należy wiązać ze spadkiem pH w przełyku poniżej
4.0.
Zwracanie pokarmów, kolejny objaw kojarzony z GERD, polega na biernym cofaniu się
treści żołądkowej poza połączenie przełykowo-żołądkowe (gastro-esophageal junction, GEJ),
często wysoko do przełyku, co daje uczucie goryczy lub kwaśnego smaku w ustach. Objaw
ten nasilają sytuacje podwyższające ciśnienie śródbrzuszne oraz leżąca pozycja ciała.
Dysfagia, występująca dość często u chorych z GERD, jest wynikiem zaburzeń
motoryki przełyku, zwężeń przełyku w jego końcowym odcinku lub niedostatku śliny. W
przypadku zwężeń przełyku dysfagia może mieć charakter postępujący i nasilać się od
postaci łagodnej (gdzie upośledzone jest jedynie połykanie dużych kęsów stałych pokarmów)
do bardzo ciężkiej (dotyczącej również płynów).
Bolesne połykanie (odynofagia) może wystąpić zwłaszcza u chorych z nadżerkami lub
owrzodzeniem przełyku zlokalizowanymi na wysokości zwężenia.
Bóle w klatce piersiowej pochodzenia pozasercowego (non-cardiac chest pain, NCCP)
symulujące chorobę wieńcową także mogą występować u chorych z GERD i wtedy często
bywają przyczyną trudności diagnostycznych.
Krwawienia ze zmienionej zapalnie błony śluzowej przełyku rzadko przybierają
nasilenie istotne klinicznie, stanowiąc zaledwie 1% wszystkich krwawień z górnego odcinka

przewodu pokarmowego. Przy dłuższym jednak trwaniu mogą powodować niedokrwistość z
niedoboru żelaza.
Pozaprzełykowe objawy GERD, zależnie od narządów, w których się manifestują,
dzielimy na płucne, laryngologiczne i żołądkowe.
Wśród objawów płucnych wymienić należy przewlekły kaszel, duszności. Objawy te są
rezultatem powtarzających się mikro- lub makro- aspiracji treści żołądkowej do dróg
oddechowych lub odruchowej reakcji przełykowo-oskrzelowej na obecność kwaśnej treści
w przełyku. Relatywnie częste występowanie GERD u chorych na astmę oskrzelową może
jednak być u części chorych zjawiskiem wtórnym do choroby układu oddechowego. W czasie
ataku astmy zmiany ciśnienia wewnątrzbrzusznego i wewnątrz klatki piersiowej mogą
bowiem sprzyjać występowaniu refluksu.
Laryngologiczne manifestacje GERD obejmują: zaburzenia w produkcji śliny, chrypkę,
zapalenie gardła i krtani oraz uczucie dławienia w gardle. Wszystkie powyższe objawy są
wiązane z obecnością kwaśnej treści w przełyku, która cofając się może osiągnąć gardło
i jamę ustną.
U ponad 40% chorych z GERD daje się wykazać objawy opóźnionego opróżniania
żołądkowego: poposiłkowe uczucie pełności w nadbrzuszu, wzdęcia, nudności.
Diagnostyka GERD
Rozpoznanie GERD jest łatwe w przypadkach, gdy występują typowe objawy takie jak
zgaga, odbijania, zwracanie treści żołądkowej lub gdy stwierdzamy zmiany zapalne błony
śluzowej przełyku. Natomiast u chorych z nietypowymi dolegliwościami jak: bóle w klatce
piersiowej, nudności, wymioty, objawy dyspeptyczne, wzrasta znaczenie pomocniczych
badań diagnostycznych. Ze względu na polietiologiczny charakter GERD wydaje się, że nie
ma idealnego pojedynczego testu diagnostycznego.
Podstawowe metody diagnostyczne GERD zestawiono w tabeli 2.
Badanie radiologiczne z użyciem papki barytowej do stwierdzenia refluksu jest metodą
"historyczną". Może ono być przydatne dla oceny morfologii zwężenia przełyku (zwłaszcza
przy niemożności oceny endoskopowej) oraz dużych przepuklin rozworu przełykowego
przepony.
Manometria przełyku pozwala na ocenę podstawowego napięcia spoczynkowego
dolnego zwieracza przełyku, jego popołykowej relaksacji oraz czynności perystaltycznej
przełyku. Rozwój 24-godzinnego monitorowania pH znacznie ograniczył obecne wskazania
do manometrii. Celowe wydaje się jej wykonanie u chorych z objawami dysfagii (bez zmian
wendoskopii!) - przy podejrzeniu pierwotnych zaburzeń motoryki przełyku, oraz u chorych
przed planowanym leczeniem operacyjnym. Szczególną uwagę trzeba zwrócić na to ostatnie

wskazanie, gdyż wynik przedoperacyjnej manometrii może decydować o wyborze techniki
zabiegu.
Dwudziestoczterogodzinne monitorowanie wewnątrzprzełykowego pH jest jedynym
badaniem umożliwiającym ilościową ocenę ekspozycji śluzówki przełyku na kwas solny
i obserwację zależności pomiędzy objawami klinicznymi a zmianami pH przełyku. Elektroda
pomiarowa, umiejscowiona 5 cm powyżej LES, przekazuje dane do mikroprocesora
umiejscowionego na zewnątrz ciała (analogicznie do 24-godzinnej rejestracji ekg metodą
Holtera). Analiza danych obejmuje dwa podstawowe parametry: liczbę epizodów refluksu
i czas ich trwania (w różnych kombinacjach - sumarycznie, średnio, w zależności od pory
dnia, posiłku, pozycji ciała, itd.).
Zastosowanie techniki monitorowania pH pozwoliło na wykrycie krótkotrwałych
epizodów refluksu (zwłaszcza po posiłkach) również u ludzi zdrowych. Chorzy z GERD, w
porównaniu do zdrowych, wykazują jednak w badaniu pH-metrycznym znamiennie większą
liczbę epizodów refluksu w ciągu doby i dłuższy czas ich trwania.
Parametrami najlepiej odróżniającymi chorych z GERD od zdrowych są: całkowity czas
utrzymywania się w przełyku pH < 4.0, czas utrzymywania się w przełyku pH < 4.0 w pozycji
stojącej oraz liczba epizodów refluksu w ciągu doby.
24-godzinna pH - metria często jest uważana za „złoty standard” diagnostyczny w
GERD. Jej czułość i swoistość ocenia się na 95%. Jednak rozpoznaje ona ekspozycję
przełyku na kwas żołądkowy jedynie u około 2/3 chorych z ENRD. Tak więc nie jest to
wystarczające, aby i ta metoda diagostyczna mogła być uważana za „złoty standard” w
diagnostyce GERD.
Wadą 24-godzinnej pH-metrii jest, mimo daleko posuniętej miniaturyzacji, pewna
uciążliwość dla chorego i wciąż wysoki koszt. Wydaje się ona być jednak niezbędna
u chorych z uporczywymi, znacznie nasilonymi dolegliwościami, a bez zmian
endoskopowych oraz u chorych z nietypowym obrazem klinicznym, źle reagujących na
leczenie. Celowe jest też wykonanie pH-metrii przed leczeniem operacyjnym, co pozwala na
pooperacyjną, obiektywną ocenę jego skuteczności.
Wszystkie powyższe metody, wymagające stosunkowo skomplikowanego sprzętu, a
przede wszystkim, zwłaszcza w warunkach naszego kraju - wciąż zbyt drogie, są w
codziennej praktyce lekarskiej trudno dostępne. Należy także pamiętać, że służą one tylko
do jakościowego bądź ilościowego potwierdzenia refluksu, lub skłonności do niego.
Jedyną natomiast metodą, która pozwala na ocenę następstw wywołanych przez
refluks jest badanie endoskopowe.
Ze względu na powszechną dostępność endoskopia jest i powinna być stosowana jako
pierwsze badanie diagnostyczne u chorych zgłaszających objawy GERD. Endoskopia
pozwala na ocenę nasilenia choroby, stwierdzenie powikłań trudno rozpoznawalnych innymi

metodami (przełyk i wrzód Barretta, zwężenia przełyku), umożliwia pobranie materiału do
badania histopatologicznego. Co bardzo ważne, endoskopia pozwala również na
rozpoznanie innych niż refluks przyczyn dolegliwości przełykowych, jak nowotwory
(dysfagia!) czy zapalenia przełyku o innej etiologii (grzybicze, wirusowe, polekowe). Wsród
endoskopowych objawów RE wymienia się: zaczerwienienie i utratę połysku śluzówki
przełyku, zatarcie linii "Z", zwiększoną kruchość śluzówki, jej obrzęk oraz występowanie
ubytków w postaci nadżerek i owrzodzeń. W przypadku negatywnego bądź wątpliwego
wyniku badania endoskopowego celowe wydaje się wykonanie badania histopatologiczego
(biopsja przynajmniej 5 cm powyżej linii "Z", w celu uniknięcia wyniku fałszywie dodatniego).
Można w nim uwidocznić obecność nacieku leukocytów wielojądrzastych w ścianie przełyku
oraz hiperplazję komórek w warstwie podstawnej i wydłużenie brodawek będące
następstwem wzmożonego złuszczania komórek powierzchownych warstw nabłonka
i zwiększonego obrotu komórkowego. Negatywny wynik endoskopii przy nasilonych
objawach jest również wskazaniem do wykorzystania uzupełniających metod
diagnostycznych - pH-metrii lub manometrii (ew. scyntygrafii).
Możliwe jest również zastosowanie, jako metody diagnostycznej, 1-2 tygodniowego
leczenia wysokimi dawkami inhibitorów pompy protonowej (PPI). Ustąpienie dolegliwości
sugeruje, że były one wywołane refluksem. Jest to prosta, tania i efektywna metoda
diagnostyczna dająca podobne rezultaty jak pomiar przełykowego pH, jednak również nie
spełniająca wymagań, aby stać się „złotym standardem” diagnostycznym.
Tak więc postawienie rozpoznania GERD wymaga dokładnej analizy wywiadu
chorobowego i często zastosowania przynajmniej 2-3 badań dodatkowych. Proponujemy
następującą ich kolejność: endoskopia, 24-godzinna pH-metria, próbne leczenie PPI,
manometria.
Endoskopowa klasyfikacja choroby refluksowej przełyku
W GERD tak jak dolegliwości, tak i obraz endoskopowy mogą wahać się od prawie
zupełnie nieobecnych do bardzo znacznie nasilonych. Sytuacja ta wymusza stosowanie
systemów stopniujących nasilenie choroby. Jest to celowe przynajmniej z 2 powodów. Po
pierwsze, umożliwia zastosowanie różnych, mniej lub bardziej agresywnych, a co za tym
idzie - mniej lub bardziej kosztownych schematów leczenia, w zależności od nasilenia zmian
zapalnych. Po drugie, umożliwia obiektywną ocenę wyników leczenia.
Końcowy kształt "idealnego" systemu klasyfikacyjnego musi być kompromisem
pomiędzy prostotą ułatwiająca jego zapamiętanie i stosowanie, a złożonością pozwalającą
na możliwie najdokładniejszą i nie pozostawiającą wątpliwości ocenę. Jako przykład systemu

stosunkowo prostego można tu przytoczyć klasyfikację Maratki (Maratka), na drugim końcu
zaś wymienić wyjątkowo złożoną, zaproponowaną przez Armstronga klasyfikację MUSE
(Armstrong). Największą popularnością cieszą się obecnie systemy Savary-Millera i Los
Angeles; systemy te przedstawiono w tabelach 3 i 4.
Leczenie
Leczenie GERD obejmuje: (1) eliminację czynników sprzyjających refluksowi, (2)
leczenie farmakologiczne, (3) leczenie chirurgiczne, oraz (4) leczenie powikłań tejże
choroby.
Eliminacja czynników sprzyjających refluksowi obejmuje m.in.: sypianie z uniesioną
górną połową ciała, nieprzyjmowanie pozycji leżącej po posiłkach i unikanie posiłków późno
przed snem, redukcję masy ciała, unikanie obcisłych ubrań, unikanie potraw i leków
zmniejszających napięcie LES, zaprzestanie palenia tytoniu. Wszystkie te stare i proste
sposoby walki z refluksem, mimo wprowadzenia w ostatnich 20 latach wielu skutecznych
leków, pozostają nadal aktualne jako leczenie wspomagające. U chorych z ENRD, ww.
zalecenia mogą okazać się wystarczające.
Leczenie farmakologiczne obejmuje stosowanie leków prokinetycznych, alkalizujących
oraz hamujących wydzielanie kwasu solnego.
Leki prokinetyczne - zwiększające motorykę przełyku i przyspieszające opróżnianie
żołądkowe - są kolejnym elementem terapii mającym na celu zapobieganie wystąpieniu
epizodów refluksu. Zanajdują one zastosowanie tak w przypadkach GERD bez jak i ze
zmianami endoskopowymi. Jednak stosowanie leków dopaminolitycznych (metoklopramid,
domperidon) aczkolwiek prowadzi u niektórych chorych do poprawy klinicznej, nie wpływa
w istotny sposób na poprawę obrazu endoskopowego. Cisaprid - lek prokinetyczny nowej
generacji - stosowany w monoterapii może być skuteczny jedynie w lżejszych postaciach
zapalenia przełyku i z reguły jest stosowany z lekami hamującymi wydzielanie HCl. Ostatnio
opisuje się coraz więcej powikłań związanych ze stosowaniem cisapridu; bezwzględnie
należy unikać stosowania tego leku u chorych z chorobami serca, noworodków i niemowląt,
zwłaszcza o niskiej masie urodzeniowej oraz u chorych w trakcie terapii erytromycyną lub
lekami przeciwgrzybiczymi z grupy azoli.
W cięższych postaciach zapalenia przełyku (stopień II-IV Savary-Millera lub C-D Los
Angeles) istnieje konieczność zastosowania leczenia obniżającego kwasotę treści
żołądkowej.
S kuteczność terapii alkaliami była wielokrotnie podważana - wydaje się, że jedyne ich
obecne znaczenie polega na doraźnym łagodzeniu objawów refluksu.
Wprowadzenie do leczenia leków blokujących receptor H2 (H2RA), mimo niewątpliwie
ogromnego postępu jakim było, również nie rozwiązało do końca problemu leczenia RE.

Zastosowanie H2RA powoduje ustąpienie objawów klinicznych u większości chorych, co
jednak nie idzie w parze z równie skutecznym ustępowaniem zmian endoskopowych;
ponadto część chorych słabo reaguje na leczenie H2RA.
Skuteczne leczenie RE stało się możliwe dopiero po wprowadzeniu nowej generacji
leków hamujących wydzielanie żołądkowe - inhibitorów pompy protonowej (proton pump
inhibitor, PPI). PPI selektywnie i skutecznie hamują wydzielanie żołądkowe, zmniejszając
produkcję HCl o ponad 90%. Najstarszym lekiem tej grupy jest omeprazol, podobnie działają
pantoprazol, lansoprazol i rabeprazol. Szczególną uwagę warto zwrócić na pantoprazol – lek
ten nie wchodzi w interakcje z cytochromem P450 znacznie zmniejszając ryzyko wystąpienia
interakcji z innymi lekami. PPI pozwalają tak na wyleczenie zmian zapalnych, jak i na
zapobieganie nawrotom choroby. Standardowe dawki powszechnie stosowanych PPI to 15
mg lansoprazolu, 20 mg omeprazolu i 40 mg pantoprazolu.
W metaanalizie oceniającej ponad 7600 chorych z II-IV stopniem RE Savary-Millera
leczonych w czasie nie dłuższym niż 12 tygodni wyleczenie uzyskano u 84% chorych
leczonych PPI, 52% chorych leczonych H2RA oraz 39% chorych leczonych sukralfatem. Co
więcej, uzyskanie wygojenia zmian zapalnych i ustąpienia objawów było znacznie szybsze
po stosowaniu PPI (odpowiednio 12% i 12%/tydzień) niż H2RA (6% i 6%/tydzień). Dane te
dowodzą, że PPI są lekami z wyboru w RE.
Ostatnio publikowane wytyczne postępowania proponują zastosowanie u chorych z RE
w II-IV stopniu PPI w dawce standardowej przez 8 tygodni. Po uzyskaniu wyleczenia można
próbować obniżyć dawkę leku w leczeniu podtrzymującym do najniższej skutecznej wg tzw.
strategii „schodów w dół”. Jeśli leczenie jest nieskuteczne, dawki leków zwiększa się wg
strategii „schodów w górę” na kolejne okresy 8-tygodniowe, redukując je po uzyskaniu
wyleczenia. Brak skuteczności podwójnej dawki PPI połączonej z podaniem H2RA na noc
(mającym zapobiegać tzw. zjawisku nocturnal acid breakthrough) nasuwa konieczność
rozważenia leczenia chirurgicznego. Leczenie podtrzymujące jest prowadzone z
zastosowaniem najmniejszej skutecznej dawki PPI podawanej codziennie. Jeśli skutecznie
zapobiega ono nawrotowi choroby, zgodnie ze strategią „schodów w dół” można podjąć
próbę przejścia na leczenie PPI co drugi dzień lub codzienne H2RA albo prokinetykami,
a w kolejnych etapach na leczenie „na żądanie” i zupełnego odstawienia leczenia (rycina 1)
Miejsce chirurgii w leczeniu GERD i RE nie jeszcze do końca określone. Wydaje się,
że przy braku efektów leczenia zachowawczego prowadzonego ponad 4 miesiące, gdy
utrzymują się zarówno objawy kliniczne, jak i zmiany endoskopowe, rozważyć należy
możliwość interwencji chirurgicznej. Dodatkowymi wskazaniami do postępowania
zabiegowego są: powtarzające się krwawienia i uporczywe objawy pozaprzełykowe (np.
astma lub zapalenie krtani). Zawsze trzeba też rozważyć leczenie operacyjne u młodych
ludzi wymagających stałego leczenia podtrzymującego. Przeciwwskazania do leczenia

operacyjnego stanowią przede wszystkim: starszy wiek z ciężkimi chorobami
współistniejącymi oraz znaczne zaburzenia motoryki przełyku, związane z ryzykiem
wystąpienia dysfagii po zabiegu.
Najczęściej stosowaną obecnie techniką jest fundoplikacji laparoskopowej. Zabieg ten
polega na wytworzeniu wokół końcowych 2 cm przełyku "kołnierza" ze zmobilizowanego
sklepienia żołądka. Mimo iż zabieg fundoplikacji laparoskopowej jest znacznie
bezpieczniejszy od zabiegu w technice tradycyjnej, jest on nadal obciążony około 9%
ryzykiem powikłań i
0.0 - 0.6% ryzykiem zgonu. Ocenia się, że fundoplikacja przynosi poprawę w 85 – 95%
przypadków.
Przełyk Barretta (BE)
Pojęcie BE obejmuje zmiany metaplastyczne śluzówki przełyku, charakteryzujące się
zastąpieniem nabłonka wielowarstwowego płaskiego przełyku typowym dla żołądka
nabłonkiem walcowatym. Metaplazja walcowatokomórkowa z reguły rozwija się jako
powikłanie długotrwałej GERD, choć może być również zmianą wrodzoną. Obecnie
większość znawców tematu uważa, że przełyk Barretta rozpoznaje się wyłącznie
w przypadku stwierdzenia w przełyku pokrycia błony śluzowej wyspecjalizowanym
nabłonkiem walcowatym, przypominającym nabłonek jelitowy o kosmkowatej powierzchni
z obecnością komórek kubkowych (tj. w przypadku stwierdzenia metaplazji jelitowej); gdyż
tylko ten rodzaj metaplazji wydaje się prowadzić do gruczolakoraka przełyku. BE obserwuje
się u aż do 12% endoskopowanych chorych z podejrzeniem GERD, a u około 10% chorych z
BE dochodzi do rozwoju raka w obrębie metaplastycznego nabłonka. Ryzyko raka u chorych
z BE jest około 30 – 125 razy większe od obserwowanego w populacji ogólnej.
W przebiegu BE częściej niż w GERD nie powikłanej rozwojem tej patologii dochodzi do
rozwoju owrzodzenia trawiennego (tzw. wrzód Barretta), zwężeń na poziomie GEJ, obfitych
krwawień, a nawet perforacji przełyku. Najpoważniejsze powikłanie BE - rozwój
gruczolakoraka przełyku objawia się postępującą dysfagią, anoreksją i spadkiem masy ciała.
Trzeba pamiętać, że u niektórych chorych BE przebiega prawie zupełnie bezobjawowo
(prawdopodobnie z powodu zmniejszonej wrażliwości błony śluzowej na kwas), a pierwszymi
objawami klinicznymi mogą być objawy związane z nowotworem! Z tego też powodu chorzy
z rozpoznanym BE wymagają stałego nadzoru specjalistycznego, z okresowym
wykonywaniem endoskopii z pobraniem licznych wycinków do badania histopatologicznego,
wg schematów zależnych od zaawansowania choroby. Stwierdzenie w obrębie segmentu
Barretta dysplazji wysokiego stopnia jest wskazaniem do leczenia zabiegowego –
endoskopowego (ablacja błny śluzowej) lub chirurgicznego (esophagectomia).

W leczeniu zachowawczym chorzy z BE wymagają wysokich dawek PPI, gdyż szansa na
zahamowanie progresji choroby jest proporcjonalna do skuteczności hamowania wydzielania
żołądkowego.
Tabela 1. Objawy choroby refluksowej przełyku.
I. Objawy
przełykowe
Zgaga
Puste
odbijania
Zwracanie
i
wymioty
Dysfagia
Odynofagia
Bóle w klatce piersiowej
Krwawienie z górnego odcinka p. pokarmowego
II.
Objawy pozaprzełykowe
Płucne: Kaszel, duszność, świsty oddechowe, bezdech w czasie snu
Laryngologiczne: Chrypka, ból gardła, krztuszenie się, zaburzenia
produkcji
śliny.
Żołądkowe: pełność w nadbrzuszu, wzdęcia, nudności, wymioty
Tabela 2. Badania diagnostyczne stosowane w GERD.
I.
Badania wykonywane w celu stwierdzenia skłonności do refluksu
1. Badanie radiologiczne górnego odcinka p. pokarmowego
2.
Manometria
przełyku
II.
Badania wykonywane w celu ilościowej oceny refluksu
1. 24 godzinna pH-metria przełyku
2.
Scyntygrafia
III.
Badania wykonywane w celu oceny skutków refluksu
1. Endoskopia + biopsja (histopatologia)
Tabela 3. System Los Angeles klasyfikacji refluksowego zapalenia przełyku

Stopień A
Co najmniej jeden ubytek błony śluzowej o długości nie przekraczającej 5 mm.
Stopień B
Co najmniej jeden ubytek błony śluzowej o długości przekraczającej 5 mm,
nie zajmujący jednak całej odległości pomiędzy dwoma fałdami przełykowymi.
Stopień C
Co najmniej jeden ubytek błony śluzowej zajmujący całą odległość pomiędzy dwoma
(lub więcej) fałdami przełykowymi, nie obejmujący jednak całego obwodu przełyku.
Stopień D
Ubytek błony śluzowej obejmujący cały obwód przełyku.
Tabela 4. System Savary-Millera klasyfikacji refluksowego zapalenia przełyku
Stopień I
Pojedyncze, nie zlewające się ze sobą nadżerki
Stopień II
Zlewające się nadżerki nie obejmujące całego obwodu przełyku
Stopień III
Zlewające się nadżerki obejmujące cały obwód przełyku
Stopień IV
Powikłania – dominujące owrzodzenie (IVa) lub zwężenie (IVb)Rycina 1. Strategie „schody w
górę / w dół” zmiany dawkowania leków w GERD.
Podwójna dawka PPI + H2RA na noc
Podwójna dawka PPI (2x pełna /d)
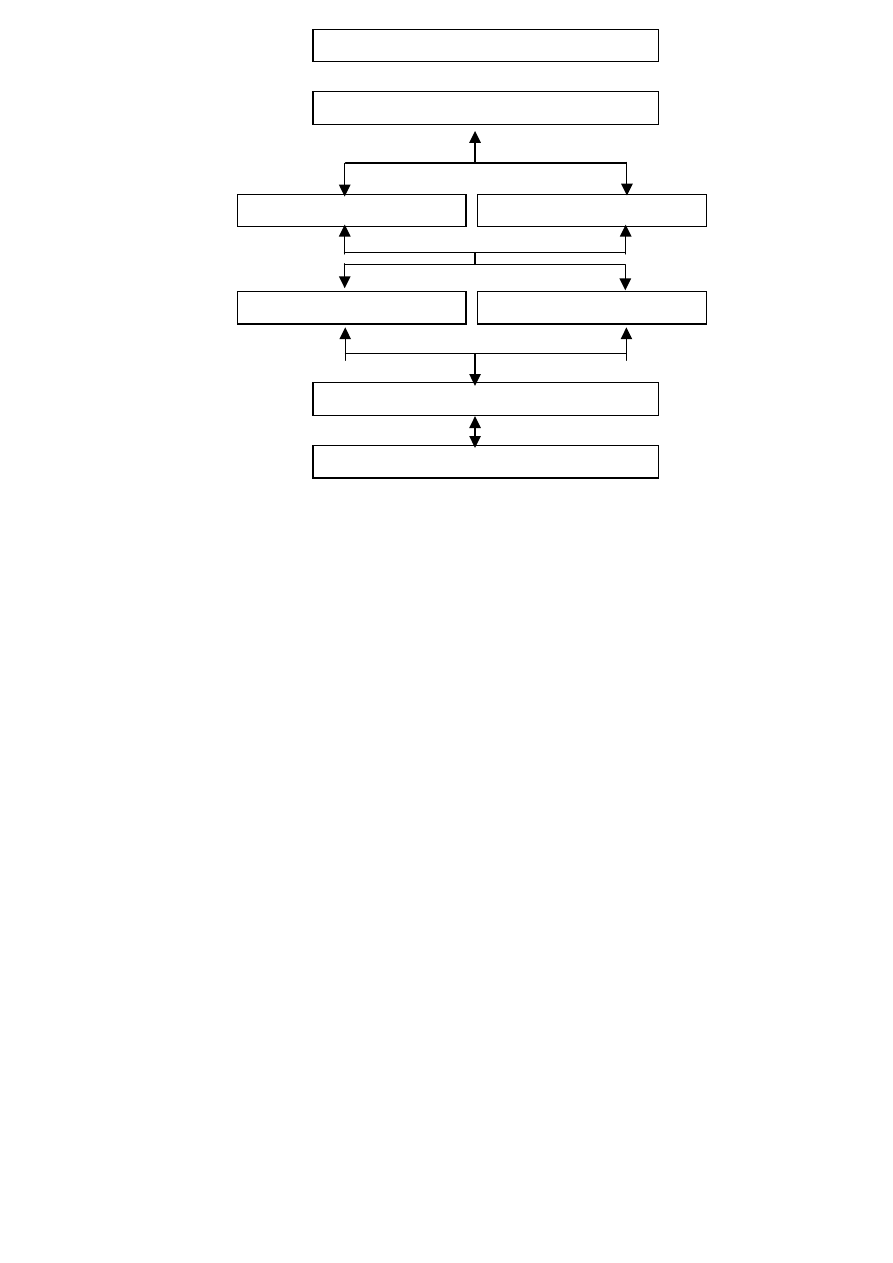
Pełna dawka PPI (1x/d)
Połowa dawki PPI (1x/d) Pełna dawka PPI (co 2 dzień)
Pełna dawka H2RA Pełna dawka prokinetyku
Leczenie na żądanie (PPI, H2RA, prokinetyk)
Bez leczenia farmakologicznego
”S
ch
od
y w
d
ó
ł”
”Schody w
gór
ę”
Wyszukiwarka
Podobne podstrony:
choroba refluksowa przelyku diety fr
W07(Aspekt stomatologiczny choroby refluksowej przełyku)
WK choroba refluksowa przelyku
Choroba refluksowa przełyku M Touściuk
Choroba refluksowa przełyku Poradnik dla Pacjenta
Choroba refluksowa przełyku
Choroba refluksowa przelyku1
CHOROBA REFLUKSOWA PRZEŁYKU, INTERNA, Gastroentero
choroba refluksowa przelyku diety fr
Choroba refluksowa przełyku Poradnik dla Pacjenta
Rola diety i stylu życia w leczeniu choroby refluksowej przełyku
Zalecenia żywieniowe w chorobie wrzodowej i w refluksie przełyku
więcej podobnych podstron