Tytuł ćwiczenia
Uwalnianie substancji z ma
Cel ćwiczenia
Celem ćwiczenia jest porównanie uwalniania DCPIP przy ró
przez różne membrany. Ma to na celu pokazanie jak mo
leków transdermalnych poprzez kontrole fizykochemicznych wła
Zakres wymaganych wiadomo
Niezbędnymi do wykonania ćwiczenia s
Dyfuzja (prawa Ficka, stała dyfuzji), sporz
automatycznej itd), liczenie st
substancji żelujących, czynniki sieciuj
pomiarowe, liczenie niepewnoś
spektrofotometrze (widma, absorbancja, ekstynkcja, transmitancja, absorpcja itp).
Tabela wyników pomiarów
W tabeli wyników należy zestawi
•
Kinetyki uwalniania –
•
Krzywe kalibracyjne do pomiar
•
Zestawienie chwilowych warto
Materiały
•
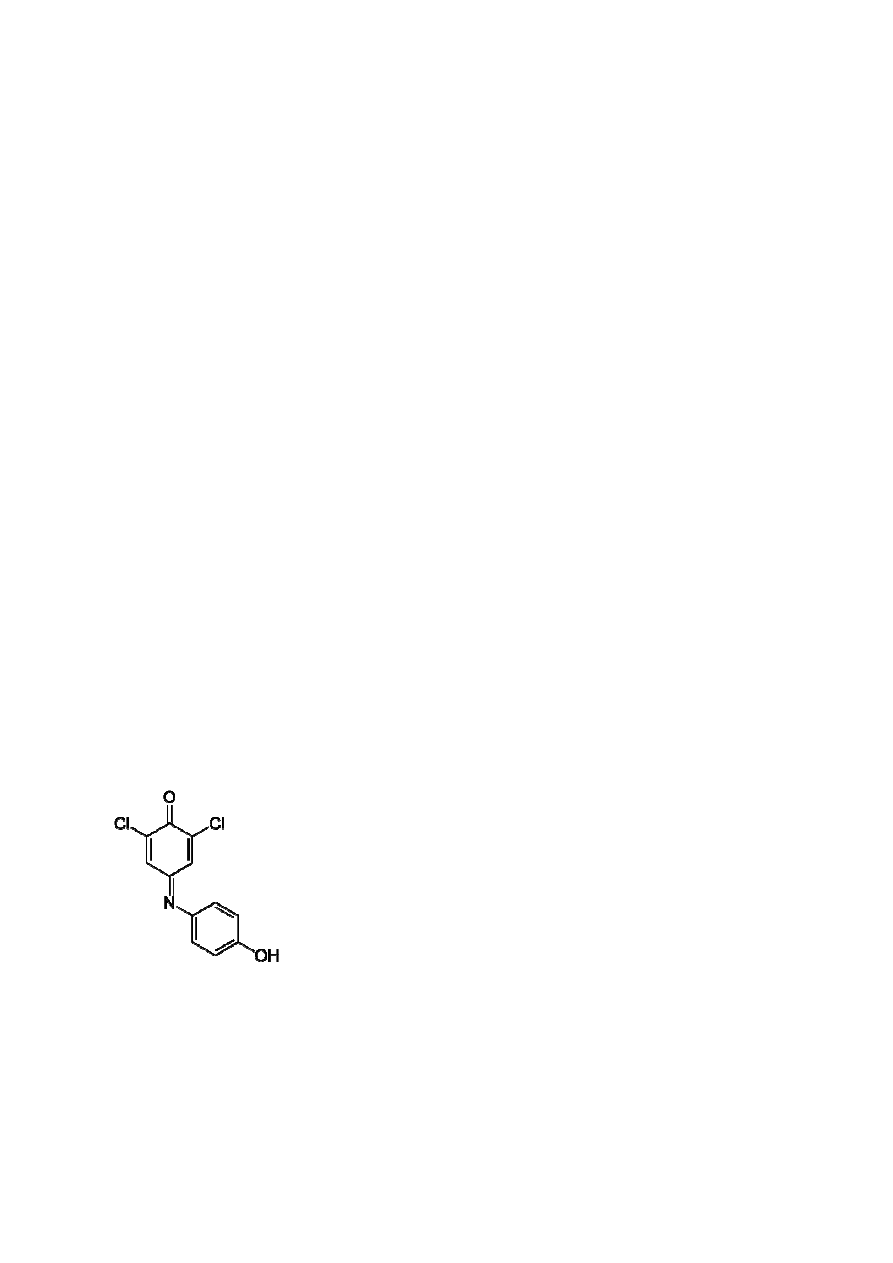
Roztwór DCPIP - 2,6-Dichlorofenoloindofenol
•
Aristoflex AVC – substancja
kryloamidometylopropanosiarczan amonu i winylopi
•
H
2
0 w tryskawce
•
Membrany z regenerowanej celulozy
•
Membrany poliwęglanowe
Uwalniana substancja:
DCPIP – cząsteczka – sumarycznie C
Masa molowa - 268,09548 g/mol
Aparatura
•
Spektrofotometr Spekol 11
•
Cylinder miarowy
•
Pipety
•
Zlewki
Uwalnianie substancji z maści i żeli
wiczenia jest porównanie uwalniania DCPIP przy różnych parametrach dyfuzyjnych i
ne membrany. Ma to na celu pokazanie jak można sterować szybko
transdermalnych poprzez kontrole fizykochemicznych właściwości formulacji.
Zakres wymaganych wiadomości
dnymi do wykonania ćwiczenia są informację o:
Dyfuzja (prawa Ficka, stała dyfuzji), sporządzanie roztworów (naważki, obsługa pipety
j itd), liczenie stężeń (wagowe, molowe, objętościowe itd),
cych, czynniki sieciujące itp), pomiary stężeń (krzywe kalibracyjne, bł
pomiarowe, liczenie niepewności pomiarowej, rodzaje błędów pomiarowych itd), pomiary na
ektrofotometrze (widma, absorbancja, ekstynkcja, transmitancja, absorpcja itp).
y zestawić następujące wynik.
zmiana stężenia uwolnionej substancji w czasie
Krzywe kalibracyjne do pomiarów stężeń
Zestawienie chwilowych wartości strumieni i gradientów w komorach pomiarowych
Dichlorofenoloindofenol
substancja żelująca (nazwa chemiczna kopolimer
kryloamidometylopropanosiarczan amonu i winylopirolidonu)
regenerowanej celulozy – 0,45 µm pory
glanowe – 0,4 µm pory
sumarycznie C
12
H
7
NCl
2
O
2
mol
Spekol 11
nych parametrach dyfuzyjnych i
szybkością dostarczania
ś
ci formulacji.
dzanie roztworów (naważki, obsługa pipety
ciowe itd), żele (rodzaje
(krzywe kalibracyjne, błędy
dów pomiarowych itd), pomiary na
ektrofotometrze (widma, absorbancja, ekstynkcja, transmitancja, absorpcja itp).
enia uwolnionej substancji w czasie
ci strumieni i gradientów w komorach pomiarowych
kopolimer

•
Komory teflonowe do uwalniania
•
Szpatułka
•
Waga analityczna
•
probówki Ependorfa
•
próbówki typu Falcon
Wykonanie ćwiczenia.
W ramach ćwiczenia należy wykonać równolegle 3 pomiary uwalniania roztworów DCPIP z
komory pomiarowej do wody.
•
Należy wykonać 2 roztwory wodne DCPIP w taki sposób, aby oba miały finalnie
identycznej stężenia 3 mM.
•
Jeden z nich należy zżelować poprzez dodanie 1%
wagowo
aristoflexu AVC, a drugi
pozostawić jako roztwór wodny
•
Należy przygotować po 2 ml obu roztworów w próbówkach typu Falcon i dokładnie
rozmieszać.
Rys. 1. Widok komory pomiarowej
•
Należy nałożyć po 500 mg przygotowanych roztworów do komór pomiarowych – 1
komorę z żelowanym roztworem, oraz do dwóch komór niezżelowane roztwory

Rys.2. Napełniona komora pomiarowa
•
Po nałożeniu roztworów należy przykryć je membranami – zżelowaną: membrana
celulozowa, niezżelowana 1 – membrana celulozowa, niezżelowana 2 – membrana
poliwęglanowa (membrany należy staranie umieszczać na komorach, tak, aby nie było
na membranie pęcherzyków powietrza)
Rys. 3. Nałożona membrana do uwalniania.
•
Komorę pomiarową nakryć pokrywą i skręcić śrubami..
Rys. 4. Skręcona komora pomiarowa
•
Zanurzyć w niewielkich odstępach czasu komory pomiarowe w zlewkach z 100 ml
wody (odstępy na tyle dobrane, aby dało się kolejno pobierać próbki w tych samych
momentach czasu dla wszystkich pomiarów)
•
W odstępach 7 minutowych odpipetowywać po 1 ml płynu akceptorowego,
uzupełniając powstały braki. Pobrany płyn pipetować do probówki Ependorfa, tak aby
na koniec móc dokonać pomiarów stężenia na spektrofotometrze. Pierwszą próbkę
pobrać w chwili t=0.
•
Pomiary prowadzić przez przynajmniej 8 punktów czasowych
•
W trakcie pomiaru należy przygotować próbki do wykonania krzywych
kalibracyjnych do pomiaru stężeń. Należy wstępnie oszacować jakie może być
stężenie osiągnięte w trakcie pomiaru na podstawie stężenia w komorze pomiarowej i
objętości płynu akceptorowego.
•
Aby przygotować krzywe kalibracyjne należy wykonać kilka próbek (przynajmniej 5-
7) roztworów o znanym stężeniu.

•
Roztwory DCPIP mierzyć przy długości fali 600 [nm] na spektrofotometrze.
•
Do wykonania obliczeń potrzebna będzie średnica okna uwalniania w komorze
pomiarowej – 10 [mm].
•
Po zakończonych pomiarach należy uporządkować stanowisko pracy, umyć
wykorzystywany sprzęt laboratoryjny i pozostawić wykorzystywane membrany przez
które zostało wykonywane doświadczenie w zlewce z wodą oczyszczoną od
odmoknięcia.
Opracowanie wyników
Wyniki należy przedstawić w postaci raportu, który należy oddać w przeciągu 1 tygodnia od
daty ćwiczenia. Do raportu należy mieć podpisanych przez prowadzącego protokół z
wykonanego doświadczenia. Raport powinien mieć następujące części:
1. Cel doświadczenia.
2. Wstęp teoretyczny – max. 1,5 strona A4 z teorią i wzorami wykorzystanymi dalej w
raporcie.
3. Opis przebiegu doświadczania – co i jak było wykonywane podczas pomiarów.
4. Przykładowe obliczenia – jeden przykład wyliczenia stężeń, rozcieńczeń i błędów
pomiarowych.
5. Zestawienie wyników – tabele zbiorcze i wykresy.
6. Wnioski – należy przeczytać definicję słowa wniosek przed przystąpieniem do tego
podpunktu.
W raporcie należy zawrzeć:
- Pełne dane osobowe: imię nazwisko/nr indeksu/grupę/datę ćwiczenia/nr Podgrupy na zajęcia
- Kinetyki uwalniania dla trzech komór w czasie
- Przeliczyć czas po jakim uwolni się całość substancji – przewidywanie dalszej części
kinetyki
- Przeliczyć maksymalny strumień uwalnianej substancji
- Policzyć niepewności pomiarowe
Literatura
-Stanisław Janicki, Małgorzata Sznitowska, Waldemar Zieliński: Dostępność farmaceutyczna
i dostępność biologiczna leków. Warszawa: Ośrodek Informacji Naukowej "Polfa", 2001.
ISBN 83-914984-1-7.
- Grażyna Samczewska, Marian Mikołaj Zgoda, Aleksandra Ciałkowska-Rysz, Sylwia Farida
Kaźmierczak Wpływ parametrów reologicznych vehiculum (hydrożele, podłoża absorpcyjne
typu w/o) na szybkość dyfuzji w warunkach in vitro do kompartmentu zewnętrznego siarczanu
morfiny, Polska Medycyna Paliatywna 2003, tom 2, nr 3
Opracował:
mgr inż. Wojciech Jopek
Wyszukiwarka
Podobne podstrony:
C3b C3c Cwiczenia 3b
Ćwiczenie 3B (2)
Cwiczenie 3B id 99456 Nieznany
Ćwiczenie 3b, Analiza instrumentalna, II część(seminaryjna)
cwiczenie 3b przepompownia
Ćwiczenie 3b 01 04 2014 WIARYGODNOŚĆ DANYCH Zadanie nr 2
01 04 2014 Ćwiczenie 3b SPRAWDZAMIE WIERYGODNOŚCI DANYCHid 2722 pptx
Wykład 3a 01 04 2014 SPRAWDZENIE WIARYGODNOŚCI DANYCH do ćwiczenia 3b Zadanie nr 2
ĆWICZENIE 3B
Ćwiczenie 3B
podstawy automatyki ćwiczenia lista nr 3b
3 ćwiczenia BADANIE asfaltów
więcej podobnych podstron