CHEMIA ANALITYCZNA
(EGZAMIN – prof. dr hab. J. Kurzawa)
Mol jest to miara liczności. Jest to taka ilość substancji, która zawiera tyle atomów (cząstek, jonów) ile atomów węgla znajduje się w 12 g atomu izotopu węgla C12, czyli 6,02 ⋅ 1023 (liczba Avogadro).
2. Co jest jednostką masy atomowej?
Masa atomowa to miara jednego mola substancji wyrażona w gramach, jest liczbowo równa masie atomowej lub cząsteczkowej [g/mol].
Masa atomowa – jest to stosunek średniej masy atomu danego pierwiastka do 1/12 masy atomu węgla C12.
Innymi słowy jest to masa atomu wyrażona w jednostkach równych 1/12 masy atomu C12. Wyrażona w jednostkach masy atomowej.
Jednostka masy atomowej – do oznaczania mas cząstek elementarnych, atomów i innych strukturalnych składników materii stosuje się atomową jednostkę masy oznaczoną symbolem u – jest to 1/12 masy atomu węgla C12. Przeliczanie atomowej jednostki masy na jednostki układu SI umożliwia wzór: 1 6,02 · 10
1,66 · 10
3. Prawo zachowania masy.
4. Prawo działania mas + wyprowadzić wzór na stałą równowagi.
5. Co to jest dysocjacja elektrolityczna?
Dysocjacja elektrolityczna – proces rozpadu związku na składniki prostsze; rozpad związku na jony pod wpływem wody w jej wyniku powstaje elektrolit.
CuSO
Cu SO
Położenie równowagi reakcji dysocjacji:
(
K !"#$%!&' %
"#&'
[ termiczna – pod wpływem temperatury, np. wapno palone CaO, wapno gaszone Ca(OH)2]
6. Co to jest stała i stopień dysocjacji? Wyprowadź wzór między stałą i stopniem dysocjacji.
7. Co to jest elektroliza?
Elektroliza – wędrówka jonów do odpowiednich elektrod pod wpływem przepływu przez niego prądu elektrycznego.
8. Co to jest stopień dysocjacji?
9. Kwasy i zasady wg teorii Brönsteda?
Teoria protonowa definiuje kwasy jako donory protonów, zaś zasady, jako akceptory i postuluje reakcje kwas-zasada jako reakcje 2 sprzężonych par.
kwas1 + zasada2 ↔ kwas2 + zasada1
Kwas oddaje proton i powstaje z niego zasada.
Kwas
Zasada
HO
↔
H O H (proton)
sprzężona zasada pochodząca od kwasu
CH3COOH
↔
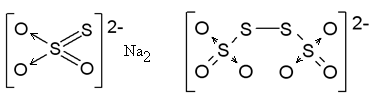
CH3COO- + proton
NH
↔
NH3 + p
H
2CO3
↔
HCO + p
HSO
↔
SO + p
Al-H O./
↔
Al-H O.0OH + p
CH
NH
↔
CH3NH2 + p
HA
↔
A- + H+
kwas1
↔
zasada1 + proton
HA
↔
A- + H+
zasada2 + proton
↔
kwas2
B + H+
↔
BH+
kwas1 + zasada2
↔
kwas2 + zasada1
HA + B
↔
BH+ + A-
CH3COOH + H2O
↔
H3O+ + CH3COO-
H
2SO4 + H2O
H3O+ + HSO
H
2O + NH3
↔
NH + OH-
Mocniejsze kwasy chętniej niż słabe pozbywają się protonów. Zasada mocniejsza chętniej niż słabsza łączy się z protonem. Im mocniejszy kwas, tym słabsza sprzężona z nim zasada. Kwasy to substancje o większych właściwościach protonodonorowych niż woda, zasady także (woda jest najsłabszym kwasem i zasadą). Jeżeli substancja ma silniejsze właściwości od wody to powstają jony H3O+ (kwas).
kwasy:
- cząsteczkowe: cząsteczki obojętne HCl, H2O
- jonowe:
• jony dodatnie, kwasy kationowe H
3O+, NH , Al-H O./, akwakompleksy (uwodnione jony metali),
• jony ujemne: HS-, H
PO , aniony kwasów wieloprotonowych
zasady:
- cząsteczkowe: H2O, NH3, NH4OH, CH3NH2
- jonowe: jony ujemne: OH-, N
, CN-, HSO
10. Czy anion może być kwasem? Uzasadnij.
Wg teorii Brönsteda kwas to donor protonu zasada akceptor protonu, dlatego opierając się na tej teorii można stwierdzić, że anion jest kwasem. Musi istnieć sprzężona para red-oks, dlatego niektóre aniony kwasów wieloprotonowych mogą zachowywać się jak kwas w sprzężonej parze, np.: HSO
H O 2 HO SO
kwas1 + zasada2 ↔ kwas2 + zasada1
Wieloprotonowe kwasy zgodnie z teorią Brönsteda reagują z wodą tworząc amfoteryczne anionowe zasady, które mogą reagować dalej z wodą jako kwasy, np. H3PO4
kwas1 + zasada2 ↔ kwas2 + zasada1
H
PO H O 2 HO H PO
H
PO H O 2 HO HPO
HPO
H O 2 HO PO - jest to już tylko anionowa zasada nie może reagować z wodą jako kwas
Moc kwasów (elektrolitów odczepiających jon H+) i zasad (elektrolitów przyłączających jon H+) w roztworach wodnych jest określona wielkością stałych równowagi Ka i Kb odpowiednio dla procesów przeniesienia protonu z cząsteczki kwasu na cząsteczkę wody w celu utworzenia H3O+ jak i procesów przeniesienia protonu z cząsteczki zasady z tworzeniem jonu wodorotlenowego OH-.
6
34 3
7
5 2 35 4
A – cząsteczka kwasu
6
8 3
9
5 2 53 83
B – cząsteczka zasady
Im większa wartość stałej Ka i Kb tym mocniejszy kwas lub zasada. Moc kwasów i zasad jest bardzo zróżnicowana. Dla kwasów mocnych HClO4, HCl i mocnych zasad KOH, NaOH zakłada się całkowitą dysocjację w roztworach wodnych.
Dla wielu kwasów nieorganicznych (H2CO3, H2S, HNO2, HClO, CH3COOH, bursztynowego) i zasad (amin, pirydyn, anilin, NH3) wartości stałych Ka i Kb są niewielkie, dlatego stopień dysocjacji, który w tym przypadku oznacza stopień przereagowania kwasu lub zasady w reakcji przeniesienia protonu na lub z wody jest również
niewielki, zwykle mniejszy niż 5. Oznacza to, że dla kwasów i zasad słabszych niż 5 % ogólnej liczby cząstek…
12. Co to są bufory? Uzasadnij na podstawie buforu octanowego, dlaczego po dodaniu kwasu i zasady pH nie zmienia się?
13. Oznaczanie Na2CO3 i NaHCO3 metodą Wardera (reakcje, dochodzenie do wyniku)?
Otrzymujemy do analizy roztwór rozcieńczony. Badany roztwór miareczkuje się kwasem wobec fenoloftaleiny (dla odbarwienia). Odmiareczkowuje się przy tym całą ilość wodorowęglanu i całość węglanu (węglan przechodzi w wodorowęglan) – I.
;<=>?>;@?A?<B=A
I Na CO HCl CDDDDDDDDD NaHCO NaCl
II NaHCO HCl >EA=ż G<@H?>IH
CDDDDDDDDDD NaCl CO J H O
Gdy cały węglan przejdzie w wodorowęglan pH ok. 8,3 następuje odbarwienie fenoloftaleiny. Następnie dodaje się oranżu metylowego i miareczkuje kwasem do zmiany barwy (reakcja II).
Oblicza się zawartość węglanów i wodorowęglanów w mg/l wody. Oznaczając obok siebie Na2CO3 najpierw badany roztwór miareczkuje HCl wobec fenoloftaleiny do odbarwiania się roztworu (a ml) co odpowiada 2 a ml kwasu. Następnie po dodaniu oranżu metylowego badany r-r miareczkuje się do pierwszej zmiany barwy wskaźnika (b ml). Zmiana te następuje, gdy cały NaHCO3 (zarówno powstały z Na2CO3 oraz ten z próbki pierwotnej) zostanie miareczkowany). Zawartość Na2CO3 w próbce odpowiada 2 a ml kwasu NaHCO3
(b - a) ml.
Oblicza się zawartość:
Na CO: 2a · c"? · MNA
· 10 P ml
"O
NaHCO: -b S a. · c"? · MNA" · 10 P mg/l
O
14. Jak przygotować 2 dm3 0,2 M roztworu HCl z 36 % r-ru HCl
d = 1,18 g/dm3
1 mol – 36,5 g HCl
36 g - 100 g
2 dm3 – 0,2 m
0,4 mola – x g HCl
14,6 g – x g r-ru
0,2 m – 1 dm3
x = 14,6 g HCl
x g = 40,5 g r-ru
0,4 m - 2 dm3
d G
WX
v G
A
v Z,0
[,[\
v = 34,37
Należy wprowadzić 34,37 cm3 36 % HCl i dopełnić wodą destylowaną do 2 dm3.
15. Obliczyć stężenie molowe r-ru H2SO4 50 % o d = 1,4 g/dm3
50 % 50 g w 100 g r-ru
50 g substancji – 71,428
1 mol - 98,06 g H2SO4
100 g – x ml
x g – 1000 ml
x mol – 700,006 g H2SO4
1,4 g – 1 ml
x = 700,006 g substancji
x = 7,143 g H2SO4
x = 71,428 ml
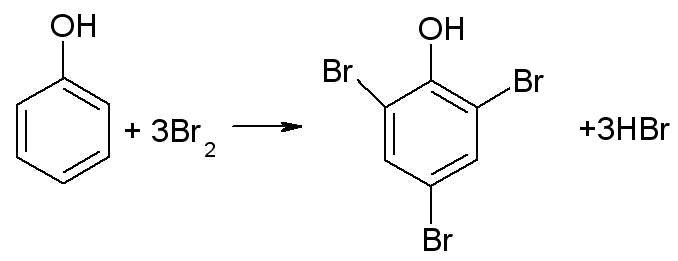
16. Oznaczanie fenolu metodą bromometryczną?
Otrzymany r-r rozcieńczamy wodą destylowaną, a następnie dodajemy znane objętości KBrO3, KBr i HCl.
Zachodzi reakcja:
KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O
2Br0 5ea b BrZ
2Br S 2ea b BrZ reduktor!
Reakcja bromowania fenolu:
trójbromofenol (żółty osad)
Następnie wyznacza się ile bromu zostało, brom ilościowo zamienia się na jod; zachodzi reakcja: Br2 + 2KI → 2KBr + I2
BrZ 2ea b 2Br
I S 2ea b IZ reduktor!
Następnie otrzymany jod miareczkuje się Na2S2O3 do odbarwienia (lekko żółty) I2 + 2Na2S2O3 → 2NaI + Na2S4O6
IZ 2ea b 2I
2S
O S 2ea b SO/ reduktor!
Następnie dodaje się skrobi (niebieski) i miareczkuje. Ilość zużytego Na2S2O3 podstawia się do wzoru: x = 10 ⋅ (25 ⋅ 0,1 – v ⋅ 0,1) ⋅15,67
v – objętość 0,1 N Na2S2O3
Oznaczoną zawartość fenolu podaje się w mg/l.
17. Reakcje utleniania i redukcji kwasu szczawiowego H2S2O4 nadmanganianem potasu. Reakcja autokatalizy.
2KMnO4 + 5H2C2O4 + 3H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O
Mne 5ea b Mn |· 2g
C
O S 2ea b 2CO |· 5g reduktor!
18. Napisz reduktory z pytania 17 i 18.
Reduktor - czynnik redukujący, oddaje elektrony i ulega reakcji utleniania, zwiększa swoja wartościowość.
19. Uzupełnij współczynniki reakcji jeżeli reakcja zachodzi.
20. Co to jest liczba koordynacyjna?
Kompleks – składa się z atomu centralnego i ligandów.
Liczba koordynacyjna – liczba wiązań koordynacyjnych utworzonych przez atom centralny (liczba ligandów), które są zgrupowane w kompleksie dookoła atomu centralnego, najczęściej 4 lub 6. Liczba koordynacyjna, np.: 6: Ni-NH
./
4: HgI
2: Ag-CN.
21. Co to jest EDTA i jak reaguje z metalami?
22. Jak określić trwałość kompleksów?
23. Jak działają wskaźniki w kompleksometrii?
24. Oznaczanie kompleksometryczne wapnia i magnezu w próbce zawierającej oba te jony?
25. Efekt wspólnego jonu, jak następuje zwiększanie i zmniejszanie rozpuszczalności?
26. Efekt solny, jak następuje zwiększanie i zmniejszanie rozpuszczalności?
27. Napisz reakcje metody Volharda, kiedy się ją stosuje?
28. Wpływ pH na przebieg reakcji red-oks.
Im większe pH tym reakcja red-oks zachodzi szybciej.
MnO 8H 5ea b Mn 4H O
utl[ mH nea b red[ G H
O
E EZ Z,Z0m log #@?o!$%G
=
E<po
równanie Nernsta
E EZ Z,Z0m log #@?o Z,Z0m·G log H
=
E<po
=
log H SpH
E EZ Z,Z0m log #@?o S Z,Z0m·G pH
=
E<po
=
W miarę jak wzrasta pH r-ru, potencjał się zmniejsza. Gdy w reakcji biorą udział jony H+, wzrost kwasowości powoduje wzrost potencjału. Gdy w reakcji biorą udział jony OH- to im większe pH, tym potencjał jest większy.
29. Elektroda wodorowa.
Blaszka platynowa pokryta czernią platynową obmywana gazowym wodorem.
H b 2H 2ea
E EZ Z,Z0m log !$%
r
[H+] = 1
PH2 = 1
E = E0 = 0
Dla tych parametrów potencjał elektrody wodoru przyjęto za 0.
Zależność między potencjałem elektrody wodoru a pH
E EZ Z,Z0m log !$% Z,Z0m 2log H S0059 pH
s
30. Stała równowagi reakcji red-oks.
Związek między stałą równowagi a potencjałem reakcji red-oks:
uvw[ x 2 uvw x[
y z{| }~o
}~ z{|o
uvw[ 2 x[ [v
x v 2 uvw
W stanie równowagi E1 = E2
E
Z
[ E[ Z,Z0m log #@?o
=o
E<po
E
Z
E Z,Z0m log #@?
=
E<p
E1 – E2 = 0
-EZ
Z
S E[ . Z,Z0m log E<p #@?o 0
=o=
#@? E<po
czyli:
xy -Z
Z
S [ . o
Z,Z0m
Im większa różnica potencjałów tym większa wartość stałej reakcji.
31. Opisz S GAA A@>G>IA
[/?B A A@>G>IA
32. Ka kwasu wynosi 10-5. W jakim stopniu kwas jest zdysocjowany w r-rze o stężeniu 0,1 M?
y
[
100 Z,[
[
-0,1 - 10-5α + 10-5 = 0
α = 10 %
∆ = 10-10 + 0,4 ⋅ 10-5
√∆ 0,002
α[ [Z(Z,ZZ
Z,
α [Z(Z,ZZ 0,1
Z,
33. Co to jest siła jonowa, aktywność jonów?
Aktywność jonowa – matematyczna zdolność jonów do reagowania, umożliwia określenie efektywnego stężenia jonów
Siła jonowa – moc jonowa, miara oddziaływań elektrostatycznych wszystkich jonów w r-rze
0,5 ∑
34. Reakcje KMnO4 w środowisku kwaśnym z NaNO2, H2O2 i H2C2O4.
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10CO2 + 8H2O
Mne 0<a
b Mn |2g
C <a
C C|5g|2g reduktor!
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
M7+ +5v→ M2+ |· 2g
2O- - 2v→ 2OZ |· 5g reduktor!
2KMnO4 + 5NaNO2 + 2H2SO4 → 2MnSO4 + K2SO4 + 5NaNO3 + 3H2O
Mn b Mn S 5ea|2g
N b N 2ea|5g
35. Fabryka wypuściła do ścieków FeCl3, jaki będzie odczyn r-ru?
FeCl3 ↔ Fe3+ + 3Cl-
Fe3+ + H2O ↔ Fe(OH)2+ + H+ ← środowisko kwaśne
36. Wzór tiosiarczanu sodu. S
O , SO/
37. Na jedno miareczkowanie zużyto 12 ml HCl, a na drugie 2,2 ml HCl. Ile było Na2CO3 i NaHCO3?
Na
· 10 46,64 mg/l
2CO3: 2a · c"? · MNA"O
NaHCO
· 10 164,64 mg/l
3: -b S a.c"? · MNA"O
MNA
53
"O
c"? 0,02
MNA" 84
O
38. Jak należy przygotować 5 litrów 0,5 M r-ru H2SO4 (98,06) o gęstości d = 1,49 g/ml 0,5 mola H2SO4 – 1000 ml
1 mol H2SO4 – 98 g
mwody = 7450 g – 245g = 7205 g
x moli - 5000 ml
2,5 mola – x
V 7205 ml
x = 2,5 mola
x = 245 g
m
r-ru = ρ ⋅ V = 1,49 g/ml ⋅ 5000 ml = 7450 g
Trzeba odważyć 245 g H2SO4 i dodać 7205 ml wody.
39. Do 1000 ml dodano 50 g substancji. Objętość r-ru wzrosła o 25 ml. Obliczyć stężenie molowe i procentowe.
Miareczkowanie w obecności fenoloftaleiny.
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaHCO3 + NaCl
Zużyto a ml HCl.
Miareczkowanie w obecności oranżu metylowego
NaHCO3 + HCl → NaCl + H2O + CO2
Zużyto b ml HCl
NaOH: (a – b)
Na2CO3: 2 b
Co to jest dysocjacja elektrolityczna?
Jest to rozpad substancji na składniki (czynniki) prostsze. W chemii rozróżniamy dysocjację termiczną – rozpad związku chemicznego na składniki prostsze pod wpływem temperatury. W wysokich temperaturach mogą powstawać wolne atomy. Rozkład pod wpływem temperatury, np. technika otrzymywania wapna palonego.
5 ~{.
CDD 5 5
związki chemiczne ulegające dysocjacji nazywamy elektrolitami
Dysocjacja elektrolityczna – w wyniku tej dysocjacji otrzymuje się elektrolit, który przewodzi prąd (rozpad związków chemicznych na składniki prostsze w wyniku czego otrzymuje się elektrolit), np.:
5
CD 5
Położenie równowagi reakcji dysocjacji elektrolitycznej:
(
y !}$%! ' %
} '
Stała K w warunkach laboratoryjnych zależy tylko od temperatury.
Co to jest stała dysocjacji?
Stała dysocjacji K to stosunek iloczynu stężeń jonów do stężenia cząsteczek niezdysocjowanych. Stała dysocjacji w danej temperaturze jest wielkością stałą, a wraz ze wzrostem temperatury jej wartość na ogół
wzrasta:
y ¡ ¢
¡¢
Jeżeli w trakcie rozpuszczania elektrolit słaby ulega dysocjacji zgodnie z równaniem AB ↔ A + B to stała równowagi tej reakcji nosi nazwę stałej dysocjacji.
Co to jest stopień dysocjacji?
Dysocjację opisuje się także za pomocą stopnia dysocjacji α, który mówi nam, jaka część substancji została zdysocjowana.
£
¤¥ść ¨©ą«~{¨©{¬ ©|«¥¨®¥¯¨°
|¥ ¥±ó{® ¤¨©³ ¨©ą«~{¨©{¬ ¯ z¥©~¯¥z©{
α przyjmuje max. wartość 1 (100 %) dla mocnych elektrolitów, dla słabych wartości zbliżają się do 0.
Dla słabych elektrolitów stopień dysocjacji zależy od stężenia, w miarę rozcieńczenia roztworu α rośnie z tego powodu nie może służyć do wyznaczania mocy kwasów i zasad.
Stopień dysocjacji jest ściśle powiązany ze stałą dysocjacji K (prawo rozcieńczeń Ostwalda). Stopień dysocjacji zależy nie tylko od stałej dysocjacji K danej substancji, ale także od jej stężenia początkowego.
Zależność stałej dysocjacji K od stopnia dysocjacji α
CH3COOH + H2O ↔ CH3COO- + H3O+ jon hydroniowy
y O(!O$% ´¨·´¨ ´¨·´¨ ´¨ ´¨
prawo rozcie
ńczeń Ostwalda
O
¨´¨
¨-[´.
¨´¨
[´
gdy α > 1 % → y ´.
[´
Dla bardzo małych wartości stopnia dysocjacji α, wzór ulega uproszczeniu α < 0,01 → K = α2c i dalej £ µ6.
¨
a) osady koloidalne
- osady serowate (chlorek srebra)
- osady galaretowate (wodorotlenek żelaza)
• hydrofilowe (emulsoidy) – chętnie przyłączają cząsteczki wody, np. uwodniony kw. krzemowy,
• hydrofobowe (suspenso idy) – nie mają powinowactwa do wody, np. siarczek arsenowy W procesie tworzenia się osadu koloidalnego cząsteczki trudno rozpuszczalnej substancji łączą się w zespoły (aglomeraty), o ładunkach jednoimiennych, które tworzą zol poprzez wzajemne odpychanie. Pod wpływem elektrolitu cząstki zostają zobojętnione i następuje koagulacja zolu w żel, czyli strącanie się osadu koloidalnego odpowiedniego do odsączenia, odwirowania i do przemycia.
Osady koloidalne mają rozbudowaną powierzchnię i wykazują dużą zdolność do adsorbowania na swej powierzchni innych jonów obecnych w r-rze, na powierzchni do zanieczyszczenia tych osadów. Oczyszczenie jest możliwe przez podwójne strącanie. Polega ono na rozpuszczaniu strąconego i odmytego od r-ru macierzystego osadu i powtórnym strąceniu go tym samym odczynnikiem strącającym.
b) osady krystaliczne
- charakteryzują się uporządkowaną budową krystaliczną, np. siarczan baru, fosforan amonowo-magnezowy.
W przypadku strącania osadów krystalicznych postać drobnokrystaliczna czy grubokrystaliczna zależy w znacznej mierze od sposobu strącania. Najpierw tworzą się po przekroczeniu iloczynu rozpuszczalności zarodki krystaliczne, które wzrastają do rozmiarów właściwych kryształów. Jeżeli istnieją warunki strącania umożliwiające powstawanie małej liczby zarodków, które wzrastają powoli, otrzymuje się osad grubokrystaliczny
czysty
i
o
prawidłowej
sieci
krystalicznej.
Warunki
powstawania
czystych
grubokrystalicznych osadów zapewnia mały nadmiar jonów strąceniowych, dobre mieszanie r-ru, powolne dodawanie odczynnika i wysoka temperatura.
Osady krystaliczne są zanieczyszczone znajdującymi się w r-rze obcymi jonami wskutek adsorpcji, okluzji i w wyniku tworzenia osadów mieszanych.
Tworzenie osadu – polega na przechodzeniu osadu drobnokrystalicznego w osad o większych kryształach podczas dłuższego pozostawiania osadu w r-rze mocniejszym. Szybciej – gdy podgrzewamy.
Oznaczanie wapnia i magnezu
Oznaczanie wapnia – mureksyt (NaOH + H2O + roztwór) – miareczkowanie EDTA x = v1 ⋅ cEDTA ⋅ 40,08 ⋅ 10 =
oznaczanie Mg – EDTA – miareczkuje; czerń eriochromowa + (bufor amoniakalny + roztwór + woda destylowana)
m = (v2 – v1) ⋅ 24,3 ⋅10 ⋅ cEDTA =
reakcje:
Ca , Mg In #;>E, s¶[Z
CDDDDDDDDD Ca S In, Mg S In EDTA b CaEDTA, MgEDTA In
Ca In s¶[
CDDD Ca S In EDTA In
Twardość ogólna wody – miara ilości rozpuszczonych soli Ca2+ i Mg2+
¹¥± º[ · »¼½¡ · 56,08 · 10 podajemy w [°n] stopniach niemieckich równych 10 mg CaO w 1 dm3 H2O
---
Zn + 2HNO3 → Zn(NO3)2 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Cu + HCl → x
Cu + 4HNO3 → Cu(NO3)2 + NO2 + 2H2O
Fe + H2SO4 → FeSO4 + H2↑
Wyszukiwarka
Podobne podstrony:
Chemia Analityczna Egzamin
Analka - egzamin zestawy, Chemia analityczna, Egzamin
Chemia analityczna egzamin, Chemia analityczna
CHEMIA ANALITYCZNA egzamin
Chemia analityczna egzamin
EGZAMIN TESTOWY Z CHEMII ANALITYCZNEJ SEMESTR III-1, PK, chemia, analityczna
EGZAMIN ANALIZA ŚLADOWA-2002, chemia analityczna
CHEMIA ANALITYCZNA Pytania na Egzamin, Chemia analityczna, Od Krzemi, Nowy folder
egz, e (4), Egzamin Chemia analityczna
analityczna egzamin pohl, Studia PWr, IV semestr, Chemia analityczna, Wykład (Pohl), Egzamin
pytania-chemia, POLITECHNIKA ŁÓDZKA, Technologia żywności i żywienia człowieka, Sem I i II, Chemia o
Analityczna egzamin zesz - odp, PK, chemia, analityczna, Chemia analityczna sem. 34, Chemia analityc
EGZAMIN Z ANALITYCZNEJ(1), Chemia analityczna
EGZAMIN ANALIZA ŚLADOWA-2002(B), chemia analityczna
egzamin analityczna, analityka medyczna UMP 2014, chemia analityczna, kolokwium
więcej podobnych podstron