1.Na czym polega zjawisko amfoteryczności
Istnieje pewna grupa pierwiastków, których wodorotlenki i tlenki mają zdolność reagowania z mocnymi kwasami i mocnymi zasadami. Wodorotlenki tych metali w roztworach mocnych kwasów przejawiają właściwości słabych zasad, a w roztworach mocnych zasad są słabymi kwasami. Zjawisko to nosi nazwę amfoteryczności. Właściwości amfoteryczne posiadają niektóre metale grup głównych i przejściowych takie, jak np.: glin, cyna, ołów, arsen, antymon, cynk, chrom, mangan.
1) Al3+ + 3OH‾ → Al (OH)3 (↓)
- osad łatwo roztwarza się w nadmiarze zasady Al(OH)3 (↓) + OH‾ → [Al(OH)4]‾
- osad łatwo roztw. się również w rozcieńczonych kw. mineralnych
Al(OH)3 (↓) + 3H+ → Al3+ + 3H2O
2) Cr3+ + 3 OH‾ → Cr(OH)3 (↓)
Cr(OH)3 (↓) + OH‾ → [ Cr(OH)4 ]‾ - z nadmiarem zasady
[Cr(OH)4]‾ → Cr(OH)3 (↓) + OH‾ - r. roztw. w kw. (rozkł. do wodorotl.)
6.Jon żelaza (III) tworzy związki kompleksowe
Związki kompleksowe (inaczej kompleksy, związki koordynacyjne) - związki chemiczne, w których można wyróżnić jeden lub więcej atomów centralnych, otoczonych przez inne atomy lub ich grupy zwane ligandami, przy czym przynajmniej jedno wiązanie atomu centralnego z ligandem ma charakter wiązania koordynacyjnego.
Kompleksy powstają ze związków prostych, w wyniku przyłączenia jonów lub cząsteczek obecnych w środowisku reakcji, do atomów (metali) w innym związku. Połączenie następuje na zasadzie tworzenia wiązań koordynacyjnych (tj. donorowo-akceptorowych), dzięki obecności wolnych par elektronowych w wiążącym atomie liganda - ten atom liganda jest donorem, a atom centralny (metal), w pierwotnym związku prostym jest akceptorem pary elektronowej tworzącej nowe wiązanie.
Kompleks może być:
1) kationem
np.: [Cr(H2O)6]3+ kation h e k s a a k w a c h r o m u (III)
[Al(OH)(H2O)5]2+ kation p e n t a a k w a h y d r o k s o g l i n u (III)
2) anionem
np.: [Fe(CN)6]3- anion h e k s a c y j a n o ż e l a z i a n o w y (III)
(tradycyjnie nazywany: anion żelazocyjankowy)
[Fe(CN)6]4- anion h e k s a c y j a n o ż e l a z i a n o w y (II)
(tradycyjnie nazywany: anion żelazicyjankowy)
3) obojętną cząsteczką
np.: [Co(NO2)3(NH3)3] t r i a m i n a t r i n i t r o k o b a l t (III)
[Fe(CO)5] p e n t a k a r b o n y l ż e l a z o (0)
7.Wyjaśnij pojęcia
Analit jest to składnik próbki, który podlega oznaczaniu. Analit może być składnikiem roztworu, mieszaniny gazów, czy składnikiem ciała stałego. Przykładem mogą być odpowiednio jony chlorkowe oznaczane w roztworze soli kuchennej, tlen oznaczany w powietrzu, czy żelazo oznaczane w stali.
Matryca, składniki głównej próbki, inne niż składnik wykrywany lub oznaczany.
Próka przeznaczona do przeprowadzenia analiz nazywa się próbką do badań natomiast jej część przeznaczona w całości do jednego badania lub oznaczenia nazywa się próbką analityczna
10. Podaj skład mieszaniny magnezowej do czego jest ona wyko?
Mieszanina magnezowa - MgCl2 + NH3 • H2O + NH4Cl - wytrąca z roztworów krystaliczny osad. Stos. do wykrywania jonów fosforanowych (v) PO43 -
PO43‾ + Mg2+ + NH4+ → ↓ MgNH4PO4 ortofosforan (V) amonowomagnezu
11.Jaką rolę w reakcji „obrączki” spełnia roztwór siarczanu żelaza (II)
Napisz odpowiednie równania reakcji
Azotany (III) z zakwaszanym stężonym roztw. FeSO4 tworzą brunatne kompleksy kationowe nitrozylżelaza (II). W pierwszym etapie następuje redukcja anionów azotanowych (III) do tlenku azotu: ...................................
Powstający tlenek azotu reaguje z nadmiarem jonów żelaza (II) tworząc brunatny kompleks nitrozylżelaza (II) Fe2+ + NO → [Fe(NO)]2+
15 Krzywa miareczkowania słabego kwasu mocną zasadą
Miareczkowanie słabego kwasu mocną zasadą
Jest to krzywa obrazująca przebieg miareczkowania kwasu octowego mocną zasadą. Wskaźnik fenoloftaleina 8,3-10 pH Zmiana barwy z bezbarwnej w czerwoną. W początkowym punkcie (A) stężenie jonów wodorowych nie jest równe stężeniu molowemu kwasu, ponieważ miareczkowany kwas jest kwasem słabym a to oznacza, że jest w niewielkim stopniu zdysocjowany. Stężenie jonów wodorowych w tym przypadku zależy od stałej dysocjacji kwasu Ka i jego stężenia molowego cm(a).
16 Krzywa miareczkowania słabych zasad mocnym kwasem
Miareczkowanie słabych zasad mocnym kwasem Osiągnięcie punktu równowagi miareczkowania będzie określone przez punkt równoważnikowy dla pH < 7. Dla tego przypadku najodpowiedniejszym wskaznikiem jest czerwień metylowa, gdyż zmiana jej barwy zachodzi dokładnie w granicach skoku miareczkowania (pH = 6,2 - 4,2)
17. Krzywa miareczkowania mocnego kwasu mocną zasadą
Mocne zasady i mocne kwasy są całkowicie zdysocjowane, a więc stężenie jonów wodorowych jest praktycznie równe stężeniu kwasu.
18 Co decyduje o wielkości skoku miareczkowania
Skok miareczkowania
W pobliżu punktu równoważnikowego następuje gwałtowny skok pH po dodaniu niewielkiej ilości roztworu mianowanego. Różnice wartości pH przed osiągnięciem i po przekroczeniu punktu równoważnikowego wywołana niewielkim dodatkiem ilości odczynnika miareczkującego, nazywa się skokiem miareczkowania. Wielkość tego skoku zależy od stężenia substancji reagujących - jest on większy, gdy miareczkuje się roztwory o większym stężeniu.
20 Omów krzywą miareczkowania węglanu roztworem kwasu solnego
Węglan sodowy jest zasadą dwuprotonową, gdyż może przyłączyć dwa protony.
Wodny roztwór Na2CO3 posiada pH około 12. Podczas miareczkowania
węglanu sodowego za pomocą roztworu HCl zachodzą dwie reakcje:
Na2CO3 + HCl → NaHCO3 + NaCl
NaHCO3 + HCl → NaCl + H2CO3 → NaCl + H2O + CO2
Krzywa miareczkowania węglanu sodowego wykazuje dwa skoki miareczkowania,
drugi jest znacznie wyraźniejszy od pierwszego. Pierwszy punkt równowaŜności
odpowiada zobojętnieniu węglanu do wodorowęglanu i następuje
w roztworze o wartości pH 8,3. Drugi punkt równowaŜności odpowiada powstaniu
CO2 i następuje w roztworze o wartości pH 4.
21 Nastawianie miana NaOH
Kwas solny -
NaOH + HClNaCl + H2O
Kwas szczawiowy
H2C2O4 + 2NaOH
Na2C2O4 + 2H2O
22 Nastawianie miana HCl
Bezwodny węglan sodu Na2CO3
Na2CO3 + 2HCl
+ 2NaCl + CO2 + H2O
Wodorowęglan potasu KHCO3
KHCO3 + HCl
KCl + CO2 + H2O
24 Omów zasadę działania wskaźników w metodzie
Oznaczanie chlorkow metoda Mohra:
metoda Mohra polega na bezposrednim miareczkowaniu obojetnego roztowru chlorku mianowanym roztworem AgNO3, w obecnosci chromianu (VI) potasu jako wskaznika
w czasie miareczkowania wytraca się najpierw trudno rozpuszczalny osad AgCl:
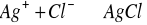
gdy praktycznie cala ilosc chlorkow Cl- zostanie wytracona, nadmiar roztworu AgNO3 wytraca chromian srebra, którego brunatnoczerwone zabarwienie wskazuje na koniec miareczkowania:
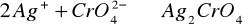
odczyn roztworu powinien być obojetny ponieważ w roztworze kwasnym jony wodorowe lacza się z jonami CrO42-, tworzac jony wodorochromianu (VI) HCrO4- i dwuchromianu (VI):
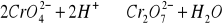
powoduje to zmniejszenie stezenia jonow chromianowych (VI) a w bardziej kwasnych roztworach osad nie wytraca się wcale
chromian (VI) srebra jako sol slabego kwasu ulega rozpuszczeniu w kwasnych roztworach; w roztworach silnie zasadowych przy pH> 10,5 nastepuje wytracenie osadu Ag2O:
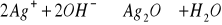
metody Mohra nie można stosowac do oznaczania chlorkow w obecnosci anionow tworzacych w roztworach obojetnych trudno rozpuszczalne sole srebrowe (Br-, I-. PO43-, CO32-, AsO43-), kationow tworzacych trudno rozpuszczalne chromiany (Ba2+ i Pb2+) oraz substancji redukujacych Ag+ do srebra metalicznego (np. jony Fe2+).
metody Mohra można uzywac do oznaczania bromkow
Oznaczanie chlorkow metoda Volharda:
metoda Volharda polega na dodaniu nadmiaru mianowanego roztworu AgNO3 do zakwaszonego kwasem azotowym roztworu chlorkow; nadmiar AgNO3 odmiareczkowuje się mianowanym roztworem KSCN lub NH4SCN w obecnosci ałunu żelazowo-amonowego jako wskaźnika.
po wytraceniu srebra kropla nadmiaru roztworu tiocyjanianu powoduje powstanie rozowego zabrwienia, ponieważ tworza się czerwone kompleksy zelaza o wzorze ogolnym Fe(SCN)n3-n, w którym liczba koordynacyjna n przyjmuje wartosci od 1 do 6; sklad tych kompleksow zalezy od stezenia jonow tiocyjanianow, najczesciej jednak powstaje najprostszy kompleks FeSCN2+
zawartosc chlorku oblicza się z roznicy poczatkowej objetosci roztworu AgNO3 i objetosci dodanego nadmiaru, która okresla się na podstawie zuzytej objetosci roztworu tiocyjanianu
w metodzie Volharda miareczkowany roztwor znajduje się w zetknieciu z dwoma osadami: AgCl i AgSCN o roznej rozpuszczalnosci przy czym AgSCN jest trudniej rozpuszczalny niż AgCl; po odmiareczkowaniu wiec AgNO3 tiocyjanianem, nadmiar dodanego rodanku amonu zaczyna reagowac z uprzednio wytraconym AgCl, na skutek czego roztwor się odbarwia:

barwa kompleksu FeSCN2+ zanika w ciagu ok. minuty, dalszy dodatek rodanku amonu przywraca chwilowo rozowe zabarwienie, które nastepnie zanika na skutek powyzszej reakcji; dlatego zuzycie tiocyjanianu będzie znacznie wieksze niż jest to konieczne do osiagniecia PR
aby zapobiec reakcji tiocyjanianu z AgCl można zastosowac niewielka ilosc nitrobenzenu; nitrobenzen ulega silnej adsorpcji na powierzchni czastek osadu, lepiej zwilza osad niż woda i oddziela faze stala od roztworu wodnego, uniemozliwiajac tym samym reakcje jonow SCN- z AgCl
metoda Volharda można także oznaczac bromki, jodki i tiocyjaniany, duza zaleta tej metody jest mozliwosc miareczkowania chlorkow w srodowisku kwasnym
Oznaczanie chlorkow w obecnosci wskaznikow adsorpcyjnych metoda Fajansa i Hassela
metoda Fajansa i Hassela polega na wykorzystaniu właściwości adsorpcyjnych fluorowcowych zwiazkow srebra; w PR miareczkowania nastepuje zmiana ladunku na powierzchni osadu i adsorpcja wskaznika, czemu towarzyszy zmiana zabarwienia
zmiana ladunku na powierzchni osadu jest zwiazana z rodzajem ladunku adsorbowanych jonow, np. podczas oznaczania chlorowcow osad ma ladunek ujemny na skutek adsorpcji jonow chlorowcow, sklad osadu można wyrazic wzorem:
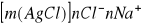
po zakonczonym miareczkowaniu, kiedy w roztworze znajduje się nadmiar jonow Ag+, one przede wszystkim, jako jony wspolne z osadem ulegaja adsorpcji i powierzchnia osadu ma ladunek dodatni
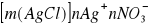
warstwa przeciwjonow czyli Na+ i NO3- jest adsorbowana slabo i może być latwo zastapiona przez inne jony
silniej od jonow azotanowych sa adsorbowane aniony wskaznikow fluoresceiny, tetrabromofluoresceiny (eozyny), dichlorofluoresceiny
zastapienie anionu azotanu przez anion fluoresceiny, która jest bardzo slabym kwasem, jest zwiazane z powstaniem na powierzchni osadu zabarwionego na kolor czerwony zwiazku srebra z fluoresceina
jeżeli do takiego roztworu dodac nadmiar jonow chlorkowych, to osad odbarwi się, ponieważ zamiast jonow Ag+ zostana zaadsorbowane jony Cl- i nastapi desorpcja jonow fluoresceiny
tak wiec wsazniki adsorpcyjne wykazuja zmiane barwy nie roztworu, lecz powierzchni wytraconego osadu
25 Jakie roztwory mianowane używane są w agentometrii
Argentometria to przykład analizy strąceniowej, którą określa się mianem precypitometrii. W analizie strąceniowej, w reakcji między składnikiem oznaczanym a roztworem mianowanym, zachodzi reakcja strącania osadu. Argentometrię można wykonać dwoma metodami
Produktem reakcji strącania jest związek srebra w postaci odpowiedniej soli. Metodami argentometrycznymi można oznaczać zawartość w roztworze jonów: chlorkowych, bromkowych, jodkowych, rodankowych, fosforanowych lub kationu srebra.
26 Kompleksony.
kompleksony - grupa kwasow aminopolikarboksylowych, pochodne kwasu iminodioctowego
kompleksony tworza bardzo trwale zwiazki kompleksowe niemal ze wszystkimi kationami wielowartosciowymi
najbardziej znane kompleksony to:
komplekson I czyli kwas nitrylotrioctowy (NTA)
komplekson II czyli kwas etylenodiaminotetraoctowy (EDTA), nazwa handlowa kwas wersenowy;
komplekson III czyli sol dwusodowa EDTA - Na2H2Y ; ma najwieksze znaczenie ze wszystkich kompleksonow, w porownaniu z kompleksonem II oznacza się on wieksza rozpuszczalnoscia w wodzie
27 Zasada działania metalowskaźników
Metalowskazniki można podzielic na trzy grupy
Grupa I sa to zwiazki praktycznie bezbarwne, np. kwas salicylowy czy jodek potasu lub tiomocznik; zwiazki te reaguja z kationami tworzac barwne kompleksy, np. kwas salicylowy reagujac z jonami żelaza (III) tworzy kompleksy, których barwa zalezy od pH; w srodowisku bardzo kwasnym powstaje fioletowy kompleks, przy pH 4 pomaranczowoczerwony, a przy pH 9 jasnozolty
Grupa II sa to zwiazki które reagujac z kationem powoduja zmetnienie, np. kwas szczawiowy dla jonow wapnia, lub tworza zabarwione, nierozpuszczalne lub koloidalne laki (np. galocyjanina dla galu)
Grupa III czyli tzw. wskazniki metalochromowe, sa to barwniki organiczne zdolne do tworzenia kompleksow z metalami, przy czym reakcji towarzyszy zmiana zabarwienia, przyklady: mureksyd, czern eriochromowa T, kalces
Dzialanie wskaznikow metalochromowych można wyjasnic np. dla kompleksonometrycznego oznaczania magnezu, z którym czern eriochromowa T tworzy czerwony kompleks: ![]()
; w czasie miareczkowania nastepuje zmiana barwy z czerwonej na niebieska, charakterystyczna dla jonow czerni eriochromowej: ![]()
. Wydzielajace się jony wodorowe zostaja zwiazane przez bufor
28. Zasada działania miareczkowania odwrotnego
Miareczkowanie odwrotne stosuje się w przypadku oznaczania metali, których kompleksy z EDTA tworzą się powoli (mp. glinu, chromu(III)), gdy nie można dobrać odpowiedniego wskaźnika do miareczkowania bezpośredniego lub gdy oznaczany metal mógłby strącać się (np. hydrolizować) przy pH wymaganym przy miareczkowaniu bezpośrednim. Miareczkowanie odwrotne polega na tym, że do badanego roztworu wprowadza się nadmiar roztworu EDTA, po czym nie związaną część odczynnika odmiareczkowuje się mianowanym (wzorcowym) roztworem odpowiedniego metalu (najczęściej cynku lub magnezu).
Jest to jedna z metod pośrednich kompleksometrycznych. Oznaczenie polega na dodaniu do roztworu analitu (M2+), nadmiaru mianowanego roztworu MgSO4 lub ZnSO4 wobec wskaźnika HJnd2-
M2+ + H2Y2‾ → [MY]2‾ + 2H+ (w roztw.obecny nadmiar H2Y2- i wolny HJnd2-
Miareczkowanie zapisujemy - przed PK: H2Y2‾ + Mg2+ → [MgY]2‾ + 2H‾
Przed PK: HJnd2‾ + Mg2+ → [MgJnd]‾ + H+
W tym przypadku zmiana barwy jest odwrotna niż w miareczkowaniu bezpośrednim początkowo roztwór miał zabarwienie wolnego wskaźnika, a w PK - zabarwienie kompleksowe z kationem, którego solą miareczkowany jest nadmiar Na2H2EDTA
29. W jaki sposób możemy kompleksometrycznie oznaczyć aniony?
Pośrednie oznaczanie anionów polega na tym, że oznaczony anion strąca się roztw. odpowiedniego kationu, o znanym stęż., dodanego w ściśle określonej objętości. Nadmiar użytego r-ru kationu w przesączu po oddzieleniu osadu odmiareczkowuje się mianowanym roztw. EDTA. W ten sposób oznacza się np. siarczany stosując do ich strącania r-r chlorku baru.
30 Na jakie subst. wzorcowe nastawia się miano EDTA
Mianowany roztwor EDTA:
- substancje wzorcowe do nastawiania miana: weglan wapnia, chlorek olowiu (II), siarczan (VI) magnezu, tlenek magnezu lub tlenek cynku, magnez, miedz, nikiel, cynk, kadm
31 Wskaźniki stosowane w redoksometri
Wskaźniki stosowane w redoksymetrii
Wskaźniki odwracalne, które w obecności nadmiaru utleniacza przechodzą w formę utlenioną, a w obecności nadmiaru reduktora w formę zredukowaną. Forma utleniona wskaźnika jest inaczej zabarwiona niż postać zredukowana. Np.
Safranina T: p.utl.: czerwona; p. zred. bezbarwna
Błękit metylowy: zielononiebieski:, bezbarwna
Ferroina: jasnoniebieska: czerwona
Często PK wskazuje zabarwienie lub odbarwienie roztw. miareczkowanego wskutek nadmiaru titranta np. miareczk. manganometryczne wskaźnikiem jest sam jon MnO4‾ (nadmiar zabarwia r-r na różowofioletowo) W miareczk. jodometrycznym wskaźnikiem jest skrobia, tworząca z jodem zw. addycyjny o intensywnie granatowym zabarwieniu,znikającym w PK.
Wyszukiwarka
Podobne podstrony:
EGZAMIN TESTOWY Z CHEMII ANALITYCZNEJ SEMESTR III-1, PK, chemia, analityczna
EGZAMIN ANALIZA ŚLADOWA-2002, chemia analityczna
Chemia Analityczna Egzamin
CHEMIA ANALITYCZNA Pytania na Egzamin, Chemia analityczna, Od Krzemi, Nowy folder
egz, e (4), Egzamin Chemia analityczna
analityczna egzamin pohl, Studia PWr, IV semestr, Chemia analityczna, Wykład (Pohl), Egzamin
pytania-chemia, POLITECHNIKA ŁÓDZKA, Technologia żywności i żywienia człowieka, Sem I i II, Chemia o
Analka - egzamin zestawy, Chemia analityczna, Egzamin
Analityczna egzamin zesz - odp, PK, chemia, analityczna, Chemia analityczna sem. 34, Chemia analityc
EGZAMIN Z ANALITYCZNEJ(1), Chemia analityczna
CHEMIA ANALITYCZNA, egzamin
EGZAMIN ANALIZA ŚLADOWA-2002(B), chemia analityczna
egzamin analityczna, analityka medyczna UMP 2014, chemia analityczna, kolokwium
chemia ogolna analityczna egzamin
Chemia analityczna - zestawy egzaminacyjne, Technologia Chemiczna PW, III SEMESTR, Chemia analityczn
CHEMIA ANALITYCZNA egzamin
Chemia analityczna egzamin
więcej podobnych podstron