
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Rozdział 7.
Metale
1. Otrzymywanie metali
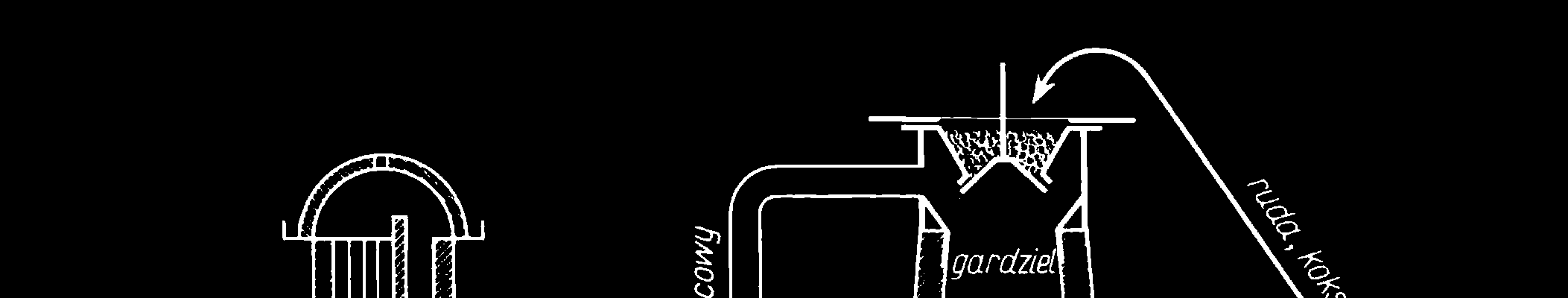
1.1. Metalurgia (pirometalurgia) żelaza
Ruda żelaza zawiera minerały tego metalu:
Fe2O3 - hematyt, Fe3O4 - magnetyt
Ponadto jako złoże występuje głównie krzemionka (SiO2)
Rozdział 7. Metale
1 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
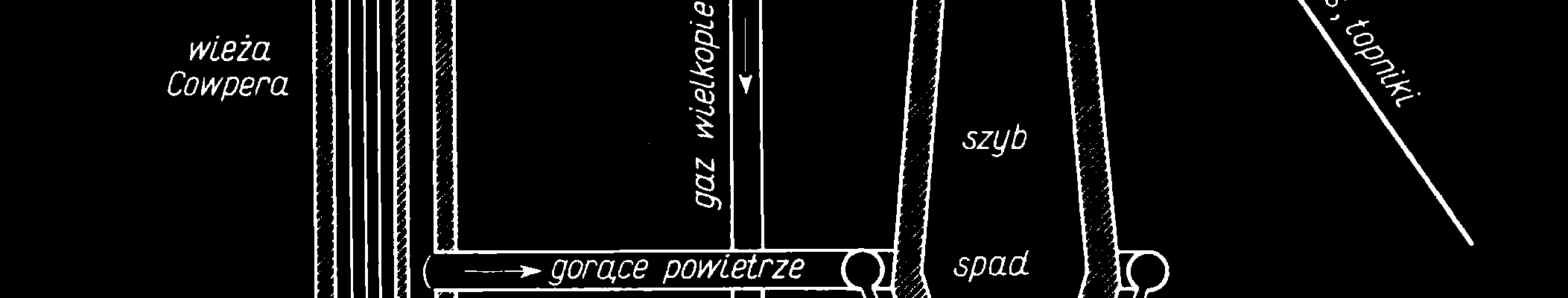
Wytop żelaza w wielkim piecu
Procesy redukcji tlenków żelaza:
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2
FeO + C = Fe + CO
Tlenek węgla powstaje w reakcjach:
2C + O2 = 2CO
CO2 + C = 2 CO
Surówka oprócz żelaza zawiera:
C 2,5 - 4 %
Si 0,2 - 3 %
P 0,1 - 2 %
oraz mangan i siarkę
Rozdział 7. Metale
2 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Usunięcie tych składników następuje w procesie świeżenia
świeżenie
surówka
stal
powietrze (tlen)
(konwertory)
1.2. Pirometalurgia miedzi
Miedź występuje głównie w postaci siarczków, np.:
Cu2S
- chalkozyn
CuFeS2
- chalkopiryt
Pierwszym etapem jest prażenie rudy
2Cu2S + 3O2 = 2Cu2O + 2SO2
Rozdział 7. Metale
3 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Wytapia się tzw. kamień miedziowy, tj. mieszaninę:
Cu2S + Cu2O
Miedź surową otrzymuje się w procesie konwertorowania:
2Cu2O + Cu2S = 6Cu + SO2
Ostatnim
etapem
jest
oczyszczanie
miedzi
w
procesie
elektrorafinacji:
anoda: Cu = Cu2+ + 2e
katoda: Cu2+ + 2e = Cu
1.3. Pirometalurgia innych metali
Wiele metali występuje w formie siarczków. Najczęściej przerabia się je poprzez prażenie (w powietrzu):
2ZnS + 3O2 = 2ZnO + 2SO2
2MoS2 + 7O2 = 2MoO3 + 4SO2
Rozdział 7. Metale
4 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
CoS + 2O2 = CoSO4
HgS + O2 = Hg + SO2
Z kolei rudę tlenkową poddaje się chlorowaniu w obecności węgla, np.:
TiO2 + C + 2Cl2 = TiCl4 + CO2
Tlenki redukuje się do metalu za pomocą reduktorów:
ZnO + CO = Zn + CO2
SnO2 + 2C = Sn + 2CO
WO3 + 3H2 = W + 3H2O
TiCl4 + 2Mg = Ti + 2MgCl2
3V2O5 + 10Al = 6V + 5Al2O3
} (aluminotermia)
3Mn3O4 + 8Al = 9Mn + 4Al2O3
Co2+ + 2e = Co
(elektroliza)
Rozdział 7. Metale
5 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Reduktorami w tych reakcjach są: C, CO, H2, Mg, Al.
Redukcja następuje też na katodzie.
Często zależy nam na metalach o bardzo dużej czystości.
Wówczas przeprowadzamy związki metali w połączenia lotne i następnie je rozkładamy. Takimi związkami mogą być jodki (np. tytanu i cyrkonu) lub karbonylki (np. niklu):
TiI4 = Ti + 2I2
ZrI4 = Zr + 2I2
Ni(CO)4 = Ni + 4CO
Oczyszczanie półprzewodników - topnienie strefowe (np. Ge, Si)
Rozdział 7. Metale
6 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
1.4. Hydrometalurgia
Hydrometalurgia jest metodą selektywnego wydzielania metali z rud za pomocą procesów zachodzących w roztworach wodnych.
Najważniejszym procesem jest tutaj ługowanie.
Ługowanie roztworem H2SO4 w obecności tlenu:
Cu2S + O2 + 4H+ = 2Cu2+ + S + 2H2O
Ługowanie roztworami cyjanków w obecności tlenu:
4Au + 8CN- + O
-
2 + 2H2O = 4Au(CN)2 + 4OH-
Ługowanie alkaliczne boksytów:
AlOOH + OH- + H2O = [Al(OH)4]-
Pozostałe etapy procesów hydrometalurgicznych:
* selektywne koncentrowanie: ekstrakcja, procesy
membranowe, wymiana jonowa, flotacja jonowa,
Rozdział 7. Metale
7 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
*wydzielanie metalu (metali): elektroliza, cementacja, redukcja ciśnieniowa wodorem:
- elektroliza
Cu2+ + 2e = Cu
- cementacja
Cu2+ + Fe = Fe2+ + Cu
- redukcja wodorem Cu2+ + H2 = Cu + 2H+
1.5. Biometalurgia
Bakterie typu ferrobacillus utleniają jony Fe2+ do Fe3+.
bakterie
Fe2+
Fe3+
CuS + 2Fe3+ = Cu2+ + 2Fe2+ + S
Można tymi bakteriami roztwarzać metale z ubogich złóż
siarczkowych.
Optymalne warunki: pH ≈ 3,5, temperatura = +28 oC.
Rozdział 7. Metale
8 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
2. Roztwarzanie
metali
w
kwasach,
wodorotlenkach
i w wodzie
1) Wodór może być wydzielany z roztworu przez metale o ujemnym potencjale a więc metale nieszlachetne. Przykład:
Fe + 2H+
= Fe2+ + H2
Podobnie roztwarza się cynk lub chrom.
Ale te metale (tzn. cynk i chrom) roztwarzają się także w wodorotlenkach z wydzieleniem wodoru, gdyż są to metale amfoteryczne.
Zn + 2OH- + 2H2O = [Zn(OH)4]2- + H2
Rozdział 7. Metale
9 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Natomiast nie zajdzie reakcja roztwarzania miedzi w kwasie solnym:
Cu + 2H+
= Cu2+ + H2
Podobnie
zachowuje
się
srebro
(Cu
i
Ag
metalami
szlachetnymi).
2) Metale szlachetne roztwarzają się natomiast w roztworach wodnych silnych utleniaczy, np. kwasów utleniających (HNO3, st. gorący H2SO4)
Cu + H+ + NO -
3 → Cu2+ + NO + H2O
Eo 2+
+
=
0,34V
Cu /Cu
Eo -
+
=
0,96V
NO /NO
3
Dobrać współczynniki do tej reakcji!
3Cu + 8H+ + 2NO -
3 = 3Cu2+ + 2NO + 4H2O
Rozdział 7. Metale
10 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Stężony, gorący H2SO4:
Cu + 4H+ + SO 2-
4
= Cu2+ + SO2 + 2H2O
Podobnie roztwarza się srebro.
3) Złoto, platyna i pallad nie roztwarzają się w kwasie azotowym oraz gorącym st. siarkowym.
Potrafi je natomiast roztworzyć woda królewska.
Jest
to
mieszanina
stężonych
kwasów:
solnego
(HCl)
i azotowego (HNO3) w stosunku objętościowym 3:1
HCl + HNO
-
3 = H+ + NO3 + Cl-
Rozdział 7. Metale
11 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Napisz reakcje roztwarzania złota, platyny i palladu w wodzie królewskiej.
Roztwarzanie platyny:
3Pt + 16H+ + 4NO -
2-
3 + 18Cl- = 3PtCl6
+ 4NO + 8H2O
4) Roztwarzanie metali w wodzie
0
Litowce E
+ = -3,05 ÷ -2,92 V
Me / Me
- nie występują w stanie wolnym, bardzo trudne do
otrzymania w stanie wolnym. Otrzymuje się je jedynie w procesie elektrolizy ze stopionych soli.
Reagują energicznie z wodą:
Me + H
↑
2O = Me+ + OH- + 1/2H2
0
Berylowce E
2+ = - 1,85 ÷ -2,91 V
Me / Me
Rozdział 7. Metale
12 / 13
Władysław Walkowiak Podstawy Chemii Nieorganicznej - kurs WPC2002w
Roztwarzalność berylowców w wodzie:
Beryl - nie roztwarza się, a pozostałe - roztwarzają się wg reakcji:
Me + 2H2O = Me2+ + 2OH- + H2
Mg - na gorąco, a pozostałe - na zimno
Rozdział 7. Metale
13 / 13
Wyszukiwarka
Podobne podstrony:
Leszek wyklad11 metale
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
BUD OG wykład 6 Metale
metale ciezkie - wyklad I, Metale ciężkie
Leszek wyklad11 metale
18 wyklad Metale wiĄzania pierw przejc [F]7 12 04id 17855 ppt
metale ściąga 3, Budownictwo ogólne, KONSTRUKCJE STALOWE, Konstrukcje metalowe wykłady, Egzamin, ści
Metale - Wykłady, Ukw, Egzaminy
metale ściąga 2, Budownictwo ogólne, KONSTRUKCJE STALOWE, Konstrukcje metalowe wykłady, Egzamin, ści
metale ściąga, Budownictwo ogólne, KONSTRUKCJE STALOWE, Konstrukcje metalowe wykłady, Egzamin, ściąg
Metale wykład - ściąga, Ukw, Egzaminy
metale ciezkie wyklad I
METALE wykłady!
Wykład 6 Weglowce CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
Wykład 10 Pierwiastki -d i -f elektronowe CHC13005w, chemia, chemia ogólna ; nieorganiczna ; metale
więcej podobnych podstron