Mieszaniny substancji
Podział mieszanin
W przyrodzie i życiu
codziennym rzadko spotykamy
się z pojedynczymi substancjami
chemicznymi. Najczęściej mamy
do czynienia z kilkoma
zmieszanymi ze sobą
substancjami. Tak zmieszane ze
sobą substancje nazywamy
mieszaniną. Przykładem
mieszaniny jest; mleko, słodzona
herbata, woda morska, zaprawa
murarska, sól zmieszana z
piaskiem, róż nego rodzaju stopy
metali, powietrze, itp. Także nasza
Ziemia jest mieszaniną gazów, cieczy i ciał
stałych.
Badając różnego rodzaju mieszaniny, daje
się zauważyć że są mieszaniny w których
różne składniki można zidentyfikować
Rys.5 Ziemia jest mieszaniną gazów, cieczy i
gołym okiem lub korzystając z mikroskopu.
ciał stałych
Ale są i takie mieszaniny, gdzie oko
uzbrojone w bardzo silny mikroskop nie jest
w stanie zidentyfikować poszczególnych
składników mieszaniny a mieszanina w
całej objętości jest jednorodna.
W oparciu o stopień
rozdrobnienia wymieszanych
substancji dokonano podziału
mieszanin. Mieszaniny mogą być
: jednorodne i niejednorodne
Mieszanina jednorodna (homogeniczna) - ma jednakowe właściwości w całej rozciągłości, tzn. gołym okiem lub za pomocą lupy czy mikroskopu nie można rozróżnić jej składników.
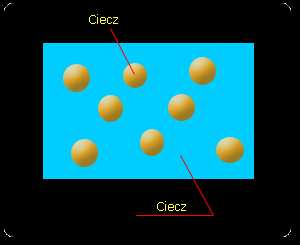
Przykładami mieszanin
jednorodnych (homogenicznych)
są:
• stopy metali (brąz)
• benzyna (mieszanina
węglowodorów)
• solanka (roztwór wodny
soli kamiennej)
• cukier w wodzie
• powietrze (mieszanina
gazów)
• roztwory wodne soków
• ocet
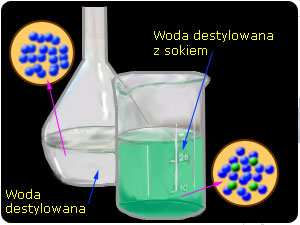
Rys.6 Mieszanina jednorodna – roztwór soku
Szczególnym przykładem mieszaniny
w wodzie
jednorodnej, jest roztwór sporządzony przez
rozpuszczenie cukru w wodzie. Kryształy
cukru rozpuszczone w wodzie rozpadają sie
na takie drobiny, które praktycznie stają się
niewidoczne dla naszego oka. Efekt taki
możemy zaobserwować podczas słodzenia
herbaty.
Mieszaniny niejednorodne (heterogeniczne)
Mieszaniny niejednorodne
(heterogeniczne) - składają się z
części o różnych właściwościach,
w których można gołym okiem
lub za pomocą lupy czy
mikroskopu rozróżnić
przynajmniej jeden składnik.
Przykładem takiej mieszaniny są:
• opiłki żelaza zmieszane z
cukrem,
• piasek z wodą,
• zaprawa murarska (piasek
Rys.7 Emulsja
zmieszany z wodą, wapnem
i cementem).
Szczególnymi rodzajami mieszanin
niejednorodnych są;
• Emulsje (rys.7). Powstają w wyniku
zmieszania dwóch
nierozpuszczalnych wzajemnie
cieczy, z których jedna jest
rozproszona w drugiej. Mleko jest
przykładem emulsji. Zewnętrznie
wygląda jak czysta substancja, ale
pod mikroskopem można dostrzec
pojedyncze kulki tłuszczu,
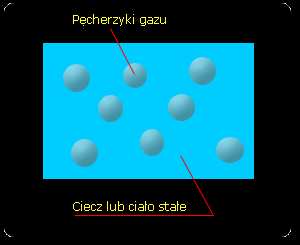
• Piana (piana z mydła) (rys.8). Składa
się z pęcherzyków gazu
rozproszonych w cieczy lub ciele
stałym,
• Dym. Zawiera drobiny ciał stałych
rozproszone w fazie gazowej jaką jest
powietrze,
Rys.8 Piana
• Mgła. Zawiesina bardzo małych
kropel wody lub lodu w powietrzu.
Czy moż emy rozdzielić mieszaninę róż nych substancji?
Jeżeli znamy właściwości fizyczne poszczególnych składników mieszaniny możesz to zrobić.
W mieszaninie substancje zachowują swoje właściwości.
Mieszaniny
możemy
rozdzielać
wykorzystując
różnice
we
właściwościach fizycznych tworzących je składników.
Rozdzielanie mieszanin
Do rozdzielenia ciał stałych od cieczy w mieszaninach niejednorodnych wykorzystujemy następujące metody:
• Filtracja (sączenie)
• Dekantacja (jeżeli zachodzi zjawisko sedymentacji)
• Krystalizacja
• Wirowanie
• Chromatografia
Do rozdzielenia ciał stałych od cieczy w mieszaninach jednorodnych wykorzystujemy następujące metody:
• Destylacja (można rozdzielać także mieszaniny jednorodne cieczy)
• Odparowanie
• Krystalizacja
Do rozdzielenia ciał stałych od ciał stałych w mieszaninach niejednorodnych wykorzystujemy następujące metody:
• Segregacja
Do rozdzielenia cieczy od cieczy w mieszaninach niejednorodnych wykorzystujemy następujące metody:
• Rozdzielenie w rozdzielaczu
Rozdzielanie mieszanin - przykłady
Rozdzielanie mieszaniny ciał stałych
Przykład - opiłki żelaza zmieszane z cukrem
Sposób pierwszy
W tym przypadku wiedząc, że cukier rozpuszcza się w wodzie, wystarczy do mieszaniny wlać wodę, która rozpuści cukier i następnie taką mieszaninę (cukier w wodzie, opiłki żelaza) przepuścić przez filtr. Na filtrze pozostaną opiłki żelaza a za filtrem otrzymamy mieszaninę (jednorodną) wody z cukrem. Następnie odparowując wodę otrzymamy naczyniu cukier Sposób drugi
W drugim sposobie wykorzystamy właściwości magnetyczne opiłków żelaza. Mieszaninę wysypujemy na płaską powierzchnię i zbliżamy do niej magnes owinięty w polietylenową folię. Magnes przyciąga opiłki żelaza, wyciąga je z mieszaniny. Nad drugą powierzchnią usuwamy magnes z folii - opiłki zelaza spadają na kartkę Filtracja (są czenie)
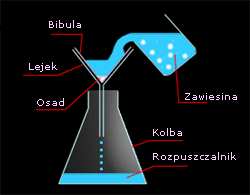
Przykładem filtracji (sączenia) jest rozdzielenie
mieszaniny zawierającej drobiny kredy zawieszone
wodzie (rys. 7). W celu rozdzielenia takiej mieszany
wystarczy przepuścić taką mieszaninę przez warstwę
filtrującą, którą może być zwykła bibuła. Na filtrze
pozostaje osad a rozpuszczalnik przenika przez filtr i oczyszczona od osadu spływa do naczynia.
W celu przeprowadzenia filtracji sączek z
pofałdowanej bibuły filtracyjnej układamy w lejku
odpowiedniej wielkości, dociskamy do ścianek i
zwilżamy wodą destylowaną. Ciecz do filtracji
Rys.7 Filtracja - oddzielenie drobin
powoli (najlepiej po bagietce) wlewamy do lejka.
kredy od wody
Filtr napełniamy do poziomu ok. 1 cm poniżej jego
krawędzi. Następną porcję wlewamy do filtru
dopiero wtedy, kiedy poprzednia została już
przefiltrowana.

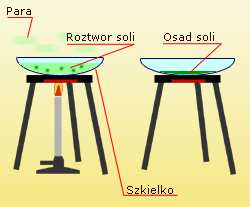
Odparowanie
Odparowanie ma zastosowanie do mieszanin
jednorodnych. Przykładem takiej mieszaniny jest
solanka (woda + sól) (rys.8).. Przepuszczając taką
mieszaninę przez filtr nie jesteśmy w stanie jej
rozdzielić. Dopiero zastosowanie odparowania
pozwala nam rozdzielic ten rodzaj mieszanin. Sam
proces polega na ogrzewaniu mieszaniny z której
odparowuje woda a w naczyniu pozostaje sól.
Proces odparowania (zatężania) może być
przeprowadzony w parownicy lub szkiełku. Przed
rozpoczęciem odparowania naczynie napełniamy
roztworem co najwyżej do połowy, Następnie
ustawicznie mieszając bagietką podgrzewamy
Rys.8 Odparowanie
naczynie na małym ogniu. Usuwamy palnik po
odparowaniu około połowy objętości
rozpuszczalnika. Pozostała ilość rozpuszczalnika
odparowuje wykorzystując ciepło rozgrzanego
naczynia.
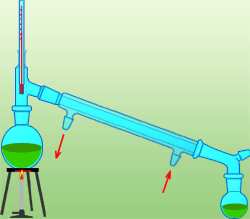
Destylacja
Jeżeli będzie nam zależało na odzyskaniu cieczy,
wtedy zastosujemy proces, który nazywamy
destylacją (rys.9).
Kolba destylacyjna powinna być wypełniona co
najwyżej do połowy. Przed rozpoczęciem
podgrzewania cieczy w kolbie należy odkręcić
dopływ wody do chłodnicy. Oczekiwana temperatura
par w kolbie destylacyjnej mierzona jest
termometrem laboratoryjnym. Kolbę ogrzewamy
początkowo stosunkowo dużym płomieniem, który
zmniejszamy w momencie rozpoczęcia wrzenia. Aby
Rys.9 Destylacja
zapobiec przegrzaniu cieczy, do kolby wrzucamy
kawałeczki porcelany.
Krystalizacja
Proces krystalizacji ma zastosowanie do rozdzielenia
mieszanin jednorodnych, z których jedna jest cieczą
a druga ciałem stałym rozpuszczalnym w wodzie lub
innych rozpuszczalnikach. Przykładem takiej
substancji może być sól kuchenna, która jak wiemy
jest bardzo dobrze rozpuszczalna w wodzie.
śeby krystalizacja była możliwa, mieszanina
(roztwór) musi znajdować się w stanie przesycenia,
co osiągamy poprzez odparowanie i ogrzewanie
Rys.10 Kryształy
roztworu. W takim roztworze po schłodzeniu, na
dnie naczynia tworzą się kryształy (rys.10).
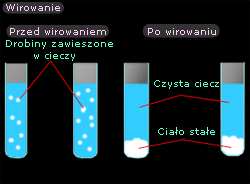
Wirowanie
Wirowanie pozwala nam rozdzielić ciała stałe od
cieczy. Przykładem może być wcześniej
prezentowana zawiesina kredy w wodzie. Wirowanie
odbywa się w wirówkach. W wyniku oddziaływania
siły odśrodkowej zawiesina kredy zostaje
przemieszczona w kierunku dna naczynia, gdzie
gromadzi się. Po odwirowaniu, ciecz zlewamy a osad
usuwamy z naczynia. Ilustruje to rysunek 10.
Rys.10 Wirowanie
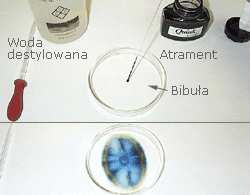
Chromatografia
Chromatografia służy do oczyszczania i identyfikacji
mieszanin substancji chemicznych. W
chromatografii wykorzystuje się zjawisko podziału
składników mieszaniny między fazę nieruchomą
(stacjonarną) i ruchomą. Rysunek 12 przedstawia
zasadę działania najprostszego chromatografu w
którym fazą stałą jest bibuła a fazą ruchomą
destylowana woda. Mieszaniną, która podlega
rozdziałowi jest zwykły atrament, który za pomocą
pipety jest nanoszony centralnie na bibułę. W to
samo miejsce nanosi się porcjami destylowaną wodę.
Po pewnym czasie zaobserwujemy występowanie
barwnych pierścieni ułożonych centralnie.
Rys.12 Chromatografia
Chromatografia rozwija się bardzo dynamicznie. Ta
metoda analizy mieszanin wykorzystywana jest w
badaniach biologicznych, przy produkcji leków i w
wielu innych dziedzinach. Najprostszym przykładem
zastosowania chromatografii może być zwykły
domowy filtr do oczyszczania wody.
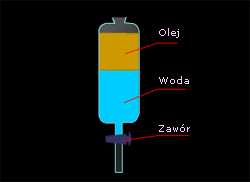
Rozdzielanie mieszaniny, dwóch nierozpuszczalnych wzajemnie cieczy
Przykładem takiej mieszaniny woda zmieszana z
olejem. Te dwie substancje zmieszane ze sobą po
pewnym czasie rozdzielą się, tworząc dwie warstwy.
Olej jako lżejszy od wody, utworzy warstwę górną a
woda znajdzie się w warstwie dolnej. Wystarczy
wtedy zlać olej z nad wody aby uzyskać rozdzielenie
tych dwóch substancji. Dokładniejszy rozdział tych
substancji uzyskamy w rozdzielaczu spuszczając
Rys.11 Separacja - rozdział dwóch
dolną warstwę przez zawór, jednocześnie obserwując
nie mieszających się cieczy
granicę kontaktu tych dwóch warstw. Przebieg tej
metody ilustruje rysunek 11.
Zadanie domowe
Wypełnić ćwiczenia – „Mieszaniny substancji”
Wykonaj doświadczenie:
Rozdzielenie składników atramentu lub tuszu z flamastra metodą chromatografii – zastosuj różne dostępne w domu ciecze np. wodę, ocet ... Zapisz wnioski.
Materiał zaczerpnięty ze strony
http://www.dami.pl/~chemia/gimnazjum/gimnazjum1/substancje2.htm
Wyszukiwarka
Podobne podstrony:
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
Szkol Substancje i preparaty chemiczne
Substancje odurzające(1)
Psychiatria W4 28 04 2014 Zaburzenia spowodowane substancjami psychoaktywnymi
19 Substancje toksyczne
5 3 Rozpuszczalność substancji
zmiany w oznakowaniu substancji i preparatów chcemicznych
kom podporowe i substancja pozakom
Substancje antyodżywcze w żywności, różności, dietetyka, ciekawostki, diety, normy
SUBSTANCJE KONSERWUJACE, WNOŻCiK wieczorowe, semestr V, toksykologia
CYNK-GRANULAT, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
informacja o substancjach, preparatach o działaniu rakotwórczym lub mutagennym
SLS, SLES i inne substancje pieniące w kosmetykach
Zagrożeniem chemicznym mogą być substancje chemiczne
Dwie substancje zawarte w popularnych kosmetykach niebezpieczne dla zdrowia
Dz U 05 39 372 stosowanie substancji niebezpiecznych i preparatów niebezpiecznych
więcej podobnych podstron