Nr. ćw. |
Data: |
|
|
Prowadzący: |
Wydział |
|
2 |
3.12.2002 |
Dr Stachowiak |
Tech. Chem. IPC |
|||
Wykonujący: |
||||||
Hałdaś Jarosław |
||||||
SPEKTROFOTOMETRIA
Część teoretyczna:
PRAWA ABSORPCJI
W celu wykorzystania zjawiska absorpcji promieniowania w analizie chemicznej trzeba poznać zależności pomiędzy stężeniem substancji w roztworze oraz grubością warstwy roztwory badanej substancji a ilością promieniowania zaabsorbowanego przez ten roztwór.
Zmiany energii (ΔE) są związane z częstością drgań lub długością fali promieniowania
ΔE = hv = c/ λ h - stała Plancka h = 6,626 * 10 J * s
v - częstość drgań
c - prędkość światła λ - dł. fali
I prawo absorpcji (prawo Lamberta)
Absorpcja jest proporcjonalna do grubości warstwy absorbującej, jeżeli wiązka promieniowania monochromatycznego przechodzi przez jednorodny ośrodek absorbujący.
I= I0 * ē I - natężenie promieniowania po przejściu przez ośrodek promieniujący
I0 - natężenie wiązki promieniowania monochromatycznego
b - grubość warstwy absorbującej
k - współczynnik absorpcji
A = log - ab A - zdolność pochłaniania zwana absorbancją
a = 0,4343k
II prawo absorpcji
Natężenie promieniowania przechodzącego przez ośrodek absorbujący zmniejsza się w stosunku geometrycznym, gdy grubość warstwy rośnie w stosunku arytmetycznym..
III prawo absorpcji (prawo addytywności absorpcji)
Absorpcja roztworu wieloskładnikowego równa się sumie absorbancji poszczególnych składników.
A= A1 + A2 + … +An
Źródła promieniowania:
- Lampy żarowe
- Lampy deuterowe
- Lampy wolframowo - halogenowe
- Wysokociśnieniowe łukowe lampy ksenonowe
Detekcja promieniowania
- ogniwa fotoelektryczne (ogniwa z warstwą zaporową)
- komórki fotoelektryczne
- fotopowielacze
- fotodiody
Monochromatory
Mają za zadanie wybrać, z emitowanego przez źródło ciągłego promieniowania wąskie pasmo o żądanej długości fali i przepuścić je przez komórkę z badaną substancją. Składają się z 1) szczeliny wejściowej 2) kolimatora 3) elementu rozpraszającego promieniowanie 4) szczeliny wyjściowej
Fala elektromagnetyczna
Rozchodzące się w przestrzeni i czasie spójne drganie pól elektrycznego elektrycznego magnetycznego.
Długości fal elektromagnetycznych
Ultrafioletowe promieniowanie - odpowiada długości fali od 400 do ok. 10 nm (granica pomiędzy promieniowaniem ultrafioletowym a rentgenowskim jest umowna), dzieli się na ultrafiolet tzw. bliski (400-190 nm) i daleki (190-10 nm).
Promieniowaniem widzialnym / światłem / nazywamy promieniowanie elektromagnetyczne o długościach fal w próżni w zakresie od 400 nm do 760 nm, na które reaguje oko ludzkie.
Podczerwone promieniowanie, podczerwień - niewidzialne promieniowanie elektromagnetyczne formalnie zaliczane do fal świetlnych, o długości fali od 760 nm do 2000 µm. Emitowane jest przez rozgrzane ciała
2. POMIARY I OPRACOWANIE WYNIKÓW
Na podstawie pomiarów absorbancji wykreślić krzywą wzorcową i na jej podstawie wyznaczyć stężenie azotu azotynowego w próbce.
*Roztwór wzorcowy azotu azotynowego (0,5μg NNO /ml)
Pomiary:
Długość fali λ=543nm
Lp. |
STĘŻENIE ROZTWORU [μg/ml] |
ABSORBANCJA |
1. (0,0) |
0,00 |
0,000 |
2. (2,0) |
0,01 |
0,042 |
3. (4,0) |
0,02 |
0,055 |
4. (10.0) |
0,05 |
0,214 |
5. (20,0) |
0,10 |
0,319 |
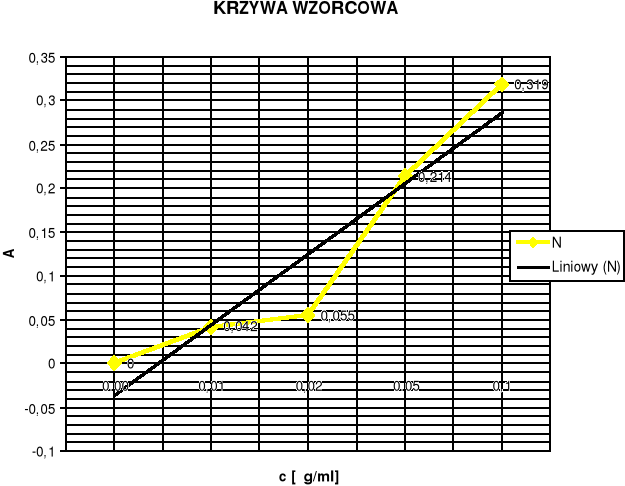
Z krzywej wzorcowe wyznaczam stężenie azotu azotynowego w badanej próbce.
Przy określonej długości fali λ=543nm i A=0,069
⇒z wykresu odczytuję, że dla takiej absorbancji c≈0,025μg/ml
Po przeliczeniu stężeń :
→ do kolbki miarowej na 100ml wlano 5,0ml azotu azotynowego.
Zależność A od c musi mieć przebieg prostoliniowy, czyli nachylenie krzywej kalibracyjnej musi być stałe.
W naszym przypadku tak nie jest, dlatego poprowadziłam drugą prostą liniową (N), o stałym nachyleniu.
Na jej podstawie obliczam również stężenie dla absorbancji A=0 069, przy długości fali λ=543nm.
⇒ c≈0,0125μg/ml, czyli do próbki na 100ml wlano 2,5ml azotu azotynowego.
WNIOSKI:
Otrzymane wyniki różnią się znacząco od siebie, ale przyjmuje za poprawne obliczenia na podstawie prostej liniowej(N), czyli c=0,0125μg/ml, gdyż krzywa wzorcowa musi mieć stałe nachylenie. W naszych pomiarach wystąpiło znaczące odchylenie w pkt.3. Mogło ono być spowodowane nie dokładnym odmierzeniem roztworu wzorcowego - to spowodowało zmianę stężenia, a co się z tym wiąże odchylenie od praw absorpcji.
Wyszukiwarka
Podobne podstrony:
Analiza Laborki, 4 Spektrografia, ANALIZA INSTRUMENTALNA
Analiza Laborki, 3 AsA, Nr
Analiza Laborki, !TABELKA, Nr
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1 kam
Analiza żywności spektrofotometria
sprawozdanie analiza ekstrakcyjno-spektrofotometryczna
Analiza zrzutu sieciowego nr 0
Analiza Laborki, Chromatografia x
Analiza Laborki, 1 Elektrody, ANALIZA INSTRUMENTALNA
Analiza Laborki, obliczenia elektrody, 0,03 mg - 1 ml
Analiza wydajności pracy nr 1 ćwiczenie
Cz 4 Instrumentalne metody analizy chemicznej Spektrometria w podczerwieni
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna poprawa
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Wykres 2
1 analiza ekstrakcyjno spektrofotometryczna
Analiza Instrumentalna Analiza ekstrakcyjno spektrofot (2)
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1
więcej podobnych podstron