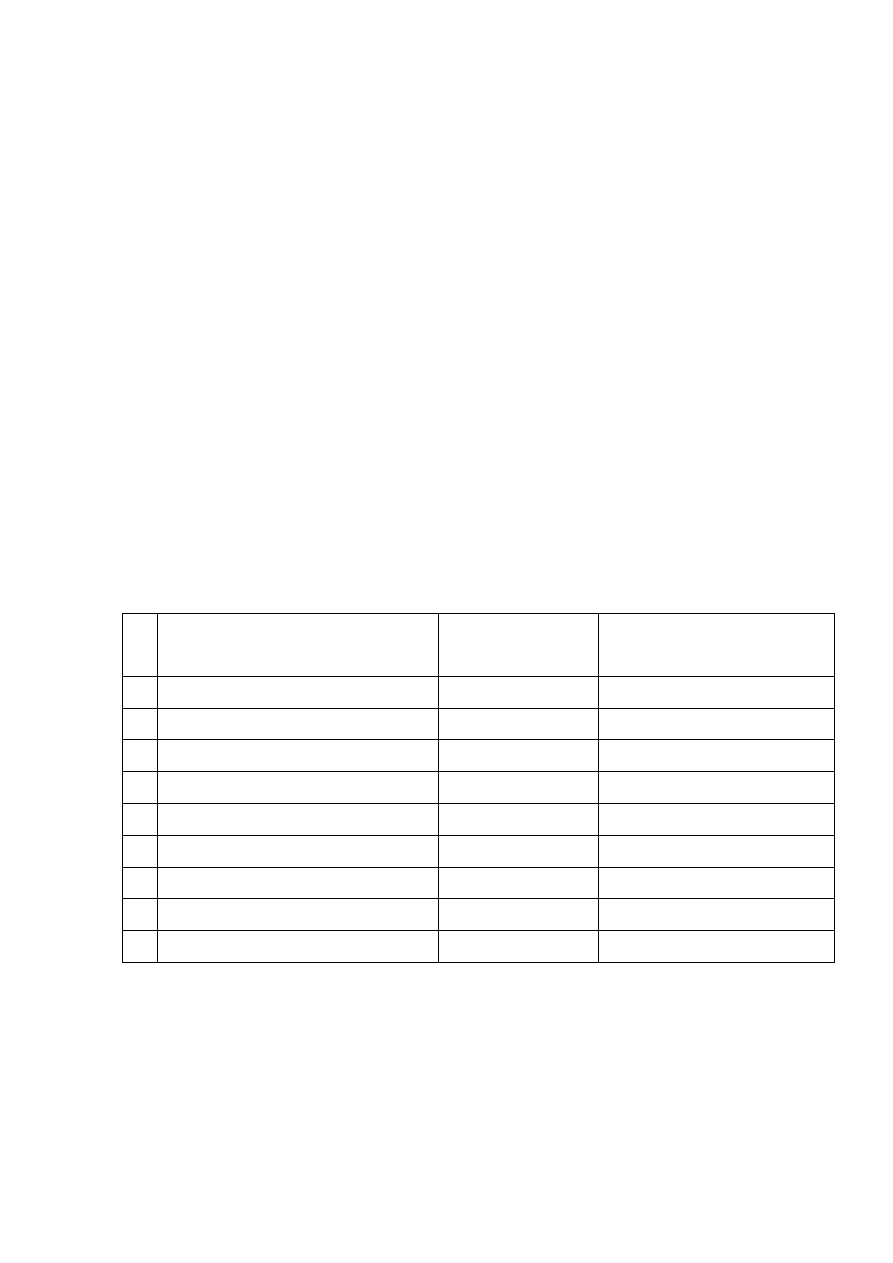
1
ĆWICZENIE 1
ANALIZA EKSTRAKCYJNO-SPEKTROFOTOMETRYCZNA
Celem ćwiczenia jest zapoznanie się z oznaczaniem śladowych ilości jonów
z zastosowaniem metod wydzielania na przykładzie ekstrakcyjno-spektrofotometrycznego
oznaczania jonów miedzi(II)
WYKONANIE OZNACZENIA
1.
Przygotowanie roztworu wzorcowego
Do kolby o pojemności 100 ml odmierzyć 10 ml roztworu podstawowego miedzi(II) o stężeniu
ok. 1 mg/ml (dokładne stężenie na butelce!). Uzupełnić wodą destylowaną do kreski
i wymieszać.
2. Do sześciu kolejno ponumerowanych rozdzielaczy o pojemności 50 ml odmierzyć
odpowiednie objętości roztworu wzorcowego zgodnie z danymi zawartymi w tabeli 1.
Tabela 1.
Lp. Objętość roztworu podstawowego,
ml
Stężenie Cu(II),
mg/ml
A
max
1.
0.1
2.
0.5
3.
1.0
4.
1.5
5.
2.0
6.
0.0
0.0
Ślepa próba (odnośnik)
X
1
--
X
2
--
X
3
--
3. Do wszystkich rozdzielaczy wprowadzić:
- 5 ml cytrynianu sodu
- 2 ml 1% EDTA
- NH
3
H
2
O st. (do pH ok. 8.5 wobec papierka wskaźnikowego)
- 5 ml 1% dietyloditiokarbaminianu sodowego (Na-DDTK)
- 10 ml CCl
4

2
4. Zawartość rozdzielaczy wytrząsać przez około 5 minut.
5. Po rozdzielaniu fazę organiczną przenieść do odpowiednio ponumerowanych suchych kolb
miarowych o poj. 50 ml.
6. Do pozostałej w rozdzielaczu fazy wodnej dodać 10 ml CCl
4
. Zawartość wytrząsać przez
kolejne 5 minut. Po rozdzieleniu fazę organiczną dołączyć do odpowiednich kolb
miarowych.
7. Ekstrakcję powtórzyć jeszcze raz zgodnie z p. 6.
8. Roztwory w kolbach uzupełnić do kreski za pomocą CCl
4
. Zawartość kolb wymieszać.
9. Dla roztworu nr 3 wykonać widmo absorpcji względem odnośnika (roztwór nr 6).
10. Na podstawie uzyskanego widma wybrać optymalną do oznaczeń długość fali.
11. Przy wybranej długości fali zmierzyć absorbancję dla wszystkich sporządzonych roztworów.
Jako odnośnik zastosować roztwór nr 6.
12. Wydaną w kolbie poj. 50 ml próbkę badaną uzupełnić wodą destylowaną do kreski.
13. Pobrać trzy porcje po 10 ml roztworu badanego i przenieść do rozdzielaczy. Dodać
odpowiednie ilości odczynników zgodnie z p.3.
14. Przeprowadzić trzykrotną ekstrakcję. Fazy organiczne gromadzić w suchych kolbach
miarowych o poj. 50 ml (X
1
, X
2
, X
3
). Zawartość kolb uzupełnić CCl
4
i wymieszać.
15. Zmierzyć absorbancję ekstraktów przy wcześniej dobranej długości fali.
OPRACOWANIE WYNIKÓW
1.
Obliczyć stężenie roztworu wzorcowego Cu(II) w mg/ml oraz jej stężenia w ekstraktach.
2.
Na podstawie wyników z tabeli 1 wykreślić krzywą wzorcową (kalibracyjną), A = f(c).
Omówić jej przebieg. Z nachylenia obliczyć molowy współczynnik absorpcji, ε jonów
Cu(II).
3.
Z krzywej kalibracyjnej odczytać stężenia miedzi(II) w ekstraktach z próbki badanej.
4.
Uwzględniając objętość próbki obliczyć masę miedzi(II) w ekstraktach. Wynik końcowy
podać w miligramach jako średnią z trzech ekstrakcji.
ZAGADNIENIA
1.
Podstawy procesów ekstrakcji:
a)
wielkości charakteryzujące proces ekstrakcji
b)
rodzaje skstrakcji
2.
Mechanizm powstawania widm absorpcji w zakresie UV-Vis.

3
3.
Prawa absorpcji i warunki ich spełnienia.
4.
Metody analizy ilościowej w spektrofotometrii: algebraiczna, krzywej wzorcowej,
porównywania z wzorcem, dodatku wzorca (jedno- i wielokrotnego), spektrofotometria
różnicowa, miareczkowanie spektrofotometryczne. Możliwości oznaczania roztworów
wieloskładnikowych.
5.
Zastosowanie spektrofotometrii UV-Vis do badania składu i wyznaczania stałych trwałości
związków kompleksowych.
6.
Charakterystyka metod spektrofotometrycznej analizy ilościowej: czułość, precyzja,
dokładność i selektywność.
7.
Aparatura spektrofotometryczna (UV-Vis): budowa, charakterystyka i przeznaczenie.
LITERATURA
1.
A. Cygański, Metody spektroskopowe w chemii analitycznej, WNT, Warszawa 2002.
2.
A. Cygański, Chemiczne metody analizy ilościowej, WNT, Warszawa 2005.
3.
Z. Marczenko, Kolorymetryczne oznaczanie pierwiastków, WNT, Warszawa, 1968.
4.
A. K. Babko, A. T. Pilipienko, Analiza fotometryczna, WNT, Warszawa, 1972.
5.
E. Szyszko, Instrumentalne metody analityczne, PZWL, Warszawa, 1982.
6
W. Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, Warszawa, 2002.
7.
J. Garaj, Fizyczne i fizykochemiczne metody analizy, WNT, Warszawa 1981.
8.
J. Minczewski, Z. Marczenko, Chemia analityczna, tom 3, PWN, Warszawa 2005.
9.
D.A. Skoog, D.M. West, F.J. Holler, S.R. Crouch, Podstawy chemii analitycznej, tom II,
PWN, Warszawa 2007.
10. Chemia analityczna, tom 2, red. R. Kocjan, PZWL, Warszawa 2002.
Wyszukiwarka
Podobne podstrony:
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1 kam
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna poprawa
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Wykres 2
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Sprawozdanie 1
Analiza Instrumentalna Analiza ekstrakcyjno spektrofotometryczna Wykres 1
sprawozdanie analiza ekstrakcyjno-spektrofotometryczna
1 analiza ekstrakcyjno spektrofotometryczna
1 analiza ekstrakcyjno spektrofotometryczna
Analiza Laborki, 4 Spektrografia, ANALIZA INSTRUMENTALNA
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
Cz 4 Instrumentalne metody analizy chemicznej Spektrometria w podczerwieni
Analiza instrumentalna - lab. [EWA], Spektrofluorymetria - ćw.9, ANNA BRACIKOWSKA
Cz 3 Instrumentalne metody analizy chemicznej Spektrofuorymetria
Analiza żywności spektrofotometria
Analiza Laborki, 2 Spektrofotometria, Nr
Analiza cwiczenie 2 spektrofotometria
FWD analiza opracowania Spektrofotometria?sorpcyjna
Kafarski, podstawy chemii organicznej, ANALIZA WIDM SPEKTROSKOPOWYCH
więcej podobnych podstron