Wstęp teoretyczny
W odróżnieniu od elektrolitów mocnych słabe elektrolity o tym samym stężeniu przewodzą prąd w znacznie mniejszym stopniu. Do słabych elektrolitów należą słabe kwasy (np. CH3COOH, H2CO3, H2S) i słabe zasady (NH3*ag, aminy).
W słabych elektrolitach cząsteczki niezdysocjowane znajdują się w stanie równowagi z produktami dysocjacji:
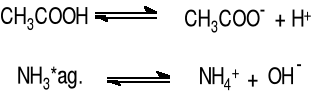
Jak w każdej równowadze, również i w tej ustala się stan równowagi dynamicznej pomiędzy dwoma przeciwnie skierowanymi procesami:
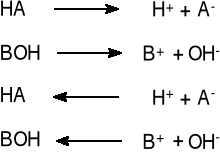
dysocjacji:
i asocjacji:
Ilościowa zależność pomiędzy składnikami równowagi określa stała równowagi, zwana stałą dysocjacji:
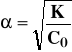
oraz związany z nią stopień dysocjacji:
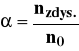
gdzie: CA, CB, CH+, COH- - stężenie odpowiednich jonów,
CHA, BOH - stężenie odpowiednich cząstek niezdysocjowanych,
nzdys. -liczba cząstek zdysocjowanych
n0 - początkowa liczba cząstek.
Stałe dysocjacji wyznaczone na drodze eksperymentalnej zmieniają się w bardzo szerokim zakresie, od wartości rzędu 10-10 do wartości rzędu 108. Aby uniknąć posługiwania się potęgami, często podaje się ujemny logarytm ze stałej dysocjacji, oznaczony symbolem pK:
![]()
Podobnie jak kwas jednoprotonowy HA, również kwasy wieloprotonowe HnA dysocjują w roztworze na jony związane ze sobą procesem równowagi chemicznej. W roztworze wodnym trójprotonowy kwas ortofosforowy zachowuje się jak słaby elektrolit. Na pierwszym stopniu dysocjacji odszczepia się jeden proton :

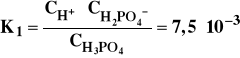
Jon H2PO4- ulega dysocjacji w znacznie mniejszym stopniu :

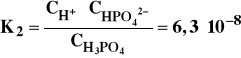
W miarę dodawania zasady wiążącej jony wodorowe również i jon HPO42- ulega dysocjacji:

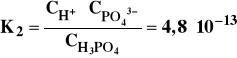
Aby znaleźć związek między stałą dysocjacji KHA i stopniem dysocjacji , rozważmy proces dysocjacji kwasu HA o początkowym stężeniu C0 [mol/dm3]
Z C0 moli kwasu HA dysocjującego w stopniu powstanie C0* moli jonów H+i C0* moli anionów A-. Reszta kwasu w ilości C0(1-) moli, pozostanie w stanie niezdysocjowanym. Po podstawieniu tych wartości do równania na stałą dysocjacji otrzymujemy zależność zwaną prawem rozcieńczeń Ostwalda:
![]()
W roztworach słabych elektrolitów, w których stopień dysocjacji nie przekracza kilku procent, mianownik tego równania jest w przybliżeniu równy jedności (1- 1), a stąd:
![]()
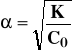
Metody doświadczalne wyznaczania stałych równowag polegają na oznaczeniu stężeń reagentów mieszaniny, w której reakcja chemiczna osiągnęła stan równowagi. Dogodnymi i szybkimi metodami oznaczeń ilościowych są pomiary fizykochemiczne. Równowagę reakcji dysocjacji elektrolitów można badać potencjometrycznie i konduktometryczne
Celem ćwiczenia jest oznaczenie stałej dysocjacji słabego kwasu metodą potencjometryczną. Metoda pomiaru polega na potencjometrycznym miareczkowaniu kwasu mocną zasadą. W ogniwie utworzonym z elektrod: szklanej i kalomelowej lub uniwersalnej, mierzy się pH roztworu w czasie miareczkowania. Na podstawie uzyskanych wyników kreśli się tzw. krzywą miareczkowania, z której bezpośrednio odczytuje się logarytm stałej dysocjacji kwasu.
We wzorze opisującym stałą dysocjacji kwasu symbole CH+, CA- i CHA oznaczają stężenia jonów i cząsteczek niezdysocjowanych po ustaleniu się stanu równowagi. W czasie miareczkowania kwasu zasadą zmniejsza się stężenie zdysocjowanych cząstek kwasu CHA, a zwiększa stężenie anionów CA-, pochodzących praktycznie z dysocjacji soli.
W momencie zobojętnienia połowy zawartości kwasu w roztworze można przyjąć, że:
![]()
i ![]()
oraz wykorzystując definicje pH i pK:
![]()
i ![]()
otrzymuje się zależność:
![]()
Dlatego stopień dysocjacji roztworu słabego kwasu można oznaczyć za pomocą pomiaru pH roztworu, w którym 50% kwasu zostało zneutralizowane zasadą.
Wykonanie ćwiczenia
Całość ćwiczenia polegała na miareczkowaniu 0,1 molowego kwasu ortofosforowego (słaby elektrolit) 0,1 molowym wodorotlenkiem sodu. Podczas miareczkowania notowaliśmy ilość używanego NaOH, oraz pH roztworu. Dzięki uzyskanym danym z pomiarów przystąpiliśmy do przeprowadzenia odpowiednich obliczeń.
Obliczenia przykładowe i tabele pomiarowe.
Za pomocą wykresu określiliśmy punkt równoważnikowy, oraz połowiczne zobojętnienie słabego kwasu mocną zasadą.
Dla objętości 69 cm3 zużytego NaOH - pkt. równoważnikowy
Dla objętości 34,5 cm3 zużytego NaOH - pkt połowicznego zobojętnienia
Dla tego pkt pH = 1,7
korzystając z zależności
![]()
oraz ![]()
obliczyliśmy KHA
KHA=0,020
dalej korzystając z zależności
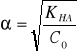
, gdzie C0 oznacza stężenie początkowe kwasu (w naszym przypadku 0,1 ![]()
)
![]()
0,447
Tabela pomiarowa
Lp. |
pH |
V[cm3] |
Lp. |
pH |
V[cm3] |
Lp. |
pH |
V[cm3] |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47
|
0,99 0,96 0,97 1,00 1,01 1,04 1,06 1,08 1,10 1,14 1,15 1,17 1,18 1,20 1,23 1,26 1,28 1,29 1,34 1,36 1,38 1,42 1,43 1,45 1,47 1,48 1,49 1,53 1,55 1,57 1,59 1,61 1,62 1,66 1,68 1,69 1,71 1,73 1,75 1,78 1,81 1,83 1,86 1,89 1,92 1,95 1,97
|
0,0 0,5 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 11,0 12,0 13,0 14,0 15,0 16,0 17,0 18,0 19,0 20,0 21,0 22,0 23,0 24,0 25,0 26,0 27,0 28,0 29,0 30,0 31,0 32,0 33,0 34,0 35,0 36,0 37,0 38,0 39,0 40,0 41,0 42,0 43,0 44,0 45,0
|
48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94
|
1,99 2,01 2,03 2,06 2,10 2,13 2,16 2,20 2,24 2,27 2,32 2,35 2,41 2,45 2,52 2,58 2,64 2,70 2,80 2,84 2,88 2,95 3,00 3,04 3,09 3,10 3,11 3,14 3,16 3,21 3,25 3,27 3,30 3,34 3,38 3,41 3,45 3,48 3,53 3,58 3,66 3,69 3,76 3,82 3,91 3,95 4,00
|
46,0 47,0 48,0 49,0 50,0 51,0 52,0 53,0 54,0 55,0 56,0 57,0 58,0 59,0 60,0 61,0 62,0 63,0 64,0 64,5 65,0 65,5 66,0 66,2 66,4 66,5 66,6 66,8 67,0 67,2 67,4 67,5 67,6 67,7 67,8 67,9 68,0 68,1 68,2 68,3 68,4 68,5 68,6 68,7 68,8 68,9 69,0
|
95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 |
4,16 4,34 4,41 4,45 4,50 4,62 4,71 4,78 4,82 4,89 4,97 5,06 5,20 5,31 5,41 5,46 5,53 5,59 5,69 5,80 5,90 5,95 6,00 6,07 6,13 6,19 6,26 6,34 6,46 6,55 6,63 6,75 6,90 7,07 7,12 |
69,2 69,5 69,6 69,7 69,8 70,1 70,3 70,5 70,7 71,0 71,5 72,0 73,0 74,0 75,0 76,0 77,0 78,0 80,0 82,0 84,0 86,0 88,0 90,0 92,0 94,0 97,0 100,0 104,0 108,0 111,0 115,0 120,0 125,0 130,0 |
Wnioski
Jak widać na załączonym wykresie określenie pkt równoważnikowego nie jest trudnym zadaniem. Korzystając z odpowiednich formuł można szybko i w łatwy sposób określić stopień dysocjacji. Jednak wykonanie samego pomiaru jest dosyć długie i monotonne - aby wyniki były dokładne należy wykonywać pomiary małymi krokami (niewielka ilość cm3 użytego ługu). Pkt. równoważnikowy przy miareczkowaniu słabego kwasu stężoną zasadą wystąpił po 3 krotnym przekroczeniu ilości użytego kwasu(mniej więcej proporcje 3:1)
Wyszukiwarka
Podobne podstrony:
Chemia fiz - spr2 - seria 2, 1
Chemia fiz - spr12 - seria 2, 1
Chemia fiz - spr4 - seria 2, 1
Chemia fiz - spr10 - seria 2, 1
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
sprawozdanie chemia fiz
Chemia fiz. - moje spraw, 35 oznaczanie stałej równowagi rekacji, Marzena Chmielecka
chemia fiz CHB labor
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
Chemia fiz. - moje spraw, 21 hydroliza estru w środowisku kwaśnym, Marzena Chmielecka
Chemia fiz zad
chemia fizyczna ps, Studia, Mibm, semestr II, Chemia Fizyczna, !chemia fiz
materialowa zagadnienia chemia fiz
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
Chemia fiz - spr8, Akademia Techniczno-Humanistyczna w
Chemia fiz. - moje spraw, 50 pomiar SEM ogniwa elektrochemicznego, Marzena Chmielecka
więcej podobnych podstron