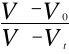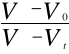Marzena Chmielecka 1
Biotechnologia numer studenta
Wydział Biotechnologii i Nauk o Żywności
Politechniki Łódzkiej
Środa 1215 - 1600
Ćwiczenie nr 21
Hydroliza estru w środowisku kwaśnym
Data wykonania ćwiczenia: 17. 10. 2007 r.
Data oddania sprawozdania: 24. 10. 2007 r.
Wstęp teoretyczny:
Reakcja hydrolizy estru polega na przyłączeniu cząsteczki H2O do atomu węgla C w grupie karboksylowej. W środowisku obojętnym reakcja zachodzi bardzo wolno, natomiast dodanie kwasu, który jest katalizatorem, znacznie przyśpiesza reakcję. Równanie reakcji hydrolizy estru w obecności jonów H+ możemy zapisać w postaci:
CH3COOC2H5 + H2O ![]()
CH3COOH + C2H5OH (1)
Zgodnie ze schematem (1) szybkość reakcji hydrolizy, wyrażona przez zmianę stężenia estru, powinna zależeć od stężeń obu substratów, estru i wody, i można ją opisać równaniem reakcji II rzędu:
![]()
(2)
W roztworach wodnych stężenie wody (cwody ok. 55![]()
) jest bardzo duże, znacznie większe od stężenia estru, i podczas reakcji praktycznie nie ulega zmianie (cwody= const.), dlatego równanie wyrażające szybkość reakcji hydrolizy można zapisać jak dla reakcji I- rzędu:
![]()
(3)
Rozwiązanie równania różniczkowego (3) prowadzi do wzoru, który umożliwia wyznaczenie eksperymentalnej stałej szybkości kexp z zależności logarytmu stężenia substratu ct od czasu rekcji t:
lnct = lnc0 - kexp t (4)
gdzie c0 oznacza początkowe stężenie estru (dla t= t0).
Szybkość reakcji zależy od stężenia jonów H+, cH, na szybkosć reakcji hydrolizy, opisuje równanie (5), w którym k0 jest szybkością reakcji niekatalizowanej (w środowisku obojętnym), natomiast kH stałą szybkości reakcji katalitycznej:
![]()
(5)
Pomiary:
SERIA I |
SERIA II |
||||
CHCl= 0,5 M |
CHCl= 0,2 M |
||||
t (min.) |
Vt (ml) |
ln |
t (min.) |
Vt (ml) |
ln |
0 |
20,2 |
0 |
0 |
11,8 |
0 |
15 |
21,3 |
0,0293 |
15 |
12,2 |
0,0185 |
30 |
21,5 |
0,0623 |
30 |
12,8 |
0,0470 |
45 |
23,6 |
0,0935 |
45 |
13,2 |
0,0664 |
60 |
24,3 |
0,1139 |
60 |
13,8 |
0,0962 |
75 |
25,4 |
0,2095 |
75 |
14,5 |
0,1322 |
90 |
29,6 |
0,2833 |
90 |
14,8 |
0,1481 |
105 |
30,8 |
0,3260 |
105 |
15,5 |
0,1860 |
∞ |
58,3 |
|
∞ |
33,6 |
|
Stałą szybkości reakcji obliczam z równania: ![]()
poprzez badanie nachylenia prostej w układzie współrzędnych ![]()
.
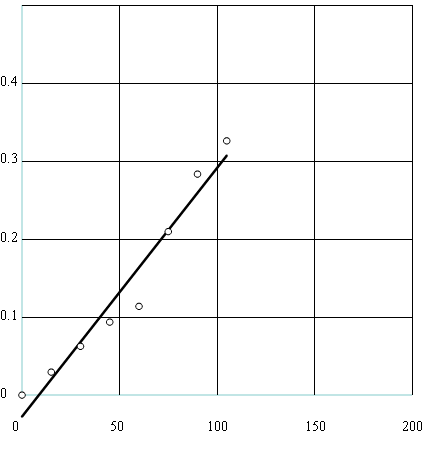
Wykres dla 0,5 M kwasu HCl:
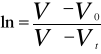
t [s]
Współczynnik kierunkowy prostej: ![]()
, ![]()
współczynnik korelacji: 0,98593
a= -k
Szybkość reakcji: ![]()
![]()
Wykres dla 0,2 M kwasu HCl:

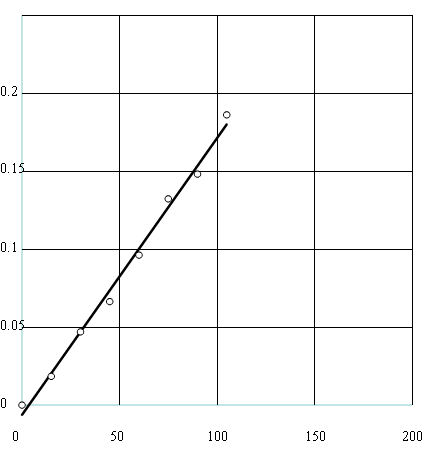
t [s]
Współczynnik kierunkowy prostej: ![]()
, ![]()
współczynnik korelacji: 0,9966
a= -k
Szybkość reakcji: ![]()
![]()
Wnioski:
Stała hydrolizy w przypadku użycia kwasu HCl o stężeniu 0,5 M wynosi ![]()
![]()
, a dla kwasu o stężeniu 0,2 M ![]()
![]()
. Z wyznaczonych stałych widać, że na jej wpływ ma stężenie kwasu, gdyż tam gdzie było większe stężenie stała jest większa. Wyniki obarczone są optycznym błędem odczytu.
6
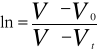
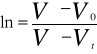
Wyszukiwarka
Podobne podstrony:
Chemia fiz. - moje spraw, 35 oznaczanie stałej równowagi rekacji, Marzena Chmielecka
Chemia fiz. - moje spraw, 50 pomiar SEM ogniwa elektrochemicznego, Marzena Chmielecka
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
Chemia fiz. - moje spraw, 24 kineryka rozkładu jonowego kompleksu trójszczawianomanganowego, Marzena
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
S1.Z1.pompy.po.popr.OK.3.0, Ochrona Środowiska, semestr III, MECHANIKA PŁYNÓW, Mechanika płynów (+)
31 wyznaczanie izotermy mieszania trzech cieczy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, la
pwsz ioś kalisz moje sprawozdanie PEHAMETRIA, inżynieria ochrony środowiska kalisz, a pwsz kalisz io
moje spraw.2, TŻ, SEMI, SEM II, fizyka
Chemia fiz - spr2 - seria 2, 1
Chemia fiz - spr12 - seria 2, 1
Chemia fiz - spr4 - seria 2, 1
sprawozdanie chemia fiz
więcej podobnych podstron