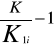Marzena Chmielecka 1
Biotechnologia numer studenta
Wydział Biotechnologii i Nauk o Żywności
Politechniki Łódzkiej
Środa 1215 - 1600
Ćwiczenie nr 35
Oznaczanie stałej równowagi reakcji I2 + I- I3-
Data wykonania ćwiczenia: 07. 11. 2007 r.
Data oddania sprawozdania: 14. 11. 2007 r.
Wstęp teoretyczny:
Stała równowagi to współczynnik opisujący stan równowagi odwracalnych reakcji chemicznych. Stała ta jest równa ilorazowi reakcji w stanie doskonałej równowagi, t.j. w sytuacji gdy szybkość reakcji w stronę od substratów do produktów i od produktów do substratów jest dokładnie taka sama.
Prawo podziału Nernsta albo krótko prawo podziału określa sposób, w jaki dowolna substancja chemiczna ulega podziałowi pomiędzy dwie oddzielone od siebie, ale pozostające w kontakcie fazy objętościowe (ośrodki). Układy, w których może zaistnieć równowaga podziałowa (rodzaj równowagi dynamicznej), to np. gazy lub pary rozdzielone membraną półprzepuszczalną, gaz i ciecz oraz dwie ciecze niemieszające się lub oddzielone membraną.
Jod, źle rozpuszcza się w wodzie, ale dobrze rozpuszcza się natomiast w wodnych roztworach jodku potasu, dzięki zachodzącej w układzie reakcji:
I2 + I- I3- (1)
Stała równowagi tej reakcji jest wyrażona wzorem:
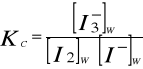
(2)
W stałej temperaturze i pod stałym ciśnieniem, zgodnie z prawem podziału Nernsta, stosunek stężeń jodu w obu fazach- rozpuszczalniku organicznym i wodzie jest stały i równy współczynnikowi podziału K, który wyrażony jest równaniem:
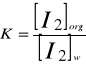
(3)
W stałej temperaturze i pod stałym ciśnieniem stosunek stężeń jodu w rozpuszczalniku organicznym i wodnym roztworze jodku potasu jest stały i określony współczynnikiem podziału K1, wyrażonym zależnością:
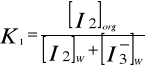
(4)
Dzieląc powyższe równania stronami otrzymujemy następującą zależność:
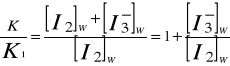
(5)
Po uwzględnieniu zależności (5) w równaniu (2) otrzymujemy zależność pomiędzy stałą równowagi reakcji Kc i współczynnikami podziału jodu pomiędzy fazę organiczną i wodną, K oraz fazę organiczną i wodny roztwór jodku potasu K1:
![]()
Stałą równowagi Kc dla reakcji (1) można obliczyć oznaczając współczynnik podziału jodu K pomiędzy rozpuszczalnik organiczny i wodę, a także współczynniki podziału jodu K1 pomiędzy rozpuszczalnik organiczny i wodne roztwory jodku potasu o różnych stężeniach jonów jodkowych [I-].
Obliczenia:
Lp. |
[I-]w Stężenie KI |
(A2)i |
(K1)i |
|
1. |
1,0 |
0,12 |
0,75 |
|
2. |
0,8 |
0,14 |
1,00 |
|
3. |
0,6 |
0,165 |
1,43 |
|
4. |
0,4 |
0,18 |
1,80 |
|
5. |
0,2 |
0,22 |
3,67 |
|
Obliczam współczynnik podziału jodu pomiędzy fazą organiczną i wodny roztwór jodku potasu z zależności:
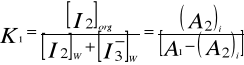
gdzie: A1= 0,28
Przykład obliczenia dla stężenia KI = 1 M:
![]()
Wyznaczanie wartości (A2)0 przez ekstrapolację z wykresu zależności (A2)i od cKI:
![]()
cKI
(A2)0 = 0,26
Obliczam współczynnik podziału jodu pomiędzy rozpuszczalnik organiczny i wodę [K] z zależności:
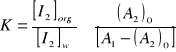
gdzie: (A2)0 = 0,26
A1= 0,28
![]()
Wykres zależności
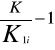
od stężenia jodku potasu cKI:
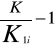
cKI
Wyznaczam z wykresu (wykonanego metodą najmniejszych kwadratów) współczynnik kierunkowy [a], który liczbowo jest równy stałej równowagi reakcji Kc:
![]()
![]()
![]()
![]()
korelacja: 0,99186
stąd stała równowagi reakcji I2+ I- = I-3:
Kc = 15,125
Wnioski:
Z przeprowadzonego przez mnie doświadczenia można zauważyć, że wraz ze wzrostem stężenia roztworu jodku potasu maleje zmierzona absorbancja [(A2)i] dla poszczególnych stężeń KI. Stała równowagi reakcji I2+ I- = I-3 otrzymana przeze mnie w ćwiczeniu wynosi: 15,125, co wskazuje, że reakcja ta ma silna tendencję do tworzenia produktów. Wyniki są obarczone błędem, który mógł być spowodowany zabrudzeniem kuwet pomiarowych. Na błędy mogła mieć też wpływ niedokładność wykonywanych pomiarów.
6
![]()
![]()
Wyszukiwarka
Podobne podstrony:
Chemia fiz. - moje spraw, 21 hydroliza estru w środowisku kwaśnym, Marzena Chmielecka
Chemia fiz. - moje spraw, 50 pomiar SEM ogniwa elektrochemicznego, Marzena Chmielecka
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
Chemia fiz. - moje spraw, 24 kineryka rozkładu jonowego kompleksu trójszczawianomanganowego, Marzena
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ad 8 Zależność stałej równowagi reakcji od temperatury
moje spraw.2, TŻ, SEMI, SEM II, fizyka
Chemia fiz - spr2 - seria 2, 1
Chemia fiz - spr12 - seria 2, 1
Chemia fiz - spr4 - seria 2, 1
sprawozdanie chemia fiz
Chemia fiz - spr9 - seria 2, 1
więcej podobnych podstron