Marzena Chmielecka 1
Biotechnologia numer studenta
Wydział Biotechnologii i Nauk o Żywności
Politechniki Łódzkiej
Środa 1215 - 1600
Ćwiczenie nr 24
Kinetyka rozkładu jonu kompleksu trójszczawianowego [Mn(C2O4)3]3-
Data wykonania ćwiczenia: 24. 10. 2007 r.
Data oddania sprawozdania: 31. 10. 2007 r.
Wstęp teoretyczny:
W obecności nadmanganianu potasu kwas szczawianowy kompleksuje jony Mn2+. Powstający kompleks [Mn(C2O4)3]3- jest nietrwały i ulega rozpadowi według równania:
[Mn(C2O4)3]3- Mn2+ + ![]()
[C2O4]2- + CO2![]()
Rozkład kompleksu trójszczawianomanganowego jest reakcją I- rzędową, którą opisuje równanie kinetyczne:
-![]()
= kc
Rozwiązanie równania kinetycznego (tego powyżej) ma postać:
lnct = lnc0 - kt
W którym c0 oraz ct oznaczają stężenia kompleksu [Mn(C2O4)3]3- na początku reakcji i po czasie t.
Kompleks [Mn(C2O4)3]3- jest barwny, dzięki czemu postęp reakcji jego rozkładu można śledzić metodą kolorymetryczną, rejestrując zanik zabarwieni roztworu.
Opis wykonywanych czynności:
Ćwiczenie polega na wykonaniu pomiarów absorbancji roztworu jonowego kompleksu trójszczawianomanganowego podczas jego rozkładu w różnych momentach czasu. Mierzona absorbancja jest proporcjonalna do stężenia kompleksu.
Do kolby miarowej o pojemności 100 ml dodaję kolejno 10 ml 0,1M roztworu MnSO![]()
, 35 ml 0,1 M (COOH)![]()
i 40 ml wody destylowanej. Dodaje do kolby dla pierwszego pomiaru 10 ml roztworu KMnO4, do drugiego 7 ml KMnO4. Oba roztwory uzupełniam wodą destylowana do kreski. Pomiary wykonywane w temp. 295, 15 K ( temp. otoczenia ).
Pomiar absorbancji dokonuję za pomocą fotokolorymetru. W kuwecie wzorcowej umieszczam wodę destylowaną . Obliczenia i wykres wykonuję na komputerze.
Pomiary:
Lp. |
10 ml KMnO4 |
7 ml KMnO4 |
||
|
t |
A |
t |
A |
1 |
1 |
0,459 |
1 |
0,550 |
2 |
2 |
0,425 |
2 |
0,548 |
3 |
3 |
0,395 |
3 |
0,546 |
4 |
4 |
0,371 |
4 |
0,543 |
5 |
5 |
0,344 |
5 |
0,536 |
6 |
10 |
0,248 |
10 |
0,496 |
7 |
15 |
0,192 |
15 |
0,408 |
8 |
20 |
0,161 |
20 |
0,320 |
9 |
25 |
0,145 |
25 |
0,264 |
10 |
30 |
0,132 |
30 |
0,231 |
11 |
35 |
0,130 |
35 |
0,211 |
12 |
40 |
0,128 |
40 |
0,199 |
13 |
45 |
0,128 |
45 |
0,196 |
Wykres ln At = f ( t ) dla objętości KMnO4 równej 10 cm3 i temperatury 295,15 K.
![]()
![]()
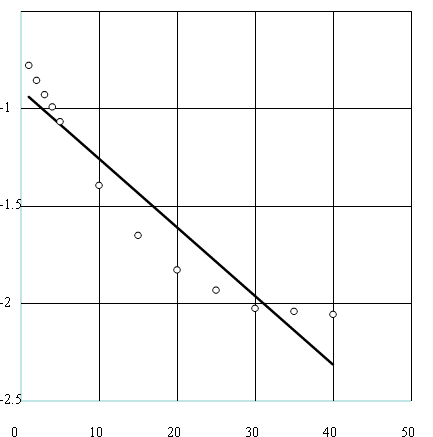
Współczynnik kierunkowy prostej a = - 0,03519467 Δa = 0,00353082
a = - k
Szybkość reakcji: k = ( 0,0352 ± 0,0035 ) ![]()
Wykres ln At = f ( t ) dla objętości KMnO4 równej 7 cm3 i temperatury 295,15 K.
![]()
![]()
Współczynnik kierunkowy prostej a = - 0,0276259 Δa = 0,0014753
a = - k
Szybkość reakcji: k = ( 0,0276 ± 0,0015 ) ![]()
Wnioski:
W wykonanym ćwiczeniu dokonałam pomiaru stałej szybkości rozpadu kompleksu trójszczawianomanganowego. Obliczenia przeprowadziłam za pomocą pomiaru absorbancji światła o długości 450 nm przez zbadanie dwóch próbek, w których znajdowało się 10 i 7 ml KMnO4. współczynnik kierunkowy wyznaczyłam metodą najmniejszych kwadratów. Uzyskałam następujące wyniki odpowiednio: k = ( 0,0352 ± 0,0035 ) ![]()
i k = ( 0,0276 ± 0,0015 ) ![]()
. Wyniki są obarczone błędem, który mógł być spowodowany zabrudzeniem kuwet pomiarowych. Na błędy mogła mieć też wpływ niedokładność wykonywanych pomiarów, czyli przesunięcia odstępów czasu pomiędzy pomiarami, jak również spore opóźnienie przy odczytaniu pierwszej wartości spowodowane wadliwym działaniem fotokolorymetru. Na wartość otrzymanej przeze mnie stałej szybkości reakcji k największy wpływ miała temperatura, w jakiej zachodziła reakcja. Pomiarów dokonywałam w temperaturze pokojowej, wynosiła ona 295,15 K.
1
![]()
![]()
![]()
![]()
Wyszukiwarka
Podobne podstrony:
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
Chemia fiz. - moje spraw, 35 oznaczanie stałej równowagi rekacji, Marzena Chmielecka
Chemia fiz. - moje spraw, 21 hydroliza estru w środowisku kwaśnym, Marzena Chmielecka
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
Chemia fiz. - moje spraw, 50 pomiar SEM ogniwa elektrochemicznego, Marzena Chmielecka
15 wyznaczanie ciepła spalania(1), Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, C
Moje Ćw 24, POLITECHNIKA ŁÓDZKA, Technologia Żywności i Żywienia Człowieka, semestr 4, Chemia fizycz
moje spraw.2, TŻ, SEMI, SEM II, fizyka
Chemia fiz - spr2 - seria 2, 1
Chemia fiz - spr12 - seria 2, 1
Chemia fiz - spr4 - seria 2, 1
sprawozdanie chemia fiz
Chemia fiz - spr9 - seria 2, 1
chemia fiz CHB labor
chemia fiz spr połączone, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, od ol
więcej podobnych podstron