POLITECHNIKA KOSZALIŃSKA
Wydział Mechaniczny
Zakład Elektrochemii Powierzchni
L A B O R A T O R I U M
Z TECHNOLOGII POWIERZCHNI I POWŁOK
ĆWICZENIE NR 3
Temat ćwiczenia:
Badanie charakterystyk polaryzacyjnych w procesie ECP
Grupa/Rok studiów IZK III Grupa K - 02
Semestr VI
Sprawozdanie wykonał
Paweł Urban Magdalena Krudos
Data wykonania ćwiczenia
11 marzec 1997
Data zaliczenia
Sprawdził/Ocena
KOSZALIN 1997
Informacje wstępne.
Polerowanie chemiczne i elektrolityczne można rozpatrywać jako zabieg wykańczający, lub zabieg wstępny.Oba procesy, zarówno polerowanie elektrolityczne jak i chemiczne mają charakter elektrochemiczny. W procesie polerowania elektrolitycznego metal zanurzony w odpowiedniej kąpieli, w określonych warunkach elektrycznych i odpowiedniej temperaturze, może rozpuszczać się na anodzie w ten sposób, że powierzchnia jego zostaje wygładzona i wybłyszczona. W przypadku polerowania chemicznego proces odbywa się bezprądowo, z dodatkiem środków utleniających do kąpieli.
Ze względu na złożony charakter procesów elektrodowych, nie wszystkie metale dają się polerować z jednakowym powodzeniem. Najlepsze efekty osiąga się gdy struktura metalu jest jednorodna i drobnoziarnista
Proces polerowania elektrolitycznego posiada szereg zalet, które stanowią o szerokim zastosowaniu z różnych gałęziach. Najważniejszą z nich jest możliwość polerowania przedmiotów o skomplikowanych kształtach. W procesie tym nie jest konieczne przygotowanie powierzchni, gdyż nie ma to wpływu na końcowy efekt. W innych metodach byłoby to niemożliwe. Oczyszczanie powierzchni stosuje się tylko ze względu na trwałość elektrolitu, spełnia on tutaj rolę „materiału ściernego”.
Proces polerowania elektrolitycznego jest sterowanym procesem roztwarzania powierzchni anody w warunkach pseudopasywnych w celu uzyskania szczególnych cech powierzchni. Do opisu procesu służą charakterystyki polaryzacyjne, zwane też charakterystykami woltamperometrycznymi, lub charakterystykami prądowo-napięciowymi.
ia = f(E)
gdzie:
ia - gęstość prądu anodowego;
E - potencjał anody względem normalnej elektrody odniesienia.
Oto typowa zależność gęstości prądu anodowego od potencjału przyłożonego do elektrody miedzianej w roztworze kwasu ortofosforowego.
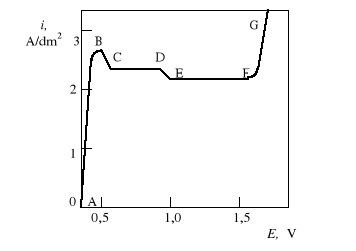
Na każdym z odcinków krzywej zachodzą inne zjawiska:
AB - zakres aktywnego rozpuszczania miedzi, powodujący trawienie warstwy wierzchniej próbki, bardzo mocno zależy od potencjału anody.
BD - rozpuszczanie powierzchni, dającemu jasną strukturę metalu, nie zawsze dobrze wygładzoną;
BC - najintensywniejsze rozpuszczanie powierzchni;
CF - niemal poziomy odcinek krzywej, tzw. plateau krzywej polaryzacji, odpowiadający gęstości prądu granicznego ilim.
EF - zakres „najlepszego elektropolerowania”,
FG - gwałtowny, ciągły wzrost gęstości prądu anodowego i wydzielanie się pęcherzyków tlenu na powierzchni próbki. Przy braku mieszania na powierzchni metalu powstaje pitting w postaci widocznych pod mikroskopem małych wżerów.
Zarówno sam przebieg krzywej polaryzacji, jak i poziom plateau zależą od wielu czynników, w tym głównie od temperatury roztworu. Innym naturalnym sposobem zwiększania anodowej gęstości prądu jest zwiększenie względnej szybkości roztworu względem polerowanej powierzchni.
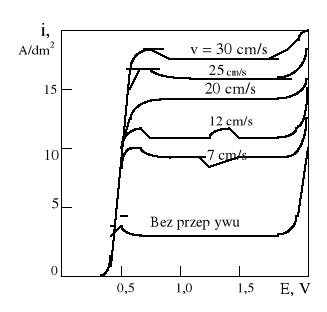
Przy polerowaniu stali, krzywe polaryzacyjne spełniają nieco inną rolę. Zakres plateau, na ogół mniejszy niż przy polerowaniu miedzi, świadczy jedynie o możliwości uzyskania lepszej lub gorszej powierzchni. Zakres „najlepszego ECP” znajduje się bowiem poza obszarem plateau, w kierunku wyższych potencjałów anody. Jest to więc zakres „gazowania” elektrody a zatem dla uzyskania dobrych wyników jakości powierzchni, konieczne jest zapewnienie odpowiednich warunków hydrodynamicznych dla szybkiego odprowadzenia gazu.
Cel ćwiczenia.
Celem ćwiczenia jest poznanie budowy stanowiska i zasady badania charakterystyk polaryzacyjnych w procesie polerowania elektrolitycznego metali i wyznaczenie krzywej polaryzacji anodowej stali w określonym roztworze elektrolitu.
Przebieg ćwiczenia.
Podczas wykonywania ćwiczenia obserwowaliśmy wykreślanie krzywej polaryzacji anodowej za pomocą układu pomiarowego jak na poniższym rysunku.
Schemat blokowy układu pomiarowego:
GENERATOR POTENCJOSTAT REJESTRATOR
PG - 30/1 PG - 30/1 SVI 738
OUTPUT INPUT OUT Eref IN A
PROGRAM A
OUT I IN B
Eref Ec Ew
Eref Ec Ew
Układ elektrolizera z elektrodą odniesienia
Ew Ec
Hg2SO4 0,1nH2SO4
Hg
Lp. |
E [V] |
I |
Lp. |
E [V] |
I |
Lp. |
E [V] |
I |
1 |
0,009 |
0 |
52 |
0,853 |
53 |
103 |
1,306 |
128 |
2 |
0,089 |
0 |
53 |
0,862 |
55 |
104 |
1,315 |
129 |
3 |
0,178 |
0 |
54 |
0,871 |
56 |
105 |
1,324 |
129 |
4 |
0,267 |
0 |
55 |
0,880 |
57 |
106 |
1,333 |
128 |
5 |
0,355 |
0 |
56 |
0,888 |
58 |
107 |
1,342 |
129 |
6 |
0,444 |
0 |
57 |
0,897 |
59 |
108 |
1,350 |
128 |
7 |
0,453 |
20 |
58 |
0,906 |
61 |
109 |
1,359 |
130 |
8 |
0,462 |
20 |
59 |
0,915 |
62 |
110 |
1,368 |
130 |
9 |
0,471 |
20 |
60 |
0,924 |
63 |
111 |
1,377 |
129 |
10 |
0,480 |
20 |
61 |
0,933 |
63 |
112 |
1,386 |
129 |
11 |
0,489 |
20 |
62 |
0,942 |
64 |
113 |
1,395 |
130 |
12 |
0,498 |
20 |
63 |
0,951 |
63 |
114 |
1,404 |
-90 |
13 |
0,506 |
20 |
64 |
0,960 |
64 |
115 |
1,413 |
-90 |
14 |
0,515 |
20 |
65 |
0,968 |
66 |
116 |
1,422 |
-90 |
15 |
0,524 |
20 |
66 |
0,977 |
66 |
117 |
1,430 |
-90 |
16 |
0,533 |
20 |
67 |
0,986 |
64 |
118 |
1,439 |
-90 |
17 |
0,542 |
20 |
68 |
0,995 |
66 |
119 |
1,448 |
-89 |
18 |
0,551 |
20 |
69 |
1,004 |
65 |
120 |
1,457 |
-87 |
19 |
0,560 |
20 |
70 |
1,013 |
66 |
121 |
1,466 |
-86 |
20 |
0,569 |
20 |
71 |
1,022 |
65 |
122 |
1,475 |
0 |
21 |
0,578 |
20 |
72 |
1,031 |
68 |
123 |
1,484 |
0 |
22 |
0,586 |
20 |
73 |
1,040 |
69 |
124 |
1,493 |
0 |
23 |
0,595 |
20 |
74 |
1,048 |
71 |
125 |
1,502 |
0 |
24 |
0,604 |
20 |
75 |
1,057 |
73 |
126 |
1,510 |
0 |
25 |
0,613 |
20 |
76 |
1,066 |
73 |
|
|
|
26 |
0,622 |
20 |
77 |
1,075 |
76 |
|
|
|
27 |
0,631 |
20 |
78 |
1,084 |
80 |
|
|
|
28 |
0,640 |
20 |
79 |
1,093 |
80 |
|
|
|
29 |
0,649 |
19 |
80 |
1,102 |
86 |
|
|
|
30 |
0,657 |
20 |
81 |
1,111 |
88 |
|
|
|
31 |
0,666 |
20 |
82 |
1,119 |
91 |
|
|
|
32 |
0,675 |
19 |
83 |
1,128 |
96 |
|
|
|
33 |
0,684 |
20 |
84 |
1,137 |
99 |
|
|
|
34 |
0,693 |
19 |
85 |
1,146 |
104 |
|
|
|
35 |
0,702 |
20 |
86 |
1,155 |
110 |
|
|
|
36 |
0,711 |
20 |
87 |
1,164 |
114 |
|
|
|
37 |
0,720 |
20 |
88 |
1,173 |
118 |
|
|
|
38 |
0,729 |
20 |
89 |
1,182 |
121 |
|
|
|
39 |
0,737 |
19 |
90 |
1,191 |
126 |
|
|
|
40 |
0,746 |
20 |
91 |
1,199 |
130 |
|
|
|
41 |
0,755 |
21 |
92 |
1,208 |
128 |
|
|
|
42 |
0,764 |
22 |
93 |
1,217 |
129 |
|
|
|
43 |
0,773 |
25 |
94 |
1,226 |
130 |
|
|
|
44 |
0,782 |
30 |
95 |
1,235 |
139 |
|
|
|
45 |
0,791 |
33 |
96 |
1,244 |
130 |
|
|
|
46 |
0,800 |
38 |
97 |
1,253 |
130 |
|
|
|
47 |
0,809 |
40 |
98 |
1,262 |
130 |
|
|
|
48 |
0,817 |
45 |
99 |
1,271 |
128 |
|
|
|
49 |
0,826 |
47 |
100 |
1,279 |
128 |
|
|
|
50 |
0,835 |
48 |
101 |
1,288 |
129 |
|
|
|
51 |
0,844 |
51 |
102 |
1,297 |
129 |
|
|
|
Uwagi i wnioski.
Wyznaczanie krzywej polaryzacji anodowej odgrywa bardzo ważną rolę w procesie elektropolerowania. Jest niezbędne do zrozumienia zachodzących zjawisk. Znajomość charakterystyki jest niezbędna do zaprojektowania procesu technologicznego polerowania elektrochemicznego każdego materiału. Do tego celu potrzebna jest znajomość zakresu potencjału, w którym występuje tzw. krzywa plateau i zakres najlepszego polerowania. Ważna jest również znajomość zakresu, w którym występuje wydzielanie się pęcherzyków tlenu na powierzchni próbki, które prowadzi do powstawania na powierzchni metalu tzw. pittingu w postaci widocznych pod mikroskopem małych wżerów.
W przeprowadzonym przez nas doświadczeniu szerokość zakresu plateau wyniosła 0,1V. Na początku wykresu wystąpił wzrost wartości prądu, który może być spowodowany warunkami początkowymi pracy urządzenia pomiarowego.Szerokość zakresu plateau dla stali jest dziesięciokrotnie mniejsza niż dla miedzi co świadczy o tym, że ustalenie parametrów jest znacznie trudniejsze.
Technologia Powierzchni i Powłok - Laboratorium
Str. 7
Peweł Urban & Magda Krudos
Przewód Cu w izolacji z sieciowanego PE
Ew - anoda
Łącznik PE
Elektroda pomocnicza (1H18N9T) - stal
Teflonowa podstawka elektrody
Eref - elektroda odniesienia
Zakres potencjału anodowego odpowiadający obszarowi plateau.
Wyszukiwarka
Podobne podstrony:
2LAB, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka -
WYKRES73, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
C7, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka - la
b, 1 STUDIA - Informatyka Politechnika Koszalińska, muniol, I rok, pam - egz, 1 koło
Fizzad2, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
STOS-EM, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Fizyka21, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
FizWyks2, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
ROZS, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Labolatorium Fizyki
065S~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Laboratorium 4, Politechnika Koszalińska, III semestr, Laboratorium techniki cyfrowej
FizPrad, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
051C~1, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, fizyka1, fiza, fizyka
Politechnika KoszalińskaKoszalin
więcej podobnych podstron