Rozwiązania zadań - temat 11
2*/107
2 NH3 = N2 + 3 H2
pN2 = 305 MPa, pH2 = 6,89 MPa, pNH3 = 213 MPa, Kp = ?
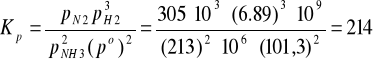
3*/107
Cstały + H2Opara = CO + H2
T = 1000 K, V = 4,00 m3
mCO = 336,1 g, MCO = 28,011 g/mol; nCO = 336,1/28,011 = 11,999 mol
mH2 = 28,22 g, MH2 = 2,016 g/mol; nH2 = 28,22/2,016 = 13,998 mol
mH2O = 72,06 g, MH2O = 18,015 g/mol; nH2O = 72,06/18,015 = 4,000 mol
[CO] = nCO/V = 11,999/4 = 3,000·10-3 kmol/m3
[H2] = nH2/V = 13,998/4 = 3,500·10-3 kmol/m3
[H2O] = nH2O/V = 1,000·10-3 kmol/m3
Kc = ?
![]()
8*/107
CO2 + H2 = CO + H2Opara
noCO2 = 20,5 mol
moH2 = 89,0 g, MH2 = 2,016 g/mol; noH2 = 89,0/2,016 = 44,15 mol
T = 700 K
W stanie równowagi nCO2 = 13,2 mol
Warunki |
CO2 |
H2 |
CO |
H2O |
Stan początkowy, noi |
20,5 |
44,15 |
- |
- |
Reakcja, n*i |
-7,30 |
-7,30 |
+7,30 |
+7,30 |
Stan równowagi, ni |
13,2 |
36,85 |
7,30 |
7,30 |
Kc = ?; αCO2 = ?; αH2 = ?
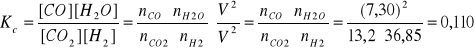
αCO2 = n*CO2/noCO2 = 7,30/20,5 = 0,356
αH2 = n*H2/noH2 = 7,30/44,15 = 0,165
Uwaga: Odpowiedzi podano w skrypcie z dokładnością do dwóch cyfr znaczących, ale poprawnie należy je podać z dokładnością do trzech cyfr znaczących!
16/108
Cstały + CO2 = 2 CO
pcałk = pCO + pCO2
pCO2 = pcałk - pCO
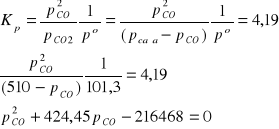
Po rozwiązaniu równania kwadratowego otrzymujemy:
pCO = 299,2 kPa; pCO2 = 210,8 kPa
Na tej podstawie obliczamy ułamki molowe CO i CO2 w mieszaninie równowagowej, które po pomnożeniu przez 100 dają skład mieszaniny w procentach molowych, które są identyczne z jej składem wyrażonym w procentach objętościowych:
p[%]CO = (299,2/510)·100 = 58,7% obj.; p[%]CO2 = 41,3% obj.
18/108
N2 + 3 H2 = 2 NH3
noN2 = 1 mol, noH2 = 3 mol
T = 530 K, pcałk = 500 kPa
W stanie równowagi: xNH3 = 0,183
Warunki |
N2 |
H2 |
NH3 |
Stan początkowy, noi |
1 |
3 |
- |
Reakcja, n*i |
-a |
-3a |
2a |
Stan równowagi, ni |
1-a |
3-3a |
2a |
Ułamki molowe w stanie równowagi |
0,204 |
0,613 |
0,183 |
Suma liczności reagentów w stanie równowagi:
Σni = 1 - a + 3 - 3a + 2a = 4 - 2a
Z definicji ułamka molowego amoniaku w stanie równowagi mamy:
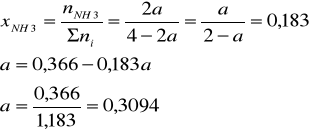
Obliczamy ułamki molowe azotu i wodoru w mieszaninie w stanie równowagi:
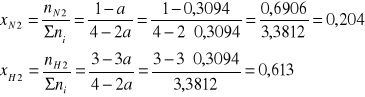
pi = xi·pcałk
pNH3 = 91,5 kPa
pN2 = 102 kPa
pH2 = 306,5 kPa
25/109
Br2 = 2 Br
T = 1830 K, Kp = 1,60
moBr2 = 235 g, MBr2 = 159,818 g/mol; noBr2 = 235/159,818 = 1,470 mol
W stanie równowagi: αBr2 = 0,315
αBr2 = n*Br2/noBr2
n*Br2 = αBr2· noBr2 = 1,470·0,315 = 0,463 mol
Warunki |
Br2 |
Br |
Stan początkowy, noi |
1,470 |
- |
Reakcja, n*i |
-0,463 |
+2·0,463 |
Stan równowagi, ni |
1,007 |
0,926 |
Ułamki molowe w stanie równowagi |
0,521 |
0,479 |
Σni = nBr2 + nBr = 1,007 + 0,926 =1,933 mol
xBr2 = nBr2/ Σni = 1,007/1,933 = 0,521
xBr = 1 - 0,521 = 0,479
pcałk = ?
pi = xi·pcałk
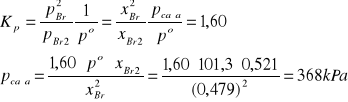
pBr2 = 0,521·368 = 192 kPa
pBr = pcałk - pBr2 = 176 kPa
27/109
2HI = H2 + I2
T = 860 K, pcałk = 95,0 kPa, Kp = 0,0269
moHI = 31,98 g, MHI = 127,912 g/mol
noHI = 0,2500 mol
Warunki |
HI |
H2 |
I2 |
Stan początkowy, noi |
0,2500 |
- |
- |
Reakcja, n*i |
-a |
+ 0,5a |
+0,5a |
Stan równowagi, ni |
0,2500 - a |
0,5a |
0,5a |
Ułamki molowe w stanie równowagi |
0,7530 |
0,1235 |
0,1235 |
Σni = 0,2500 - a + 0,5a + 0,5a = 0,2500
xHI = (0.2500 - a)/0,2500
xH2 = xI2 = 0,5a/0,2500
pi = xi·pcałk
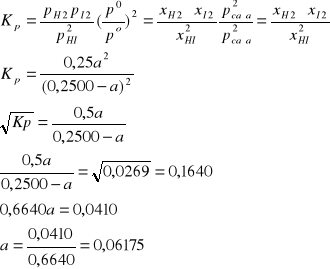
xHI = 0,1882/0,2500 = 0,7530
xH2 = xI2 = 0,06175/2*0,2500 = 0,1235
pi = xi·pcałk = ciRT
ci = xi·pcałk/RT
cHI = 0,7530·95,0·103/8,314·860 = 10,0 mol/m3
cH2 = cI2 = 0,1235·95,0·103/8,314·860 = 1,64 mol/m3
Wyszukiwarka
Podobne podstrony:
Rozwiązania zadań - temat 12, Rozwiązania zadań - temat 13
Rozwiązanie zadania z fizyki 12 11 Bogdan Mendel Janusz Mendel Fizyka i Astronomia I Liceum Nowa Era
temat 12, chemia wody-w-
bank temat 12 slajdy
Temat 12 Selekcje szkolne konspekt, Socjologia edukacji
sprawozdanie temat 12-[ www.potrzebujegotowki.pl ], Ściągi i wypracowania
TEMAT 12 Choroby nowotworowe
Temat 12 wcięcie przestrzenne GeoII-Temat11-MaF
Temat 12 i 13 korporacje transnarodowe, IV semestr, Międzynarodowe stosunki gospodarcze, OPRACOWANE
Gimnazjum przekroj, odp do zadań testowych 7-12, KSZTAŁT I SYMETRIA
TEMAT 12, TEMAT 12: STRONA BRZMIENIOWA WYPOWIEDZI LITERACKIEJ
12. niewola egipska karta pracy, Klasa I Gimnazjum, Temat 12
TEMAT 12, Na zajęcia - różne
KAPITAŁ LUDZKI I ZASOBY SPOŁECZNE WSPÓŁCZESNEJ WSI temat 12, MIASTO I WIEŚ
Temat 12, STRAŻ, OSP Szkolenie część I
więcej podobnych podstron