ZAKŁAD CHEMII FIZYCZNEJ
LABORATORIUM STUDENCKIE
ĆWICZENIE 12
RÓWNOWAGA FAZOWA CIECZ - CIECZ W UKŁADZIE TRÓJSKŁADNIKOWYM
Wyznaczanie izotermy rozpuszczalności w układzie chloroform - woda - kwas octowy.
Wyznaczanie cięciwy równowagi.
WYPOSAŻENIE ĆWICZENIA:
CZĘŚĆ I
Szkło: 10 kolb stożkowych 3 biurety
termometr
Odczynniki: woda destylowana
chloroform
kwas octowy ok. 100%
CZĘŚĆ II
Szkło: wkraplacz
2 naczynka wagowe
2 pipety 5 cm3
2 kolbki miarowe 250 cm3
Odczynniki: 0.05 m NaOH
Fenoloftaleina roztwór 1%
WSTĘP:
Układ cieczy o ograniczonej rozpuszczalności wzajemnej.
Nie wszystkie ciecze mieszają się tworząc roztwór homogeniczny. Znane są układy cieczy mieszających się częściowo. Układ dwuskładnikowy utworzony z dwóch faz ciekłych i pozostającej w równowadze z nimi pary, ma jeden stopień swobody. W stałej temperaturze określono składy dwóch warstw ciekłych, a także prężność i skład pary nad cieczą. Układy o ograniczonej rozpuszczalności wzajemnej wykazują duże odchylenia od prawa Raoulta. Mieszaniny dające odchylenia dodatnie są bardzo często spotykane i stanowią większość wszystkich przypadków. Gdy stosunek sił między cząsteczkowych będzie odwrotny pojawia się odchylenie ujemne.
Gdy w przypadku mieszania się dwu cieczy siły międzycząsteczkowe ulegają zmniejszeniu, wówczas cząsteczkom łatwo jest przejść do fazy gazowej i w związku z tym nastąpi wzrost sumarycznej prędkości pary nasyconej. Jeśli natomiast siły te się zwiększą to cząsteczki będą mocniej przytrzymywane w cieczy, co wpłynie na obniżenie prężności pary mieszaniny.
Prawo podziału.
Współczynnik podziału wiąże się z procesem rozpuszczania substancji A w układzie dwóch niemieszających się cieczy, rozdzielonych powierzchnią międzyfazową. Proces przedstawia rysunek
Faza 2
Faza 1
Rys. 1 Schemat podziału substancji (A) między fazę (1) i (2).
Rozpuszczalność substancji (A) zależy od właściwości fizykochemicznych poszczególnych faz. Stąd należy oczekiwać , że ilość rozpuszczonego składnika (A) będzie różna w poszczególnych fazach. Proces podziału ( przeniesienia) przez powierzchnię międzyfazową z fazy (1) do fazy (2) ( lub odwrotnie) trwa tak długo, aż ustali się równowaga termodynamiczna, wtedy potencjały chemiczne składnika (A) przy p, T = const w obu fazach są sobie równe:
μ A(1)= μA(2)
Potencjał chemiczny składnika (A) w każdej z faz jest funkcją aktywności
wobec tego:
![]()
gdzie:
![]()
i ![]()
- standardowe potencjały chemiczne substancji (A) w fazie (1) i (2)
![]()
i ![]()
- aktywność substancji (A) w fazie (1) i (2)
Po przekształceniu równania (2) otrzymujemy ogólną postać prawa podziału Nernsta:

lub
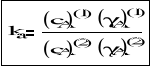
gdzie: ka - termodynamiczny współczynnik podziału
cA(1),cA(2) - stężenie molowe substancji (A) w fazie (1) i (2)
γA(1), γA(2)- współczynnik aktywności
Dla małych stężeń cA → 0 ( współczynnik aktywności γi = 1) otrzymujemy:
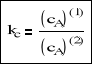
Stałą kc nazywamy współczynnikiem podziału Nernsta. Wartość współczynnika podziału Nernsta kc dla roztworów rozcieńczonych jest zbliżona do wartości termodynamicznego współczynnika podziału ka.
kc ≈ ka
z reguły faz:
z= s - f + 2
gdzie :
z- liczba stopni swobody
s- liczba składników niezależnych
f- liczba faz.
W przypadku układu trójskładnikowych, w stałej temperaturze i pod stałym ciśnieniem (pozwala to usunąć te parametry z równania i uprościć je do postaci: z = 3 - f), liczba stopni swobody może osiągnąć wartość 2. Ułamki molowe lub procenty wagowe dwóch składników trzeba jako zmienne niezależne odkładać na dwóch osiach wykresu fazowego. Stężenie trzeciego składnika wymagałoby trzeciej osi , tak związanej z poprzednimi, by odczytywane na niej wartości stanowiły dopełnienie do 1 lub 100% sumy dwóch pozostałych stężeń.
Do tego celu wykorzystano trójkąt równoboczny zwany trójkątem stężeń Gibbsa. Znajduje on zastosowanie w badaniach nad równowagami fazowymi ustalającymi się między trzema cieczami o ograniczonej mieszalności ( rozpuszczalności wzajemnej).
CEL ĆWICZENIA:
Określenie zakresu stężeń , w którym występuje ograniczona mieszalność dla układu kwas octowy + woda + chloroform poprzez miareczkowanie odpowiedniego roztworu dwuskładnikowego z pomocą trzeciego składnika. symptomem wydzielenia się drugiej fazy ciekłej jest łatwo zauważalne zmętnienie.
WYNIKI:
CZĘŚĆ II
Po zmieszaniu składników w ilości :
kwas octowy 15 cm3
chloroform 30 cm3
woda 12 cm3
otrzymano mieszaninę składającą się z dwóch warstw.
Zawartość CH3COOH w poszczególnych warstwach obliczamy ze wzoru:
![]()
Dla warstwy dolnej:
![]()
![]()
i -1, 2 warstwa
ViNaOH - objętość zmiareczkowanego NaOH
Dla warstwy dolnej (A)- 4,4 cm3
Dla warstwy górnej (B)- 13,3 cm3
Zawartość CH3COOH dla warstwy chloroformowej wynosi 41.66%
Zawartość CH3COOH dla warstwy wodnej wynosi 12.96 %.
CZĘŚĆ I
Nr próbki |
Objętość w cm3 |
% wag. w roztworze |
% molowy w roztworze |
||||||
|
H2O |
CH3COOH |
CHCl3 |
H2O |
CH3COOH |
CHCl3 |
H2O |
CH3COOH |
CHCl3 |
1 |
0.5 |
5 |
30 |
0,9891 |
10,4065 |
88,6043 |
5,65628 |
17,855 |
76,4887 |
2 |
0.8 |
7 |
20 |
2,1039 |
19,3684 |
78,5277 |
10,6422 |
29,3945 |
59,9633 |
3 |
1.6 |
8 |
14 |
5,1749 |
27,2225 |
67,6026 |
21,9761 |
34,6855 |
43,3384 |
4 |
3.55 |
11 |
10 |
11,812 |
38,5091 |
49,6784 |
38,2703 |
37,433 |
24,2968 |
5 |
5.4 |
14 |
10 |
15,402 |
42,013 |
42,5846 |
44,7274 |
36,6047 |
18,6679 |
6 |
5.56 |
12.5 |
6 |
20,094 |
47,5304 |
32,375 |
51,206 |
36,3399 |
12,4541 |
7 |
12.4 |
13 |
4 |
38,690 |
42,676 |
18,6336 |
71,2432 |
23,5772 |
5,17961 |
8 |
15.9 |
14 |
2 |
47,2997 |
43,8176 |
8,88274 |
76,5524 |
21,2774 |
2,17024 |
9 |
18.65 |
14 |
1.5 |
52,3598 |
41,3529 |
6,28733 |
79,6757 |
18,88 |
1,44429 |
10 |
31.5 |
14 |
1 |
66,0067 |
30,8648 |
3,12848 |
87,1497 |
12,2268 |
0,62355 |
WNIOSKI:
Trójkąt równoboczny Gibbsa znajduje zastosowanie w badaniach równowag fazowych ustalającymi się pomiędzy trzema cieczami o ograniczonej mieszalności ( rozpuszczalności wzajemnej).
Określenia zakresu stężeń , w którym występuje ograniczona mieszalność, można dokonać przez miareczkowanie odpowiedniego roztworu dwuskładnikowego z pomocą trzeciego składnika. Na przykład kwas octowy i chloroform tworzą parę cieczy o nieograniczonej mieszalności, nie miesza się natomiast z chloroformem, uzyskuje się wydzielenie drugiej fazy ciekłej, czego symptomem jest łatwo zauważalne zmętnienie.
(A)(2)
(A)(1)
Wyszukiwarka
Podobne podstrony:
sprawozdanie 3, Zakład Chemii Fizycznej
2lab Chemii Fizycznej26, Zakład Chemii Fizycznej
ZAKŁAD CHEMII FIZYCZNEJ 21, Studia, Politechnika
FIZYKOCHEMIA, cwiczenie 38, Zakład Chemii Fizycznej
MOJE9, ZAKŁAD CHEMII FIZYCZNEJ
ZakBad Chemii Fizycznej 19, Zakład Chemii Fizycznej
SPRAWOZDANIE nr 14(1), ZAJKŁAD CHEMII FIZYCZNEJ
Sprawozdanie 12 do druku, Studia, Chemia fizyczna, Laborki, 12 - Równowaga fazowa ciecz-para
Zależność stałej równowagi reakcji od temperatury sprawozdanie, Politechnika Poznańska, Laboratorium
Zależność stałej równowagi reakcji od temperatury sprawozdanie 2, Politechnika Poznańska, Laboratori
Sprawozdanie z Laboratorium Chemii Fizycznej æw211 (3)
chemia fizyczna wykłady, sprawozdania, opracowane zagadnienia do egzaminu Zagadnienia do egzaminu
sprawozdanie z chemii fizycznej cw 42
SPRAWOZDANIE Z CHEMII FIZYCZNEJ, II rok, chemia fizyczna
12 Zakladanie pasiekiid 13664 Nieznany (2)
więcej podobnych podstron