Ćwiczenie
Temat: Izolacja i identyfikacja gronkowców
Staphylococcus aureus jest Gram-dodatnim ziarniakiem o średnicy ok.
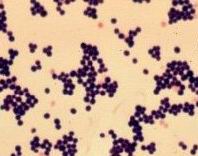
1 μm. W preparatach mikroskopowych przygotowanych z hodowli płynnych i stałych, obok pojedynczych komórek, obserwuje się charakterystyczne skupiska przypominające grona. Inną typową dla S. aureus cechą jest żółte zabarwienie kolonii na podłożach stałych, przy czym wytwarzanie barwnika zależy od składu podłoża, temperatury i światła.
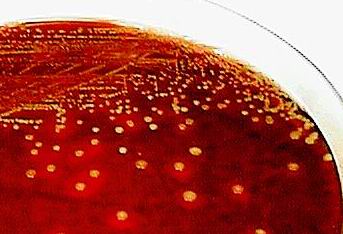
Hodowla laboratoryjna gronkowca nie sprawia raczej trudności. Do wzrostu wymagane są warunki tlenowe oraz temperatura 37˚C. Zwykle wykorzystuje się podłoża agarowe wzbogacone krwią, ze względu na zdolność S. aureus do hemolizy krwinek (typu β).
Identyfikację gronkowca złocistego w laboratoriach mikrobiologicznych przeprowadza się rutynowo z zastosowaniem prostych testów diagnostycznych. Przykładowa procedura postępowania przedstawiona jest na rysunku 1, natomiast w tabeli 1 umieszczono inne użyteczne w badaniach cechy S. aureus.
Tab. 1. Właściwości wykorzystywane w różnicowaniu gatunków rodzaju Staphylococcus.
Właściwości |
S. aureus. |
Beztlenowy rozkład mannitolu |
+ |
Rozkład sacharozy w war. tlenowych |
+ |
Rozkład trehalozy w war. tlenowych |
+ |
Wytwarzanie α-toksyny |
+ |
Wytwarzanie termostabilnej nukleazy |
+ |
Wytwarzanie acetoiny |
+ |
Zapotrzebowanie biotyny do wzrostu |
− |
Zawartość rybitolu w ścianie |
+ |
Zawartość glicerolu w ścianie |
− |
Aktywność kwaśnej fosfatazy |
+ |
Wrażliwość na nowobiocynę |
MIC 0,6 μg/l |
Rys. 1. Schemat identyfikacji S. aureus.
![]()
![]()
![]()
![]()

Fot. 1. Wzrost S. aureus na podłożu agarowym z krwią
Fot. 2. Preparat mikroskopowy komórek S. aureus barwiony metodą Grama
Fot. 3. Wynik testu na obecność enzymu katalazy - rozkład H2O2
Fot. 4. Wynik testu na obecność enzymu koagulazy - aglutynacja osocza
Staphylococcus aureus jako czynnik etiologiczny
Gronkowiec złocisty jest jednym z najczęściej izolowanych patogenów człowieka. Zakażenia dotyczą przede wszystkim skóry i tkanek podskórnych, zwykle z udziałem procesu ropnego (czyraki, trądzik, jęczmień, liszajec zakaźny, toksyczna nekroliza naskórka, róża, cellulitis, zapalenie mieszków włosowych, gronkowcowy zespół oparzonej skóry).
Infekcje gronkowcowe stanowią poważny problem, zwłaszcza w szpitalach, gdzie często dochodzi do zagrażających życiu zakażeń, takich jak syndrom szoku toksycznego, ropnie mózgu, zapalenie płuc, wsierdzia, szpiku kostnego i kości, opon mózgowych, mięśnia sercowego, żył. Często dochodzi też do infekcji układu moczowego. Ponadto u pacjentów po zabiegach chirurgicznych oraz osób z obniżoną odpornością, zakażenie gronkowcowe może przejść w postać uogólnionej posocznicy.
Rozprzestrzenianiu S. aureus sprzyja bezobjawowe nosicielstwo. Szacuje się, że co najmniej 10% ludzi zdrowych to stali nosiciele gronkowca złocistego, zaś 70 - 90% należy do tzw. nosicieli przejściowych. Bakteria zasiedla głównie błony śluzowe nosa oraz gardło.
Chorobotwórczość S. aureus uwarunkowana jest wytwarzaniem przez ten drobnoustrój szeregu enzymów i toksyn, a także obecnością otoczki oraz pewnych powierzchniowych białek i receptorów. Czynniki te umożliwiają gronkowcowi efektywną kolonizację i uszkadzanie tkanek gospodarza. Najważniejsze produkty sekrecyjne gronkowca odpowiedzialne za jego patogenność zestawiono w tabeli 2.
Dodatkowo S. aureus zdolny jest do łatwego nabywania oporności na antybiotyki. Cecha ta jest kodowana chromosomalnie lub wiąże się z obecnością w komórce plazmidu niosącego geny oporności. Obecnie coraz częściej obserwuje się występowanie szczepów wielolekoopornych, co utrudnia skuteczne leczenie infekcji gronkowcowych
Tab. 2. Właściwości wybranych enzymów i toksyn S. aureus.
Enzym / toksyna |
Właściwości |
Acetoina |
Decyduje o zjadliwości |
Hialuronidaza |
Powoduje rozkład substancji międzykom., przez co umożliwia w tkankach penetrację innych czynników chorobotwórczości |
Enterotoksyny A-F |
Odpowiada za zatrucia pokarmowe |
Fosfataza |
Determinuje patogenność |
Fosfolipaza |
Decyduje o zjadliwości |
Katalaza |
Rozkłada H2O2 do tlenu i wody |
Koagulaza |
Odpowiada za krzepnięcie krwi |
Leukocydyny |
Niszczą leukocyty - ochrona przed sfagocytowaniem |
Lipazy |
Uczestniczą w patogenezie zmian ropnych skóry |
Nukleazy |
Odpowiadają za uszkodzenie kw. nukleinowych |
Penicylinaza |
Rozkłada wiązania β-laktamowe w podstawowej strukturze antybiotyków z grupy penicylin |
Proteinazy |
Odpowiadają za chorobotwórczość |
Stafylokinaza |
Rozpuszcza fibrynę |
Toksyna α |
Powoduje Lizę erytrocytów i uszkadza płytki krwi |
Toksyna β |
Uszkadza erytrocyty |
Toksyna γ |
Uszkadza lizosomy |
Toksyna pirogenna |
Odpowiada za gorączkę |
Toksyna epidermolityczna |
Odpowiada za uszkodzenie naskórka w liszaju i gronkowcowym zespole oparzonej skóry (ang.SSSS) |
T. zespołu wstrząsu toksycznego 1 i 2 |
Odpowiadają za wstrząs toksyczny |
Część praktyczna: materiały
Szczepy S.aureus MSSA i MRSA (referencyjne i kliniczne) na podłożu stałym (agarowym) i płynnym; Staphylococcus epidermidis na podłożu płynnym
Podłoża agarowe zwykłe 12 płytek
Podłoże krwawe na hemolizę 2 sztuki
Podłoże Chapmana 12x2
Podłoże na fermentację glukozy 12x2
Sól fizjologiczna, woda jałowa
Szkiełka podstawowe 24 sztuki
Probówki serologiczne( 6 x 2 )+ 1 sztuk
Test lateksowy
Woda utleniona
Osocze królicze stosuje się w diagnostyce gronkowców w testach:
szkiełkowym - do oznaczania gronkowców wytwarzających czynnik zlepny clumping factor (koagulaza związana),
probówkowym - do oznaczania szczepów gronkowców zdolnych do produkcji pozakomórkowego enzymu koagulazy, powodującej krzepnięcie osocza króliczego (koagulaza wolna)
Potencjalnie chorobotwórcze szczepy S.aureus wytwarzają przeważnie oba te czynniki.
Ampułkę rozpuścić w 1.8 ml jałowej wody destylowanej
Oznaczanie gronkowcowego clumping factor metodą szkiełkową:
na szkiełku podstawowym umieścić obok siebie dwie krople fizjologicznego roztworu chlorku sodowego,
w obu kroplach zawiesić za pomocą ezy badane bakterie pochodzące z hodowli na podłożu agarowym, zawiesina powinna być gęsta, w przybliżeniu odpowiadać wyglądowi mleka
do jednej kropli zawiesiny dodać za pomocą ezy (1 oczko0 osocza króliczego i delikatnie wymieszać
Oznaczanie koagulazy metodą probówkową:
do oznaczeń stosuje się osocze królicze 5x jałowym, fizjologicznym roztworem chlorku sodowego
do 0.5 ml osocza dodać 0.5 ml hodowli bulionowej
w taki sam sposób przygotować próbę kontrolną ze szczepami koagulazo-dodatnimi i koagulazo - ujemnymi
inkubować w temperaturze +37
wynik testu odczytać po 1,3, 6, 24 godzinach
Odczyt i interpretacja wyników:
Oznaczanie clumping factor
W ciągu kilkunastu sekund powinny pojawić się wyraźne kłaczki, co dowodzi obecności clumping factor. Zawiesina bakterii bez osocza powinna pozostawać homogenna, pojawienie się kłaczków w zawiesinie bez osocza świadczy o autoaglutynacji bakterii i nie może być podstawą do przyjęcia ujemnego lub dodatniego wyniku.
Oznaczenie koagulazy
Szczepy koagulazo-dodatnie Staphylococcus aureus powodują powstanie w probówce wyraźnego skrzepu, natomiast koagulazo-ujemne nie powodują krzepnięcia osocza.
Wynik testu obserwować we wskazanym powyżej czasie, ponieważ po dłuższej inkubacji, , w niektórych przypadkach może nastąpić rozpuszczenie skrzepu przy udziale wytwarzanego przez gronkowce aktywatora plazmowego.
Slidex Staph Plus (bioMerieux)
Zasada działania
Odczynnik zawiera cząsteczki niebieskiego lateksu uczulone ludzkim fibrynogenem i przeciwciałami monoklonalnymi.
Dlatego jest możliwe wykrywanie równoczesne:
clumping factor
białka A, dzieki uzyciu fragmentu Fc IgG myszy
grupowo specyficznego antygenu związanego ze strukturami powierzchniowymi S.aureus
Wynik pozytywny dla S.aureus obserwuje się jako widoczną aglutynację, bez użycia szkła powiększającego.
Odczynniki:
R1 lateks do wykrywania S.aureus - lateks uczulony ludzkim fibrynogenem i przeciwciałami monoklonalnymi anty- S.aureus
R2 negatywna kontrola lateksowa
Wybrać dwa sąsiadujące pola reakcyjne na karcie i opisć je numerami
Na jedno pole nanieść 1 kroplę R1, na drugie R2. Nakrapiając odczynnik trzymać butelkę w pozycji pionowej
Używając dwóch różnych pałeczek nanieść na każde z dwóch pól reakcyjnych kolonie bakteryjne:1-2 śre3dniej wielkości z niewybiórczego podłoza lub 3-6 małych koloni z podłoża Chapmana
Mieszać przez 10 sekund, rozetrzeć lateks na całej powierzchni pola reakcyjnego
Przez 20 sekund powoli obracać kartą, obserwując powstawanie aglutynacji
Pastorex Staph-plus (czerwone kuleczki) Bio-Rad - test aglutynacji lateksowej do identyfikacji S.aureus. Służy do detekcji następujących czynników
clumping factor (czynnik wiążący fibrynogen)
białko A, które wykazuje powinowactwo do fragmentu Fc gamma immunoglobuliny IgG
otoczki polisacharydowe
Odczynnik jest kompozycją lateksowych cząsteczek opłaszczonych fibrynogenem, IgG, specyficznymi monoklonalnych przeciwciałami przeciw otoczkom polisacharydowym.
Test na katalazę
Test na katalazę - na szkiełko podstawowe nakładamy ezą kroplę soli fizjologicznej i szczep bakterii, następnie zalewamy to wodą utlenioną. Jeśli pojawią się bąbelki znaczy to, że szczep ten jest katalazo (+).
Test na DNAzę - szczep bakterii na szalce Petriego zalewa się 10% HCl, co powoduje denaturację DNA.
Staphylococcus aureus Growing on DNase Agar
Note there is breakdown of the DNA in the agar. There is a clear zone (arrow) around the bacterial growth where there is no longer any DNA left in the agar to precipitate out of solution after the HCl was added.
|
|
|
|
||
|
The Staphylococus aureus on the left is negative for DNase production; the Serratia marcescens on the right is positive for DNase production as evidenced by the area of clearing around the growth. |
|
|
The Staphylococcus aureus ferments mannitol and turns the medium yellow. The Serratia marcescens does not grow because of the high salt content.
Streptococcus agalactiae does not grow on MSA because of the high salt content. Staphylococcus epidermidis grows but does not ferment mannitol.
Test na fermentację glukozy na podłożu Hugh i Leifsona (omówiony na ćwiczeniu)
|
6
Badany materiał
Posiew na podłoże agarowe z krwią
24h, 37°C
Określanie morfologii kolonii
Barwienie preparatu metodą Grama
Próba na katalazę (+)
Próba na wytwarzanie koagulazy (+)
Wyszukiwarka
Podobne podstrony:
25 Wyklad 1 Dlaczego zwiazki sa wazne
Przemiany aminokwasów w biologicznie ważne, wyspecjalizowane produkty
Co jest wazne w internetowym marketnigu 2
PŁACHTA WAŻNE
DZIECKO W CYBERPRZESTRZENI, Ważne dla sudenta, Studia pedagogika
Zakażenia ważne w stomatologii, Mikrobiologia
2 Ważne rolniczo trawy
ważne punkty orientacyjne w układzie człowieka i ich zastosowanie w praktyce
Układ pokarmowy spełnia bardzo ważne zadanie
Epidemiologia ważne 2
Mikrofony z Tu 154 Nie wszystko co ważne stało się w kabinie
Ważne postacie Nowego Testamentu
WAŻNE DLA KAŻDEGO PIT 08 Ulgowe żniwa
0001 Ważne strony internetowe
Kontrola chemikaliów ważne pojęcia
4) Ważne postacie ZSRR
Co jest naprawdę ważne w internetowym marketingu
B WAZNE PRAWO ADMIN
zakazne, WAZNE-DIETA-CHOROBY
Jak ssać olej(1), ZDROWIE-Medycyna naturalna, 1-Ziołolecznictwo-ogólnie ważne
więcej podobnych podstron