Siła elektromotoryczna ogniwa, SEM, różnica potencjałów dwóch półogniw otwartego ogniwa elektrochemicznego (przez ogniwo nie płynie prąd, znajduje się ono w stanie równowagi). Źródłem SEM są reakcje przebiegające w półogniwach (ich suma nosi nazwę reakcji ogniwa). SEM zależy od aktywności jonowej składników półogniw,
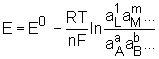
temperatury i ciśnienia. Może być wyliczona z równania Nernsta: gdzie: E0 - standardowa SEM ogniwa równa różnicy potencjałów standardowych półogniwa prawego i lewego, R - stała gazowa, T - temperatura bezwzględna, n - liczba elektronów wymienianych podczas jednego stechiometrycznego przebiegu reakcji ogniwa, F - stała Faradaya (elektroliza), aL, aM - aktywności produktów, aA, aB aktywności substratów, l, m, a, b - wykładniki potęgowe równe współczynnikom stechiometrycznym w równaniu reakcji ogniwa. Znak SEM jest dodatni, gdy zapis reakcji ogniwa (a więc i schematu ogniwa) odpowiada jej samorzutnemu przebiegowi.
Aby dokonywać pomiarów różnic potencjałów dwóch półogniw jest konieczne wyznaczenie punktu odniesienia. Takim punktem jest SPW. Półogniwo wodorowe nosi nazwę standardowego gdy:
stężenie jonów wodorowych wynosi 1mol/dm3,
ciśnienie wodoru równe jest 1013 hPa. Półogniwu o takich właściwościach przypisuje się potencjał równy zeru w każdej temperaturze.
W półogniwie powstaje równowaga chemiczna w postaci H2(g)<=>2H++2e-.
Anoda
1)w ogniwie galwanicznym elektroda pobierająca elektrony z obszaru międzyelektrodowego; zachodzi na niej reakcja utleniania; jest elektrodą ujemną;
2) w przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np. elektrolizerze) elektroda odprowadzająca ujemne nośniki prądu z obszaru międzyelektrodowego; połączona z dodatnim biegunem zewnętrznego źródła prądu jest elektrodą dodatnią.
Katoda
1) w ogniwie galwanicznym elektroda oddająca elektrony do obszaru międzyelektrodowego; zachodzi na niej proces redukcji; jest elektrodą dodatnią;
2) w przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np. elektrolizerze) elektroda doprowadzająca ujemne nośniki prądu do obszaru międzyelektrodowego; połączona z ujemnym biegunem zewnętrznego źródła prądu - jest elektrodą ujemną
Wśród elektrod rozróżniamy elektrody pierwszego i drugiego rodzaju. Potencjał elektrodowy elektrod pierwszego rodzaju jest wynikiem wysyłania lub przyjmowania przez metal jonów dodatnich z roztworu elektrolitu. Elektrody pierwszego rodzaju są więc odwracalne wzgledem kationów.
Przykładem takich elektrod są znane już nam, elektroda cynkowa i miedziana, a także elektroda węglowa, która jest odwracalna względem jonów wodorowych.
Elektrody drugiego rodzaju składają się z metalu jego trduno rozpuszczalnej soli oraz elektrolitu zawierającego aniony wchodzące w skład trudno rozpuszczalnej soli.
Przykładem elektrody drugiego rodzaju jest elektroda kalomelowa.
Elektroda ta składa się z naczyńka, w którym w charakterze kontaktu, umieszczony jest drucik platynowy, zanurzony w rtęci znajdującej się na dnie naczynia. Rtęć pokryta jest warstwą mieszaniny rtęci i chlorku rtęciowego Hg2Cl2 (kalomel) a nad tą mieszaniną znajduje się roztwór chlorku potasu KCl (rys. 9.4).
Rys.9.4 Schemat elektrody kalomelowej
Budowę elektrody kalomelowej mozna przedstawić następującym schematem.
Hg, Hg2Cl2(st) // KCl
a procesy na niej zachodzące wyraża równanie
2Hg + 2Cl- <=> Hg2Cl2 + 2e
O potencjale elektrody kalomelowej decyduje stężenie jonów chlorkowych, wobec których jest odwracalna. Stężenie jonów chlorkowych w roztworze KCl, którym elektroda jest wypełniona, wpływa na stężenie jonów rtęciowych z uwagi na to, że iloczyn rozpuszczalności kalomelu
LHg2Cl2(st) = CHg2+ * C2Cl-
ma wartość stałą w niezmiennej temperaturze.
Im większe jest stężenie jonów chlorkowych, tym mniejsze jest stężenie jonów rtęciowych i tym mniejszy potencjał elektrody. Elektroda kalomelowa może być użyta zarówno jako anoda jak i katoda.
W przypadku, gdy w jakimś ogniwie jest anodą, wówczas podczas pracy ogniwa ulega utlenieniu i przechodzi do roztworu w postaci jonów Hg22+, które z jonami Cl- pochodzącymi od KCl tworzą trudno rozpuszczalny osad Hg2Cl2(st). Jeżeli natomiast stanowi ona katodę, wówczas jony Hg22+ pochodzące z kalomelu redukują się do metalicznej rtęci, przy czym wzrasta stężenie jonów chlorkowych.
Ogniwo chemiczne (galwaniczne) - połączenie dwóch różnych półogniw chemicznych, po których połączeniu zewnętrznym przewodnikiem w układzie nastąpi przepływ elektronów
Półogniwo chemiczne (galwaniczne) - część ogniwa zbudowana z elektrody, przewodnika metalicznego i roztworu, w którym zanurzona jest elektroda
Elektroda - faza metaliczna półogniwa
Anoda - elektroda, na której biegnie proces utlenienia; ma ładunek ujemny
Katoda - elektroda, na której biegnie proces redukcji; ma ładunek ujemny
Elektrolit katodowy - elektrolit, w którym zanurzona jest katoda
Elektrolit anodowy - elektrolit, w którym zanurzona jest anoda
Klucz elektrolityczny - zazwyczaj wygięta rurka, wypełniona roztworem KCl lub innej soli, zamknięta z obu stron membraną, łącząca dwa półogniwa działająca w różnych roztworach
Siła elektromotoryczna ogniwa (SEM) - różnica potencjałów wewnętrznych jednakowych przewodników połączonych z elektrodami ogniwa mierzona przy ogniwie niepracującym
Półogniwo pierwszego typu - półogniwo składające się z metalicznej płytki i roztworu zawierającego jony metalu ją budującego
Półogniwo drugiego typu - półogniwo zbudowane z metalu pokrytego warstwą swojej trudno rozpuszczalnej soli, zanurzonego w roztworze zawierającego jony tej soli
Półogniwo redoks - półogniwo, w którym materiał elektrody nie bierze udziału w reakcji elektrodowej
Półogniwo metalowe - półogniwo, w którym materiał elektrodu bierze udział w reakcji elektrodowej
Półogniwo gazowe - półogniwo zbudowane z metalu szlachetnego, na który wdmuchiwany jest gaz, i roztworu zawierającego jony wdmuchiwanego gazu
Potencjał standardowy ogniwa - potencjał półogniwa pracującego w warunkach standardowych (p=1013 hPa, T=298 K) w roztworze 1-molowym
.Szereg potencjałów napięciowych (szereg elektrochemiczny, potencjałów standardowych) - uporządkowanie potencjałów standardowych półogniw (od najniższego do najwyższego)Stała Farraday'a (F) - 96485 C/mo
lStała gazowa (R) - 8,314 J/(mol*K)
Warunki normalne - p=1013 hPa, T=273 K Warunki standardowe - p=1013 hPa, T=298 K
12.2 Ogniwo galwaniczne. SEM
Jeżeli obie elektrody połączymy przewodnikiem metalicznym to w obwodzie będzie płynął prąd elektryczny. tak zbudowany układ nazywamy ogniwem galwanicznym
Przykład ogniwa galwanicznego został przedstawiony na rys.9.4
Rys.9.3 Schemat ogniwa galwanicznego
Dla przykładu przedstawionego na rys.9.3, w miarę upływu czasu płytka cynkowa zużywa się a na płytce miedzianej wydziela się osad miedzi.
Ogniwo działa w następujący sposób.
Na płytce cynkowej zachodzi utlenianie, a więc cynk jest anodą.
Zn(s) --> Zn2+ + 2e
Jony cynkowe wedrują od powierzchni anody w głąb roztworu, a elektrony poruszają się w przewodniku zgodnie ze strzałką na rysunku. Na płytce miedzianej zachodzi redukcja, a więc jest ona katodą. Elektrony, które docierają przez przewodnik gromadzą się na powierzchni katody, skąd są pobierane i zużywane w reakcji.
Cu2+ + 2e --> Cu(s)
W ten sposób jony miedziowe są usuwane z roztworu, a na ich miejsce dyfundują nowe jony miedziowe. W ogniwie te samorzutnie przebiegajace reakcje wytwarzają prąd elektryczny.
Jeżeli nie ma odpływu elektronów z elektrody, to ustala się równowaga.
Ogólnie dla metalu stan równoawgi można przedstawić równaniem.
M <=> Mn+ + ne
Potencjał elektrody zanurzonej w roztworze jonów tego samego pierwiastka zwany potencjałem utleniająco-redukujacym (potencjał redox), okresla równanie Nernsta
E = Eo + RT/nF * lnaMn+
gdzie: Eo - potencjał normalny, R - stała gazowa, F - stała Faradaya, n - liczba elektronów biorących udział w reakcji utlenienia-redukcji, aMn+ - aktywność molowa kationów metalu w roztworze.
Dla roztworów rozcieńczonych aMn+ = CMn+
Siłę elektromotoryczną ogniwa delta E określa równanie
(delta)E = EMoks - EMred
gdzie EM - potencjał elektrody.
Wykorzystując równanie na potencjał elektrody otrzymamy:
E = Eo + RT/nF * ln(aM2n+ / aM1n+)
= Eo + 0,059/n * lg(aM2n+ / aM1n+)
gdzie: Eo - normalna siła elektromotoryczna ogniwa.
Na przykład normalna siła elektromotoryczna ogniwa prezentowanego na rys.9.3 (ogniwa Daniela), gdy ECuo = 0,34 V, EZno = 0,76 V wyniesie Eo = +0,34V - (-0,76V) = 1,10 V.
Wyszukiwarka
Podobne podstrony:
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
Siła elektromotoryczna ogniwa
Siła elektromotoryczna ogniwa galwanicznego
OGNIWA GALWANICZNE SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNY
elektroenergetykacykl1 Ogniwa P Nieznany
18 Sila elektrostatyczna (10)
sila elektromotoryczna, Fizyka
SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNYCH
Siła elektromotoryczna opór wewn2, Sprawozdania - Fizyka
Siła elektrostatyczna
siŁa-elektrodynamiczna, SIŁA ELEKTRODYNAMICZNA-sila dzialajaca na przewodnik z pradem umieszczony w
4 2 Elementy Elektrochemii Ogniwa
elektroenergetykacykl1, Ogniwa paliwowe - rozdziały
FIZYKA Siła elektrodynamiczna, indukcja, silnik
Pomiar siły elektromotorycznej ogniwa, Akademia Morska Szczecin, SEMESTR II, Fizyka, I semestr
18 siła elektrostatyczna
15 Pomiar siły elektromotorycznej ogniwa i charakterystyka jego pracy
więcej podobnych podstron