Przemysław Woiński
166867
Ochrona Środowiska
BiNoŻ
Data: 4.01.2012r
Godziny zajęć: 12:15 - 16:15
Laboratoria Chemii Fizycznej
ĆWICZENIE NR 26
TEMAT: Kinetyka jodowania acetonu
1. Celem ćwiczenia obliczenie stałej szybkości procesu jodowania acetonu w obecności katalizatora - jonów H+.
2. Wstęp:
Enolami nazywamy związki organiczne w których grupa hydroksylowa (OH) wiąże się z tym węglem, który uczestniczy w podwójnym wiązaniu C=C.
Jodowanie acetonu jest reakcją autokatalizowaną przez jony wodorowe, będące jednym z jej produktów:
Jest to reakcja dwustopniowa:
Etap I ![]()
Etap II ![]()
Reakcja autokatalityczna w swym okresie początkowym tzw. indukcyjnym przebiega bardzo powoli, i dopiero w miarę tworzenia się produktu, jej szybkość zaczyna wzrastać. Szybkość reakcji katalitycznej w okresie początkowym można zwiększyć, wprowadzając do układu pewną ilość produktu katalizującego reakcję.
Stała szybkości wyraża liczbowo szybkość reakcji, gdy stężenie każdego z substratów wynosi 1 mol/l. Przyjmuje się, że stała k jest niezależna od stężenia reagentów i czasu reakcji, natomiast zmienia się z temperaturą i zależy od rodzaju i stężenia katalizatorów.
W zależności od zewnętrznego rzędu reakcji chemicznej stała szybkości przyjmuje różne jednostki wg ogólnego wzoru:
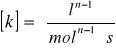
3. Wyniki pomiarów i obliczenia:
I. 2 cm3 acetonu 20 cm3 HCl
t [min.] |
Vt[ml] |
x |
a-x |
b+x |
|
współczynnik k |
|
0 |
14,8 |
0 |
0,1082 |
0,0800 |
-0,3019 |
0 |
|
7 |
13,2 |
0,0064 |
0,1018 |
0,0864 |
-0,1640 |
0,1047 |
|
12 |
12,9 |
0,0076 |
0,1006 |
0,0876 |
-0,1383 |
0,0724 |
|
18 |
12,0 |
0,0112 |
0,0970 |
0,0912 |
-0,0616 |
0,0709 |
|
25 |
8,4 |
0,0256 |
0,0826 |
0,1056 |
0,2457 |
0,1164 |
|
30 |
6,8 |
0,0320 |
0,0762 |
0,1120 |
0,3852 |
0,1217 |
|
36 |
5,1 |
0,0388 |
0,0694 |
0,1188 |
0,5377 |
0,1239 |
|
41 |
3,8 |
0,0440 |
0,0642 |
0,1240 |
0,6584 |
0,1245 |
|
47 |
1,7 |
0,0524 |
0,0558 |
0,1324 |
0,8642 |
0,1318 |
|
II. 2 cm3 acetonu 30 cm3 HCl
t [min.] |
Vt[ml] |
x |
a-x |
b+x |
|
współczynnik k |
0 |
15,8 |
0 |
0,1082 |
0,1200 |
0,1036 |
0 |
5 |
15,1 |
0,0028 |
0,1054 |
0,1228 |
0,1529 |
0,0432 |
10 |
14,8 |
0,0040 |
0,1042 |
0,1240 |
0,1740 |
0,0309 |
15 |
14,3 |
0,0060 |
0,1022 |
0,1260 |
0,2094 |
0,0309 |
20 |
13,1 |
0,0108 |
0,0974 |
0,1308 |
0,2949 |
0,0419 |
26 |
12,5 |
0,0132 |
0,0950 |
0,1332 |
0,3380 |
0,0395 |
31 |
12,0 |
0,0152 |
0,0930 |
0,1352 |
0,3742 |
0,0383 |
Do obliczeń, których wyniki przedstawiłem powyżej w tabeli użyłem wzorów:
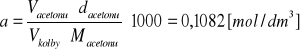
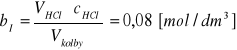
bII = 0,12 [mol/dm3]
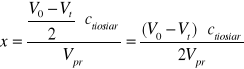
![]()
Współczynnik kierunkowy prostej dla roztworu I i II wynosi odpowiednio a'1 = 0,02551 i a'2 = 0,008991.
Wyznaczam stałą szybkości reakcji (w temperaturze 25 oC) która wynika z zależności:
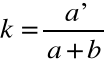
Roztwór I:
![]()
Roztwór II:
![]()
4. Wnioski:
Stała szybkości reakcji jest większa dla roztworu I (1,1355 dm3/mol*s), niż roztworu II (0,03940 dm3/mol*s). Zwiększenie stężenia jonów H+ w roztworze prowadzi do spowolnienia szybkości reakcji.
Niedokładność pomiaru mogła być spowodowana przez niewprawność w miareczkowaniu (niedokładne odmierzanie miareczkowanej objętości Na2S2O3,, oraz upływającego czasu).
Ponadto tak duża rozbieżność wyników między próbkami mogła być spowodowana tym, iż w początkowej fazie doświadczenia, niewyćwiczony w szybkim i dokładnym przestrzeganiu kolejnych punktów instrukcji, mogłem doprowadzić do zachwiania kinetyki reakcji - zbyt długo trzymając badaną próbkę poza termostatem.
![]()
Wyszukiwarka
Podobne podstrony:
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
hk spr numer 23, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
11 wyznaczanie ciepła rozpuszczania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy,
więcej podobnych podstron