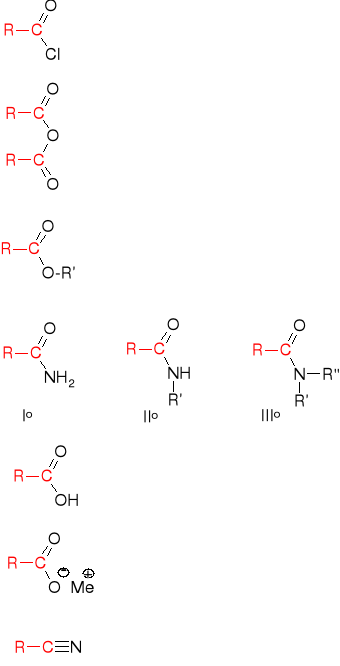
AMIDY KWASOWE
Amidy kwasowe - pochodne kwasów karboksylowych, w których grupa OH- grupy karboksylowej została zastąpiona grupą aminową -NH2
przykłady:
Właściwości fizyczne acetamidu:
-biała krystaliczna substancja
-dobrze rozpuszczalny w wodzie
-odczyn roztworu wodnego obojętny
Reakcje charakterystyczne:
Amidy kwasowe reagują zarówno z kwasami jak i z zasadami, są więc amfolitami. Ich charakter amfolityczny jest spowodowany występowaniem tautomerii amidowo-imidowej, polegającej na wędrówce protonu między grupą aminową i karbonylową. Forma amidowa tworzy połączenia z kwasami dzięki obecności wolnej pary elektronowej na atomie azotu grupy NH2 forma imidowa może reagować z zasadami odszczepiając proton z grupy hydroksylowej.
1. Hydroliza w środowisku kwaśnym (pod wpływem mocnych kwasów nieorganicznych)
2. Hydroliza w środowisku zasadowym (pod wpływem wodorotlenków litowców)
Otrzymywanie:
1. Ogrzewanie kwasów karboksylowych z …
a) z amoniakiem (otrzymywanie amidów I-rzędowych)
b) z aminami I-rzędowymi (otrzymywanie amidów II-rzędowych)
c) z aminami II-rzędowymi (otrzymywanie amidów III-rzędowych)
Elektrofile i nukleofile
Większość reakcji w chemii organicznej możemy rozpatrywać jako reakcje przebiegające między kwasem a zasadą. Reakcje kwasów z zasadami są na ogół reakcjami szybkimi. Natomiast w chemii organicznej niektóre reakcje są szybkie (np. spalania lub addycji bromu do etylenu), inne natomiast wymagają wielogodzinnego ogrzewania (reakcje estryfikacji, eliminacji bromowodoru z bromoalkanu). Z tego względu pomimo, że niektóre cząsteczki możemy zaliczyć do kwasów lub zasad Lewisa, nie możemy ich nazwać kwasami lub zasadami. W chemii organicznej takie cząsteczki nazywa się elektrofilem lub nukleofilem.
Elektrofil - cząsteczka lubiąca centra bogate w elektrony, czyli kwas Lewisa. Centra elektrofilowe charakteryzują się obniżoną gęstością elektronową (np. poprzez efekt indukcyjny innych atomów), lub posiadają sekstet elektronów zamiast oktetu. W przypadku gdy centrum elektrofilowe powstało w wyniku obniżenia gęstości elektronowej, atom będący centrum elektrofilowym musi być połączony z atomem lub grupą łatwo odchodzącą (trwałą termodynamicznie, grupy trwałe termodynamicznie najprościej rzecz ujmując to takie, które istnieją w przyrodzie. OH-, H-, NH2- i ich pochodne nie są trwałe termodynamicznie, nie istnieją w przyrodzie, a zatem nie są grupami odchodzącymi). Elektrofil jest kwasem Lewisa.
Nukleofil - cząsteczka lubiąca jądra atomowe, czyli sama musi posiadać elektrony, za pomocą których może utworzyć wiązanie chemiczne. Centrami nukleofilowymi są atomy, które posiadają pary elektronowe i mogące te pary uwspólnić z elektrofilem. Nukleofil jest zasadą Lewisa.
Elektrofil zawsze reaguje z nukleofilem, a dokładnie centrum elektrofilowe z centrum nukleofilowym. Z wolnej pary elektronowej, która znajduje się na centrum nukleofilowym powstaje wiązanie chemiczne. Bez względu jak bardzo złożone są te reagenty, nowe wiązanie powstaje zawsze pomiędzy elektrofilem i nukleofilem:
Dlatego centra elektrofilowe i nukleofilowe nazywamy centrami reakcyjnymi. Kwaśny atom wodoru zgodnie z definicją podaną powyżej jest elektrofilem lub kwasem Lewisa. Jednakże z uwagi na inny charakter reakcji (często reaguje on o wiele szybciej z silnymi zasadami od innych kwasów Lewisa) wygodniej jest rozpatrywać go oddzielnie. Z tego samego względu, również silne zasady Brønsteda-Lowrye'go rozpatrywane są oddzielnie (reagują one chętnie z kwaśnymi atomami wodoru). W każdym związku organicznym należy zatem odszukać następujące centra reaktywne:
♦ centrum elektrofilowe |
|
|
♦ atom wodoru o charakterze kwasowym |
Właściwości estrów
Podstawową reakcją estrów jest hydroliza a w tym;
reakcja hydrolizy z udziałem wody
reakcja z wodorotlenkami
W przypadku estrów hydroliza jest to proces odwrotny do reakcji estryfikacji. Może przebiegać z udziałem wody ale wtedy konieczny jest udział mocnych kwasów. W przypadku hydrolizy z udzialem mocnych zasad mamy do czynienia z reakcją nieodwracalną. Przykłady:
Produktem reakcji z wodorotlenkiem jest alkohol i odpowiednia sól. W przypadku hydrolizy tłuszczy, produktem jest sól kwasu tłuszczowego i glicerol (gliceryna). Sól którą otrzymujemy nazywamy mydłem - patrz sole kwasów karboksylowych. Hydrolizę tłuszczów nazywamy reakcją zmydlania |
nitryl
nazwa wglowodoru + nitryl (nazwa weglowodoru R + karbonitryl)
sól
-(owy)(i)an + nazwa metalu (aminy)
amid
-(owy)oamid
nazwa grupy acylowej + amid
ester
-(owy)(i)an + nazwa reszty R'
bezwodnik kwasowy
bezwodnik kwasu …
chlorek kwasowy, chlorek -(owy)oilu
wzrost aktywnosci
Wyszukiwarka
Podobne podstrony:
OTRZYMYWANIE AMIDOW Z KWASOW KARBOKSYLOWYCH, Materiały, Chemiczne, Chemia organiczna
Barwniki azotowe, Materiały, Chemiczne, Chemia organiczna
Krystalizacja, Materiały, Chemiczne, Chemia organiczna
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
organiczna-koła, Technologia chemiczna, Chemia organiczna, 3 semestr, 1 kolokwium
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
dyd inz25, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Inżynieria Chemiczna, Chemia Organiczna -
2009 nowy program organiczna, Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotech
NITROANILINY, technologia chemiczna, chemia organiczna 2003,2004
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
więcej podobnych podstron