MONIKA POMYKAŁA GR.LAB 7
Nr. ćwiczenia: 10 |
Tytuł ćwiczenia: OTRZYMYWANIE ESTRÓW METYLOWYCH KWASU BENZOESOWEGO I JEGO POCHODNYCH |
||
Data wykonania:
9.05.2003 r |
Data zaliczenia: |
Ocena:
K:
P:
S:
|
Ocena średnia: |
Przepis literaturowy:
W 100 kolbie okrągłodennej umieszczamy 5 g odpowiedniego podstawionego kwasu benzoesowego, 50 g metanolu oraz ok. 1 ml stężonego kwasu siarkowego. Kolbę łączymy z chłodnicą zwrotną, dodajemy porcelankę i mieszaninę ogrzewamy przez 1-2 godziny. Co pewien czas, np. co 20 min, sprawdzamy postęp reakcji metodą chromatografii cienkowarstwowej na żelu krzemionkowym. Dobór rozpuszczalnika bądź mieszaniny rozpuszczalników do rozwijania chromatogramu zależy od tego, z jaką pochodną kwasu mamy do czynienia i należy go ustalić dla konkretnego przypadku. Przed pobraniem pierwszej próbki znajdujemy rozpuszczalnik, który powoduje w zauważalny sposób przesuwanie się plamy kwasu. Ester jako mniej polarny ma większą wartość RF i wędruje na chromatogramie znacznie szybciej. Po zakończeniu reakcji stwierdzonym na podstawie chromatografii cienkowarstwowej, oziębiamy roztwór do temperatury pokojowej, przenosimy do 250 ml rozdzielacza, dodajemy 50 ml eteru i 75 ml wody i dokładnie wytrząsamy. Po rozdzieleniu warstw odrzucamy warstwę wodną, a warstwę organiczną przemywamy kolejno 25 ml wody, dwiema porcjami po 25 ml 10%-ego roztworu NaHCO3 i na koniec 25 ml nasyconego roztworu NaCl. Następnie suszymy nad siarczanem sodu przez 5-10 min, odsączamy środek suszący przemywając eterem i odpędzamy rozpuszczalnik. Większość podstawionych w pierścieniu estrów pochodnych kwasu benzoesowego otrzymuje się w postaci stałej i można je oczyszczać przez krystalizację z heksanu lub mieszaniny benzenu i heksanu. Wyjątek stanowią: benzoesan metylu, m-toluilan metylu m-chlorobenzoesan metylu oraz m-metoksybenzoesan metylu. Niektóre spośród stałych estrów mają dość niskie temp. topnienia i podczas krystalizacji roztwór trzeba oziębić w łaźni z lodem. Estry stosowane do następnego ćwiczenia muszą być krystaliczne i wolne od resztek rozpuszczalnika, a te, które są olejami, należy przedestylować. Destylację można przeprowadzić w zestawie bez chłodnicy, gdyż nie jest ona w tym przypadku konieczna z powodu wysokiej temp. wrzenia. Odnotowujemy obserwowaną temp. wrzenia (topnienia) oraz wydajność.
Spis odczynników:
Octan etylu ( CH3COOC2H5): masa molowa: 88,084 g.mol-1; temp. topnienia: -83,6oC; temp. wrzenia: 77,06oC gęstość: 0,9 g.cm-3; bezbarwny, palny, ciekły ester, stosowany jako rozpuszczalnik oraz środek zapachowy
Kwas siarkowy (H2SO4): masa molowa: 98,08 g.mol-1; temp. topnienia: 10,36oC; temp. wrzenia: 338oC gęstość: 1,84 g.cm-3; bezbarwna, oleista, higroskopijna ciecz, stężony kwas działa silnie żrąco
Kwas solny (HCl): masa molowa: 36,46 g.mol-1; temp. topnienia: -114,8oC; temp. wrzenia: -85oC gęstość: 1,84 g.cm-3; roztwory 10-25% działają drażniąco, roztwory powyżej 25%- silnie żrąco, nie należy również wdychać par
Metanol (CH3OH): masa molowa 32,032 g.mol-1; temp. topnienia: -93,9oC; temp. wrzenia: 64,96oC; gęstość: 0,79g.cm-3; bezbarwna ciecz
Wodorowęglan sodu (NaHCO3): masa molowa 83,99 g.mol-1; gęstość: 2,159 g.cm-3; biała krystaliczna substancja, rozpuszczalna w wodzie, słabo rozpuszczalna w etanolu
Siarczan sodu (Na2SO4): masa molowa 142,05 g.mol-1; temp. topnienia: 888oC; gęstość: 2,67 g.cm-3; biała krystaliczna substancja
Schemat reakcji:
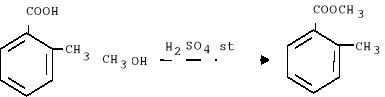
1 mol
M=137,78 g.mol-1
m=5 g
0,036 mol
1 mol
M=151,95 g.mol-1
m=5,5 g
0,036 mol
Przebieg ćwiczenia:
1. W kolbie okrągłodennej (100 ml) umieszczono 5 g kwasu 2-metylobenzoesowego,25 g alkoholu metylowego (ok. 32 ml) oraz 0,5 ml stężonego kwasu siarkowego. Do reakcji użyto dużego nadmiaru alkoholu metylowego, co spowoduje przesunięcie równowagi w kierunku tworzenia produktów i zwiększenia wydajności.
2. Kolbę połączono z chłodnicą zwrotną, dodano porcelankę, w celu równomiernego ogrzewania i mieszaninę ogrzewano przez ok. 2godz
3. Po godzinie sprawdzono postęp reakcji metodą chromatografii cienkowarstwowej:
Przygotowano roztwór wzorcowy kwasu 2-metylobenzoesowego przez rozpuszczenie niewielkiej ilości kwasu w ok. 2,5 ml alkoholu etylowego i wykonano chromatografię, aby sprawdzić umiejscowienie plamy czystego kwasu
Dobrano odpowiednią mieszaninę do rozwijania chromatogramu- najodpowiedniejsza okazała się mieszanina octanu etylu i heksylu w stosunku 0,5:1,5
Za pomocą kapilary pobrano próbkę z kolby reakcyjnej i naniesiono ją na płytkę; obok naniesiono plamkę roztworu wzorcowego (w celu porównania)
Suche płytki umieszczono w zamkniętym pojemniku zawierającym na dnie kryształki jodu, w celu wywołania plam związków. Po wyjęciu płytki stwierdzono, że plamy nie były dobrze rozdzielone, co świadczyło o tym, że nie przereagował do końca kwas i nie powstał ester
4. Kontynuowano ogrzewanie i po upływie kolejnej godziny powtórzono chromatografię cienkowarstwową i stwierdzono, że plamy kwasu i estru były robrze rozdzielone, co świadczyło, że przereagował kwas i powstał ester oraz że można zakończyć ogrzewanie
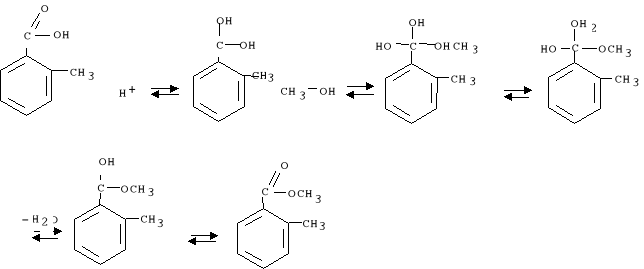
5. W kolbie zaszła reakcja:
6. Po zakończeniu reakcji stwierdzonej na podstawie chromatografii, oziębiono roztwór do temp pokojowej i przeniesiono do rozdzielacza. Następnie dodano 50 ml eteru, (aby rozpuścić ester, kwas benzoesowy oraz jego pochodne) oraz 75 ml wody, (aby alkohol został przeniesiony do warstwy wodnej a ester do warstwy organicznej) i dokładnie wytrząsano. Po rozdzieleniu warstw spuszczono wodną warstwę do zlewki, a pozostałą w rozdzielaczu warstwę organiczną przemyto, najpierw 25 ml wody, potem dwiema porcjami po 25 ml 10%-ego roztworu NaHCO3, (aby rozpuścił się pozostały kwas w warstwie organicznej i pozostał ester) a na końcu 25 ml nasyconego roztworu NaCl (w celu szybszego rozdzielenia się warstw)
7. Po przeprowadzeniu tych wszystkich czynności powstały ester przelano z rozdzielacza do enenmajerki i suszono NaSO4 przez 5 min. Następnie odsączono środek suszący na sączku karbowanym do kolby o pojemności 50 ml. Przemywając eterem
8. Przeprowadzono destylację pod zmniejszonym ciśnieniem w celu odpędzenia eteru. Następnie oznaczono współczynnik załamania światła w celu sprawdzenia czystości otrzymanego estru
Wartość literaturowa współczynnika załamania światła-
Oznaczona wartość współczynnika załamania światła- 1,50638
Wnioski:
Otrzymany ester 2-metylobenzoesanmetylu jest substancją ciekłą o jasno brązowym zabarwieniu. Oznaczony współczynnik załamania światła różni się od literaturowej wartości współczynnika załamania światła, co oznacz, że otrzymany ester jest zanieczyszczony. Zanieczyszczenia mogą pochodzić od nieprzereagowanych produktów, jak również od nie dokładnie usuniętych związków, z którymi był wytrząsany roztwór.
Wyszukiwarka
Podobne podstrony:
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
NITROANILINY, technologia chemiczna, chemia organiczna 2003,2004
ZWIĄZKI NATURALNE, technologia chemiczna, chemia organiczna 2003,2004
SYNTEZA GRIGNARDA, technologia chemiczna, chemia organiczna 2003,2004
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
organiczna-koła, Technologia chemiczna, Chemia organiczna, 3 semestr, 1 kolokwium
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech404b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
Egz pierwszy, Technologia chemiczna, Chemia organiczna, 3 semestr, egzaminy
dyd tech406b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech413, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
więcej podobnych podstron