Rodzaje reakcji złożonych
• addycja - czyli inaczej reakcja dodawania
• substytucja - czyli inaczej reakcja podstawienia
• eliminacja - czyli inaczej reakcja oderwania
• W chemii substrat jest ogólną nazwą każdej substancji chemicznej, która wchodząc do reakcji chemicznej, ulega przemianie - w odróznieniu od produktów które są wynikiem reakcji.
Ze względu na budowę i skład, dzielimy białka na proste i złożone.
Białka proste zbudowane są wyłącznie z aminokwasów
protaminy - są silnie zasadowe, Są dobrze rozpuszczalne w wodzie. Najbardziej znanymi protaminami są: klupeina, salmina, cyprynina, ezocyna, gallina.
1. histony są silnie zasadowe i dobrze rozpuszczają się w wodzie; jak lizyna i arginina.
2. albuminy - są enzymami, hormonami i Dobrze rozpuszczają się w wodzie i rozcieńczonych roztworach soli, łatwo ulegają koagulacji. Znajdują się w tkance mięśniowej, osoczu krwi i mleku.
3. globuliny -są źle rozpuszczalne w wodzie, natomiast dobrze w rozcieńczonych roztworach soli; Występują w dużych ilościach w płynach ustrojowych i tkance mięśniowej.
4. prolaminy - są to typowe białka roślinne, występują w nasionach. Charakterystyczną właściwością jest zdolność rozpuszczania się w 70% etanolu.
5. gluteliny - typowe białka roślinne; posiadają zdolność rozpuszczania się w rozcieńczonych kwasach i zasadach.
6. skleroproteiny -nie rozpuszczalne w wodzie i rozcieńczonych roztworach soli. Są to typowe białka o budowie włóknistej, dzięki temu pełnią funkcje podporowe. Do tej grupy białek należy keratyna.
Białka złożone:
1. chromoproteiny - złożone z białek prostych i grupy prostetycznej - barwnika.
2. fosfoproteiny - zawierają około 1% fosforu w postaci reszt kwasu fosforowego. Do tych białek należą: kazeina mleka, witelina żółtka jaj, ichtulina ikry ryb.
3. nukleoproteiny - składają się z białek zasadowych i kwasów nukleinowych w rybosomach, mikrosomach i mitochondriach, Wirusy są zbudowane prawie wyłącznie z nukleoproteidów.
4. lipidoproteiny - połączenia białek z tłuszczami prostymi lub złożonymi, np. sterydami, kwasami tłuszczowymi. Lipoproteidy są nośnikami cholesterolu (LDL, HDL, VLDL). Wchodzą na przykład w skład błony komórkowej.
5. glikoproteiny - ich grupę prostetyczną stanowią cukry, należą tu m.in. mukopolisacharydy (ślina). Glikoproteidy występują też w substancji ocznej i płynie torebek stawowych.
6. metaloproteiny - zawierają jako grupę prostetyczną atomy metalu (miedź, cynk, żelazo, wapń, magnez, molibden, kobalt). Atomy metalu stanowią grupę czynną wielu enzymów.
Białka mają następujące funkcje:
• kataliza enzymatyczna - od uwadniania dwutlenku węgla do replikacji chromosomów,
• transport i magazynowanie - hemoglobina, transferyna, ferrytyna,
• kontrola przenikalności błon - regulacja stężenia metabolitów w komórce,
• ruch uporządkowany - np. skurcz mięśnia, aktyna i miozyna,
• wytwarzanie i przekazywanie impulsów nerwowych,
• bufory,
• kontrola wzrostu i różnicowania,
• immunologiczna,
• budulcowa, strukturalna.
• przyleganie komórek (np. kadheryny)
• regulatorowa - reguluje przebieg procesów biochemicznych
Ze względu na skalę przestrzenną pełną strukturę białka można opisać na czterech poziomach:
• Struktura pierwszorzędowa białka, zwana również strukturą pierwotną - jest określona przez sekwencję (kolejność) aminokwasów w łańcuchu białkowym
• Struktura drugorzędowa białka - są to lokalne struktury powstające w wyniku tworzenia się wiązań wodorowych pomiędzy tlenem grupy >C=O, a wodorem grupy -NH, dwóch niezbyt odległych od siebie w łańcuchu wiązań peptydowych. Do struktur drugorzędowych zalicza się:
o helisę - gł. helisę alfa (ang. α helix)
o beta nici (struktura beta-fałdowa) tworzące "pofałdowane kartki" (ang. β sheet)
o beta zakręt (pętle omega) (ang. turn)
• Struktura trzeciorzędowa białka - Wzajemne położenie elementów struktury drugorzędowej stabilizowane przez oddziaływania reszt aminokwasowych oraz tworzenie mostków dwusiarczkowych -S-S-, powstających pomiędzy dwiema resztami cysteiny, dwoma resztami metioniny lub też jeden metioniny drugi zaś cysteiny w łańcuchu.
• Struktura czwartorzędowa białka - przestrzenna budowa białka zbudowanego z kilku łańcuchów polipeptydowych oraz zawierająca struktury niebiałkowe:
o glikoproteiny - zawierają cukier
o lipoproteiny - zawierają lipidy
o nukleoproteiny - zawierają kwas nukleinowy
o chromoproteiny - zawierają barwnik; np. hemoglobina może przybierać czwartorzędową budowę białka, gdyż poza kilkoma łańcuchami polipeptydowymi posiada jeszcze barwnik - hem.
o fosfoproteiny - zawierają resztę kwasu fosforowego
Według najnowszej klasyfikacji białka mają tylko trzy rzędy budowy, trzeciorzędowa odpowiada trzeciorzędowej i czwartorzędowej razem według starej klasyfikacji. Powodem zmiany były trudności w klasyfikacji struktur niektórych białek oraz brak czwartorzędowej innych. Dopuszcza się stosowanie obu klasyfikacji w okresie przejściowym.
Właściwości fizykochemiczne [edytuj]
Białka nie posiadają charakterystycznej dla siebie temperatury topnienia. Przy ogrzewaniu w roztworze, a tym bardziej w stanie stałym, ulegają, powyżej pewnej temperatury, nieodwracalnej denaturacji (ścinanie się włókien białka) - zmianie struktury, która czyni białko nieaktywnym biologicznie (codziennym przykładem takiej denaturacji jest smażenie lub gotowanie jajka). Jest to spowodowane nieodwracalną utratą trzeciorzędowej lub czwartorzędowej budowy białka. Z tej przyczyny dla otrzymania suchej, ale niezdenaturowanej próbki danego białka, stosuje się metodę liofilizacji, czyli odparowywania wody lub innych rozpuszczalników z zamrożonej próbki pod zmniejszonym ciśnieniem. Denaturacja białek może również zachodzić pod wpływem soli metali ciężkich, mocnych kwasów i zasad, niskocząsteczkowych alkoholi, aldehydów oraz napromieniowania. Wyjątek stanowią proste białka, które mogą ulegać także procesowi odwrotnemu, tzw. renaturacji - po usunięciu czynnika, który tę denaturację wywołał. Niewielka część białek ulega trwałej denaturacji pod wpływem zwiększonego stężenia soli w roztworze, jednak proces wysalania jest w większości przypadków w pełni odwracalny, dzięki czemu umożliwia izolowanie lub rozdzielanie białek.
Białka są na ogół rozpuszczalne w wodzie. Do białek nierozpuszczalnych w wodzie należą tzw. białka fibrylarne, występujące w skórze, ścięgnach, włosach (kolagen, keratyna) lub mięśniach (miozyna). Niektóre z białek mogą rozpuszczać się w rozcieńczonych kwasach lub zasadach, jeszcze inne w rozpuszczalnikach organicznych. Na rozpuszczalność białek ma wpływ stężenie soli nieorganicznych w roztworze, przy czym małe stężenie soli wpływa dodatnio na rozpuszczalność białek. Jednak przy większym stężeniu następuje uszkodzenie otoczki solwatacyjnej, co powoduje wypadanie białek z roztworu. Proces ten nie narusza struktury białka, więc jest odwracalny i nosi nazwę wysalania białek.
Białka posiadają zdolność wiązania cząsteczek wody. Efekt ten nazywamy hydratacją. Nawet po otrzymaniu próbki suchego białka zawiera ona związane cząsteczki wody.
Białka, ze względu na obecność zasadowych grup NH2 oraz kwasowych COOH mają charakter obojnaczy - w zależności od pH roztworu będą zachowywały się jak kwasy (w roztworze zasadowym) lub jak zasady (w roztworze kwaśnym). Dzięki temu białka mogą pełnić rolę bufora stabilizującego pH, np. krwi. Różnica pH nie może być jednak znaczna, gdyż białko może ulec denaturacji. Wypadkowy ładunek białka zależy od ilości aminokwasów kwaśnych i zasadowych w cząsteczce. Wartość pH, w której ładunki dodatnie i ujemne aminokwasów równoważą się nazywany jest punktem izoelektrycznym białka.
Białka odgrywają zasadniczą rolę we wszystkich procesach biologicznych. Biorą udział w katalizowaniu wielu przemian w układach biologicznych (enzymy są białkami), uczestniczą w transporcie wielu małych cząsteczek i jonów (np. 1 cząsteczka hemoglobiny przenosząca 4 cząsteczki tlenu), służą jako przeciwciała oraz biorą udział w przekazywaniu impulsów nerwowych jako białka receptorowe. Białka pełnią także funkcję mechaniczno-strukturalną. Wszystkie białka zbudowane są z aminokwasów. Niektóre białka zawierają nietypowe, rzadko spotykane aminokwasy, które uzupełniają ich podstawowy zestaw. Wiele aminokwasów (zazwyczaj ponad 100) połączonych ze sobą wiązaniami peptydowymi tworzy łańcuch polipeptydowy, w którym można wyróżnić dwa odmienne końce. Na jednym końcu łańcucha znajduje się niezablokowana grupa aminowa (tzw. N-koniec), na drugim niezablokowana grupa karboksylowa (C-koniec).
Podział białek
Porównanie kształtu i wielkości kilku białek. Od lewej: Przeciwciało (IgG), Hemoglobina, Insulina, kinaza AK1, ligaza glutaminy.
Ze względu na budowę i skład, dzielimy białka na proste i złożone.
Białka proste zbudowane są wyłącznie z aminokwasów. Dzielimy je na następujące grupy:
1. protaminy - są silnie zasadowe, charakteryzują się dużą zawartością argininy oraz brakiem aminokwasów zawierających siarkę. Są dobrze rozpuszczalne w wodzie. Najbardziej znanymi protaminami są: klupeina, salmina, cyprynina, ezocyna, gallina.
2. histony - podobnie jak protaminy są silnie zasadowe i dobrze rozpuszczają się w wodzie; składniki jąder komórkowych (w połączeniu z kwasem dezoksyrybonukleinowym), czyli są obecne także w erytroblastach. W ich skład wchodzi duża ilość takich aminokwasów jak lizyna i arginina.
3. albuminy - białka obojętne, spełniające szereg ważnych funkcji biologicznych: są enzymami, hormonami i innymi biologicznie czynnymi związkami. Dobrze rozpuszczają się w wodzie i rozcieńczonych roztworach soli, łatwo ulegają koagulacji. Znajdują się w tkance mięśniowej, osoczu krwi i mleku.
4. globuliny -w ich skład wchodzą wszystkie aminokwasy białkowe, z tym że kwas asparaginowy i kwas glutaminowy w w większych ilościach; w odróżnieniu od albumin są źle rozpuszczalne w wodzie, natomiast dobrze w rozcieńczonych roztworach soli; posiadają podobne właściwości do nich. Występują w dużych ilościach w płynach ustrojowych i tkance mięśniowej.
5. prolaminy - są to typowe białka roślinne, występują w nasionach. Charakterystyczną właściwością jest zdolność rozpuszczania się w 70% etanolu.
6. gluteliny - podobnie jak prolaminy - to typowe białka roślinne; posiadają zdolność rozpuszczania się w rozcieńczonych kwasach i zasadach.
7. skleroproteiny - białka charakteryzujące się dużą zawartością cysteiny i aminokwasów zasadowych oraz kolagenu i elastyny, a także proliny i hydroksyproliny, nie rozpuszczalne w wodzie i rozcieńczonych roztworach soli. Są to typowe białka o budowie włóknistej, dzięki temu pełnią funkcje podporowe. Do tej grupy białek należy keratyna.
Białka złożone:
1. chromoproteiny - złożone z białek prostych i grupy prostetycznej - barwnika. Należą tu hemoproteidy (hemoglobina, mioglobina, cytochromy, katalaza, peroksydaza) zawierające układ hemowy oraz flawoproteidy.
2. fosfoproteiny - zawierają około 1% fosforu w postaci reszt kwasu fosforowego. Do tych białek należą: kazeina mleka, witelina żółtka jaj, ichtulina ikry ryb.
3. nukleoproteiny - składają się z białek zasadowych i kwasów nukleinowych. Rybonukleoproteidy są zlokalizowane przede wszystkim w cytoplazmie: w rybosomach, mikrosomach i mitochondriach, w niewielkich ilościach także w jądrach komórkowych, a poza jądrem tylko w mitochondriach. Wirusy są zbudowane prawie wyłącznie z nukleoproteidów.
4. lipidoproteiny - połączenia białek z tłuszczami prostymi lub złożonymi, np. sterydami, kwasami tłuszczowymi. Lipoproteidy są nośnikami cholesterolu (LDL, HDL, VLDL). Wchodzą na przykład w skład błony komórkowej.
5. glikoproteiny - ich grupę prostetyczną stanowią cukry, należą tu m.in. mukopolisacharydy (ślina). Glikoproteidy występują też w substancji ocznej i płynie torebek stawowych.
6. metaloproteiny - zawierają jako grupę prostetyczną atomy metalu (miedź, cynk, żelazo, wapń, magnez, molibden, kobalt). Atomy metalu stanowią grupę czynną wielu enzymów.
Funkcja białek
Przykłady rozmieszczenia białek w obrębie komórki - białka charakterystyczne dla poszczególnych organelli uwidoczniono przy pomocy przeciwciał znakowanych GFP.
Białka mają następujące funkcje:
• kataliza enzymatyczna - od uwadniania dwutlenku węgla do replikacji chromosomów,
• transport i magazynowanie - hemoglobina, transferyna, ferrytyna,
• kontrola przenikalności błon - regulacja stężenia metabolitów w komórce,
• ruch uporządkowany - np. skurcz mięśnia, aktyna i miozyna,
• wytwarzanie i przekazywanie impulsów nerwowych,
• bufory,
• kontrola wzrostu i różnicowania,
• immunologiczna,
• budulcowa, strukturalna.
• przyleganie komórek (np. kadheryny)
• regulatorowa - reguluje przebieg procesów biochemicznych
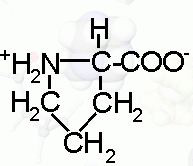
(*) aminokwasy egzogenne; pozostałe to aminokwasy endogenne
(**) w środowisku wodnym do masy aminokwasu należy doliczyć masę 1 cz. Wody.
|
C2H5NO2 |
kwas 2-aminoetanowy
glikokol |
H |
||||
|
C3H7NO2
|
kwas 2-aminopropionowy |
CH3 |
||||
|
C3H7NO3 |
S)-2-amino-3-hydroksypropanowy kwas |
CH2 OH |
||||
|
C3H7NO2S |
|
CH2 SH |
||||
|
C4H7NO4 |
|
CH2 COO- |
||||
|
C5H9N1O4 |
|
CH2 CH2 COO- |
||||
|
Metionina (*) |
|
|
CH2 CH2 S CH3 |
|||
|
Lizyna (*) |
C6H14N2O2 |
kwas 2,6-diaminoheksanowy |
CH2 CH2 CH2 CH2 NH3 |
|||
|
Leucyna (*) |
(CH3)2CHCH2CH(NH2)COOH |
|
CH2 CH CH3CH3 |
|||
|
C4H8N2O3 |
kwas 2,4-diamino-4-oksobutanowy |
CH2 C = O NH2 |
||||
|
Izoleucyna (*) |
|
|
CH-CH3 CH2 CH2 |
|||
|
Treonina (*) |
C4H9NO3 |
(2S,3R)-2-amino-3-hydroksymasłowy kwas |
H-C-OH CH3 |
|||
|
Walina (*) |
C5H11NO2 |
kwas (S)-2-amino-3-metylobutanowy |
CH CH3 CH3 |
|||
|
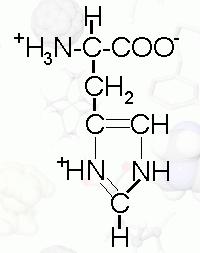
Arginina (*) |
C6H15N4O2 |
kwas 2-amino-5-(diamino- |
CH2 CH2 CH2 NH / \\ NH2 NH2+ |
|||
|
C5H10N2O3 |
kwas (2S)-2,5-diamino-5-oksopentanowy |
CH2 CH2 CH2 NH / \\ NH2 NH2 |
||||
|
C5H9NO2 |
kwas (S)-pirolidyno-2-karboksylowy |
|
||||
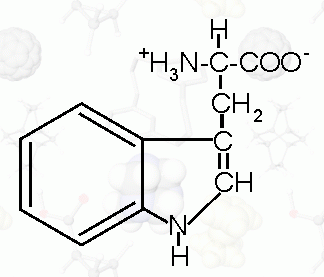
|
Tryptofan (*) |
C9H11NO3 |
kwas (2S)-2-amino-3- |
|
|||
|
C11H12N2O2 |
|
|
||||
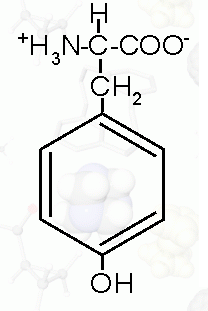
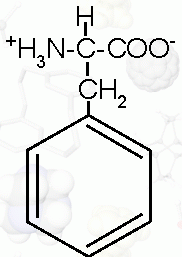
|
Fenyloalanina (*) |
C9H11NO2 |
kwas 2-amino-3-fenylopropionowy |
|
|||
|
Histydyna (*) |
C6H9N3O2
|
|
|
|||
Aminokwasy egzogenne |
Aminokwasy endogenne |
||||||
Lizyna |
Alanina |
||||||
Wyszukiwarka
Podobne podstrony:
Biochemia ściąga białka
Biochemia ściąga
biochemia ściaga egzamin
biochemia ściąga koło 2
Biochemia ściąga
biochemia sciaga poprawa, biochemia
biochemia ściągadocx
oczyszczająco-ściągająca z białka kurzego, Uroda, fitness, Maseczki
biochem ściąga z pytań, OCHRONA ŚRODOWISKA UJ, BIOCHEMIA
biochemia sciaga, biochemia
biochemia ściąga testy, Dietetyka, biochemia
biochemia sciaga witaminy, Biochemia
Biochemia-sciaga2
02 BIOCHEMIA aminokwasy i bialka
Biochemia - sciaga, ATP + H2O ŕATPazyŕ ADP + Pi
aminokwasy i białka, Biochemia, aminokwasy białka
biochemia sciaga eg, Dietetyka, Biochemia
biochemia sciaga monosacharydy
więcej podobnych podstron