Robert Maniura
Sprawozdanie z ДҮwiczenia nr 24: Elektronowe widma absorpcyjne.
1. WstДҷp teoretyczny:
Widmo elektronowe to widmo promieniowania elektromagnetycznego odpowiadajД…ce przejЕӣciom miДҷdzy rГіЕјnymi stanami elektronowymi czД…steczki. W czД…steczkach stany energetyczne elektronГіw sД… kwantowane. PrzejЕӣciom elektronГіw miДҷdzy tymi stanami moЕјe towarzyszyДҮ emisja lub absorpcja promieniowania. Koniecznym warunkiem absorpcji fotonu, ktГіra wywoЕӮuje przeniesienie elektronu, jest dopasowanie wartoЕӣci jego energii do rГіЕјnicy poziomГіw energetycznych. PrawdopodobieЕ„stwo przejЕӣДҮ elektronГіw miДҷdzy dwoma stanami energetycznymi okreЕӣlajД… reguЕӮy wyboru. PrzejЕӣcie zaleЕјy od:
zmiany rozkЕӮadu ЕӮadunku podczas przejЕӣcia;
zmiany multipletowoЕӣci podczas przejЕӣcia (2S + 1);
nakЕӮadania siДҷ chmur elektronowych stanГіw, miДҷdzy ktГіrymi nastДҷpuje przejЕӣcie.
PrzejЕӣcia sД… tym bardziej prawdopodobne, im wiДҷksza zachodzi zmiana rozkЕӮadu ЕӮadunku i im wiДҷksze jest wzajemne przenikanie chmur elektronowych oddziaЕӮywujД…cych stanГіw. Dozwolone sД… tylko przejЕӣcia pomiДҷdzy stanami o tej samej multipletowoЕӣci. UkЕӮady pasm elektronowych wystДҷpujД… w nadfiolecie oraz w widzialnej czДҷЕӣci widma. Na przejЕӣcia elektronowe nakЕӮadajД… siДҷ przejЕӣcia oscylacyjne i rotacyjne. Parametrami charakteryzujД…cymi pasma absorpcyjne sД…:
maksimum absorpcji (l max) podane w nm lub cm-1 (kajzerach):
natДҷЕјenie okreЕӣlane za pomocД… molowego wspГіЕӮczynnika absorpcji e max przy maksimum absorpcji (dm 3*mol-1*cm-1); miarД… dokЕӮadniejszД… jest molowe integralne natДҷЕјenie:
gdzie: c - stДҷЕјenie roztworu [mol/dm3]; l - gruboЕӣДҮ warstwy absorbujД…cej [cm]; I0 - natДҷЕјenie promieniowania padajД…cego; It - natДҷЕјenie promieniowania przechodzД…cego.
SiЕӮa oscylatora jest to stosunek integralnego natДҷЕјenia wyznaczonego doЕӣwiadczalnie do obliczonego dla prostego modelu oscylatora harmonicznego prostego ukЕӮadu elektron - czД…steczka:
struktura wyraЕјona asymetriД… pasma i skЕӮadowymi przejЕӣДҮ elektronГіw- moЕјe byДҮ okreЕӣlona jako wartoЕӣДҮ odcinkГіw, ktГіre wyznacza n max na szerokoЕӣci poЕӮГіwkowej:
gdzie: пҒ® max - liczba falowa odpowiadajД…ca maksimum absorpcji [cm-1]; пҒ® l1/2 - wartoЕӣДҮ liczby falowej z lewej strony pasma w poЕӮowie wysokoЕӣci [cm-1]; пҒ® p1/2 - wartoЕӣДҮ liczby falowej z prawej strony pasma w poЕӮowie wysokoЕӣci [cm-1].
Widma czД…steczkowe uwidaczniajД… siДҷ w postaci szerokich pasm, poniewaЕј sД… badane zwykle w roztworach, w ktГіrych dochodzi do dodatkowych oddziaЕӮywaЕ„ miДҷdzy czД…steczkowych.
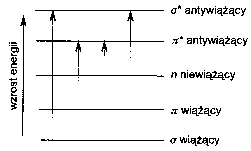
Rodzaje przejЕӣДҮ elektronowych sД… nastДҷpujД…ce:
W zwiД…zkach organicznych- absorpcja promieniowania w zakresie UV- Vis jest zwiД…zana z przejЕӣciami elektronГіw walencyjnych oraz elektronГіw wolnych par elektronowych. KolejnoЕӣДҮ poziomГіw energetycznych poszczegГіlnych orbitali i moЕјliwoЕӣci przejЕӣДҮ elektronowych jest na schemacie. Wzbudzenie elektronowe nastДҷpuje wГіwczas, gdy w wyniku absorpcji promieniowania nastДҷpuje przeniesienie elektronu z orbitalu o niЕјszej energii na wolny orbital o energii wyЕјszej.
W kompleksach metali d- elektronowych- w przejЕӣciach elektronowych biorД… udziaЕӮ elektrony d (teoria pola ligandГіw). MogД… to byДҮ przejЕӣcia typu d d, d пҒ°, f f.пҖ® LeЕјД… w zakresie bliskiego UV i w obszarze widzialnym i sД… odpowiedzialne za barwДҷ soli.
PrzejЕӣcia typu przeniesienia ЕӮadunku- CT (charge transfer)- wewnД…trz czД…steczkowe, miДҷdzy donorem i akceptorem, miДҷdzy atomem centralnym i ligandem.
JeЕјeli przez oЕӣrodek przechodzi wiД…zka ЕӣwiatЕӮa to jej natДҷЕјenie po przejЕӣciu ulega zmniejszeniu. Prawo Lamberta - Beera wiД…Ејe gruboЕӣДҮ warstwy roztworu absorbujД…cego i jego stДҷЕјenie jako wielkoЕӣci, od ktГіrych zaleЕјy absorbancja:
gdzie: A - absorbancja; c- stДҷЕјenie roztworu [mol/dm3]; l- gruboЕӣДҮ warstwy absorbujД…cej [cm]; пҒҘ- molowy wspГіЕӮczynnik absorpcji [dm3 * mol-1 * cm-1]; I0 - natДҷЕјenie promieniowania padajД…cego; It - natДҷЕјenie promieniowania przechodzД…cego.
ZaleЕјnoЕӣДҮ absorbancji od stДҷЕјenia powinna mieДҮ charakter liniowy, jednak w rzeczywistoЕӣci spotyka siДҷ odchylenia od prawa absorpcji. SД… one spowodowane przez:
podstawowe ograniczenia praw- speЕӮnione tylko dla roztworГіw rozcieЕ„czonych, moЕјliwoЕӣДҮ wystД…pienia np. fluorescencji;
czynniki chemiczne- dysocjacja, asocjacja, solwatacja, polimeryzacja, kompleksowanie;
czynniki aparaturowe.
2. Opracowanie wynikГіw:
Obliczam stДҷЕјenie roztworГіw. StДҷЕјenie wyjЕӣciowe roztworu czerwieni Kongo wynosi 0,025g/250cm3 z czego wynika, Ејe stДҷЕјenie wyraЕјone w [g/dm3] wynosi 0,1 g/dm3, jednak do obliczeЕ„ potrzebne bДҷdzie stДҷЕјenie wyraЕјone w [mol/dm3]. Masa molowa wynosi 696,712 [g/mol] z tego wynika, Ејe stДҷЕјenie wynosi 1,435*10-4.
StДҷЕјenie roztworu 1 wynosi:
gdzie: Cw - stДҷЕјenie wyjЕӣciowe roztworu czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu wyjЕӣciowego pobrana do kolby, 3 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C1 = 1,722*10-5 [g/dm3].
StДҷЕјenie roztworu 2 wynosi:
gdzie: Cw - stДҷЕјenie wyjЕӣciowe roztworu czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu wyjЕӣciowego pobrana do kolby, 8 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C2 = 4,592*10-5 [g/dm3].
StДҷЕјenie roztworu 3 wynosi:
gdzie: C2 - stДҷЕјenie roztworu 2 czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu 2 pobrana do kolby, 10 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C3 = 1,837*10-5 [g/dm3].
StДҷЕјenie roztworu 4 wynosi:
gdzie: C3 - stДҷЕјenie roztworu 3 czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu 3 pobrana do kolby, 10 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C4 = 7,347*10-6 [g/dm3].
StДҷЕјenie roztworu 5 wynosi:
gdzie: C4 - stДҷЕјenie roztworu 4 czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu 4 pobrana do kolby, 10 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C5 = 2,939*10-6 [g/dm3].
StДҷЕјenie roztworu 6 wynosi:
gdzie: C5 - stДҷЕјenie roztworu 5 czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu 5 pobrana do kolby, 10 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C6 = 1,1756*10-6 [g/dm3].
StДҷЕјenie roztworu 7 wynosi:
gdzie: C6 - stДҷЕјenie roztworu 6 czerwieni Kongo; Vp - objДҷtoЕӣДҮ roztworu 6 pobrana do kolby, 10 cm3; Vc - objДҷtoЕӣДҮ caЕӮkowita po uzupeЕӮnieniu kolby do kreski wodД…, 25 cm3. C5 = 4,7024*10-7 [g/dm3].
Widmo absorpcyjne barwnika - czerwieni Kongo - wyznaczam mierzД…c absorbancjДҷ roztworu 1 o stДҷЕјeniu C1 = 0,012 [g/dm3] w zakresie 420- 650 nm co 5 nm.
|
v[cm-1] |
пҒҒ |
|
v[cm-1] |
пҒҒ |
|
v[cm-1] |
пҒҒ |
|
v[cm-1] |
пҒҒ |
420 |
23810 |
0,25 |
485 |
20619 |
0,48 |
545 |
18349 |
0,31 |
605 |
16529 |
0,03 |
425 |
23529 |
0,26 |
490 |
20408 |
0,5 |
550 |
18182 |
0,27 |
610 |
16393 |
0,025 |
430 |
23256 |
0,265 |
495 |
20202 |
0,52 |
555 |
18018 |
0,23 |
615 |
16260 |
0,02 |
435 |
22989 |
0,29 |
500 |
20000 |
0,53 |
560 |
17857 |
0,195 |
620 |
16129 |
0,015 |
440 |
22727 |
0,29 |
505 |
19802 |
0,54 |
565 |
17699 |
0,17 |
625 |
16000 |
0,015 |
445 |
22472 |
0,31 |
510 |
19608 |
0,51 |
570 |
17544 |
0,155 |
630 |
15873 |
0,01 |
450 |
22222 |
0,34 |
515 |
19417 |
0,5 |
575 |
17391 |
0,13 |
635 |
15748 |
0,005 |
455 |
21978 |
0,35 |
520 |
19231 |
0,48 |
580 |
17241 |
0,1 |
640 |
15625 |
0,005 |
460 |
21739 |
0,37 |
525 |
19048 |
0,47 |
585 |
17094 |
0,08 |
645 |
15504 |
0,005 |
470 |
21277 |
0,42 |
530 |
18868 |
0,43 |
590 |
16949 |
0,065 |
650 |
15385 |
0 |
475 |
21053 |
0,45 |
535 |
18692 |
0,4 |
595 |
16807 |
0,045 |
|
|
|
480 |
20833 |
0,46 |
540 |
18519 |
0,35 |
600 |
16667 |
0,035 |
|
|
|
SporzД…dzam wykres zaleЕјnoЕӣci A = f(пҒ®), z ktГіrego odczytuje пҒ¬max, пҒ®max, Amax i obliczam пҒҘmax z wzoru:
gdzie A - absorbancja; C - stДҷЕјenie; l - gruboЕӣДҮ prГіbki; e - molowy wspГіЕӮczynnik absorpcji. Z wykresu odczytuje rГіwnieЕј wartoЕӣci zwiД…zane z szerokoЕӣciД… poЕӮГіwkowД… pasma: пҒ®P, пҒ®L, oraz obliczam пҒ„пҒ®пҖұпҖҜпҖІ i stopieЕ„ asymetrii pasma:
.
пҒ®P = 18182 cm-1 i пҒ®L = 23173 cm-1 вҮ’ пҒ„пҒ®1/2 = 4991 cm-1
a = 2,08
Aby wyznaczyДҮ molowe natДҷЕјenie integralne pasma B:
oraz siЕӮДҷ oscylatora f:
naleЕјy zmierzyДҮ pole pod konturem pasma. MoЕјna to zrobiДҮ posЕӮugujД…c siДҷ technikД… caЕӮkowania graficznego. Polega ona na podzieleniu pola pod konturem na szereg wycinkГіw o odpowiednio wД…skim przedziale пҒ„пҒ®. Pole kaЕјdego wycinka okreЕӣlamy jako iloczyn пҒ„пҒ® i Еӣredniej wartoЕӣci ekstyncji.
пҒ„пҒ® [cm-1] |
Еҡrednia wartoЕӣДҮ ekstyncji (AL + AP)/2 |
Pole [(AP + AL)/2]*пҒ„пҒ® [cm-1] |
пҒ„пҒ® [cm-1] |
Еҡrednia wartoЕӣДҮ ekstyncji (AL + AP)/2 |
Pole [(AP + AL)/2]*пҒ„пҒ® [cm-1] |
280 |
0,255 |
71,43 |
170 |
0,33 |
56,07 |
274 |
0,2625 |
71,82 |
167 |
0,29 |
48,37 |
267 |
0,2775 |
74,18 |
164 |
0,25 |
40,95 |
261 |
0,29 |
75,76 |
161 |
0,2125 |
34,19 |
255 |
0,3 |
76,61 |
158 |
0,1825 |
28,84 |
250 |
0,325 |
81,15 |
155 |
0,1625 |
25,23 |
244 |
0,345 |
84,25 |
153 |
0,1425 |
21,74 |
239 |
0,36 |
86,00 |
150 |
0,115 |
17,24 |
463 |
0,395 |
182,70 |
147 |
0,09 |
13,26 |
224 |
0,435 |
97,42 |
145 |
0,0725 |
10,50 |
219 |
0,455 |
99,78 |
142 |
0,055 |
7,83 |
215 |
0,47 |
100,95 |
140 |
0,04 |
5,60 |
210 |
0,49 |
103,09 |
138 |
0,0325 |
4,48 |
206 |
0,51 |
105,13 |
135 |
0,0275 |
3,73 |
202 |
0,525 |
106,06 |
133 |
0,0225 |
3,00 |
198 |
0,535 |
105,94 |
131 |
0,0175 |
2,29 |
194 |
0,525 |
101,92 |
129 |
0,015 |
1,94 |
190 |
0,505 |
96,14 |
127 |
0,0125 |
1,59 |
187 |
0,49 |
91,49 |
125 |
0,0075 |
0,94 |
183 |
0,475 |
87,00 |
123 |
0,005 |
0,62 |
180 |
0,45 |
80,86 |
121 |
0,005 |
0,61 |
176 |
0,415 |
73,18 |
119 |
0,0025 |
0,30 |
173 |
0,375 |
64,90 |
|
|
|
Suma pГіl wszystkich wycinkГіw wynosi 2447,05 cm-1 wartoЕӣДҮ ta jest przybliЕјonД… wartoЕӣciД… caЕӮki. StДҷЕјenie roztworu czerwieni Kongo jest rГіwne: C = 1,722*10-5. Dla wartoЕӣci l = 1 cm obliczam wartoЕӣДҮ molowego integralnego natДҷЕјenia pasma :
3,27*108
Obliczam siЕӮДҷ oscylatora:
f =
Wyznaczam wykresy dla pozostaЕӮych roztworГіw:
RoztwГіr 2 |
RoztwГіr 3 |
RoztwГіr 4 |
RoztwГіr 5 |
||||||||
пҒ¬ [nm] |
пҒ® [cm-1] |
пҒҒ |
пҒ¬ [nm] |
пҒ® [cm-1] |
пҒҒ |
пҒ¬ [nm] |
пҒ® [cm-1] |
пҒҒ |
пҒ¬ [nm] |
пҒ® [cm-1] |
пҒҒ |
475 |
21053 |
0,54 |
475 |
21053 |
0,23 |
475 |
21053 |
0,08 |
475 |
21053 |
0,02 |
480 |
20833 |
0,56 |
480 |
20833 |
0,235 |
480 |
20833 |
0,095 |
480 |
20833 |
0,045 |
485 |
20619 |
0,58 |
485 |
20619 |
0,24 |
485 |
20619 |
0,095 |
485 |
20619 |
0,045 |
490 |
20408 |
0,59 |
490 |
20408 |
0,24 |
490 |
20408 |
0,1 |
490 |
20408 |
0,045 |
495 |
20202 |
0,6 |
495 |
20202 |
0,245 |
495 |
20202 |
0,105 |
495 |
20202 |
0,045 |
500 |
20000 |
0,61 |
500 |
20000 |
0,25 |
500 |
20000 |
0,11 |
500 |
20000 |
0,045 |
505 |
19802 |
0,62 |
505 |
19802 |
0,25 |
505 |
19802 |
0,12 |
505 |
19802 |
0,05 |
510 |
19608 |
0,6 |
510 |
19608 |
0,23 |
510 |
19608 |
0,11 |
510 |
19608 |
0,045 |
515 |
19417 |
0,58 |
515 |
19417 |
0,225 |
515 |
19417 |
0,1 |
515 |
19417 |
0,045 |
520 |
19231 |
0,55 |
520 |
19231 |
0,21 |
520 |
19231 |
0,095 |
520 |
19231 |
0,045 |
525 |
19048 |
0,53 |
525 |
19048 |
0,205 |
525 |
19048 |
0,09 |
525 |
19048 |
0,04 |
530 |
18868 |
0,48 |
530 |
18868 |
0,18 |
530 |
18868 |
0,08 |
530 |
18868 |
0,035 |
535 |
18692 |
0,45 |
535 |
18692 |
0,175 |
535 |
18692 |
0,07 |
535 |
18692 |
0,03 |
Molowe wspГіЕӮczynniki absorpcji pozostaЕӮych roztworГіw odczytane z wykresГіw. WartoЕӣci obliczane dla
= 505 nm.
L.p. |
StДҷЕјenie fotometrowanego roztworu C [mol/dm3] |
Absorbancja A |
Molowy wspГіЕӮczynnik absorpcji |
1 |
1,722*10-5 |
0,54 |
31359 |
2 |
4,592*10-5 |
0,62 |
13502 |
3 |
1,837*10-5 |
0,25 |
13609 |
4 |
7,347*10-6 |
0,12 |
16333 |
5 |
2,939*10-6 |
0,05 |
17013 |
|
|
Еҡredni molowy wspГіЕӮczynnik absorpcji |
18363,20 [dm3*mol-1*cm-1] |
Dyskusja bЕӮДҷdГіw :
3. Wnioski:
BudowДҷ czД…steczki barwnika czerwieni Kongo przedstawia nastДҷpujД…cy wzГіr:
CzД…steczka czerwieni Kongo wykazuje selektywnД… absorpcjДҷ ЕӣwiatЕӮa. W czД…steczce wystДҷpuje caЕӮy szereg grup chromoforowych, czyli odpowiedzialnych za barwДҷ. Grupami chromoforowymi sД… nienasycone ugrupowania atomГіw i ukЕӮady sprzДҷЕјonych wiД…zaЕ„ podwГіjnych: azowa -N=N-, skondensowane pierЕӣcienie aromatyczne, pierЕӣcienie benzenowe. PrzejЕӣcia elektronowe w grupach chromoforowych sД… uЕӮatwione. Pasma absorpcyjne czerwieni Kongo pochodzД… od przejЕӣДҮ p p* w sprzДҷЕјonym ukЕӮadzie wiД…zaЕ„. SД… to pasma doЕӣДҮ intensywne. SД… one rГіwnieЕј odpowiedzialne za powstawanie barwy. Czynnikiem decydujД…cym o barwie jest jakoЕӣДҮ grup chromoforowych oraz ich wzajemne ustawienie. WiДҷksza liczba grup chromoforowych powoduje absorpcjДҷ fal dЕӮuЕјszych. Takie przesuniДҷcie maksimum absorpcji nazywa siДҷ efektem batochromowym. Chromofory sprzДҷЕјone powodujД… absorpcjДҷ ЕӣwiatЕӮa o znacznie wiДҷkszych dЕӮugoЕӣciach fali i o wiДҷkszym natДҷЕјeniu w porГіwnaniu z absorpcjД… poszczegГіlnych chromoforГіw skЕӮadowych.
Z wykresu zaleЕјnoЕӣci absorbancji od stДҷЕјenia roztworu dla czerwieni Kongo widaДҮ, Ејe prawo Lamberta - Beera jest speЕӮnione dla roztworГіw rozcieЕ„czonych. Przy wiДҷkszym stДҷЕјeniu wystДҷpuje odchylenie od prawa Lamberta - Beera (jednak odchylenie moЕјe wynikaДҮ z niedokЕӮadnoЕӣci spektrofotometru).
Molowy wspГіЕӮczynnik absorpcji charakteryzuje czuЕӮoЕӣДҮ metody. Wraz ze zmniejszaniem siДҷ stДҷЕјenia roztworu czerwieni Kongo molowy wspГіЕӮczynnik absorpcji wzrasta. ZwiДҷksza siДҷ tym samym czuЕӮoЕӣДҮ metody. Im mniejsze stДҷЕјenie tym wiДҷksza czuЕӮoЕӣДҮ oznaczenia.
4
Wyszukiwarka
Podobne podstrony:
Elektronowe widma absorpcyjne
Elektronowe widma emisyjne.вҖқ, spektroskopia
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Elektronowe widma absorpcyjne
Elektronowe Widma Absorpcyjne
Elektronowe widma absorpcyjne
promienie widma elektromagnetycznego
Analiza widma, ANALIZA, WYDZIAЛҷ AUTOMATYKI, ELEKTRONIKI I INFORMATYKI
Temat WpЕӮyw podstawnikГіw i rozpuszczalnika na widma elektronowe pochodnych aniliny i?nolux
ДҶwiczenie 70, cw70 wstep, Pomiar widma Еӣwiecenia diod elektroluminescencyjnych
37 Subtelna struktura widma elektronowo oscylacyjno rotacyjnego
widma elektronowe UV Vis
Temat WpЕӮyw podstawnikГіw i rozpuszczalnika na widma elektronowe pochodnych aniliny i fenolu wykres
NapДҷd Elektryczny wykЕӮad
Podstawy elektroniki i miernictwa2
elektryczna implementacja systemu binarnego
wiДҷcej podobnych podstron