Kierunek: Technologia Żywności i Żywienie Człowieka
Przedmiot: Enzymologia
Temat ćwiczenia:
CZYNNIKI WPŁYWAJĄCE NA SZYBKOŚĆ REAKCJI ENZYMATYCZNYCH
Wprowadzenie:
Na szybkość przebiegu reakcji enzymatycznych mają zasadniczy wpływ różne czynniki, tj. stężenie substratu, stężenie enzymu, temperatura, pH środowiska, obecność aktywatorów i inhibitorów.
Szybkość reakcji enzymatycznej w przypadku dużego stężenia substratu (wówczas stężenie substratu nie wpływa na szybkość reakcji) jest wprost proporcjonalna do stężenia enzymu (przy niezbyt dużych stężeniach enzymu). W przypadku małych stężeń substratu wzrasta wraz ze zwiększaniem stężenia enzymu, jednak nie jest to wzrost liniowy.
Wzrost temperatury powoduje zwiększenie szybkości reakcji enzymatycznej (jak każdej chemicznej), po osiągnięciu optimum szybkość ta zaczyna jednak spadać ze względu na denaturację cieplną enzymu. Szybkość inaktywacji enzymów rośnie wraz
z podwyższaniem temperatury, zależy jednak zwykle od pH środowiska. Większość enzymów traci aktywność po przekroczeniu 65oC, nieliczne tylko wytrzymują krótkotrwałe gotowanie, np. trypsyna w pH 1. Wyższą temperaturę wytrzymują enzymy suche, dlatego przechowywane są najczęściej w postaci liofilizowanej, aby zapobiegać inaktywacji. Optymalna temperatura zależy od długości inkubacji (gdy enzym ma działać kilka sekund, może być wysoka, gdy kilka dni - musi być niska, by długo zachował aktywność), pH środowiska, stężenia soli oraz obecności aktywatorów i inhibitorów (głównie jonów metali obecnych w odczynnikach jako zanieczyszczenia). W temperaturze do ok. 37oC (gdy nie grozi denaturacja cieplna enzymu) podniesienie temp. o 10oC powoduje 2-krotne zwiększenie szybkości reakcji. Zmianę szybkości reakcji w zależności od temperatury wyraża reguła van't Hoffa, według której wzrost temperatury o 10 K powoduje 2-4-krotny wzrost szybkości reakcji.
Z regułą van't Hoffa wiąże się temperaturowy współczynnik szybkości reakcji (TWSR), wyznaczający stosunek szybkości reakcji chemicznej po zmianie temperatury do szybkości reakcji przed zmianą temperatury (wzrostem lub spadkiem).
ΔT = T2 - T1
γ - temperaturowy współczynnik szybkości reakcji (TWSR)
Liczbę określającą ile razy wzrośnie stała szybkości reakcji k (a więc i szybkość reakcji) nazywamy współczynnikiem temperaturowym *.
Wpływ temperatury we wzorach opisujących szybkość reakcji zawarty jest w stałej szybkości reakcji k.
Wpływ temperatury na szybkość reakcji opisuje empiryczne równanie Arrheniusa
k - stała szybkości reakcji
A - stała Arrheniusa
EA - energia aktywacji w J/mol
R - stała gazowa (8,319 J•mol-1•K-1)
T - temperatura w K
Stała Arrheniusa A jest maksymalną stałą szybkości reakcji w warunkach, gdy wszystkie zderzenia cząsteczek są efektywne.
Równanie w postaci logarytmicznej przedstawia liniową zależność między ln k a 1/T.
Stałą Arrheniusa A oraz energię aktywacji można łatwo wyznaczyć znając doświadczalne wartości stałych szybkości reakcji w kilku temperaturach.
Równanie Arrheniusa może służyć do określenia z
ależności między energią aktywacji
a temperaturą:
gdzie:
k1 i k2 - stałe szybkości reakcji w temperaturze T1 i T2
T1 i T2 - temperatury pomiarów w skali Kelwina
W reakcjach enzymatycznych szybkości Vmax wyznaczone przy dużym nadmiarze substratu są wprost proporcjonalne do stałych szybkości, można więc wartości k1 i k2 zastąpić wartościami Vmax1 i Vmax2, wyznaczonymi dla dwóch temperatur.
Szybkość reakcji enzymatycznej jest optymalna w określonym pH (w zależności od rodzaju enzymu), zaś spada w miarę oddalania się od tego punktu na skutek denaturacji białka. Aktywność enzymatyczna zmienia się w różnym zakresie pH ze względu na zmiany stopnia zjonizowania zarówno enzymu, jak i substratu oraz kompleksu substrat-enzym. Centrum aktywne enzymu wykazuje działanie katalityczne najczęściej tylko w jednej formie zjonizowania grup, podobnie zwykle tylko jedna forma substratu jest aktywna. Również przy tworzeniu kompleksu enzym-substrat ważne są ich ładunki, ponieważ mogą je łączyć wiązania elektrostatyczne.
Substancje, które nie zmieniając sumarycznego procesu zmniejszają energię aktywacji nazywamy katalizatorami. Katalizator nie zużywa się podczas reakcji, dlatego nie występuje w równaniu stechiometrycznym.
Katalizatory ujemne, zmniejszają szybkość reakcji nazywamy inhibitorami.
Rolę katalizatora mogą pełnić pierwiastki i związki chemiczne (zwłaszcza metale grup pobocznych i ich tlenki oraz białka - enzymy - w reakcjach enzymatycznych), a także zanieczyszczenia i światło (w reakcjach fotochemicznych).
Aktywność enzymów może być zakłócana przez działanie wielu substancji. Inhibicja może być odwracalna i nieodwracalna, inhibicja odwracalna zaś może być kompetycyjna lub niekompetycyjna.
Związki, które tworzą wiązania kowalencyjne z resztą aminokwasu znajdującą się w centrum aktywnym enzymu (Ser lub Cys) lub w jego pobliżu, inaktywują enzym na stałe.
Inhibitorami kompetycyjnymi (współzawodniczącymi) mogą być związki strukturalnie podobne do normalnego substratu danego enzymu, które konkurują z nim o centrum aktywne. Enzym może wiązać albo cząsteczkę substratu, albo cząsteczkę inhibitora ale nie obie równocześnie. Hamowanie będzie tym większe im większe będzie stężenie inhibitora oraz wartość KM oraz im mniejsze będzie stężenie inhibitora i wartość Ki (stała dysocjacji kompleksu enzymu z inhibitorem). Przy dużym stężeniu substratu, działanie jego skutecznie współzawodniczy z działaniem inhibitora, więc nie zmieni się wartość Vmax, jednak wzrośnie wartość KM (pozornie mniejsze powinowactwo enzymu do substratu).
Działanie inhibitora kompetycyjnego można rozpoznać po zastosowaniu równania Lineweavera-Burka - mierzy się szybkości początkowe v0 przy różnych stężeniach substratu i stałym stężeniu inhibitora. Inhibicja kompetycyjna zmienia nachylenie prostej oraz punkt przecięcia z osią x (wzrasta KM), natomiast punkt przecięcia z osią y pozostaje bez zmian (stała wartość Vmax).
Inhibitorami niekompetycyjnymi są związki, które wiążą się z miejscem innym niż centrum aktywne enzymu i powodują zmianę przestrzennego kształtu enzymu, a przez to zmniejszenie jego aktywności katalitycznej. Mogą one wiązać się z wolnym enzymem lub z kompleksem enzym-substrat, a ich działanie nie zależy od stężenia substratu (wartość Vmax zmniejsza się), a jedynie od stężenia inhibitora i jego wartości Ki, charakteryzującej powinowactwo inhibitora do enzymu. Powinowactwo substratu do enzymu nie ulega zmianie, dlatego wartość KM pozostaje stała.
EI
±I ±S
E EIS E + P
±S ±I
ES
E+P
Działanie inhibitora niekompetycyjnego na wykresie Lineweavera-Burka można rozpoznać ze względu na zwiększenie nachylenia prostej oraz zmianę punktu przecięcia z osią y (maleje Vmax), natomiast punkt przecięcia z osią x pozostaje bez zmian (stała wartość KM).
Aktywność enzymatyczną hamuje niekompetycyjnie wiele związków, np. czynniki strącające białka, jak sole metali ciężkich w wyższych stężeniach czy odczynniki alkaloidowe. Wiele enzymów jest wrażliwych nawet na niskie stężenia metali ciężkich, co tłumaczy się katalizowaniem metalem utleniania np. grup -SH tlenem atmosferycznym. Działanie to jest odwracalne, można je cofnąć stosując nadmiar związków tiolowych, np. cysteiny, których grupy -SH będą konkurować z grupami enzymu o inhibitor.
Inhibitorami są również związki tworzące kompleksy z metalami będącymi częścią centrum aktywnego lub biorącymi bezpośredni udział w procesie katalitycznym, np. cyjanki, CO wpływają na oddychanie komórkowe, hamując oksydazy zawierające Fe lub Cu w grupie czynnej.
Typ hamowania można określić kilkoma metodami, np. za pomocą metody Dixona. Przy stałym stężeniu substratu oznacza się szybkość reakcji v przy różnych stężeniach inhibitora. Oznaczając szybkość v przy dwóch (lub więcej) stężeniach substratu, wyznacza się krzywe zależności 1/v od [I] i ustala typ hamowania (kompetycyjne - krzywe przecinają się, niekompetycyjne - krzywe zbiegają się na osi x) oraz oznacza wartość Ki (punkt przecięcia krzywych). Można również wykreślić krzywe zależności szybkości reakcji v0 od stężenia substratu według Michaelisa-Menten lub też zależność 1/v od 1/[S] wg Lineweavera-Burka, w obecności i nieobecności inhibitora, z których można wyznaczyć wartości Vmax i KM i na tej podstawie określić typ inhibicji, jak już podano wyżej.
Krzywa Dixona: a) dla inhibitora kompetycyjnego; b) dla inhibitora niekompetycyjnego
Krzywa Michaelisa-Menten bez i w obecności inhibitora a) kompetycyjnego;
b) niekompetycyjnego
Krzywa Lineweavera-Burka bez i w obecności inhibitora a) kompetycyjnego;
b) niekompetycyjnego
Celem ćwiczenia jest poznanie mechanizmów inhibicji i określanie typów hamowania reakcji enzymatycznych oraz poznanie czynników wpływających na szybkość reakcji enzymatycznych.
Wykonanie ćwiczenia:
Zadanie 1.
Obliczyć energię aktywacji, przyjmując, że podczas hydrolizy w temp. 25oC szybkość Vm reakcji wynosiła 0,27 mg/min, a w temp. 35oC 0,48 mg/min.
Wyliczyć energię aktywacji, wiedząc, że stała szybkości reakcji w temp. 27oC wynosiła 0,245.
Energia aktywacji pewnej reakcji wynosi 50 kJ/mol. Jak zmieni się stała szybkości tej reakcji, jeśli temperatura zostanie obniżona z 250C na 15oC?
Ile razy wzrosła szybkość pewnej reakcji, jeśli jej temperaturowy współczynnik wynosi γ=3, a temperatura wzrosła o 5oC?
Ile razy wzrosła szybkość pewnej reakcji, jeśli jej temperaturowy współczynnik wynosi γ=4, a temperatura wzrosła o 8oC?
Temperaturowy współczynnik pewnej reakcji wynosi γ=3. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 10 razy?
Temperaturowy współczynnik pewnej reakcji wynosi γ=4. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 3 razy?
Temperaturowy współczynnik pewnej reakcji wynosi γ=1. O ile stopni należy podnieść temperaturę, aby szybkość reakcji wzrosła 3 razy?
Zadanie 2. W wyniku działania dwóch różnych enzymów na substrat o zmiennym stężeniu określono szybkości początkowe:
Początkowe stężenie substratu [μM] |
enzym A |
enzym B |
|
v0 |
v0 |
50 100 156 208 |
5,6 8,4 9,3 10,3 |
11,2 14,9 16,8 18,7 |
Określić stałe kinetyczne KM i Vmax.
Który z enzymów wykazuje większe powinowactwo do substratu?
Zadanie 3. Zmierzono szybkości początkowe przy różnym stężeniu substratu dla reakcji katalizowanej przez trypsynę niemodyfikowaną i modyfikowaną:
Początkowe stężenie substratu [μM] |
enzym niemodyfikowany |
enzym modyfikowany |
|
v0 |
v0 |
4 8 10 15 20 |
1,2 1,7 1,9 2,2 2,6 |
1,9 2,5 2,6 3,0 3,2 |
Określić stałe kinetyczne KM i Vmax.
Jakiego rodzaju inhibicję wywołała modyfikacja trypsyny?
Zadanie 4. Oznaczono szybkości początkowe reakcji bez i z dodatkiem inhibitora. Otrzymano:
Początkowe stężenie substratu [μM] |
bez inhibitora |
działanie inhibitora |
|
v0 |
v0 |
5 10 15 20 26 |
1,8 2,0 2,4 2,6 2,7 |
1,3 1,4 1,8 2,1 3,1 |
Wyznaczyć stałe kinetyczne
Określić rodzaj inhibicji
Podać w jaki sposób można cofnąć działanie inhibitora.
Zagadnienia do przygotowania:
Wpływ różnych czynników na szybkość reakcji enzymatycznych.
Optymalne warunki działania inwertazy, amylazy ślinowej, trypsyny itp.
Energia aktywacji, reguła van't Hoffa, współczynnik temperaturowy.
Rodzaje inhibitorów, przykłady różnych typów, mechanizmy inhibicji enzymów.
Metody określenia typów inhibicji.
Przykłady inhibitorów i ich wpływu na reakcje enzymatyczne w technologii żywności.
Literatura:
Dziuba J., Kostyra H.: „Biochemia żywności (metody, zadania i testy)”, Wydawnictwo UW-M w Olsztynie, Olsztyn 2000.
Kłyszejko-Stefanowicz L. (red.): „Ćwiczenia z biochemii”, PWN Warszawa - Poznań 1982.
Kołakowski E., Bednarski W., Bielecki S. „Enzymatyczna modyfikacja składników żywności”, Akademia Rolnicza w Szczecinie, Szczecin 2005.
Murrey R.K., Granner D.K, Mayes P.A., Rodwell V.W.: „Biochemia Harpera”, Wydawnictwo Lekarskie PZWL, Warszawa 2001.
Stryer L.: „Biochemia”, PWN Warszawa 1986.
Zał. 1
Wpływ stężenia substratu na szybkość reakcji enzymatycznej
Powstawanie kompleksów enzym-substrat przy:
A) małym stężeniu substratu; B) stężeniu substratu równym KM; C) dużym stężeniu substratu;
Zał. 2.
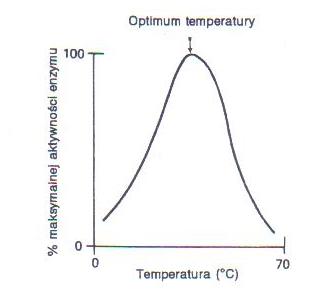
Wpływ temperatury na aktywność enzymu
Wpływ pH na aktywność enzymu
Wyszukiwarka
Podobne podstrony:
cwiczenie 2 hydrolazy czynniki wplywajace na szybkosc reakcji enzymatycznych 15 05 2014
Czynniki wpływające na szybkość biodeodoryzacji
Wpływ aktywatorów i inhibitorów na szybkość reakcji enzymatycznej
Wpływ inhibitorów i czynników fizycznych na przebieg reakcji enzymatycznych
owce 2 koło - notatki ćw, Czynniki wpływające na użytkowanie mięsne owiec
Czynniki biomechaniczne wpływające na szybkość pływania w wybranych stylach pływackich
czynniki wpływające na zmeczenie psychiczne w pracy
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
CZYNNIKI WPŁYWAJĄCE NA KSZTAŁTOWANIE SIĘ POSTAW
BADANIE WP YWU ST ENIA NA SZYBKO REAKCJI CHEMICZNYCH
Podstawowe czynniki wpływające na wartość opcji na akcje
85 Omow czynniki wplywajace na lepkosc krwi
Uczenie się - czynniki wpływające na nabieranie wprawy, Prace z socjologii, pedagogiki, psychologii,
Czynniki wplywajace na rentownosc bankow w polskim sektorze bankowym
czynniki wpływające na starość+ rozwój w późnej dorosłości, tradycje opieki i pomocy społecznej, Kon
Czynniki wpływające na wzrost roślin, Akwarium
więcej podobnych podstron