SPIS TREŚCI
I. WSTĘP I RYS HISTORYCZNY (w skrócie)
I.1. Definicja i przedmiot badań
MIKROBIOLOGIA - „micros; bios; logos” podobnie jak botanika i zoologia, jest działem biologii - nauki o życiu małych organizmów. Encyklopedia multimedialna PWN określa mikrobiologię jako „naukę o budowie, czynnościach i roli w przyrodzie (gospodarce) drobnoustrojów”.
Przedmiotem badań mikrobiologii są zatem drobnoustroje (mikroorganizmy). Są to „niższe organizmy o mikroskopowych wymiarach, np. bakterie i zbliżone do nich organizmy, wirusy, niektóre glony, grzyby, pierwotniaki; mają olbrzymie znaczenie w przyrodzie”. Niewielkie wymiary komórki nie są jednak jedynym atrybutem drobnoustrojów. Określenie „mikroorganizm” nawiązuje także do metod badawczych, jakie wykorzystujemy w badaniach tych organizmów. W miarę pełna definicja charakteryzuje mikroorganizmy jako:
wszędobylskie organizmy mikroskopijnej wielkości, mierzonej w mikrometrach (µm - 1/1000 mm) lub w nanometrach (nm - 1/1000 µm), których badanie jest możliwe za pomocą metod mikrobiologicznych, miedzy innymi mikroskopowych;
organizmy jednokomórkowe lub tworzące układy komórek, lecz nie mające struktury tkankowej, przy czym każda z komórek charakteryzuje się pełną autonomią.
Drobne rozmiary tej grupy organizmów sprawiały, że przez długi czas były one nieznane i niewidoczne. Ich poznanie było bowiem uzależnione od postępu w zakresie metod i technik badawczych, zwłaszcza mikroskopii, biochemii i genetyki. Drobnoustroje występujące w środowisku człowieka były jednak już u zarania dziejów przez ludzkość wykorzystywane, np. do sporządzania piwa i wina, kwaszenia mleka i warzyw, wypieku ciast. Powodowały także niekorzystne zjawiska (choroby roślin, zwierząt i człowieka, psucie się żywności).
I.2. Rys historyczny
Pierwsze wzmianki o chorobach spotyka się już w najstarszych źródłach. Są to zapiski chińskie i indyjskie (XX i X w p.n.e., ospa); o wściekliźnie wspomina kodeks Esznana w Babilonii, a o gruźlicy i malarii donosi HIPOKRATES - ojciec medycyny greckiej. Pojawiają się przypuszczenia, że w otoczeniu człowieka występują nieznane czynniki odpowiedzialne za dotąd niewytłumaczalne zjawiska (Varro, Columella I / II w p.n.e). Również w Biblii, w księdze „Leviticus” jest wzmianka o możliwości przenoszenia się choroby z organizmu chorego lub przedmiotu z którym on się stykał na organizm zdrowy. Nie znano jednak przyczyn i fakt ten przypisywano nieokreślonym „miazmatom”, „złemu powietrzu”
Dopiero Girolamo FRACASTORO, włoski przyrodnik (XV/XVI w), wysuwa hipotezę, że musi istnieć jakiś czynnik przenoszący chorobę zakaźną. W dziele „De Contagione” pisze: „zakażenie jest podobne do gnicia, przenoszącego się z jednej rzeczy na drugą, jego zarodki (seminaria) są bardzo aktywne, są zbudowane z silnej ciągliwej substancji i odznaczają się nie tylko materialną, ale i spirytualną antypatią w stosunku do organizmu zwierzęcego”. Nie wyjaśnia jednak natury tego czynnika.
Znaczącym osiągnięciem na drodze do poznania mikroorganizmów było skonstruowanie przez braci Jensenów (XVI w), Roberta Hooke'a (XVII w) pierwszych przyrządów optycznych. Za pomocą takiego przyrządu Hook dokonuje pierwszych obserwacji komórek roślinnych. Jednak za najlepszego w tym czasie optyka i mikroskopistę uznaje się holendra A. Van Leeuwenhoek'a (z zawodu kupca, z zamiłowania przyrodnika), który skonstruował pierwowzór jednosoczewkowego mikroskopu optycznego o powiększeniu około 300x i wyższej zdolności rozdzielczej (XVII/XVIII w). Dzięki niemu po raz pierwszy zobaczył, opisał i narysował bakterie, krwinki czerwone, plemniki, szczegóły budowy tkanek. Badania te zaprzeczały idei samorództwa, jednak eksperymentalnie jej nie obaliły.
Rys.1. Mikroskop i rysunki wykonane przez Leeuwenhoek'a (9)
Dzięki odkryciom Leeuwenhoek'a K.LINEUSZ (XVIII w) uznaje odrębność niewidzialnych gołym okiem organizmów i wyodrębnia je w swoim systemie pod nazwą „Chaos infusorium”. W grupie tej umieszcza także mikroskopijne plemniki oraz „eteryczne mgiełki czasu kwitnienia”.
Pomimo tych odkryć nie wiązano jeszcze faktu obecności i funkcji życiowych mikroorganizmów z procesami biologicznymi zachodzącymi w środowisku i w otoczeniu człowieka.
Znaczącym postępem w rozwoju mikroskopii było skonstruowanie w drugiej połowie XIX w przez Abbego i Zeissa współczesnego mikroskopu optycznego z aparatem oświetleniowym (aparatem Abbego); wprowadzenie przez Siedentopfa i Zsigmondy'ego do praktyki mikrobiologicznej mikroskopu ultrafioletowego; wreszcie zbudowanie przez Ruska w latach trzydziestych XX w pierwowzoru mikroskopu elektronowego o dużej zdolności rozdzielczej. Za ojca mikrobiologii jako nauki oraz twórcę poszczególnych jej działów, a zwłaszcza mikrobiologii przemysłowej (przemysłu fermentacyjnego), lekarskiej i weterynaryjnej uznaje się francuskiego biochemika i mikrobiologa Ludwika Pasteur'a (XIX w). Najważniejsze jego osiągnięcia to:obalenie uznawanej przez Arystotelesa hipotezy samorództwa (generatio spontanea);wykazanie, że fermentacje są sposobem beztlenowego oddychanie mikroorganizmów, właściwych dla każdego typu fermentacji oraz że przyczyną chorób wina i gnicia są mikroorganizmy;opracowanie metod zwalczania pebryny jedwabników - choroby zakaźnej wywoływanej przez pierwotniaki, wprowadzenie szczepień ochronnych przeciwko wąglikowi - chorobie bakteryjnej bydła i ludzi, opracowanie metod szczepienia przeciwko cholerze drobiu oraz wściekliźnie; wykorzystanie bieżącej pary wodnej do konserwacji żywności (pasteryzacja), gorącej pary wodnej (120º) pod ciśnieniem do sterylizacji podłoży i gorącego suchego powietrza (180º) do wyjaławiania szkła; wprowadzenie metod otrzymywania czystych kultur i podłoży selektywnych.
Współtwórcą bakteriologii i pionierem współczesnej nauki o chorobach zakaźnych był niemiecki uczony Robert Koch (1843-1910), który praktykę lekarską rozpoczął jako lekarz powiatowy w Wolsztynie.
Prowadząc badania zapoczątkowane przez Pasteur'a opisuje sprawców wąglika (Bacillus anthracis), cholery (Vibrio cholerae) i gruźlicy (Mycobacterium tuberculosis). Na podstawie badań nad sprawcami chorób zakaźnych ogłasza tzw. „Postulaty Kocha”, których spełnienie jest warunkiem uznania danego mikroorganizmu za sprawcę choroby. Postulaty te obowiązują w medycynie, weterynarii i fitopatologii (nauka o chorobach roślin). Największe uznanie i Nagrodę Nobla zapewniły mu jednak badania nad gruźlicą. Ponadto Koch opracował i zastosował metody barwienia bakterii barwnikami anilinowymi, wprowadził stałe podłoża żelatynowe i agarowe, dzięki czemu usprawnił izolację mikroorganizmów i uzyskiwanie czystych kultur.
Rozwój technik badawczych pozwolił na dalsze odkrycia, między innymi w zakresie mikrobiologii rolniczej i przemysłowej. W drugiej połowie XIX w De Bary opisuje grzyby chorobotwórcze dla roślin, Hansen badający drożdże wprowadza do piwowarstwa czyste kultury, Iwanowski i Beijerinck oraz Löeffler i Frosch wykrywają istnienie czynników zakaźnych przechodzących przez przeciwbakteryjne filtry porcelanowe Chamberlanda (wirus mozaiki tytoniu oraz pryszczycy u bydła), a Wehmer opisuje wytwarzanie kwasu cytrynowego przez grzyby. W pierwszej połowie XX w Smith opisuje fitopatogenne bakterie, Weizman zajmuje się pozyskiwaniem acetonu i butanolu na drodze fermentacji beztlenowej, Tword i d'Herelle odkrywają bakteriofagi, a Winogradzki, zajmujący się krążeniem pierwiastków, rozwija mikrobiologię gleby. Wskazuje na znaczenie mikroorganizmów w utrzymaniu jej żyzności i odżywianiu roślin.
W Polsce L.Cienkowski określa przyczynę (Leuconostoc mesenteroides) i sposób zapobiegania powstawania „żabiego skrzeku” w cukrowniach, A. Prażmowski opisuje bakterie brodawkowe (Rhizobium) i symbiotyczne wiązanie azotu atmosferycznego, izoluje bakterie z rodzaju Bacillus i Clostridium, B. Niklewski opisuje bakterie wodorowe, O.Bujwid organizuje centrum pasteurowskie i pierwszą w Polsce wytwórnię surowic oraz szczepionek, T.Chrząszcz rozwija badania nad grzybami pleśniowymi, T.Matuszewski zajmuje się mikrobiologią mleczarstwa, W.Dąbrowski - przemysłem fermentacyjnym, a W.Syniewski opracowuje pierwszy polski podręcznik „Mikrobiologia fermentacyjna”. Mikrobiologię gleby rozwijają S i H.Krzemieniewscy, K.Bassalik i J.Ziemięcka.
I.3. Działy mikrobiologii
Poszerzenie zakresu i tematyki badań mikrobiologicznych w XX w spowodował podział mikrobiologii na szereg działów, np. mikrobiologię ogólną zajmująca się budową, funkcjami życiowymi i przemianą materii i mikrobiologię szczegółową zajmującą się poszczególnymi grupami mikroorganizmów (wirusologia, bakteriologia, czy też mikologia), a w obrębie tych działów: anatomią i morfologią, fizjologią i biochemią, ekologią, genetyką, ewolucją i systematyką. Pojawiły się też działy mikrobiologii uwzględniające miejsca bytowania mikroorganizmów (np. mikrobiologia gleby, wód i ścieków, żywności), a także ważne dla gospodarki człowieka względy praktyczne (mikrobiologia lekarska, weterynaryjna, sanitarna, rolnicza, przemysłowa i inne).
Prowadzenie tak szeroko zakrojonych badań, w dużym zakresie poza naturalnym siedliskiem bytowania mikroorganizmów, stało się możliwe dzięki wykorzystaniu w laboratoriach mikrobiologicznych:
sprzętu pozwalającego na sterylizację pomieszczeń, szkła laboratoryjnego i podłoży, na których hodować możemy jeden, w danej chwili badany mikroorganizm (lampy bakteriobójcze, pasteryzatory, sterylizatory); bezpieczną pracę z mikroorganizmami (komory z laminarnym obiegiem powietrza) i ich hodowlę w określonych temperaturach (termostaty);
szkła laboratoryjnego, np. płytek Petrieg'o, kolb Erlenmayer'a, w których na różnych podłożach stały się możliwe różne sposoby izolacji i hodowli mikroorganizmów;
nowoczesnych technik mikroskopowych z wykorzystaniem mikroskopów o dużej rozdzielczości i związków chemicznych pozwalających różnicowanie mikroorganizmów lub fragmentów budowy ich komórki na drodze selektywnego barwienia. Te ostatnie pozwoliły także na sporządzanie specyficznych podłoży (selektywnych, wybiórczych) wykorzystywanych do różnicowania i hodowli różnych grup mikroorganizmów, badania ich właściwości biochemicznych i wpływu na środowisko bytowania.
I.4. Kalendarium
XVI w. - budowa mikroskopu złożonego - Bracia Jensenowie
XVII w. - budowa mikroskopu złożonego, obserwacje komórek roślinnych - Hook
- budowa mikroskopu i pierwsze obserwacje mikroorganizmów - A. v. Leeuwenhoek
XVIII w. - opisy form bakterii i ich wydzielenie spośród pierwotniaków - Műller
XIX w. - pierwsza chemiczna teoria fermentacji - Gay-Lussac
- wykorzystanie pary wodnej pod ciśnieniem do wyjaławiania konserw -Appert
- wykrycie sprawcy krwistości chleba i hostii (Serratia marcescens) - Bizio
- wykrycie jądra komórkowego - Brown
- przypisanie bakteriom roli w niebieszczeniu mleka - Fuchs
- opisanie laseczki wąglika (Bacillus anthracis) - Davaine
- opisy fitopatogenicznych grzybów - De Bary
- obalenie teorii samorództwa, rozwój technik mikrobiologicznych, określenie roli mikroorganizmów w procesach fermentacyjnych, wprowadzenie szczepień ochronnych - L.Pasteur
- hodowla bakterii na podłożu stałym (ziemniak) - Fresenius
- frakcjonowana sterylizacja - Tyndall, Prażmowski
- wprowadzeni barwienia bakterii barwnikami anilinowymi i stałych podłoży, badania nad laseczką wąglika (Bacillus anthracis), przecinkowcem cholery (Vibrio cholerae) i prątkami gruźlicy (Mycobacterium tuberculosis), ogłoszenie postulatów Kocha - Koch
- badania nad drożdżami - Hansen
- ulepszenie mikroskopu - aparat Abbego - Abbe
- wprowadzenie metody barwienia złożonego - Gram
- opracowanie metody szczepień ochronnych przeciwko wąglikowi, określenie przyczyny śluzowacenia cukru w cukrowniach (Leuconostock mesenteroides) i sposobu zabezpieczenia roztworu cukru - Cieńkowski
- wpowadzenie filtrów bakteriologicznych Chamberlanda - Chamberland
- badanie procesów nitryfikacji i asymilacji azotu przez bakterie glebowe oraz izolacja bakterii siarkowych, ekologia gleby - Winogradzki
- synteza kwasu cytrynowego przez grzyby z rodzaju Aspergillus - Wehmer
- wykrycie wirusa pryszczycy bydła - Frosch i Lőfler
- wykrycie wirusa mozaiki tytuniu - Iwanowski i Beijerinck
XX w. - mikroskop ultrafioletowy - Siedentopf i Zsigmondy
- opis fitopatogennych bakterii - Smith
- wykorzystanie fermentacji beztlenowych do produkcji acetonu i butanolu - Weizman
- wykrycie wirusów bakteryjnych (bakteriofagów) - Twort i d'Herelle
- wykrycie penicyliny - Fleming
- mikroskop elektronowy - Rusek
- wykrycie streptomycyny - Waksman
- transformacja u bakterii - Avery
- koniugacja u bakterii - Lederberg, Tatum
- budowa DNA - Crick, Watson
- transdukcja u bakterii ; wykrycie mRNA, sRNA; synteza DNA i RNA in vitro (Kornberg i Ochoa); kod genetyczny - Zinder, Lederberg
- regulacja enzymatyczna u bakterii (indukcja i represja enzymów) - Jacob, Monod.
II. LABORATORIUM MIKROBIOLOGICZNE
II.1. ZASADY BEZPIECZNEJ PRACY W LABORATORIUM MIKROBIOLOGICZNYM
Metody mikrobiologiczne, z którymi mamy do czynienia podczas ćwiczeń mają na celu wykrywanie i badanie grup mikroorganizmów zarówno pożądanych jak i szkodliwych, które występują w halach produkcyjnych, magazynach, opakowaniach i w surowcach oraz produktach rolno-spożywczych.
Aby zapobiec przypadkowemu zakażeniu oraz uniknąć zranień lub oparzeń w trakcie wykonywania poszczególnych czynności w laboratorium wymaga się stosowania właściwych warunków pracy. W tym celu przed rozpoczęciem ćwiczeń studenci są zobowiązani do zapoznania się z następującymi zasadami bezpiecznej i aseptycznej pracy:
W laboratorium mikrobiologicznym należy przebywać w fartuchu ochronnym uszytym z naturalnego materiału. Ubrania wierzchnie (płaszcze) zostawiać w szatni uczelni.
Na sali ćwiczeń nie wolno pić, jeść, palić, a także żuć gumy.
Przed przystąpieniem do ćwiczeń należy zapoznać się z metodyką ćwiczeń oraz przestrzegać wskazówek dotyczących ich wykonania.
W czasie wykonywania ćwiczeń przestrzegać zasad jałowej pracy, ostrożnie obchodzić się z materiałem badanym, wszelkie czynności związane z posiewami wykonywać przy zapalonym palniku, założone hodowle dokładnie opisywać.
Płytki Petriego, probówki z hodowlami powinny być zawsze zamknięte. Otwieramy je tylko na czas pobrania materiału i natychmiast zamykamy.
Z sali ćwiczeń nie wynosić na zewnątrz hodowli mikroorganizmów, preparatów, odczynników i szkła laboratoryjnego.
Drobny sprzęt metalowy (ezy, igły, skalpele, szczypce, pincety) należy zarówno przed jak i po użyciu opalić w palniku w celu zniszczenia drobnoustrojów.
Każde rozbicie naczyń z hodowlami oraz wszelkie skaleczenia lub oparzenia powstałe w trakcie zajęć należy zgłosić prowadzącemu.
Używane szkło, szkiełka, pipety odkładać do wyznaczonych przez prowadzącego pojemników.
Przed rozpoczęciem pracy i po jej zakończeniu miejsce pracy dokładnie przemyć środkiem dezynfekcyjnym.
Kilkakrotnie w czasie pracy i po jej zakończeniu myć ręce, stosując do ich mycia środki dezynfekcyjne.
Po zakończeniu zajęć uporządkować stoły, sprawdzić czy zostały zgaszone palniki spirytusowe. Schować używane przedmioty do szafek. Przemyć stoły środkiem odkażającym, umyć ręce.
„Każdy pracujący z drobnoustrojami winien wiedzieć, że praca, którą wykonuje stanowi rodzaj ryzyka mikrobiologicznego pośredniego lub bezpośredniego, zarówno dla niego, jak i dla otoczenia. Ryzyko mikrobiologiczne jest równoznaczne z uwolnieniem, przeniknięciem mikroorganizmów do otoczenia i powodowaniem przez nie zakażenia bezpośredniego lub pośredniego”
II.2. WYPOSAŻENIE LABORATORIUM MIKROBIOLOGICZNEGO
2.1. Podstawowa aparatura mikrobiologiczna
Autoklaw
Urządzenie służące do sterylizacji niektórych pożywek oraz jałowienia drobnego sprzętu mikrobiologicznego (płytki Petriego, kolby, probówki, zlewki, butelki).
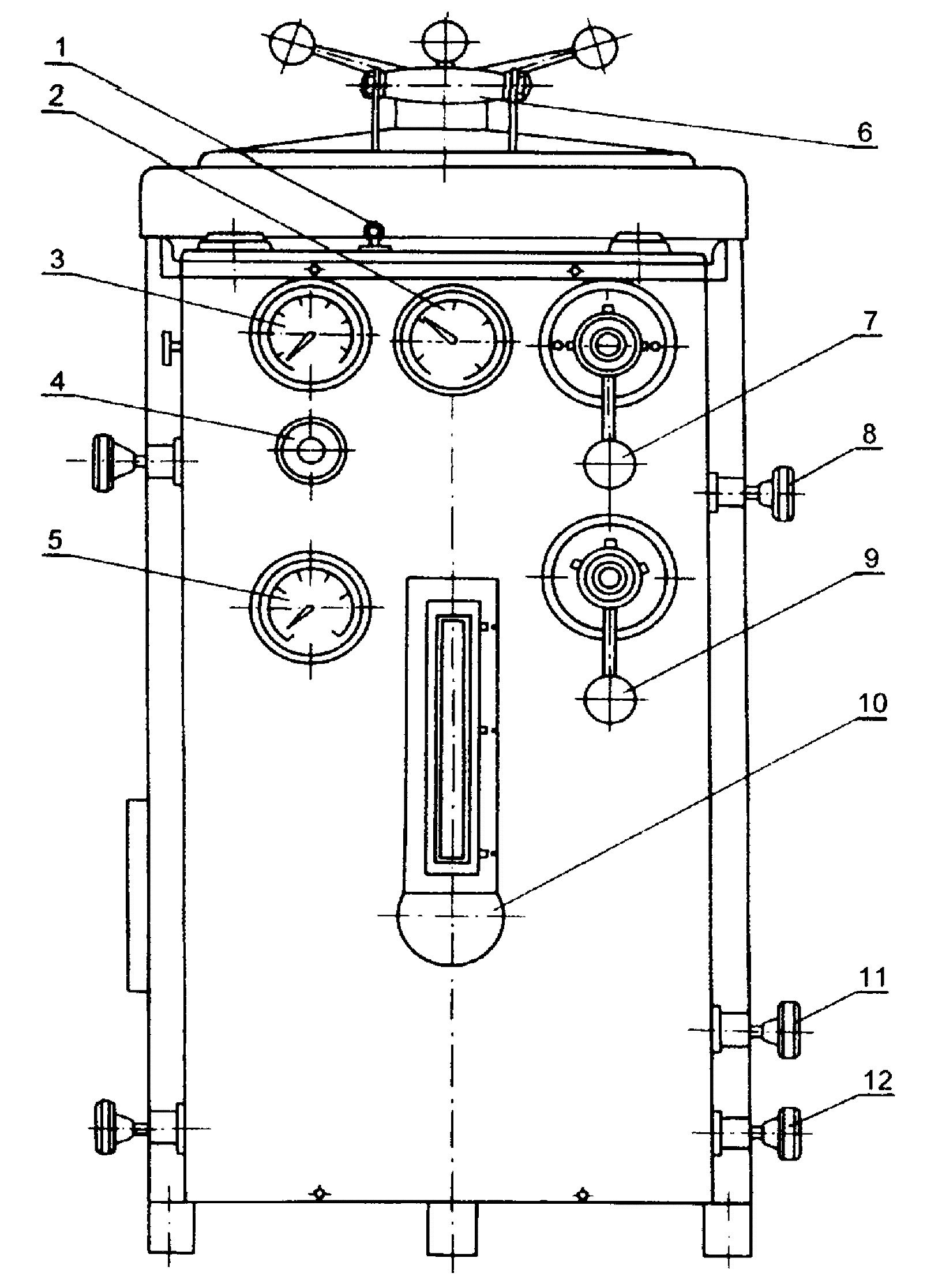
Rys.2. Widok ogólny autoklawu (1):
1. Gałka zaworu bezpieczeństwa,
2. Manometr komory sterylizacyjnej,
3. Manometr kotła,
4. Zawór trójdrożny manometru,
5. Termometr tarczowy wskazujący temperaturę w komorze,
6. Rączka zamka pokrywy,
7. Dźwignia zaworu sterującego,
8. Zawór doprowadzający parę do kotła,
9. Dźwignia zaworu selekcyjnego,
10. Wskaźnik poziomu wody w komorze
11. Zawór odpowietrzający komorę,
12. Zawór odprowadzający kondensat z komory sterylizacyjnej
Autoklaw to hermetycznie zamknięty kocioł stalowy o podwójnych ścianach i dnie, w którym uzyskuje się wysokie ciśnienie. Jest zaopatrzony w manometr, termometr, zawór bezpieczeństwa i elektryczny system grzewczy. Czynnikiem jałowiącym w autoklawie jest przegrzana nasycona para wodna pod zwiększonym ciśnieniem. W aparacie gotująca woda doprowadza do nadciśnienia parę wodną, która ulega nasyceniu po zupełnym wyparciu powietrza. Manometr znajdujący się w obudowie wskazuje wzrost ciśnienia po zamknięciu zaworu odpowietrzającego.
Większość podłoży wyjaławia się w temperaturze 121°C przez 20 - 30 min, pożywki zawierające cukry i inne składniki termowrażliwe - 117°C, a materiał zawierający drobnoustroje zakaźne w temperaturze 134°C.
Ponieważ autoklaw to kocioł pracujący pod wysokim ciśnieniem, stąd osoby go obsługujące muszą przejść odpowiednie szkolenie. W przypadku zauważenia jakichkolwiek usterek (nieszczelności, niekontrolowany wzrost ciśnienia i temperatury) autoklaw należy natychmiast odłączyć od źródła zasilania i za pomocą zaworu bezpieczeństwa zredukować ciśnienie.
Pasteryzator
Typowym pasteryzatorem jest aparat Kocha. Jest to lekki, metalowy kocioł parowy z dodatkowym ażurowym dnem, pod którym znajduje się zbiornik z wodą. Kocioł przykryty jest luźną pokrywą z otworem na termometr i wylot pary wodnej. W obudowie znajduje się również wskaźnik poziomu wody. Źródłem wytwarzanej pary jest woda znajdująca się na dnie kotła, którą doprowadza do wrzenia system grzałek. Czynnikiem wyjawiającym jest bieżąca para wodna o temperaturze około 100°C. Służy do wyjaławiania pożywek mikrobiologicznych zawierających termowrażliwe składniki. Wyjaławiany nateriał ustawia się na ażurowych półkach. Czas pasteryzacji zależy od objętości i rodzaju wyjaławianego materiału i wynosi od 15-60 min.
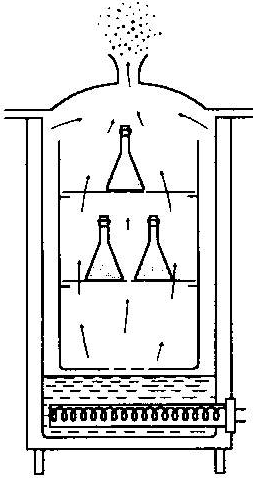
Rys.3. Aparat Kocha (10)
Suszarki
Zaopatrzone w termoregulator urządzenia ogrzewane energią elektryczną, służące do sterylizacji szkła laboratoryjnego i niektórych związków chemicznych oraz suszenia różnych substancji. Czynnikiem wyjaławiającym jest suche, gorące powietrze. Czas jałowienia w temperaturze 1600C trwa na ogół 2 godziny.
Termostaty (cieplarki)
Służą do hodowli drobnoustrojów. Są to specjalne szafki wykonane z blachy stalowej (lub drewna), zaopatrzone w płaszcz powietrzny lub wodny, który zapobiega utracie ciepła i niepożądanym wahaniom temperatury. W środku wyposażone są w ażurowe półki na hodowle mikroorganizmów. Termostaty są zasilane energią elektryczną, a wymagana temperatura jest ustawiana i utrzymywana dzięki tzw. termometrom kontaktowym.
Anaerostaty
Specjalne, hermetycznie zamykane aparaty do hodowli bakterii w warunkach beztlenowych. Zamiast powietrza mogą być wypełnione gazem obojętnym (CO2 lub N2) bądź też są zaopatrzone w pochłaniacze tlenu. Jest to najczęściej mieszanina węglanu potasowego, pirogallolu i ziemi okrzemkowej.
Obecnie wiele firm wytwarzających produkty do diagnostyki mikrobiologicznej poleca specjalne zestawy do wytwarzania środowisk gazowych wśród których znajdują się: zestawy do uzyskiwania środowiska beztlenowego; zestawy do uzyskiwania atmosfery mikroaerofilnej; zestawy do hodowli organizmów wymagających do wzrostu CO2.
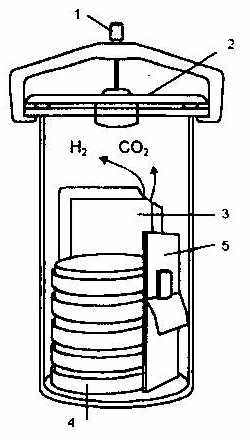
Rys.4. Anaerostat (10)
Śruba mocująca.
Pokrywa.
Saszetka z substancją pochłaniającą.
Płytki Petriego.
Saszetka ze wskaźnikiem warunków beztlenowych
Wytrząsarki
Urządzenia umożliwiające hodowlę wgłębną drobnoustrojów w podłożach płynnych w warunkach tlenowych. Dzięki wytrząsaniu (rotacji) uzyskuje się lepsze napowietrzenie hodowli. W zależności od rodzaju ruchu wyróżniamy wytrząsarki:
o ruchu posuwisto - zwrotnym z regulowaną amplitudą drgań
rotacyjne z regulowanym skokiem drgań
Temperaturę inkubacji utrzymuje własna komora cieplna (wodna - łaźnia bakteriologiczna lub powietrzna), a wytrząsarki bez komory umieszcza się w pomieszczeniach o regulowanej temperaturze. Stosowane są również do sporządzania rozcieńczeń glebowych lub rozcieńczeń z innych materiałów.
Boksy (szafy) laminarne
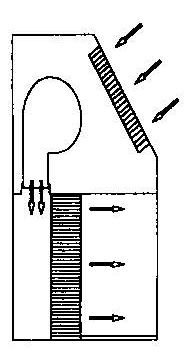
Służą do wykonywania posiewów i przeszczepów mikroorganizmów, zabezpieczając badany materiał przed przypadkowymi zanieczyszczeniami z powietrza oraz zapewniając bezpieczeństwo pracy osobom wykonującym te czynności. Są to boksy, w którym następuje przepływ powietrza w układzie liniowym (pionowo lub poziomo) z określoną szybkością. Jałowość powietrza w boksach oraz w pomieszczeniu ich usytuowania zapewniają zainstalowane w obudowy filtry powietrza. Mogą to być filtry absolutne typu HEPA, które w 99,9% zatrzymują cząstki o średnicy 0,3 ၭm lub filtry z węglem aktywnym absorbujące szkodliwe czynniki zawiesin koloidalnych oraz gazy. Dodatkowym wyposażeniem boksów jest lampa UV, palnik oraz szyba uchylna do ochrony badanego materiału i pracownika.
Rys.5. Szafa laminarna z poziomym przepływem powietrza (10)
Lampy bakteriologiczne
Są wykorzystywane do niszczenia mikroorganizmów występujących w powietrzu i na odkrytych powierzchniach zamkniętych pomieszczeń, np. hal produkcyjnych, laboratoriów, kamer do szczepień. Źródłem promieniowania są lampy kwarcowe, wypełnione oparami rtęci, emitujące w 95% statyczne lub zabójcze promieniowanie o długości fali 258 nm. Ponieważ promieniowanie to charakteryzuje się słabą przenikliwością (nie przenika przez zwykłe szkło), stąd nie jest wykorzystywane do wyjaławiania szkła i podłoży agarowych.
Filtry
Ponieważ pory filtrów są mniejsze od wymiarów bakterii, są wykorzystywane do jałowienia „na zimno” płynnych produktów (podłoży, buforów, płynów ustrojowych i innych termowrażliwych składników podłoży. Można je również stosować w metodach wydzielania toksyn z hodowli płynnej, enzymów lub innych produktów metabolizmu, a także do oznaczania liczby drobnoustrojów występujących w płynach o niewielkim skażeniu (woda, wino, klarowne soki, itp.).
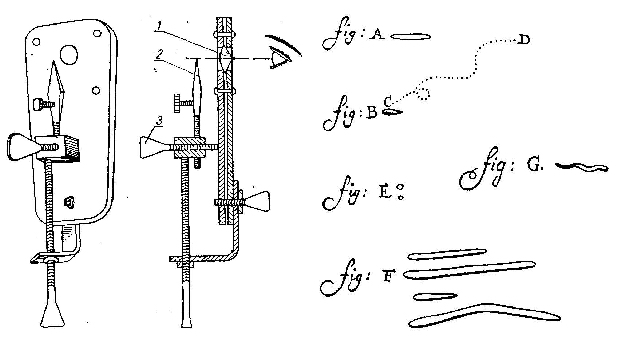
Sączenie przez filtry przebiega jednak bardzo wolno, dlatego też proces sączenia przeprowadza się w warunkach podciśnienia, wykorzystując w tym celu pompy próżniowe. W pracy mikrobiologicznej wykorzystuje się filtry:
Chamberlanda (rys.A) wykonane z nieglazurowanej porcelany i oznaczane literami L1, L2 ... L13, itd. Im wyższa liczba przy L, tym mniejsza średnica porów. Do najczęściej wykorzystywanych zalicza się filtry L3 (1,9-2,5 µm) i L5 (1,3-1,9 µm).
Berkefelda (rys.B) wykonane z ziemi krzemionkowej i oznaczone literami: W (3-4ၭm); N (5-7ၭm); V (8-12ၭm). Najczęściej stosowane są filtry oznaczone literą N.
Azbestowe Seitza (rys.C) w praktyce mikrobiologicznej do wyjaławiania podłoży stosuje się filtry oznaczone literami EK.
Schotta (rys.D) wykonane ze spiekanego porowatego szkła Oznacza się je literami G3, G4, G5. Do celów bakteriologicznych stosuje się filtry G5, które montowane są na kolbie próżniowej.
Membranowe (rys.E) najczęściej stosowane. Charakteryzują się dużą zdolnością filtracyjną. Są wykonane z estrów lub octanów celulozy, polichlorku winylu lub teflonu o średnicy porów od 0,05 - 14,0 ၭm. Mają postać cienkiej, sprężystej błony. Dzięki zastosowaniu różnicy ciśnień (nad- i podciśnienie) charakteryzują się dużą szybkością przepływu (40 cm3/min/cm2).
Rys.6. Filtry mikrobiologiczne (16, 24)
Mikroskopy - sprzęt służący do badania morfologii komórki drobnoustrojów. Omówienie w kolejnym rozdziale skryptu.
2.2. Drobny sprzęt i szkło laboratoryjne
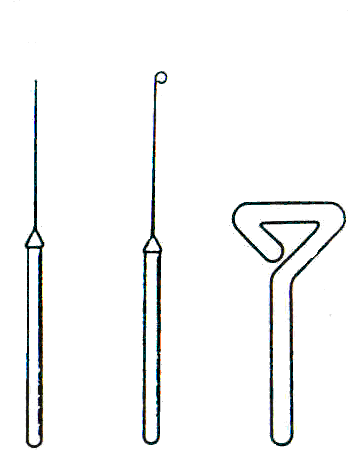
Igła preparacyjna - prosty drucik osadzony w oprawce, służący do posiewów wgłębnych bakterii, sporządzania preparatów mikologicznych. Może być zakończony haczykiem i wtedy służy do przeszczepiania grzybów.
Eza - wykonany ze specjalnego rodzaju stali, często platynowy i osadzony w oprawce drut zakończony oczkiem. Służy do posiewów, przesiewów, sporządzania preparatów mikroskopowych.
Rys.7. Igła, eza. głaszczka (21)
Głaszczka - szklany wygięty pręt służący do posiewów powierzchniowych, rozsiewania materiału biologicznego.
![]()
Płytki Petriego - dwie szklane (jednorazowe z tworzywa, najczęściej o Ø 10 cm) zachodzące na siebie szalki wykorzystywane do hodowli, liczenia i określania morfologii kolonii mikroorganizmów na pożywkach zestalonych.
Kolby, probówki szklane (ze szkła obojętnego i bez wygiętego kołnierzyka)- używane do wykonania rozcieńczeń, sporządzania i rozlewania pożywek, do posiewów i hodowli na pożywkach płynnym i zestalonych.
Rurki Durhama - małe szklane probóweczki (C), które zanurza się do góry dnem w probówkach z pożywką płynną (A). Służą do zbierania pęcherzyków gazu (B) wydzielanego podczas procesów fermentacyjnych przeprowadzanych przez drobnoustroje.
Rys.8. Probówka z płynnym podłożem i rurką Durhama (24)
Pipety szklane / miarowe (1-25 cm3) używane do posiewów ilościowych.
Pipety pasteurowskie - wykonane ze szkła sodowego, zabezpieczone wacikiem (1) szklane rurki (2) stosowane do posiewów płynnych.
![]()
Rys.9. Pipeta pasteurowska (2)
Komory - służą do bezpośredniego liczenia drobnoustrojów pod mikroskopem.
Komora Thoma (hemocytometr) - szklana płytka z 2 wgłębieniami (głębokość 0,1 mm) i naniesioną siatką podzieloną na 16 dużych kwadratów o powierzchni 1/400 mm2. Każdy z tych kwadratów składa się z 16 małych kwadracików o boku 0,05 mm i objętości pod szkiełkiem nakrywkowym 1/4000 mm3.
Rys.10. Komora Thoma (21)
Komora Bürkera - szklana płytka z 2 wgłębieniami (0,1 mm) i siatką podzieloną na kwadraciki o boku 0,2 mm, powierzchni 0,04 mm2 i objętości pod szkiełkiem nakrywkowym 0,004 mm3;
Komora Howarda - szklana, gruba płytka z wyżłobionym dołkiem o głębokości 0,1 mm, który przykrywa się szkiełkiem nakrywkowym, posiadającym 25 przeźroczystych pól o średnicy 1,382 mm. Stosowana w analizach obecności grzybów pleśniowych w sokach.
Ponadto w pracowni mikrobiologicznej wykorzystuje się szkiełka przedmiotowe i nakrywkowe, szkiełka z łezką (komora Lindnera) do preparatów przyżyciowych, kolby i czopy fermentacyjne, skalpele, pincety, szczypce, wanienki do barwienia, statywy na probówki, koszyki druciane i metalowe puszki do sterylizacji płytek Petriego i pipet.
2.3. Zadania
Organizacja pracy w pracowni mikrobiologicznej (układ przestrzenny).
Lokalizacja i charakterystyka sprzętu znajdującego się w wyposażeniu pracowni mikrobiologicznej.
Narysować schematy: autoklawu, pasteryzatora, suszarki laboratoryjnej i termostatu.
II.3. METODY JAŁOWIENIA
W badaniach mikrobiologicznych ogromny wpływ na uzyskiwane wyniki ma higiena osobista oraz jałowość pomieszczeń, sprzętu i pożywek, które są wykorzystywane w pracy. W metodach jałowienia, wykorzystywanych również w medycynie, zakładach przetwórstwa rolno-spożywczego i w życiu codziennym, zastosowanie mają następujące procesy:
Dezynfekcja. Terminem tym określa się “proces zabicia wszystkich form wegetatywnych mikroorganizmów chorobotwórczych i niechorobotwórczych za pomocą metod fizycznych, chemicznych i mechanicznych”. Proces ten nie zapewnia całkowitej jałowości, gdyż pozostają aktywne formy przetrwalne bakterii.
Sterylizacja. W ujęciu mikrobiologicznym sterylizacja to „proces polegający na zabiciu wszystkich mikroorganizmów - niezależnie od stadium rozwojowego, a więc zarówno form wegetatywnych, jak też form przetrwalnych”.
Wyjaławianie przeprowadza się najczęściej przy użyciu metod fizycznych (temperatura, promieniowanie), mechanicznych (odfiltrowanie, odwirowanie) lub chemicznych.
3.1. Metody fizyczne
Zastosowanie wysokich temperatur (na sucho lub na mokro):
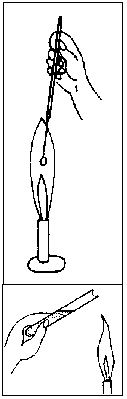
Wyżarzanie i opalanie. Ezy i igły wyżarza się do czerwoności w świecącej części płomienia palnika spirytusowego lub gazowego. Czynność tą wykonuje się przed i po każdym ich użyciu. Wyloty probówek, kolb i wszelkich naczyń, które są zamykane korkami, opala się po otworzeniu w płomieniu palnika, co zapobiega zanieczyszczeniu hodowli. Pincety, skalpele, noże, bagietki, głaszczki opala się w płomieniu po uprzednim zanurzeniu w alkoholu.
Rys. 11. Wyżarzanie ezy i opalanie wylotu probówki (21)
Gotowanie. Szkiełka podstawowe i nakrywkowe gotuje się w roztworze mydła lub środka myjącego, a następnie dokładnie płucze stosując na koniec wodę destylowaną. Po umyciu przechowuje się je na sucho w specjalnych pojemnikach, bądź też na mokro w 95% etanolu. Również metalowe narzędzia po oczyszczeniu można wygotować (20-30 minut) lub wyjałowić w autoklawie (temperatura 1210C, 20 minut).
Gorące i suche powietrze o temperaturze 160-180°C wykorzystuje się do wyjaławiania szkła oraz niektórych związków chemicznych np. węglanu wapnia, związków oleistych, wosku. Zabieg ten przeprowadza się w suszarkach laboratoryjnych.
Ponieważ szkło nowe lub nieużywane wykazuje odczyn alkaliczny stąd przed sterylizacją i użyciem należy je wygotować w wodzie z dodatkiem 1% HCl (30 min), wypłukać i ponownie wygotować w 1% roztworze Na2CO3 
(30 minut). Po dokładnym wypłukaniu w wodzie bieżącej i destylowanej, wysuszeniu, pakuje się je w papier, folię aluminiową lub też umieszcza się w metalowych puszkach i sterylizuje przez 2 godz. w temperaturze 160°C.
Przed włożeniem do suszarki kolby, probówki i pipety zamyka się korkami. Z uwagi na możliwość samozapłonu i zwęglenia temperatury 180°C nie można przekraczać podczas sterylizacji probówek z korkami z waty lub ligniny oraz szkła opakowanego w papier. Wysokie temperatury obniżają także trwałość szkła laboratoryjnego, a niedokładne wysuszenie powoduje jego pękanie.
Rys.12. Płytki Petriego przygotowane do sterylizacji (2)
Gorąca bieżąca para wodna. Jest wykorzystywana w procesie pasteryzacji (łagodnej sterylizacji) w aparacie Kocha. Pasteryzacja polega na jednokrotnym ogrzaniu wyjaławianego materiału do temperatury ok.100°C. W procesie tym giną jedynie formy wegetatywne, natomiast nie ulegają zniszczeniu formy przetrwalne bakterii, które wytrzymują wielogodzinne gotowanie. Proces pasteryzacji stosuje się w przypadku podłoży mikrobiologicznych i produktów żywnościowych, których składniki w temperaturach powyżej 100°C mogą ulegać rozkładowi, a także konserw o pH poniżej 4,5 (mikroorganizmy acidofilne charakteryzuje obniżona odporność cieplna).
Większość podłoży mikrobiologicznych poddaje się działaniu temperatury w granicach 100°C przez od 15 - 30 minut. Wrażliwe na wysokie temperatury produkty (mleko, śmietanki, moszcz, soki, piwo i inne) wyjaławia się wykorzystując modyfikacje tego procesu. Jest to pasteryzacja:
długotrwała (niska; LTLT - Low Temperature Short Time): temperatura 62 - 65°C / 20 - 30 minut;
krótkotrwała (wysoka; HTST - High Temperature Short Time); temperatura 72°C / 15 sekund;
momentalna: temperatura 85 - 90°C / 1 - 2 s.
Z praktycznego punktu widzenia pasteryzacja jest zabiegiem wystarczającym, jeśli następnie produkt zostanie schłodzony do 2-4°C i hermetycznie zamknięty, co uniemożliwia rozwój przeżywających ten zabieg mikroorganizmów.
Odmianą pasteryzacji jest tyndalizacja (pasteryzacja frakcjonowana). Jest to trzykrotna pasteryzacja przeprowadzana w odstępach co 24 godziny. W pierwszej fazie giną formy wegetatywne. Okres przerwy po pierwszej pasteryzacji pozwala na wykiełkowanie form przetrwalnych, które nie uległy zabiciu. Druga pasteryzacja zabija formy wegetatywne, które rozwinęły się z form przetrwalnych, a trzecia upewnia nas o zabiciu wszystkich drobnoustrojów.
Gorąca para wodna pod ciśnieniem. Aby uzyskać właściwy efekt sterylizacji w autoklawie proces musi przebiegać w optymalnej temperaturze, przy odpowiednim ciśnieniu i przez określony czas. Pomiędzy ciśnieniem a temperaturą wewnątrz autoklawu, a także pomiędzy temperaturą a efektem sterylizacji istnieją ścisłe zależności:przy nadciśnieniu:
0,0 atm. temperatura w autoklawie wynosi 100ºC
0,5 atm. - 111,7° (112°) C
1,0 atm. - 120,6° (121°) C
2,0 atm. - 133,9° (134°) C.
podobne efekty odkażania uzyskuje się stosując nw. temperatury i czas ekspozycji:
121°C przez 2 minuty;
110°C - 20 minut;
100°C - 200 minut.
Zatem im wyższe jest ciśnienie wewnątrz kotła tym wyższe są temperatury, a im wyższe temperatury tym krótszy okres sterylizacji. Stosując zwiększone ciśnienie, uzyskuje się zatem możliwość zniszczenia zarówno form wegetatywnych, jak i przetrwalnych. Czas sterylizacji zależy także od objętości materiału i rodzaju przedmiotów poddawanych sterylizacji (tab.1).
Tab.1. Czas sterylizacji w zależności od objętości materiału
Objętość (cm3) |
Czas sterylizacji w temperaturze 121°C (min) |
10 - 50 200 1000 2000 9000 |
12 - 14 12 - 15 20 - 25 30 - 35 50 - 55 |
Podłoża i produkty nie zawierające składników wrażliwych na wysokietemperatury sterylizuje się w autoklawie w temp. 121°C przez 15-20 min lub w temperaturze 117°C przez 15-30 minut. Procesowi sterylizacji poddaje się także konserwy o pH powyżej 4,5. Eliminacja form przetrwalnych zapobiega możliwości pojawienia się form wegetatywnych bakterii, które w warunkach niskiej kwasowości znajdują odpowiednie warunki do rozwoju.
Niektóre termowrażliwe produkty płynne (np. mleko) poddaje się sterylizacji błyskawicznej (UHT - Ultra High Temperature) w systemie przepływowym lub poprzez wtrysk pary wodnej o temperaturze 135-150°C w czasie od 2 - 9 s. Procedura ta niszczy formy wegetatywne i przetrwalne w stopniu zapewniającym trwałość handlową produktu (jeśli zostanie zapakowany w sterylnych warunkach).
Szkło używane, zawierające hodowle drobnoustrojów sterylizuje się w autoklawie w temperaturze co najmniej 134°C przez okres od 30-90 minut (w zależności od ilości i objętości sterylizowanego materiału). Po sterylizacji szkło należy opróżnić i umyć w wodzie z detergentem lub wygotować w roztworze mydła. Po dokładnym wypłukaniu w wodzie destylowanej sterylizujemy je ponownie w suszarce (160°C / 2 godz.).
Zastosowanie promieniowania (UV, X i gamma).
W praktyce mikrobiologicznej wykorzystuje się najczęściej hamujące lub zabójcze działanie na mikroorganizmy nadfioletowej części widma słonecznego o długości fali 250-260 nm, a więc tą część widma, która jest najsilniej absorbowane przez kwasy nukleinowe. Źródłem promieniowania są lampy kwarcowe, wypełnione oparami rtęci, emitujące w 95% promieniowanie o długości fali 258 nm. Promieniowanie UV jest wykorzystywane do niszczenia mikroorganizmów występujących w powietrzu i na odkrytych powierzchniach zamkniętych pomieszczeń o niewielkim zapyleniu (silosów, magazynów ichłodni, ładowni statków, laboratoriów, kamer). Ponieważ charakteryzuje się słabą przenikliwością - nie przenika przez zwykłe szkło, stąd promieniowanie UV nie jest wykorzystywane do wyjaławiania szkła i podłoży agarowych w szklanych naczyniach.
Efekt biobójczy promieniowania zależy między innymi od objętości napromienianego powietrza, wielkości powierzchni, odległości i ustawienia lamp UV. Czas emisji promieniowania nie powinien być krótszy niż 30 min, odległość lampy od sterylizowanej powierzchni nie może przekraczać 3 m, a lampy winny być ustawione prostopadle do powierzchni.
Do sterylizacji sprzętu medycznego jednorazowego użytku, surowców i preparatów farmaceutycznych oraz utrwalania produktów spożywczych (świeżych i suszonych owoców i warzyw, mięsa drobiowego, ryb, przypraw i ziół, a zwłaszcza do niszczenia mikroorganizmów w zamkniętych pojemnikach, np. w konserwach) wykorzystuje się niekiedy promieniowanie jonizujące (X, gamma), które charakteryzuje się bardzo dużą przenikliwością, energią i aktywnością biologiczną. Ponieważ stosowanie dawek promieniowania pow.10 kGy (radiopasteryzacja, radiosterylizacja) powoduje zmiany właściwości organoleptycznych, odżywczych i zdrowotnych produktów, stąd do ich sterylizacji stosuje się dawki promieniowania nie przekraczające tej wartości (raduryzacja, radycydacja). Raduryzacja to zmniejszenie ogólnej liczby mikroorganizmów i zahamowanie rozwoju form przeżywających ten zabieg; radycydacja - zmniejszenie liczebności populacji mikroorganizmów patogennych (np. Clostridium, Salmonella) i zahamowanie produkcji toksyn bakteryjnych (np. jadu kiełbasianego przez Clostridium botulinum). Stosowanie tych metod jest dozwolone tylko w niektórych krajach UE.
3.2. Metody mechaniczne
Filtrowanie. Zabieg ten stosujemy w przypadku. gdy mamy do czynienia z materiałami, które w podwyższonej temperaturze ulegają zmianom fizycznym i chemicznym. Są to zwykle pożywki zawierające witaminy, aminokwasy, surowicę, mocznik i termolabilne składniki dodawane do podłoży. Do wyjaławiania używa się najczęściej filtry membranowe o porach od 0,20-0,40 (0,75) µm średnicy. Ponieważ pory są mniejsze od wymiarów bakterii, odfiltrowane drobnoustroje osadzają się na filtrze, a uzyskany filtrat jest jałowy.
Wirowanie jest zabiegiem dzięki któremu następuje oddzielanie komórek mikroorganizmów od zawiesiny. Wykonujemy je w wirówkach z regulowanymi obrotami i czasem działania, a materiał wirowany umieszcza się w specjalnie przygotowanych pojemnikach.
3.3. Metody chemiczne
Do sterylizacji podłóg, ścian i powierzchni roboczych, linii technologicznych, czy też maszyn lub ich części stosuje się także (zgodnie z zaleceniami producenta) różne środki dezynfekcyjne. Różnią się one aktywnością biologiczną i mechanizmami działania. Aktywność biologiczna środków dezynfekcyjnych zależy od rodzaju związku chemicznego; gatunku mikroorganizmów, ich wieku i liczebności populacji; czynników środowiskowych - temperatura, kwasowość podłoża i obecność w nim innych związków chemicznych, zwłaszcza organicznych.
Mechanizm działania związany jest w pierwszym rzędzie ze strukturą chemiczną i właściwościami substancji biologicznie czynnej związku. W zależności od tych czynników, a także od koncentracji efektem może być zahamowanie wzrostu i rozwoju mikroorganizmów (działanie statyczne) lub w następstwie oddziaływania na zasadnicze struktury lub szlaki metaboliczne ich zabicie (działanie bakterio- lub grzybobójcze). Polegać ono może na: uszkadzaniu lub zmianie przepuszczalności ściany komórkowej i błony cytoplazmatycznej oraz wypływie do środowiska zewnętrznego składników komórki; utlenianiu struktur komórkowych i zakłóceniu procesów metabolicznych mikroorganizmów; tworzeniu kompleksów z białkami - blokowaniu grup funkcyjnych (-NH2, -SH, -COOH); dezaktywacji enzymów; spowodowaniu koagulacji cytoplazmy i denaturacji białek (cytoplazmatycznych, enzymatycznych, kwasów nukleinowych).
Do związków chemicznych najczęściej stosowanych w dezynfekcji należą:
Czwartorzędowe sole amoniowe (Sterinol, Dezogen). Charakteryzuje je szerokie spektrum działania (bakterie G+ i G-, grzyby pleśniowe, drożdże, wirusy), długotrwały efekt sterylizacyjny i przyjemny zapach. Ujemną stroną tych preparatów jest silna presja selekcyjna i możliwość uodpornienia się bakterii G- (np. Proteus vulgaris i Serratia marcescens), co wymusza konieczność przemiennego ich stosowania z preparatami o odmiennych mechanizmach działania (związkami nadtlenowymi, podchlorynem). Ich aktywność ulega osłabieniu w obecności związków organicznych i mydła.
Związki nadtlenowe (kwas nadoctowy, nadtlenek wodoru, nadsiarczan potasowy). Najpowszechniej stosowany kwas nadoctowy jest aktywny w stosunku do form wegetatywnych i przetrwalnych bakterii. Ponieważ związek ten nie wykazuje właściwości korozyjnych i łatwo ulega rozkładowi na produkty nieszkodliwe (woda, tlen, kwas octowy) dla produktów spożywczych, może być stosowany do dezynfekcji systemów zamkniętych (np. w browarnictwie i winiarstwie) bez konieczności przepłukiwania ich wodą. Taka procedura zapobiega powtórnemu skażeniu systemu, gdy jakość mikrobiologiczna będącej do dyspozycji wody nie jest najlepsza. Ponadto związek ten może być użyty do sterylizacji przedmiotów termowrażliwych i dezynfekcji rąk.
Alkohole (etanol, izopropanol). Charakteryzuje je szerokie działanie biobójcze (formy wegetatywne bakterii G+ i G-) uwarunkowane obecnością wody. Z tego też względu działają najsilniej jako 50-70% roztwór wodny. Aktywność alkoholi wzrasta wraz ze wzrostem liczby molowej i liczby C w łańcuchu, a maleje w obecności substancji organicznej. Są wykorzystywane do dezynfekcji systemów zamkniętych bez konieczności płukania wodą, powierzchni roboczych, sprzętu i rąk.
Wykorzystanie takich środków dezynfekcyjnych, jak: aldehydy (mrówkowy, glutarowy, formalina), związki fenolowe i pochodne fenoli (fenol, lizol, kwas karbolowy), związki chloru (podchloryn sodowy, chloramina T), jodofory (połączenia jodu z polimerami lub SPC), związki azotu (pochodne biguanidyny kw. glutaminowego i pirydyny), metale ciężkie, jest bardzo często ograniczone jedynie do dezynfekcji powierzchni roboczych nie mających kontaktu z żywnością, a w niektórych krajach zakazane. Wynika to z ich toksyczności (alergie, zakłócenia metabolizmu), wywoływania podrażnień skóry i błon śluzowych, słabej biodegradacji, długotrwałego przykrego zapachu, działania korozyjnego, wysokiej presji selekcyjnej i możliwości wykształcenia się form odpornych, uwarunkowania ich aktywności od czynników środowiskowych.
3.4. Zadania
Ocena skuteczności jałowienia za pomocą lamp UV
Zachowując warunki aseptyki płytki Petriego z hodowlami tego samego gatunku bakterii dzielimy na 4 grupy i traktujemy je w następująco:
Odkrytą płytkę naświetlamy lampą bakteriologiczną przez 10 min.;
Odkrytą płytkę naświetlamy lampą bakteriologiczną przez 20 min.;
Zamkniętą płytkę naświetlamy lampą bakteriologiczną przez 20 min.;
Odkrytą płytkę nakrywamy do połowy folią aluminiową i naświetlmy lampą bakteriologiczną przez 20 min.
Po naświetleniu hodowli płytki wstawiamy do cieplarki, inkubujemy przez 24 godz. w temp. 37°C po czym obserwujemy wzrost drobnoustrojów na podłożu. Kombinację kontrolną stanowią płytki z hodowlami nie poddanymi naświetlaniu, które inkubujemy w analogicznych warunkach. Wyniki obserwacji zapisujemy w tabeli 2.
Tab.2. Zależność pomiędzy czasem naświetlania a intensywnością wzrostu.
Czas naświetlania płytek (min) |
Intensywność wzrostu |
1. Płytka kontrolna 0 |
+++++ |
2. Płytka otwarta 10 |
|
3. Płytka otwarta 20 |
|
4. Płytka osłonięta folią 20 |
|
5. Płytka zamknięta 20 |
|
|
|
Ocena wpływu środków dezynfekcyjnych na wzrost bakterii
Dostarczone przez prowadzącego Płytki Petriego z hodowlami bakterii opisać numerem stołu oraz nazwami zastosowanych środków dezynfekcyjnych. Krążki bibuły nasączone środkiem dezynfekcyjnym, tj. 70% denaturatem, domestosem, AHD, sterinolem oraz sterylną wodą (kontrola) umieszczamy za pomocą pincety na powierzchni podłoża. Po 24 godz. inkubacji w temp. 37°C określić w mm średnicę strefy zahamowania wzrostu bakterii wokół krążków bibuły. Rys. 13 (wł)
Wyniki obserwacji zapisać w tabeli 3.
Tab.3. Strefa zahamowania wzrostu w zależności od środka dezynfekującego.
Rodzaj środka dezynfekcyjnego |
Strefy zahamowania wzrostu (Ø w mm) |
1. 70% denaturat |
|
2. Domestos (podchloryn sodu) |
|
3. AHD |
|
4.Sterinol (czwartorzędowe sole amoniowe) |
|
II.4. WARUNKI HODOWLI MIKROORGANIZMÓW
Skład ilościowy (liczebność) i jakościowy (różnorodność gatunkowa) mikroflory różnych środowisk jest odmienny, niekiedy nawet bardzo specyficzny. Zależy on od właściwości gatunkowych mikroorganizmów oraz od czynników ekologicznych: abiotycznych (fizycznych i chemicznych) oraz biotycznych (dodatnich i ujemnych, bezpośrednich i pośrednich oddziaływań jednych organizmów na drugie).
Tak silne oddziaływanie czynników środowiskowych na mikroorganizmy wynika z uproszczonej budowy, a zwłaszcza z ich ogromnej zbiorowej powierzchni czynnej (powierzchni styku ze środowiskiem). Wg Gołębiowskiej jeden organizm o objętości 1 cm3 ma powierzchnię styku ze środowiskiem ok. 6 cm2, podczas gdy 1000 mld komórek bakteryjnych mieszczących się w 1 cm3 ma powierzchnię styku około 60 tys.cm2.
Oddziaływanie poszczególnych czynników środowiskowych przebiega zgodnie z prawami, „minimum”, „maksimum” i „tolerancji”. To ostatnie mówi, że: „zarówno nadmiar, jak i niedobór jakiegoś czynnika, tak w sensie ilościowym, jak i jakościowym, poza granice tolerancji organizmu, powoduje zahamowanie wzrostu i rozwoju oraz śmierć komórki”.
Najważniejszymi czynnikami abiotycznymi wpływającymi na wzrost i rozwój drobnoustrojów, w tym także na podłożach mikrobiologicznych w warunkach laboratoryjnych, są takie czynniki fizyczne (temperatura), chemiczne (kwasowość, tlenowość) a także zawartość składników odżywczych.
4.1. Temperatura
Mikroorganizmy rozwijać się mogą w bardzo szerokim zakresie temperatur, od - 23°C (silnie zasolone wody Antarktydy w których stwierdzono obecność bakterii z rodzaju Corynebacterium i grzybów z rodzaju Sporobolomyces) do 113°C (gorące źródła, kominy termalne - Pyrodictium brockii). Większość mikroorganizmów rozwija się jednak w temperaturach od 10 - 37°C. W warunkach laboratoryjnych najczęściej stosowaną temperaturą hodowli bakterii jest zakres 30 - 37°C natomiast dla grzybów temperatura 20 - 25°C.
Ze względu na różnice w minimalnych, optymalnych i maksymalnych temperaturach wzrostu, mikroorganizmy dzieli się na ogół na trzy grupy:
Psychrofilne (-23-0; 15; 20°C). Do tej grupy zalicza się szereg drobnoustrojów zdolnych do rozwoju w środowiskach naturalnych o niskich temperaturach, jak rejony podbiegunowe, szczyty wysokich gór, dna oceanów, osady głębokich jezior. Bakterie tej grupy stanowią również poważny problem w przechowalnictwie. Występując w chłodniach i magazynach, na i w schłodzonych produktach mleczarskich, mięsnych i owocowo-warzywnych, wywierają niekorzystny wpływ na ich jakość i trwałość.
Najczęściej są to bakterie G- należące do rodzaju Pseudomonas oraz gatunki z rodzajów Vibrio, Aeromonas, Acinetobacter, Alcaligenes, Chromobacterium i Flavobacterium. Wśród bakterii G+ dominują gatunki należące do rodzajów: Micrococcus, Bacillus i Arthrobacter oraz niektóre Lactobacillus.
Spośród drożdży są to przedstawiciele rodzajów Candida, Debaryomyces, Pichia, Rhodotorula i Thurolopsis, a spośród pleśni: Aureobasidium pullulans, Botrytis cinerea i Geotrichum candidum.
Szczególne niebezpieczeństwo zatruć pokarmowych stwarzają niektóre bakterie patogenne: Listeria monocytogenes, Yersinia enterocolitica i Bacillus cereus.
Mezofilne (10-30; 20-37; 35-50°C). Grupa drobnoustrojów zdolna do wzrostu w umiarkowanych temperaturach. Do mezofili zalicza się większość drobnoustrojów występujących w środowisku (glebie, wodzie, na powierzchni ciała roślin i zwierząt). Są to na ogół mikroorganizmy saprofityczne oraz chorobotwórcze dla roślin, zwierząt i człowieka, wśród nich wywołujące zatrucia pokarmowe.
Termofilne (25-45; 45-65/80; 60-90°C). Drobnoustroje o wysokich optymalnych temperaturach wzrostu. Podzielono je na dwie grupy. Pierwsza zwana termofilami - obejmuje mikroorganizmy o optymalnej temperaturze wzrostu powyżej 45°C. Druga grupa to hipertermofile o optymalnej temperaturze wzrostu dopiero powyżej 80°C.
Mikroorganizmy tej grupy są szeroko rozpowszechnione w przyrodzie. Spotyka się je w gorących źródłach, w fermentujących resztkach roślinnych (tytoniu, sianie, nawozie i kiszonkach) oraz w przewodzie pokarmowym niektórych zwierząt. Niektóre bakterie, np. Desulfovibrio desulphuricans, rozwijają się w rurach wymienników ciepła powodując ich korozję.
Większość termofili to bakterie G+, przetrwalnikujące należące do rodzaju Bacillus (Bacillus stearothermophilus, Bacillus coagulans). Obok nich są to przedstawiciele rodzajów: Clostridium (Clostridium thermosaccharolyticum), Streptococcus, Lactobacillus, Sarcina, Staphylococcus i inne. Liczba termofili wśród bakterii G- jest ograniczona. Znane są również termofilne promieniowce (Thermomonospora, Thermoactinomyces), bakterie zielone i sinice oraz liczne gatunki grzybów, np. Absidia ramosa, Aspergillus fumigatus.
4.2. Tlenowość - potencjał oksydacyjno-redukcyjny
W warunkach naturalnych z natlenieniem środowiska łączy się zagadnienie potencjału oksydacyjno-redukcyjnego (Eh) mierzonego w woltach lub miliwoltach. Przy lepszym natlenieniu wartości potencjału redox są dodatnie i wyższe (do +0,4), a przy gorszym są niższe i przybierać mogą wartości ujemne (-0,4). Zapewnienie mikroorganizmom odpowiedniego potencjału - tlenowości ma duże znaczenie w badaniach mikrobiologicznych, przemyśle fermentacyjnym i przechowywaniu żywności. W praktyce mikrobiologicznej, w zależności od wymagań mikroorganizmów, stosujemy metody hodowli w warunkach tlenowych lub beztlenowych.
Pod względem reakcji na natlenienie środowiska mikroorganizmy dzielimy na:
Bezwzględne tlenowce (b.aeroby). Rozwijają się najlepiej przy wartościach Eh od +0,2 do +0,4 V. Obecność tlenu jest dla wzrostu i rozwoju tych mikroorganizmów niezbędna. Do tej grupy zalicza się liczne autotroficzne bakterie chemosyntetyzujące (bakterie nitryfikacyjne, Thiobacillus), wiele bakterii heterotroficznych (Pseudomonas, bakterie śluzowe), wiele gatunków grzybów pleśniowych i drożdży.
Liczne mikroorganizmy należące do tlenowców rozwijają się na w nieopakowanych produktach żywnościowych lub których opakowania zostały uszkodzone, są także wykorzystywane w procesach biotechnologicznych, np. produkcji kwasów organicznych, antybiotyków. Należą do nich bakterie z rodzaju Bacillus, pleśnie z rodzaju Aspergillus, Penicillium, promieniowce Streptomyces, Micromonospora, Nocardia.
Względne beztlenowce. Do względnych beztlenowców należy wiele różnorodnych gatunków bakterii, grzybów i pierwotniaków. Obecność tlenu może być dla tych mikroorganizmów korzystna, brak tlenu nie wyklucza jednak możliwości ich rozwoju (np. bakterie Escherichia coli, Shigella sp., Salmonella sp., Pseudomonas sp., drożdże Saccharomyces cerevisiae). Mikroorganizmy te zależnie od warunków wzrostu uzyskują energię zarówno na drodze oddychania tlenowego, jak i beztlenowego. Względne beztlenowce rozwijają się w produktach żywnościowych szczelnie opakowanych, ale nie odpowietrzonych, np. porcjowane kawałki mięsa, ryby na tackach w woreczkach z tworzyw sztucznych.
Mikroaerofile. Rosną najlepiej gdy stężenie tlenu w środowisku ich bytowania jest mniejsze. Większe stężenia tlenu powodują zahamowanie wzrostu i zatrucie komórki (bakterie fermentacji mlekowej).
Bezwzględne beztlenowce (b.anaeroby). Rozwijają się jedynie w środowisku beztlenowym przy ujemnych wartościach Eh (poniżej -0,2V). Energię uzyskują na drodze fermentacji lub oddychania beztlenowego.
Do grupy tej zalicza się: przetrwalnikujące laseczki (Clostridium) przeprowadzające fermentację masłową lub wytwarzające toksyny, które występują w odpowietrzanych konserwach oraz głębokich warstwach żywności, np. mięsie, serach; zasiedlające żwacz ziarniaki (Ruminococcus) i pałeczki (Bacteroides); bakterie metanogenne czynne w procesie beztlenowego oczyszczania ścieków).
Spośród grzybów jedynie nieliczne (Mucor) przeprowadzają w warunkach beztlenowych fermentację alkoholową.
4.2.1. Tlenowe metody hodowli mikroorganizmów to:
Hodowle powierzchniowe - na powierzchni pożywek zestalonych;
Hodowle statyczne -służą do badań morfologii, fizjologii, biochemii oraz otrzymywania czystych kultur;
Hodowle wgłębne - wzrost mikroorganizmów zachodzi w całej objętości pożywki płynnej na skutek ciągłego ruchu pożywki wywołanego intensywnym mieszaniem lub wytrząsaniem;
Hodowle ciągłe - wymagające stałego utrzymywania wzrostu drobnoustrojów przez sukcesywne zaopatrywanie hodowli w świeżą pożywkę, jednocześnie z fermentatora odprowadzana jest taka sama ilość podłoża zawierającego biomasę i szkodliwe metabolity.
4.2.2. Beztlenowe metody hodowli bakterii
Prowadzi się je eliminując ze środowiska hodowlanego tlen następującymi metodami:
fizycznymi - np. wypompowanie tlenu ze środowiska lub przez hodowlę bakterii w pożywce płynnej zawierającej tkankę zwierzęcą (kawałki wątroby, nerki lub mięśnia sercowego np. pożywka Wrzoska) lub tkankę roślinną (marchew, ziemniak), które adsorbują tlen ze środowiska hodowlanego;
chemicznymi - zastosowanie substancji wiążących tlen, np. podsiarczynu sodu, alkalicznego roztworu trioksybenzenu, a także środków chemicznych redukujących tlen glukoza, kwas askorbinowy, cysteina, siarczyn sodowy);
biologicznymi - wspólna hodowla drobnoustrojów tlenowych i beztlenowych w dwóch oddzielonych od siebie częściach płytki Petriego szczelnie oklejonej parafilmem lub plasteliną. Wyrastający wcześniej organizm tlenowy wykorzystuje tlen ze środowiska umożliwiając rozwój organizmu beztlenowego (metoda Fortnera). Niezbędnym warunkiem prowadzenia tej metody jest zastosowanie składniku pożywki, która jest optymalna zarówno dla tlenowców jak i beztlenowców. Metodę tą można zastosować do hodowli beztlenowych bakterii amylolitycznych (Clostridium acetobutylicum, Clostridium pasterianum) w obecności Bacillus subtilis, Serratia marcescens lub Candida mycoderma.
4.3. Kwasowość - odczyn środowiska
pH lub stężenie jonów wodorowych jest jednym z czynników, który znacząco wpływa na ilościowy i jakościowy skład mikroflory w danym środowisku. Chociaż pH soku komórkowego mikroorganizmów utrzymuje się na poziomie bliskim obojętnemu, co zapobiega rozkładowi wrażliwych na działanie kwasów i zasad składników komórkowych, to mikroorganizmy charakteryzują się:
różnymi wartościami punktów kardynalnych. Większości bakteriom odpowiada na ogół odczyn lekko zasadowy lub obojętny (pH 6,5-7,7). Grzyby pleśniowe i drożdże rozwijają się lepiej przy niższych wartościach pH (4-6).
rozpiętością tolerowanych granic pH. Część drobnoustrojów rozwija się w dość wąskim zakresie pH (Streptococcus pneumoniae), natomiast inne (np. Aspergillus niger) w szerokim zakresie - pH od 1,5 - 11.
Biorąc pod uwagę reakcję drobnoustrojów na minimalne, optymalne i maksymalne stężenie jonów wodorowych podzielono je na:
Alkalofile. Mikroorganizmy rozwijające się najlepiej w środowisku alkalicznym (optimum pH 8,0 - 11). Zalicza się do nich bakterie nitryfikacyjne (Nitrosomonas i Nitrobacter), wolno żyjące asymilatory azotu (Azotobacter), chorobotwórcze (Vibrio cholerae, Streptococcus pneumoniae), Enterococcus faecalis, promieniowce, przedstawiciele rodzaju Bacillus (rozwijają się jeszcze przy pH 11), a także niektóre glony rozwijające się przy pH 13.
Neutrofile. Rozwijają się najlepiej przy pH od 6,5 - 7,5.
Acidofile. Drobnoustroje środowisk kwaśnych (optimum pH 2,0 - 5,0). Zalicza się do nich, grzyby pleśniowe z rodzajów: Aspergillus, Oospora, Penicillium, drożdże Saccharomyces oraz bakterie fermentacji octowej, fermentacji mlekowej, a zwłaszcza bakterie siarkowe (Thiobacillus thiooxidans, Ferrobacillus thiooxidans), które utleniając związki siarki do kwasu siarkowego rozwijają się przy jego stężeniu dochodzącym do 10% i przy pH poniżej 0,8 (kw.siarkowy w akumulatorach).
Odczyn środowiska wpływa nie tylko na wzrost drobnoustrojów, ale modyfikuje także biochemizm komórki - zdolność do produkcji toksyn, kierunek procesów fermentacyjnych. Wobec silnej reakcji mikroorganizmów na pH, znajomość punktów kardynalnych i regulowanie odczynu środowiska jest ważnym zabiegiem w wielu procesach badawczych i technicznych. Ma kapitalne znaczenie przy:
Przygotowywaniu podłoży agarowych dla hodowli mikroorganizmów. Pamiętać należy, że kwasowość podłoża zależy od jego temperatury. Obniżenie pH zwiększa wrażliwość mikroorganizmów na wysokie temperatury, co jest wykorzystywane w procesie pasteryzacji produktów owocowo-warzywnych;
Zabezpieczaniu produktów żywnościowych poprzez obniżenie pH do 3,5 - 4,2 (większość ma odczyn słabo kwaśny), przed szkodliwym działaniem drobnoustrojów saprofitycznych, chorobotwórczych, toksynotwórczych, w szczególności wytwarzających formy przetrwalne.
4.4. Składniki odżywcze
Metabolizm komórki opiera się na dwóch przeciwstawnych procesach, które łączy proces wytwarzania, gromadzenia i przekazywania energii. Są to:
Anabolizm (asymilacja) - pobieranie z otoczenia i synteza na drodze redukcji związków o dużej złożoności (małej entropii), przy wykorzystaniu energii zgromadzonej w ATP, która następnie jest magazynowana w postaci wiązań chemicznych wytworzonych związków organicznych.
Katabolizm (dysymilacja) - powstawanie na drodze biologicznego utleniania substratu związków o małej złożoności (dużej entropii), z jednoczesnym uwolnieniem energii i wydaleniem na zewnątrz powstałych, niekiedy szkodliwych dla mikroorganizmów metabolitów.
Przebieg tych procesów, warunkujących prawidłowy wzrost i rozwój mikroorganizmów, zależy od: stałego i bezawaryjnego dopływu z otaczającego środowiska mineralnych i organicznych związków, stanowiących materiał budulcowy lub źródło energii; nakładów energii i obecności odpowiednich enzymów, od których zależy przebieg reakcji metabolicznych; planu, który zapisany jest w układzie genetycznym każdego organizmu.
4.4.1. Skład chemiczny mikroorganizmów
Skład chemiczny drobnoustrojów jest zbliżony do składu chemicznego innych organizmów. Około 80% stanowi woda, która z jednej strony jest środowiskiem wewnętrznym komórki, w którym przebiega szereg reakcji chemicznych, a z drugiej odgrywa czynną rolę w tych reakcjach. Do innych bardzo ważnych związków organicznych wytwarzanych w komórce zaliczyć należy białka, węglowodany, lipidy, kwasy nukleinowe i deoksynukleinowe.
Wykres 1. Przeciętny skład chemiczny suchej masy komórki drobnoustrojów (4)
Najważniejszymi pierwiastkami organogenicznymi, wchodzącymi w skład struktur komórkowych są: węgiel (50-65%), azot (6-12%), tlen (30%) i wodór (7%) i inne (1,5-15%). Do pozostałych ważnych pierwiastków życia, występujących w stanie wolnym lub w postaci związków mineralnych albo organicznych, zalicza się:
makroelementy (od 10-4 do 10-3 mola) - składniki strukturalne komórki, odpowiedzialne z utrzymanie właściwego ciśnienia osmotycznego w komórce (P, K, Ca, S, Fe, Mg);
mikroelementy (od 10-8 do 10-6 mola) - będące w pierwszym rzędzie składnikami enzymów (Mn, Cu, Co, Bo, Zn, Ni, Mo);
witaminy (kilka ppm) - będące składnikami lub prekursorami enzymów;
substancje wzrostowe, które stymulują wzrost i rozwój, lecz nie wchodzą w skład enzymów (np. aminokwasy, aminy, sterole, zw. pirymidynowe, puryny, itp.).
Zapotrzebowanie i rodzaj wykorzystywanych związków (mineralne, organiczne) przez poszczególne rodzaje mikroorganizmów jest odmienne i waha się niekiedy w szerokich granicach. Wśród mikroorganizmów występować mogą bowiem zarówno prototrofy (np. Escherichia coli, Psudomonas sp.), które dysponując kompletnym zestawem enzymatycznym z prostych związków wytworzyć mogą wszystkie niezbędne do życia związki organiczne, jak również auksotrofy (np. drożdże, bakterie fermentacji mlekowej) wymagające obecności w środowisku określonych związków organicznych (aminokwasów, substancji wzrostowych, itp.). Z tego też powodu wszystkie niezbędne dla prawidłowego wzrostu i rozwoju składniki winny być zawarte w podłożach mikrobiologicznych.
4.4.2. Skład pożywek hodowlanych
Pożywki hodowlane zwane inaczej podłożami mikrobiologicznymi służą do hodowli mikroorganizmów w warunkach laboratoryjnych. Stosując różne podłoża możemy prowadzić izolację mikroorganizmów, różnicować je, namnażać oraz identyfikować.
Podstawowym materiałem budulcowym komórki, stanowiącym szkielet każdego związku, są proste związki węgla, które równocześnie dostarczają energię potrzebną do syntezy (za wyjątkiem CO2). Węgiel jest zatem atrybutem zarówno pokarmu, jak również energii. Biorąc pod uwagę pochodzenie i formę wykorzystywanego C mikroorganizmy dzielimy na typy pokarmowe:
autotrofy (organizmy samożywne) - pobierające C w formie utlenionych zw. mineralnych (nieorganicznych) - CO2, H2CO3. Zalicza się do nich niektóre bakterie i wszystkie glony;
heterotrofy (organizmy cudzożywne) - wymagające obecności w środowisku zredukowanych związków organicznych zawierających C (np. węglowodanów). Są to w większości bakterie i wszystkie grzyby.
Organizmy tej grupy dzielimy na:
saprotrofy - wykorzystujące martwą materię organiczną,
biotrofy - pobierające związki wytwarzane przez organizmy żywe. W obrębie tych ostatnich wyróżnia się organizmy pasożytnicze będące sprawcami chorób roślin, zwierząt i człowieka oraz symbiotyczne, których współżycie przynosi obu partnerom korzyści.
Wykres 2. Dostępność różnych źródeł energii i węgla dla heterotrofów (8)
Pochodzenie poszczególnych składników podłoży jest różne np.:
źródłem węgla i energii są najczęściej węglowodany (np. glukoza, laktoza, maltoza, skrobia, celuloza), a także glicerol, mannitol oraz niektóre kwasy organiczne. Dodaje się je w ilości 0,5-2%.
źródłem azotu - oprócz bakterii, które wiążą azot z atmosfery, uniwersalnym źródłem azotu jest dodawany do pożywek pepton (łańcuch polipeptydowych i wolnych aminokwasów otrzymywany przez rozkład hydrolityczny białka pod wpływem działania trypsyny, pepsyny bądź 20% HCl). Innym źródłem azotu stosowanym w sztucznych podłożach są różne ekstrakty (mięsny, drożdżowy}, a także sole amonowe, wodorotlenek amonu oraz azotany. Często dodaje się czyste białko, bądź wolne aminokwasy.
Oprócz tych składników w podłożach powinny znajdować się:
składniki mineralne - należą do nich zarówno sole mineralne, jak i pierwiastki śladowe. Sole dodawane do pożywki to: fosforan potasu utrzymujący właściwy odczyn pH (zwiększona pojemność buforowa), a także NaCl (sól kuchenna, dodawana w ilości 3-5g/l) reguluje ciśnienie osmotyczne.
pierwiastki - dodawane do podłoża należą do następujących grup: pierwiastki biogenne: O,H, P,S (składniki budulcowe komórki), pierwiastki biorące udział w procesach życiowych komórki: Na, K, Mg, Ca, Fe, mikroelementy biorące udział w reakcjach komórkowych: Zn, Mn, Cu, Co.
substancje wzrostowe - są to zarówno roztwory syntetyczne witamin, a także ekstrakty roślinne i zwierzęce oraz sok pomidorowy, wyciąg glebowy, brzeczka słodowa, wyciąg ziemniaczany.
substancje różnicujące i wybiórcze - składniki różnicujące to te, które po dodaniu do pożywki ulegają pod wpływem wzrostu drobnoustrojów rozkładowi (np. cukry - następuje zmiana barwy pożywki) lub też wskazują na obecność produktów metabolizmu bakterii (np. wytwarzanie siarkowodoru, tworzenie indolu).
Składniki wybiórcze natomiast dodaje się po to, żeby hamując wzrost pewnych grup mikroorganizmów umożliwić jednocześnie rozwój flory pożądanej (mogą to być: sole kwasów żółciowych, fiolet krystaliczny, błękit brylantowy, antybiotyki).
czynniki zestalające - w przypadku pożywek o konsystencji stałej dodaje się do podłoża agar (jest to polisacharyd, który ma właściwości żelujące, dodaje się go w ilości 1,5-3%) lub żelatynę (substancja białkowa, bogata w kolagen, dodaje się w ilościach 12-15%).
4.4.3. Podział pożywek hodowlanych
Podłoża hodowlane podzielić możemy biorąc pod uwagę:
skład chemiczny:
naturalne - bulion, mleko, brzeczka słodowa, melasa buraczana
syntetyczne - złożone z odczynników chemicznych o ściśle znanym składzie ilościowym i jakościowym
półsyntetyczne - przygotowane z odczynników chemicznych z dodatkiem pojedynczego składnika naturalnego (wyciąg mięsny, mleko, serwatka, wyciągi roślinne: ziemniaczany, pomidorowy, melasa buraczana, namok kukurydziany, brzeczka słodowa).
cel hodowli:
namnażające - służące do otrzymania biomasy drobnoustroju (np. zbuforowana woda peptonowa dla pałeczek Salmonella i pożywka Kesslera-Swenartona dla pałeczek z grupy coli, podłoże Czapka lub Sabuoroda do hodowli grzybów)
selektywne - zawierają zarówno składniki odżywcze jak i wybiórcze (np. fiolet krystaliczny jest składnikiem wybiórczym w podłożu do hodowli bakterii z grupy coli, pH kwaśne podłoża pozwala na wzrost grzybów, hamując wzrost bakterii).
różnicujące - zawierają substancje diagnostyczne, pozwalające stwierdzić w środowisku obecność drobnoustrojów określonych rodzajów (np. podłoże Endo do hodowli bakterii coli, agar z krwią do hodowli paciorkowców hemolizujących, agar SS do hodowli bakterii Salmonella, Schigella, podłoże Blickfeldta do wykrywania bakterii kwaszących, podłoże Wrzoska do oznaczania bakterii beztlenowych).
wymagania pokarmowe drobnoustrojów:
ogólne (zwykłe) - do hodowli drobnoustrojów heterotroficznych o niewielkich wymaganiach pokarmowych, prototroficznych (bulion odżywczy, agar odżywczy)
wzbogacone - do hodowli drobnoustrojów o zwiększonych wymaganiach hodowlanych, auksotroficznych (np. bulion odżywczy z dodatkiem substancji wzrostowych; agar wzbogacony z dodatkiem glukozy)
wybiórcze - do izolacji ściśle określonych grup drobnoustrojów. Do podłoża dodaje się składnik, który w przypadku hodowli mieszanej pozwala na wzrost tylko tych mikroorganizmów, które tolerują ten składnik (pożywka Kesslera -Swenartona z fioletem krystalicznym dla hodowli bakterii z grupy coli).
różnicujące - do identyfikacji drobnoustrojów w hodowli mieszanej. Określone grupy mikroorganizmów różnicuje się na podstawie rozkładu przez nie substratów wprowadzonych do podłoża (podłoże laktozowe z purpurą bromokrezolową do identyfikacji bakterii z grupy coli; podłoże z mannitolem do identyfikacji gronkowców)
konsystencję:
płynne - służą głównie do namnażana drobnoustroju (np. bulion)
półpłynne - zawierają agar w ilości 0,15—0,5% i służą do hodowli organizmów o mniejszym zapotrzebowaniu na tlen oraz do badania ruchu bakterii
stałe - jako czynnik zestalający stosuje się agar, bądź żelatynę, służą do różnicowania i izolowania bakterii i grzybów, a także hodowli i liczenia bakterii.
4.4.4. Rodzaje pożywek stosowanych w mikrobiologii (przykłady):
Pożywki ogólnego zastosowania
bulion zwykły, odżywczy, brzeczka słodowa
agar zwykły, odżywczy, bulion z agarem
żelatyna
Pożywki wybiórcze stosowane do hodowli bakterii:
podłoża dla beztlenowców (podłoże Wrzoska, Wilsona-Blaira)
podłoża dla pałeczek z grupy coli (z żółcią i zielenią brylantową, Kesslera-Swenartona, Endo)
podłoże do wykrywania enterokoków (z azydkiem sodu)
podłoże do wykrywania gronkowców (Chapmanna z mannitolem)
Pożywki wybiórcze stosowane do hodowli grzybów pleśniowych i drożdży:
podłoże Sabourauda
brzeczka agarowa
pożywka Czapka - Doxa
podłoże Wikena i Richardsa do izolacji drożdży.
4.5. Przygotowywanie pożywek
Znając skład jakościowy i ilościowy pożywki, dodaje się do wody destylowanej poszczególne składniki zgodnie z podaną recepturą, następnie ogrzewa na gazie do momentu uzyskania klarowności płynu i koryguje pH (jeżeli jest różne od oczekiwanego).
W zależności od rodzaju pożywki i wymaganych temperatur sterylizacji wyjaławia się rozpuszczoną pożywkę w aparacie Kocha lub w autoklawie w określonym czasie. Po sterylizacji należy również sprawdzić i ewentualnie skorygować pH. Ustalając pH pożywki zaraz po wyjęciu z autoklawu należy uwzględnić, że po ostygnięciu do temperatury 370C kwasowość przesunie się w kierunku zasadowym. Korektę pH prowadzi się za pomocą roztworów NaOH lub HCl.
Po ostudzeniu, jeżeli pożywka nie wymaga dodatku witamin, bądź przesączenia rozlewa się ją do płytek Petriego lub probówek. Sposób rozlewania zależy od potrzeb, do jakich ma służyć przygotowane podłoże. Jeżeli potrzebujemy podłoża stałe to możemy je rozlać na płytki Petriego lub do probówek gdzie zestala się je w formie skosu lub słupka (rozlewane podłoże nie może mieć temperatury niższej od 450C, gdyż nie będzie się równo zestalało). Pożywki płynne rozlewa się do probówek lub kolbek.
4.6. Zadania
Przygotowanie podłoży stałych
Rozlewanie pożywki na płytki Petriego:
odkorkować kolbkę z pożywką i opalić jej wylot w płomieniu palnika;
uchylić lekko wieczko szalki Petriego i wlać do niej pożywkę tak aby utworzyła na dnie kilkumilimetrową warstwę (około 10 ml podłoża);
zamknąć płytkę;
ponownie opalić w płomieniu wylot kolby z podłożem i zamknąć ją korkiem;
płytkę pozostawić na stole do czasu zestalenia podłoża;
schować płytkę z podłożem do lodówki.
Rozlewanie pożywki do probówek w celu uzyskania słupka:
przygotować w statywie, szereg jałowych probówek z korkami o pojemności około 25ml;
odkorkować kolbkę z podłożem i opalić jej wylot w płomieniu palnika;
odkorkować probówkę i opalić jej wylot w płomieniu palnika;
rozlewać podłoże do 3/4 wysokości probówki;
opalić wylot probówki i zamknąć ją;
opalić wylot kolby i zamknąć korkiem;
odczekać do momentu zastygnięcia podłoża w probówce;
schować probówki z podłożem do lodówki.
Postępować w ten sam sposób z każdą następną probówką w szeregu.
Rozlewanie pożywki do probówek w celu uzyskania skosu:
przygotować w statywie, szereg jałowych probówek z korkami o pojemności około 25ml;
odkorkować kolbkę z podłożem i opalić jej wylot w płomieniu palnika;
odkorkować probówkę i opalić jej wylot w płomieniu palnika;
rozlewać po 3-4 ml podłoża
opalić wylot probówki i zamknąć ją;
opalić wylot kolby i zamknąć korkiem;
umieścić probówki na desce do skosów do momentu zastygnięcia podłoża;
schować probówki z podłożem do lodówki.
Przygotowanie podłoży płynnych
Rozlewanie bulionu odżywczego do probówek:
przygotować w statywie, szereg jałowych probówek z korkami o pojemności około 25ml;
odkorkować kolbkę z podłożem i opalić jej wylot w płomieniu palnika;
odkorkować probówkę i opalić jej wylot w płomieniu palnika;
rozlewać bulion do 3/4 wysokości probówki;
opalić wylot probówki i zamknąć ją;
opalić wylot kolby i zamknąć korkiem;
po ostygnięciu schować probówki z bulionem do lodówki.
II.5. TECHNIKA WYKONYWANIA POSIEWÓW
Jedna z definicji mówi, że „drobnoustroje to organizmy wszędobylskie”, występujące na całej kuli ziemskiej - w całej biosferze, tj.:
w powietrzu - są stałym składnikiem aeroplanktonu - zdolne do kiełkowania formy przetrwalne spotyka się nawet na wysokości ponad 5 tys.m npm.
w wodach - zasiedlają rowy oceaniczne (poniżej 6 tys. m); formy przetrwalne wytrzymują ciśnienie dochodzące do 20 tys. atmosfer przez 45 min., a formy wegetatywne Escherichia i Salmonella nie giną przy ciśnieniu 5 tys. atm. Toksyny bakteryjne (tężcowa i błonnicza) ulegają inaktywacji dopiero przy ciśnieniu powyżej 12 tys. atm. Niektóre bakterie żyją w gorących źródłach, których temperatura waha się w granicach 98ºC, a inne w wodach o zawartości NaCl dochodzącej do 28-30% (Halobacterium, Halococcus)
w glebie - najwięcej bakterii znajduje się w uprawnej warstwie gleby - do 30 cm, a zwłaszcza w ryzosferze. W warstwie tej na pow. 1 ha znajdować się może od kilku q do kilku t bakterii.
Również gleby pustynne, pozornie jałowe, zawierają mikroorganizmy, które przez wiele miesięcy, a nawet lat pozostają w stanie anabiozy. Po nawilgotnieniu gleby przez opady powracają one do na ogół krótkotrwałej aktywności życiowej.
Ogólna biomasa mikroorganizmów glebowych występujących na kuli ziemskiej szacowana jest na 1012 t i jest zbliżona do masy zwierząt i roślin lądowych. W 1 g mieści się 200x więcej komórek bakteryjnych niż cała populacja Homo sapiens.
Środowiska te mogą być źródłem skażenia surowców oraz produktów rolno spożywczych i pasz, zarówno mikroflorą saprofityczną, jak również chorobotwórczą. Źródłami skażenia w zakładach przetwórstwa rolno-spożywczego mogą być także: pracownicy, pomieszczenia oraz urządzenia produkcyjne. Ponieważ obecność mikroorganizmów prowadzić może do zakłócenia procesów technologicznych i spadku wartości konsumpcyjnej wytwarzanych produktów, stąd wykrywanie ich obecności jest jednym z podstawowych elementów analiz mikrobiologicznych. Podstawowa kontrola mikrobiologiczna obejmuje pobranie materiału mikrobiologicznego, jego przygotowanie do posiewu, wykonanie posiewów oraz izolacje bakterii w celu ilościowej i jakościowej analizy.
5.1. Pobór materiału i przygotowanie do posiewu
Odpowiednie pobranie materiału do badań jest bardzo ważnym elementem pracy w mikrobiologii, gdyż decyduje o dalszym przebiegu badania oraz wyniku posiewu.
Pobieranie materiału do badań z powierzchni
Metoda tamponowa
Stosowana do oceny skażenia mikrobiologicznego dużych powierzchni (kadzie fermentacyjne, beczki, kontenery) oraz powierzchni wewnętrznych (przewodów, zaworów, uszczelek). Materiał pobiera się przecierając jałowym tamponem z waty lub gazy powierzchnię przeznaczoną do badania, następnie tampony umieszcza się w probówce z jałowym płynem i przez dokładne wytrząsanie spłukuje pobrany materiał. Zawiesina z materiałem jest wysiewana na odpowiednie podłoże.
W przypadku pobierania materiału z powierzchni płaskich (przy ocenie ilościowej skażenia) stosuje się jałowy szablon wykonany z drutu lub blachy w postaci kwadratu o znanej powierzchni (25 lub 100 cm2).
Metoda wypłukiwania
Stosowana do oceny czystości opakowań szklanych lub metalowych. Wewnętrzne powierzchnie naczynia opłukuje się przez wytrząsanie określoną ilością jałowego płynu fizjologicznego lub wody destylowanej. Uzyskaną w ten sposób zawiesinę przeznacza się do dalszych badań.
Metoda Richtera
Stosowana do badania czystości opakowań szklanych poprzez wlewanie do naczynia podłoża agarowego, które przez obracanie naczynia rozprowadza się równomiernie na jego wewnętrznych ściankach. Naczynie dokładnie zamknięte inkubuje się w odpowiedniej temperaturze i po określonym czasie ocenia obecność kolonii drobnoustrojów.
Metoda odciskowa
Stosowana przy ocenie czystości materiałów opakowaniowych, korków, wieczek lub innych małych powierzchni. Badany materiał przyciska się do powierzchni zestalonego podłoża agarowego. Po określonym okresie inkubacji w odpowiedniej temperaturze określa się obecność kolonii mikroorganizmów.
Kontrola powierzchni może być wykonywana specjalnymi przyrządami, które są w ofercie firm zajmujących się diagnostyką mikrobiologiczną. Należą do nich:
płytki łopatkowe składające się z umieszczonej w plastikowym zakręcanym
opakowaniu plastikowej łopatki pokrytej z obu stron podłożem agarowym. Posiew można wykonywać trzema sposobami:
dociśnięcie podłoża na łopatce do badanej powierzchni stałej;
potarcie podłóż na łopatce materiałem badanym pobranym za pomocą tamponu z waty;
zanurzenie łopatki jeżeli badany materiał jest w postaci płynnej.
Po okresie inkubacji w określonej temperaturze wzrost drobnoustrojów na łopatce ocenia się zgodnie z dołączonym do opakowania wzorcem.
Ocenę czystości powierzchni można wykonać metodą bioluminescencji poprzez pomiar stężenia ATP (adenozynotrifosforanu), który jest składnikiem organizmów roślinnych i zwierzęcych. Ocenę zawartości ATP prowadzi się zgodnie z dołączonymi normami dla poszczególnych produktów.
Pobieranie płynów do badań
Soki, mleko, wodę itp. pobiera się jałową pipetą do jałowej butelki, kolbki lub probówki w ilości ¾ objętości naczynia i szczelnie korkuje. Próby pobiera się przy palniku zgodnie z opisaną procedurą. Przed posiewem należy dokładnie wytrząsnąć próbkę przygotowaną do badania.
Pobieranie past
Galaretki, przeciery, pasty itp. pobiera się jałową łopatką w ilości 20 - 50 g do wyjałowionej i wytarowanej kolbki o pojemności 200 cm3 i rozcieńcza przed posiewem określoną ilością rozcieńczalnika (rozcieńczenie 1 : 10 lub 1 : 100).
Pobieranie produktów o konsystencji stałej
Z mięsa, wędlin, narządów wewnętrznych, serów itp. pobiera się wyjałowioną skalpelem i pincetą ok. 200 g próbki (osobno z warstw powierzchniowych i z głębszych). Wycinki wkłada się do płytek Petriego lub szerokich probówek z gumowym korkiem. Pobrane próby tnie się na kawałki o boku 0,5 cm. Tak przygotowaną próbę (na ogół o masie 20 g) rozciera się w moździerzu lub rozdrabnia w homogenizatorze i dodaje do 180 g jałowego rozcieńczalnika (rozcieńczenie 1 : 10), a następnie przygotowuje się materiał do posiewu.
5.2. Technika posiewów
Posiew mikrobiologiczny jest to przeniesienie badanego materiału na jałową pożywkę, którą umieszcza się w zależności od oczekiwanego wyniku w inkubatorze. Wszystkie posiewy wykonuje się przestrzegając zasad jałowości, czyli posiew wykonuje się przy zapalonym palniku, opalając wyloty naczyń i pipet w płomieniu palnika, a także wyżarzając używane podczas posiewu ezy i igły.
Posiewy możemy również wykonać używając jałowych tamponów z waty lub gazy, a także tzw. głaszczek (wygięta pod kątem szklana bagietka).
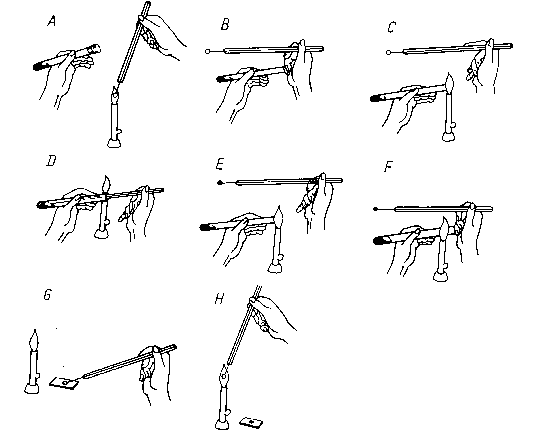
Rys.14 Pobieranie hodowli do ba-
dań ze skosu agarowego (2)
A - jałowienie ezy w płomieniu,
B - otworzenie probówki,
C - opalanie brzegu probówki,
D - pobieranie materiału,
E - opalanie brzegu probówki,
F - zamykanie probówki przy
palniku,
G - przenoszenie materiału (w
tym wypadku na szkiełko),
H - jałowienie ezy w płomieniu palnika
W zależności od sposobu nanoszenia materiału hodowlanego wyróżniamy metody:
posiewów powierzchniowych - badany materiał wysiewamy na powierzchnię wcześniej zestalonej pożywki
posiewów wgłębnych - materiał wysiewamy bezpośrednio do naczyń przeznaczonych do hodowli, zalewamy odpowiednią ilością schłodzonej pożywki, po czym całość mieszamy i pozostawiamy do zestalenia.
Wykonywanie posiewów ezą
Ezę używamy do posiewów na podłożach płynnych lub na podłożach stałych w skosach agarowych w probówkach albo też w płytkach Petriego.
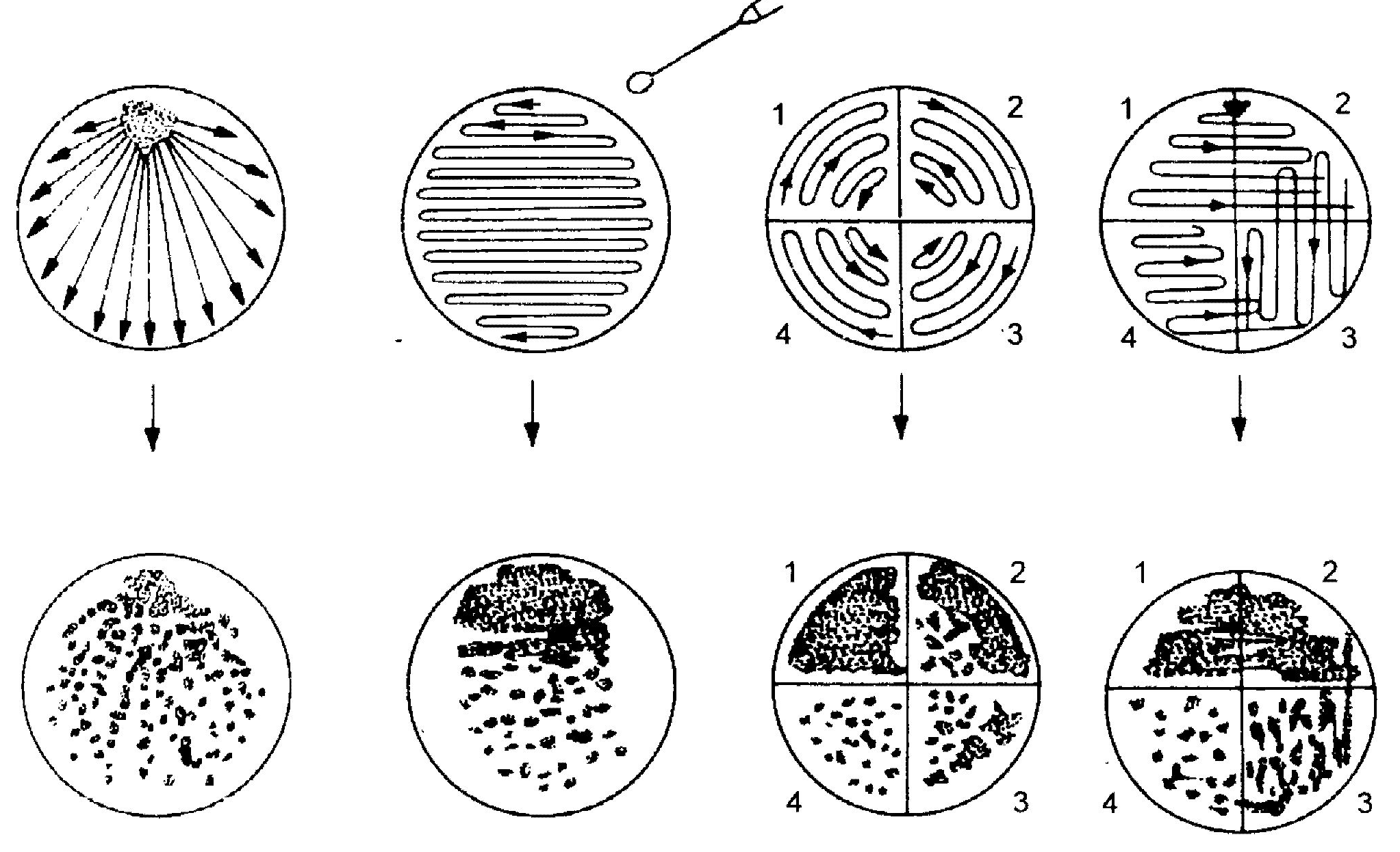
Rys.15 Posiew za pomocą ezy na płytce Petriego - 1, 2, 3, 4 kolejność przenoszenia materiału (17)
Wykonując posiew:
na podłożu płynnym należy pobrać ezą badany materiał, a następnie zanurzyć w probówce z pożywką i lekko potrząsając ezą wypłukać materiał z jej oczka
na skosie agarowym pobieramy ezą badany materiał, a następnie dotykamy ezą powierzchni skosu i ruchem falistym lub zygzakowatym przeciągamy ezę po powierzchni podłoża w kierunku wylotu probówki
na płytce Petriego odrobinę badanego materiału rozprowadza się zygzakiem lub promieniście na całej powierzchni zestalonego podłoża agarowego lub też dzieli się je na sektory i w nich rozprowadza materiał.
Wykonywanie posiewów igłą preparacyjną
Opaloną igłą pobieramy badany materiał, następnie wkłuwamy igłę w zestalone w probówce podłoże agarowe lub żelatynowe w postaci słupka.
Wykonywanie posiewów pipetą
Pipeta służy do wykonania posiewu materiału płynnego. Wyjałowioną pipetą pobieramy określoną ilość badanego materiału i przenosimy do pożywki płynnej (1 cm3), bądź na zestalone podłoże agarowe w płytce Petriego (0,1 lub 0,5 cm3). Wylany na płytkę materiał rozprowadzamy po całej powierzchni szklaną głaszczką (metoda powierzchniowa).
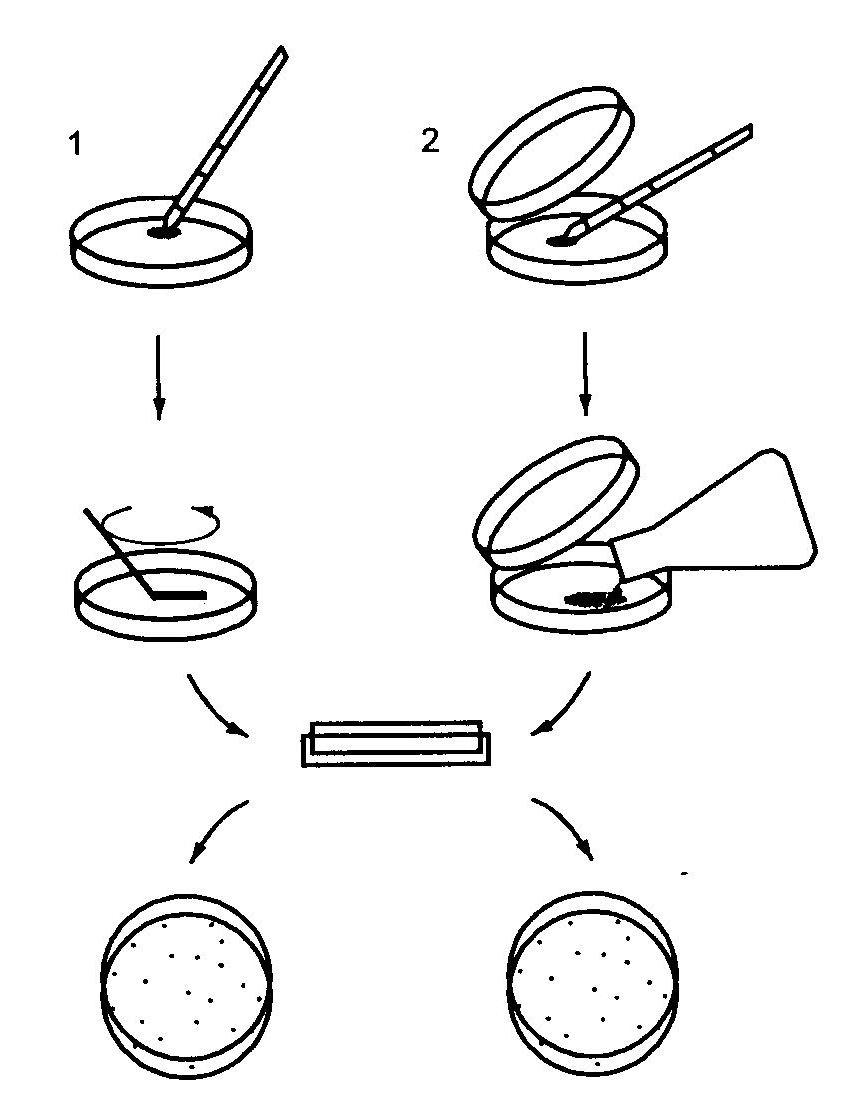
Używając pipety można wykonać posiew metodą zalewową. Określoną ilość materiału (1 cm3) przenosimy do płytki Petriego, następnie zalewamy upłynnionym i odpowiednio ochłodzonym podłożem agarowym (9 cm3). Całość lekko mieszamy poruszając płytkę ruchem kolistym po powierzchni stołu. Ten rodzaj posiewu jest wykorzystywany w posiewach ilościowych i do izolacji czystych kultur.
Rys.16. Posiew metodą powierzchniową (1) i zalewową (2) - (10)

Ryc.17 Sposoby wykonywania posiewów (2):
1 - przesiew hodowli z probówki do probówki, 2 - wylewanie hodowli płynnej na podłoże w płytce Petriego
Wykonywanie posiewów jałowym tamponem z gazy lub z waty
Przy pobieraniu materiałów z dużych powierzchni np.: stołów, naczyń, opakowań możemy używać jałowego tamponu, którym pocieramy wybrany fragment badanej powierzchni, następnie wypłukujemy go w odpowiednim rozcieńczalniku i wykonujemy posiew bezpośrednio z rozcieńczalnika.
5.3. Posiew ilościowy
Posiew ilościowy stosuje się w przypadku konieczności oznaczenia liczby drobnoustrojów w badanym materiale. Przygotowując próbę badanego materiału do posiewu ilościowego należy zastosować metodę kolejnych rozcieńczeń. W 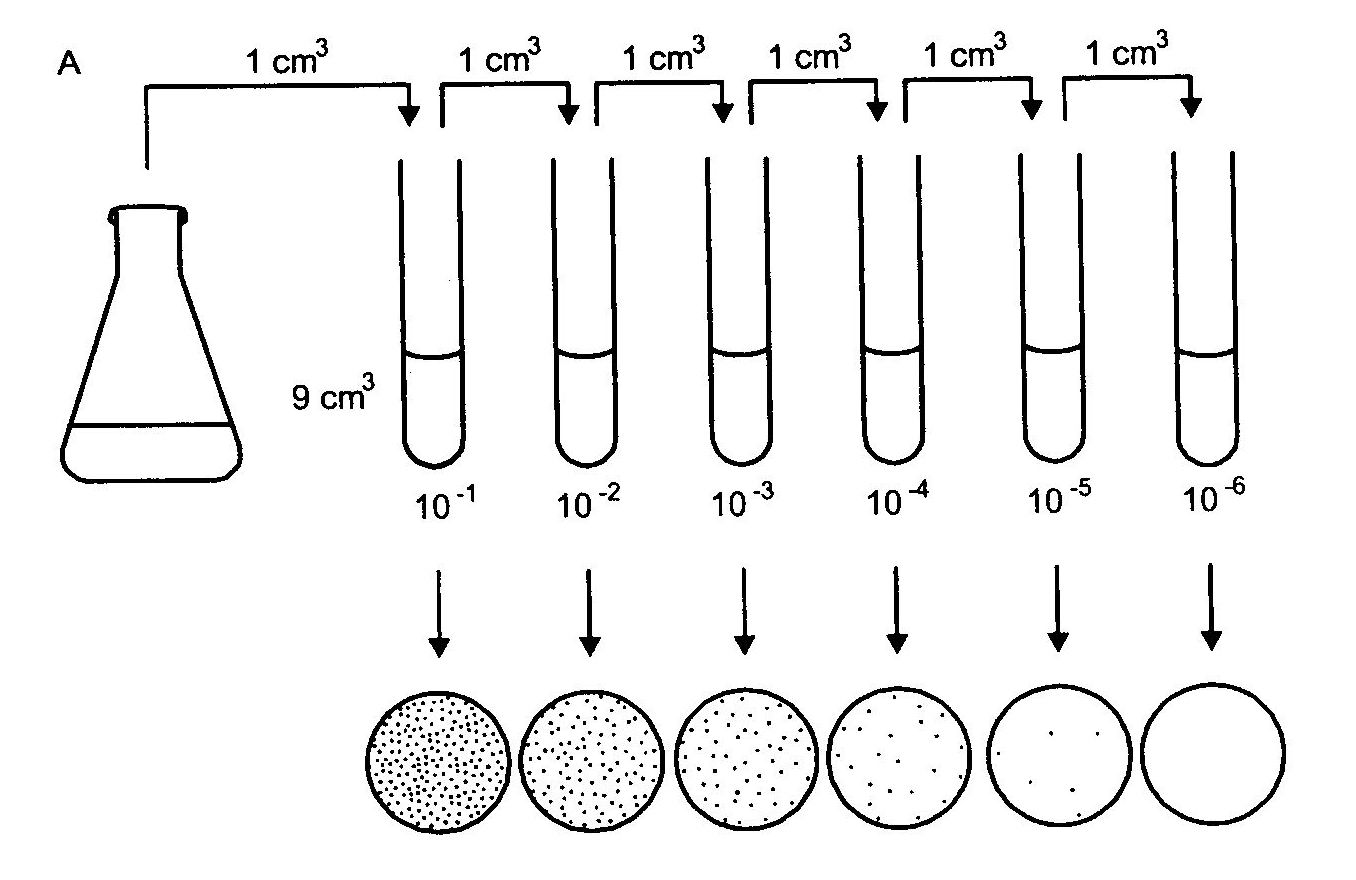
tym celu należy odważyć lub odmierzyć określoną ilość produktu (1 lub 10 cm3 / g), po ewentualnym rozdrobnieniu umieścić w naczyniu i zalać 9 lub 90 cm3 roztworu rozcieńczalnika. Po dokładnym wymieszaniu uzyskuje się rozcieńczenie wyjściowe 10-1 (1:10). Kolejne rozcieńczenie 10-2 (1:100) sporządza się przenosząc 1 cm3 zawiesiny do kolejnej probówki z 9 cm3 rozcieńczalnika. Sposób wykonania kolejnych rozcieńczeń jest identyczny, a ich liczba zależy od rodzaju badanego materiału.
Rys. 18. Metoda kolejnych rozcieńczeń (10)
Po sporządzeniu odpowiedniego rozcieńczenia wykonujemy posiew ilościowy metodą płytkową Kocha (zalewową lub powierzchniową). Po okresie inkubacji do pomiarów bierze się te płytki na których liczba kolonii mieści się w granicach od 30 do 200.
5.4. Izolacja czystych kultur
W badaniach mikrobiologicznych posługujemy się czystymi kulturami, tj. hodowlami wyprowadzonymi z jednej komórki (zarodnika), które reprezentują jeden gatunek drobnoustroju.
Sposoby izolacji czystych kultur wykonujemy przez zastosowanie:
posiewu na całej powierzchni (A)
posiewu sektorowo - redukcyjnego (B). Płytkę Petriego z zestalonym podłożem dzielimy na cztery sektory. Pobrany do izolacji materiał rozsiewamy ezą przez wszystkie sektory.
metody płytek lanych (C) polega na posiewie odpowiedniego rozcieńczenia (10-4; 10-5) zawiesiny bakterii i wykonaniu posiewu techniką wgłębną.
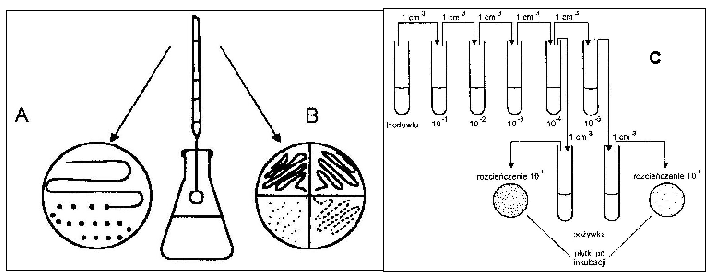
Rys. 19. Izolacja czystych kultur metodą posiewu na całej powierzchni (A)
sektorową (B) oraz płytek lanych (C). (10)
Po uzyskaniu wzrostu pojedynczych koloni przenosi się je sterylnie z kultur mieszanych, za pomocą ezy lub igły preparacyjnej, na jałową pożywkę w płytce Petriego lub probówce. Tak wyizolowane czyste kultury mikroorganizmów należących do jednego gatunku nazywamy szczepami.
5.5. Rozcieńczalniki stosowane do przygotowywania zawiesin
płyn fizjologiczny (0,85%): NaCl (8,5g) + woda destylowana 100 ml;
płyn Ringera: NaCl (9g) + KCl (0,42g) + CaCl2 (0,48g) +NaHCO3 (0,2g) + woda destylowana 4000 ml;
woda buforowana: bufor fosforanowy (1,25ml) + 1000 ml wody destylowanej;
Roztwory te są izotoniczne dla drobnoustrojów. Dozwolone jest również stosowanie wody destylowanej ale tylko w tych przypadkach, gdy metodyka obróbki badanego materiału na to pozwala. Pamiętać należy o jałowości używanych rozcieńczalników.
5.6. Zadania
Posiewy materiału metodą powierzchniową i wgłębną
Z czystej kultury bakterii wykonać przesiew na podłoże płynne, skos i słupek agarowy oraz płytkę Petriego zgodnie z omówionym sposobem postępowania. Posiewy wykonać ezą, a w przypadku słupka agarowego zastosować do posiewu igłę. Wszystkie posiane próby opisać imieniem oraz nr stołu. Wstawić do cieplarki o temp 370C. na 24-36 godz.
Z wybranej powierzchni parapetu zebrać drobnoustroje jałowym tamponem z gazy, następnie zamoczyć tampon w dostarczonej probówce z płynem fizjologicznym i dokładnie opłukać poprzez wytrząsanie zawartości probówki. Z tak przygotowanego materiału wykonać posiewy ezą na dostarczone podłoża zgodnie z omówionym sposobem postępowania. Podłoża opisać i umieścić w cieplarce o temp. 370C na okres 24-36godz.
Z powierzchni wilgotnej ręki zebrać drobnoustroje jałowym tamponem z waty następnie wykonać posiewy na dostarczone podłoża zgodnie z omówionym sposobem postępowania. Podłoża opisać i umieścić w cieplarce o temp. 370 250C oraz 200C na okres 24-96godz.
Z otrzymanej próbki gleby rozcieńczonej w jałowej wodzie destylowanej wykonać posiew na dostarczone podłoża zgodnie z omówioną metodą postępowania. Posiewy wykonać ezą, natomiast posiew na słupek agarowy wykonać igłą. Podłoża opisać i umieścić w cieplarce o temp. 370C na okres 24-36godz.
W dostarczonej probówce z solą fizjologiczną rozprowadzić pobrany wykałaczką nalot z zębów. Posiewy na dostarczone podłoża wykonać ezą, natomiast posiew na słupek agarowy wykonać igłą. Podłoża opisać i umieścić w cieplarce o temp. 370C na okres 24-36godz
Na zestalone podłoże agarowe dokonać posiewu samoczynnego z powietrza. W tym celu w wybranym pomieszczeniu otworzyć płytki Petriego na 5-10min. Po skończonej ekspozycji płytki zamknąć, opisać i wstawić do cieplarki o temp. 370C na 24-36godz (podłoża agar odżywczy). oraz 200C na 5 - 7dni (podłoże Czapka). Na podłoże ze skosem agarowym, podłoże bulionowe oraz podłoże ze zestalonym słupkiem agarowym posiać zgodnie z omówionymi metodami dostarczoną próbkę wody. Wszystkie próby wstawić do cieplarki j.w.
W jednym rzędzie statywu ustawić 3 probówki i wlać do nich po 9 cm3 wody destylowanej jałowej. 1 cm3 dostarczonej zawiesiny bakterii wlać do pierwszej probówki i opisać ją jako rozcieńczenie 10-1 (1:10), następnie z tego rozcieńczenia przenieść do następnej probówki 1cm3 i opisać probówkę 10-2 (1:100); postępując analogicznie przenieść 1cm3 do trzeciej probówki z wodą opisując ją jako 10-3 (1:1000).
Po wykonaniu rozcieńczenia dokonać posiew na płytkę Petriego biorąc z rozcieńczenia 10-3 1,0cm3 badanego materiału. Materiał wylać do płytki Petriego i zalać 10 cm3 dostarczonego podłoża. Całość wymieszać obracając płytkę ruchem kolistym na stole. Płytkę z posianym materiałem wstawić do cieplarki o temp. 300C na okres 48 h.
II.6. WZROST DROBNOUSTROJÓW NA PODŁOŻACH
Obecność w środowisku wszystkich niezbędnych składników, a także brak czynników ograniczających sprawiają, że bakterii są zdolne do szybkiego wzrostu i rozmnażania się. Łączą się z tym dwa zagadnienia:
Wzrost i rozmnażanie się (podział) pojedynczej komórki
Wzrost liczebności całej populacji
6.1 Wzrost i rozmnażanie się pojedynczej komórki
Czas jednej generacji, potrzebny do powstania z komórki macierzystej dwóch form potomnych trwa w optymalnych warunkach laboratoryjnych od 10 -20 minut. Ponieważ zależy on od czynników środowiskowych, stąd w warunkach naturalnych okres ten jest dłuższy (liczy się nie w minutach, lecz w godzinach).
Kiedy komórka bakteryjna podwoi swoją masę, przechodzi do fazy rozmnażania, która polega na:
podziale poprzecznym, zachodzącym u większości bakterii - przez przewężenie (bakterie G- i ziarniaki) lub wytworzenie wewnętrznej ściany - septum (bakterie G+)
pączkowaniu u nielicznych bakterii, np. z rodzaju Stella
fragmentacji nitek u Nocardia lub na tworzeniu konidiów powietrznych - Streptomyces
rozpadzie ciałek elementarnych lub olbrzymich u Mycoplasmales albo rozpadzie nitek u bakterii nitkowatych - Chlamydobacteriales.
6.2. Wzrost liczebności całej populacji
Wzrost populacji jest funkcją rozmnażania się pojedynczych osobników w czasie. Bakterie po przeszczepieniu na nowe, odpowiednie dla nich podłoże agarowe, są zdolne do wytworzenia w stosunkowo krótkim czasie (24-48 godzin) liczebnej populacji. Populację taką nazywamy hodowlą lub kulturą. Jeśli populację tworzy tylko jeden gatunek bakterii, to hodowlę taką nazywamy „czystą kulturą”.
Rozwój populacji bakterii przebiega w kilku fazach:
Faza zastoju - przygotowawcza (lag faza). Po przeszczepieniu bakterii na nowe podłoże początkowo nie obserwujemy rozmnażania, lecz wzrost wielkości komórek. Bakterie charakteryzuje mała aktywność metaboliczna, duża odporność, przystosowywanie się do nowych warunków środowiskowych;
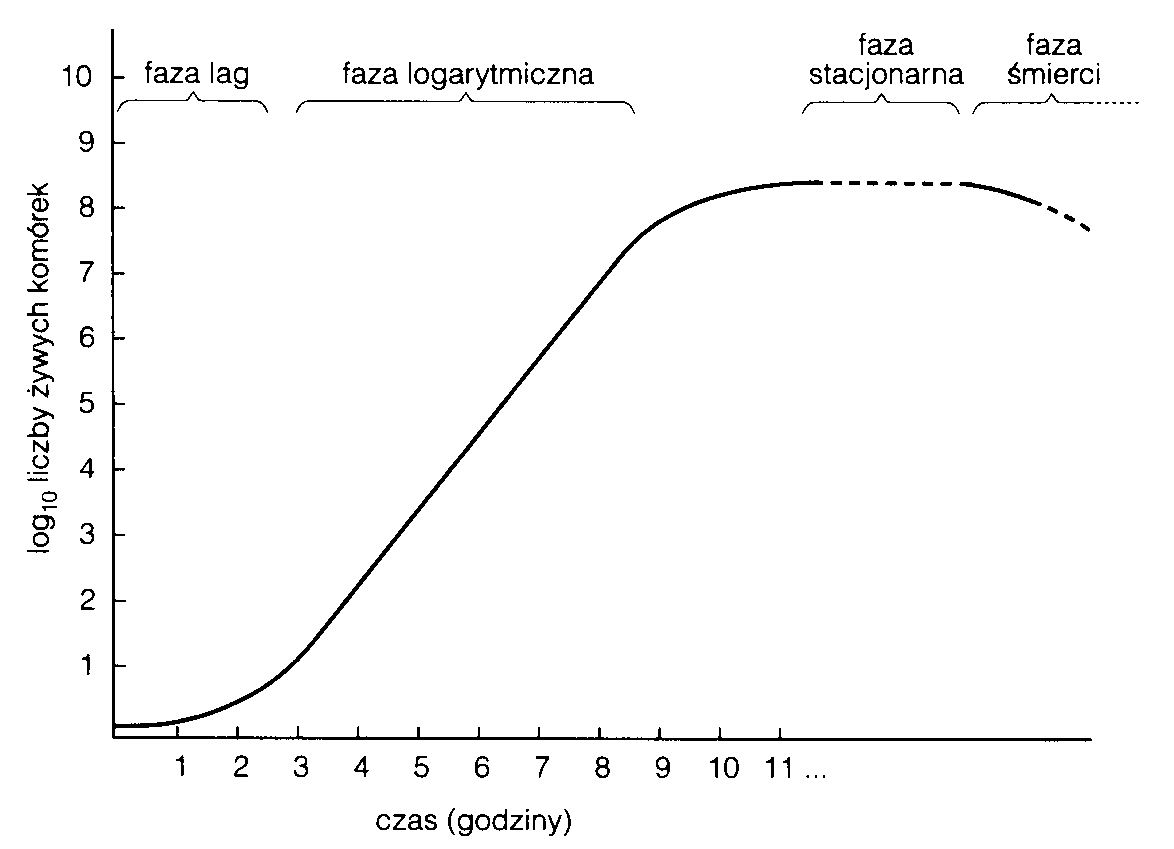
Faza logarytmicznego wzrostu, w której liczba komórek zwiększa się w postępie geometryczny, a ich wielkość maleje. Jest to największa w danych warunkach częstotliwość podziałów przy stałej i równomiernej syntezie składników komórkowych. Czas generacji bakterii waha się od 15-60 min., a drożdży od 90-120 min.
Rys.20. Fazy wzrostu liczebności populacji bakterii w warunkach laboratoryjnych (20).
Faza równowagi (f.stacjonarna). W następstwie nagromadzania się szkodliwych produktów przemiany materii i ubywania składników pokarmowych szybkość obumierania komórek zbliża się do częstotliwości podziałów. Pojawiają się komórki zdegenerowane, o odmiennych kształtach;
Faza logarytmicznego zamierania, jest ostatnią fazą w rozwoju populacji. Liczba komórek zamierających jest wyższa od liczby komórek powstających.
Na podłożach stałych wzrost liczebności populacji obserwujemy w postaci kolonii. Kolonie takie tworzą się, gdy przygotowana zawiesina komórek bakteryjnych nie jest zbyt gęsta. Jeśli zawiesina była gęsta, a liczba kolonii przekracza 300 na 100 cm2 powierzchni podłoża, to kolonie łącząc się ze sobą zarastają całą powierzchnię.
W standardowych warunkach charakter kolonii, np. jej wzniesienie, powierzchnia, kształt, brzeg, zabarwienie, wytwarzanie pigmentu są charakterystyczne dla danego gatunku i stanowią jedną z cech diagnostycznych. Cechy te zmieniać się mogą z wiekiem hodowli, są także odmienne na różnych podłożach.
W praktyce mikrobiologicznej możemy mieć do czynienia z koloniami:
wgłębnymi - o charakterystycznym kształcie soczewkowatym bądź bardziej zróżnicowanym;
powierzchniowymi - rozwijającymi się na powierzchni podłoża.
6.3. Charakterystyka wzrostu mikroorganizmów na pożywkach
Obserwacja wzrostu drobnoustrojów na pożywkach należy do ważnych informacji diagnostycznych przy identyfikacji drobnoustrojów. W zależności od rodzaju podłoża w diagnostyce uwzględnia się różne cechy (tab. 4).
Tab. 4. Cechy diagnostyczne wzrostu mikroorganizmów na różnych podłożach
Bulion płynny |
Płytka Petriego |
|
|
Skośny agar |
Słupek żelatynowy |
|
|
6.3.1. Wzrost i charakterystyka drobnoustrojów w pożywkach płynnych
Charakter wzrostu na podłożu płynnym pozwala na określenia zapotrzebowania bakterii na tlen (rys.16).
Bezwzględne tlenowce rosną na powierzchni pożywki w postaci pierścienia, błonki lub kożucha utworzonych z komórek. W zależności od gatunku bakterii kożuch może być biały, zabarwiony, suchy, sfałdowany, jednolity lub rozpadający się, kłaczkowaty, wznoszący się po ściankach;
Względne beztlenowce charakteryzuje wzrost dyfuzyjny, objawiający się jednolitym zmętnieniem całej objętości pożywki;
Bezwzględne beztlenowce rosną w postaci osadu na dnie probówki. Po wstrząśnięciu osad unosi się w sposób pylisty, osiadający, kłaczkowaty lub ziarnisty;
Mikroaerofile rozwijają się w postaci pierścienia w pewnym oddaleniu od powierzchni pożywki.
Wymienione typy wzrostu na podłożach płynnych można obserwować w różnych kombinacjach, np. zmętnienie i osad, zmętnienie i kożuszek.

Ryc.21 Wzrost bakterii w hodowlach płynnych: (18)
a) wzrost na powierzchni w postaci pierścienia,
wzrost dyfuzyjny,
częściowe zmętnienie i osad,
wzrost podpowierzchniowy.
Hodowle na podłożach płynnych prowadzi się również w celu:
rozmnożenia bakterii;
badania przemian biochemicznych prowadzonych przez bakterie (np. przy wykrywaniu ich zdolności do wytwarzanie indolu lub gazu zbierającego się w rurce Durhama),
ilościowego oznaczania bakterii w środowisku metodami wskaźnikowymi, np. określenie:
„miana coli”, czyli najmniejszej ilości środowiska, która daje wynik dodatni na obecność Escherichii coli;
obecności bakterii na podstawie ich zdolności do redukowania barwników znajdujących się w pożywce, np. błękitu metylenowego, który w wyniku działania drobnoustrojów zmienia zabarwienie podłoża (próba reduktazowa);
ilości bakterii metodą nefelometryczną i turbidymetryczną, którą oceniamy analizując stopień zmętnienia pożywki
ilości bakterii na podstawie objętości osadu po odwirowywaniu.
6.3.2. Wzrost i charakterystyka mikroorganizmów na podłożach stałych.
Ma zastosowanie w diagnostyce, przy otrzymywaniu czystych kultur oraz w analizach ilościowych.
Charakterystyka wzrostu kolonii bakterii na płytce Petriego
Kolonia to skupisko bakterii widoczne gołym okiem, wyrosłe najczęściej z jednej komórki. W standardowych warunkach środowiska kolonie charakteryzują się stałymi cechami, uwzględnianymi w diagnostyce. Obserwacje koloni przeprowadza się przy pomocy lupy lub binokularu biorąc pod uwagę:
wielkość ( w milimetrach) oraz kształt koloni, np. okrągły, nieregularny, rozgałęziony, nitkowaty:
Niektóre bakterie mogą nie tworzyć pojedynczych kolonii, lecz zarastać całe podłoże, dając wzrost mgławicowy, rozlany (Proteus), inne tworzą kolonie rozpełzające się po powierzchni podłoża (Bacillus).
brzeg koloni: gładki, falisty regularny lub nieregularny, płatowaty regularny lub nieregularny, ząbkowany regularny lub nieregularny, nitkowaty:
powierzchnia koloni: gładka i pomarszczona; może być lśniąca lub matowa:
barwa koloni i jej przejrzystość: przeźroczysta, mętna, opalizująca, nieprzeźroczysta oraz zdolność do wytwarzania pigmentu zabarwiającego otoczenie koloni: zabarwione, niezabarwione.
Na przykład Sarcina lutea i Pseudomonas herbicola - tworzą kolonie żółte, Staphylococcus aureus - pomarańczowo-złote; Serratia marcescens - krwisto-czerwone; Azotobacter - ciemno brązowe, Pseudomonas fluorescens - seledynowe fluoryzujące. Ponadto wytwarzane przez pseudomonady barwniki dyfundują do podłoża zmieniając kolor na zielonkawy, niebieskawy, fioletowy, niekiedy fluoryzujący;
konsystencja: struktura: zwarta, drobnoziarnista, gruboziarnista, luźna;
profil koloni ponad powierzchnię pożywki: płaski; wyniosły; soczewkowaty niski, soczewkowaty wysoki; pępkowaty.
Z praktycznego punktu widzenia rozróżnia się następujące typy kolonii powierzchniowych:
„S” (smooth - gładki) - o gładkim brzegu, powierzchni wypukłej bez wzniesień i wgłębień. Jest to cecha charakterystyczna dla kolonii młodych i prowadzonych na agarze odżywczym, a także zjadliwych form bakterii chorobotwórczych,
„R” (rought - szorstki) - o brzegu nierównym, płatowatym lub nitkowatym i szorstkiej powierzchni. Bakterie tworzące takie kolonie układają się w długie nici lub łańcuszki. Kolonie takie tworzą niezjadliwe formy bakterii, chociaż te same bakterie wytwarzające kolonie gładkie, są chorobotwórcze
„G” (gonidial - gonidialny) - kolonie bardzo drobne o średnicy 1 mm tworzone przez drobne bakterie
„M” (mucoid - śluzowaty) - kolonie gładkie o powierzchni śluzowatej, błyszczącej, wytwarzane przez bakterie ze śluzową otoczką
„L” (L-formy) - powstają spontanicznie lub w niesprzyjających warunkach środowiskowych. Kolonia taka składa się z komórek bardzo drobnych - przesączalnych, poprzez formy ziarniste i pałeczkowate, do form olbrzymich o średnicy dochodzącej do 10 µm.
Nieco odmienne kolonie wytwarzają promieniowce - Actinomycetales, które będąc bakteriami morfologicznie przypominają grzyby strzępkowe. Na podłożach stałych tworzą grzybnię zbudowaną ze strzępek, tzw. pseudomycelium, które może ulegać fragmentacji. U niektórych promieniowców końce pseudomycelium przekształcają się w konidia powietrzne, które są formami przetrwalnymi.
Grzyby - Fungi, których plecha ma budowę nitkowatą, złożona z mniej lub bardziej rozgałęzionych, jedno- (komórczak) lub wielokomórkowych, jedno- lub wielojądrowych strzępek. Wytwarzają grzybnię dwóch rodzajów:
grzybnię wrastającą w podłoże i służącą do pobierania pokarmu;
puszystą, zwartą lub luźną grzybnię powietrzną, zbudowaną ze strzępek z różnymi formami owocowania, na ogół wegetatywnego. Początkowo jest ona bezbarwna lub biała. W miarę wzrostu i w zależności od wytwarzanego barwnika (koloru zarodników konidialnych) kolonia przybiera różną barwę;
Drożdże - rosnąc na powierzchni podłoży stałych tworzą pojedyncze kolonie, które można sklasyfikować tak jak u bakterii (S - gładkie; R- pomarszczone; M- śluzowate) bądź tworzą jednolity nalot. Powierzchnia koloni może być gładka, gładka z wyniesieniem na środku, pomarszczona, lśniąca lub matowa. Wewnątrz podłoża tworzą charakterystyczne kolonie o kształcie soczewkowatym. W podłożach płynnych drożdże rosnąc tworzą na powierzchni błonkę lub na dnie osad.
Wzrost i charakterystyka hodowli na skosie agarowym.
Przy posiewie na skosie bakterie najczęściej nie tworzą wyodrębnionych koloni, jednak sposób wzrostu jest również ważną cechą diagnostyczną. Wzrost bakterii na skosie opisujemy uwzględniając następujące cechy:
charakter wzrostu: jednolity (w postaci zwartego nalotu komórek); perlisty (tworzą się oddzielne, niezlewające ze sobą kolonie) o brzegach gładkich, ząbkowanych, kolczastych, ziarnistych; krzewiasty, nieregularny, itp.;
powierzchnia rysy: lśniąca, matowa, czasem cienka, sucha błonka;
struktura: gładka, ziarnista, pofałdowana;
barwa i przeźroczystość.
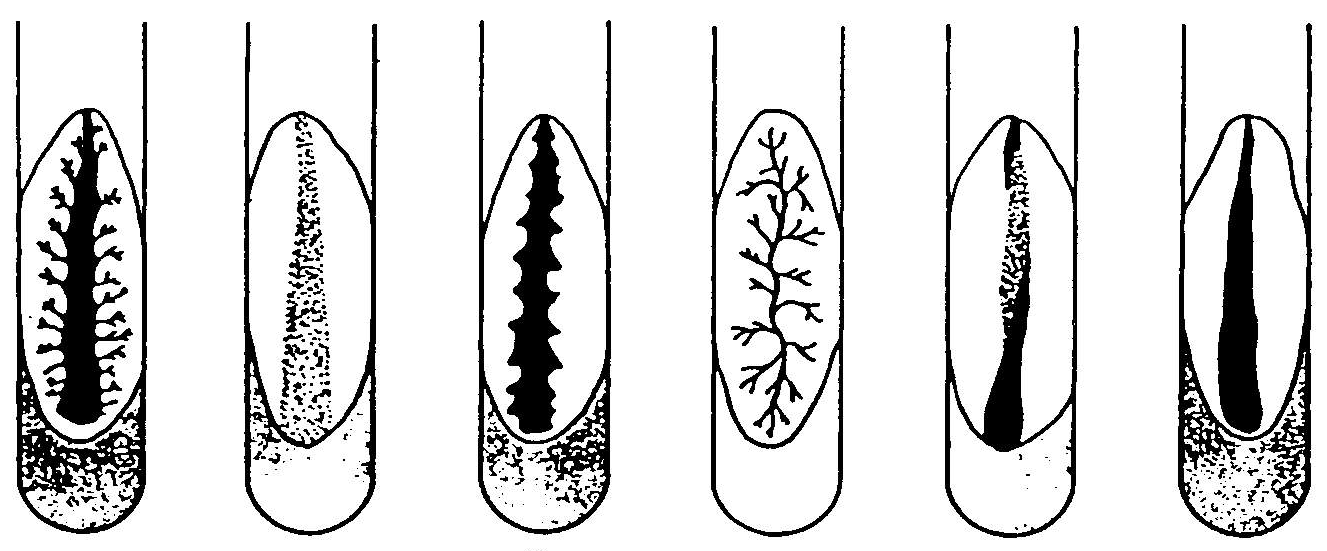
Ryc.22 Typy wzrostu bakterii w hodowlach rysowych: (24)
1 - drzewiasty
2 - mgławicowy
3 - pierzasty
4 - korzonkowy
5 - perlisty
6 - jednolity
Wzrost drobnoustrojów na słupku w hodowli kłutej opisujemy uwzględniając następujące cechy:
ruchliwość
upłynnianie żelatyny (w przypadku bakterii proteolitycznych), a także charakter upłynnienia wzdłuż nakłucia.
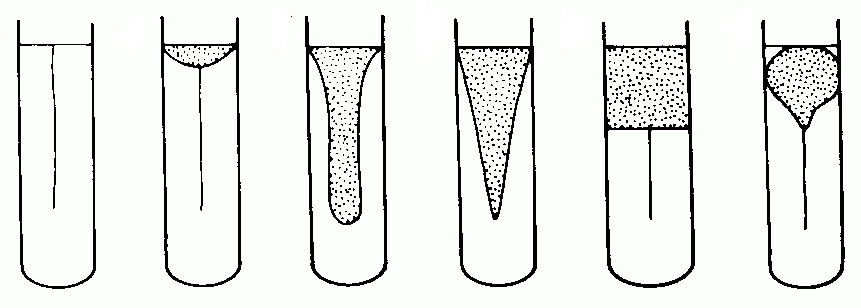
Rys.23. Wzrost bakterii na żelatynie kłutej.(2)
1 - brak upłynnienia
2 - upłynnienie kraterowate
3 - upłynnienie workowate
4 - upłynnienie lejkowate
5 - upłynnienie walcowate
6 - upłynnienie kielichowate
zależność bakterii od zapotrzebowania na tlen. Określenie stosunku bakterii do wolnego tlenu polega na badaniu wzrostu na słupku agarowym zaszczepionym igłą do dna probówki. bezwzględne tlenowce rosną tylko na powierzchni pożywki; bezwzględne beztlenowce rosną tylko w dolnych partiach pożywki; względne beztlenowce rosną na całej wysokości słupka; mikroaerofile rosną tuż pod powierzchnią pożywki.
6.4. Metody oznaczania liczby drobnoustrojów
Liczbę bakterii występujących w danym środowisku można określić różnymi metodami. Powszechnie stosowane metody dzielą się na bezpośrednie i pośrednie. Metody bezpośrednie służą do oznaczania sumy żywych i martwych komórek. Metody pośrednie (hodowlane) opierają się na obserwacji wzrostu żywych komórek.
Bezpośrednie metody oznaczania liczby drobnoustrojów:
Oznaczanie liczby komórek w polu widzenia mikroskopu. Sposób postępowania:
na środku szkiełka podstawowego wyznacza się flamastrem kwadrat o boku 10 mm;
na wyznaczoną powierzchnię przenosi się mikropipetą 0,01cm3 badanej zawiesiny bakterii i równomiernie rozprowadzacza po powierzchni;
preparat suszy się i utrwala, zabarwia błękitem metylenowym (1-2 min), a następnie spłukuje wodą i suszy;
liczbę komórek liczy się w 20 polach widzenia mikroskopu (powiększenie 1000x), po wyliczeniu średniej uzyskane dane podstawia się do wzoru:
Obliczanie wg wzoru: A = N x 4 x 104 / πd2; gdzie:
A - liczba komórek;
N - średnia liczba bakterii w jednym polu widzenia
d - średnica pola widzenia [mm]
Objaśnienie obliczeń:
Średnica pola widzenia mikroskopu d = 0,16 mm
Powierzchnia pola widzenia πr2 = 3,14 (0,08)2 = 0,02 mm2
Powierzchnia rozmazu 10 x 10 = 100 mm2
Jedno pole widzenia reprezentuje 1/5000 część powierzchni rozmazu, która wynosi 0,01 cm3.
Jedna komórka w polu widzenia odpowiada 5.000 komórek w objętości 0,01 cm3 lub 500.000 komórek w objętości 1 cm3.
Oznaczanie liczby komórek przy użyciu komory Thoma.
Komora Thoma jest wykorzystywana do liczenia komórek o wymiarach większych niż 0,4 mm, czyli drożdży, zarodników i fragmentów strzępek grzybów. Komora ma naniesioną siatkę 16 dużych kwadratów (o powierzchni 1/400 mm2 i objętości 1/4000 mm3), z których każdy zawiera 16 małych kwadracików o boku 0,05 mm. Badany materiał nanosi się na komorę, przykrywa szkiełkiem nakrywkowym i liczy pod mikroskopem przy powiększeniu 400x. Dla wiarygodnego wyniku należy policzyć komórki zgodnie z załączonym schematem w 40-80 małych kwadratach. Aby błąd obliczeń nie przekroczył 10% należy zliczyć conajmniej 700 komórek.
Obliczanie przeprowadza się według wzoru:
N = 4 x 106 x aśr x r
aśr - średnia liczba komórek w małym kwadracie
r - rozcieńczenie badanej próbki.
Rys.24. Kierunek liczenia komórek w komorze (3)
Pośrednie metody oznaczania liczby drobnoustrojów:
Posiew ilościowy metodą płytkową (zalewową) Kocha
W metodzie zakłada się, że z każdej pojedynczej komórki bakterii przeniesionej na stałe podłoże wyrasta kolonia. Zatem wynik badania określa liczbę jednostek zdolnych do tworzenia koloni.
Badaną próbkę rozcieńcza się zgodnie z metoda podana w poprzednim rozdziale, następnie wybrane rozcieńczenia posiewa się na płytki Petriego zalewa ostudzonym do temperatury 450C podłożem i po zestaleniu całości inkubuje (temperatura 370C 24-36 godzin). Po okresie inkubacji liczy się wyrosłe kolonie przyjmując, że liczymy te, których liczba mieści się w granicach: 30-200.
Liczbę organizmów oblicza się wg wzoru:
Z = A x stopień rozcieńczenia; gdzie
A = liczba koloni na płytce, Z = liczba organizmów
Wynik podaje się w postaci potęgi dla liczb zawartych między 1,0 a 9,9, pomnożonych przez 10x - gdzie x jest odpowiednią potęgą. Np. w posiewie 1 cm3 z rozcieńczenia 10-3 (1: 1000) stwierdzono, że średnia arytmetyczna wyrosłych koloni (na obu płytkach) wynosi 240, co w przeliczeniu na 1 cm3 badanej próbki wynosi 240 x 1000 = 240 000. Wynik w postaci potęgi wynosi 2,4 x 105.
Posiew powierzchniowy na podłoże stałe
Rozcieńczone próbki badanego materiału posiewa się na zestalony agar w płytkach Petriego w ilościach 0,1 lub 0,5 cm3 i równomiernie rozprowadza po pożywce głaszczką. Po okresie inkubacji liczy się kolonie zgodnie z opisaną wyżej procedurą.
Posiew samoczynny z powietrza - metoda sedymentacyjna
W celu określenia ogólnej liczby bakterii w powietrzu płytki Petriego (Ø 10 cm) z zestalonym agarem należy otworzyć i eksponować 10 min w badanym pomieszczeniu. Po upływie określonego czasu płytki zamknąć i inkubować w temp. 300C przez 48 h.
Po okresie inkubacji liczymy wyrosłe kolonie, a następnie posługując poniższym wzorem obliczamy ilość bakterii i grzybów w 10 dm3 powietrza:
N = a × 100/ b × k; gdzie:
N - liczba drobnoustrojów w 10 dm3 powietrza
a - średnia liczba kolonii z płytek (na jedno badanie 3 płytki )
b - powierzchnia płytki - dla płytki o średnicy 10 cm pow. wynosi 78,5 cm2
k - współczynnik czasu ekspozycji płytki - dla 10 min k = 2
100 - przelicznik powierzchni płytki na 100 cm2
Liczenie koloni na filtrach membranowych
Płynną próbkę filtruje się przez odpowiedni filtr membranowy zatrzymujący bakterie. Filtr z bakteriami umieszcza się na podłożu hodowlanym. Po okresie inkubacji filtr z podłoża przekłada się na 15 min. na bibułę nasączoną 0,01% roztworem błękitu metylenowego. Zabarwiony filtr przepłukuj się wodą destylowaną. Filtr jest jasnoniebieski zabarwione bakterie ciemniejsze. Do policzenia wybiera się filtry zawierające 20 -100 koloni. Wynik badania przelicza się na 100 cm3 lub 1 cm3.
Określanie najbardziej prawdopodobnej liczby drobnoustrojów NPL
Metodę tą stosujemy przy obliczaniu drobnoustrojów, które występują w niewielkiej liczbie w badanym materiale. W metodzie tej posiewy dokonuje się równolegle do ustawionych w 3 rzędach 3 lub 5 probówek (płytek) zawierających 10 cm3 lub 15 cm3 podłoża. Do pierwszego rzędu posiewa się 10 cm3 próbki z rozcieńczenia wyjściowego, a do dwóch następnych rozcieńczeń po 1cm3. Po inkubacji z odpowiednich tabel opartych na rachunku prawdopodobieństwa odczytuje się najbardziej prawdopodobną liczbę bakterii.
Modyfikacje metody Kocha
Do określania liczby drobnoustrojów wykorzystuje się często gotowe zestawy przygotowywane przez liczne firmy farmaceutyczne. Zestaw składa się z pojemnika zawierającego sztywny pasek pokryty obustronnie pożywką agarową. Z reguły jedna strona paska ma podłoże do wzrostu bakterii, a druga podłoże do wzrostu grzybów. Pasek ten jest umocowany w zakrętce naczynia. Posiew można wykonać trzema sposobami: albo zanurzamy pasek w całości w badanej płynnej próbce materiału, albo poprzez metodę odciskową dotykamy z obu stron wybranej powierzchni lub nawilżamy obustronnie materiałem badanym. Po posiewie pasek umieszczamy w pojemniku i inkubujemy w określonej temperaturze. Po okresie inkubacji oceniamy ilość wyrosłych koloni przez porównanie z dołączonym wzorcem.
6.5. Zadania
W przygotowanym na poprzednich zajęciach materiale hodowlanym ocenić wzrost drobnoustrojów uwzględniając:
Wzrost drobnoustrojów na płytce Petriego:
Wzrost drobnoustrojów na skosie agarowym:
Wzrost drobnoustrojów na słupku:
W materiale przygotowanym na poprzednich zajęciach ocenić:
Wzrost bakterii na podłożu płynnym uwzględniając ich zapotrzebowanie na tlen;
Intensywność wzrostu drobnoustrojów hodowanych w temperaturze 37ºC, 20ºC oraz w temperaturze 8ºC; na podłożu płynnym
Charakter wzrostu drobnoustrojów na podłożach agarowych o różnym pH.
Obliczyć liczbę koloni bakterii na płytkach po wykonaniu posiewu metodą zalewową uwzględniając rozcieńczenie.
Oznaczyć liczbę drobnoustrojów w powietrzu metodą sedymentacyjną.
Wyizolować czyste kultury.
optyczny utworzony z dwóch zbierających zestawów soczewek, tj. obiektywu i okularu, kondensora z przesłoną i źródła światła;
mechaniczny, który zawiera statyw, tubus z urządzeniem rewolwerowym, stolik przedmiotowy, mechanizm ruchu (śrubę makrometryczną i mikrometryczną) do regulowania ostrości obrazu.
Powiększenie - jest równe iloczynowi powiększeń obiektywu i okularu. Dla obiektywów suchych powiększenie do 600 razy, a dla obiektywów immersyjnych powiększenie do 2500 razy.
Zdolność rozdzielcza: jest to najmniejsza odległość między dwoma punktami, przy której oba punkty są widoczne jako oddzielne, nie zlewające się w jeden obraz.
Sprawdzić czystość mikroskopu, optyczne części (obiektyw, okular, lusterko);
Włączyć źródło światła, otworzyć przesłonę kondensora znajdującą się pod stolikiem;
Włączyć w oś optyczną mikroskopu obiektyw o danym powiększeniu;
Przygotowany preparat umieścić na stoliku i docisnąć zaciskami (na preparaty oglądane pod immersją nanieść olejek immersyjny);
Obserwując z boku podnosić stolik do momentu zetknięcia się obiektywu z olejkiem immersyjnym na preparacie;
Patrząc w okular podnosić tubus śrubą makrometryczną, aż do momentu uzyskania obrazu preparatu;
Ostrość obrazu ustawić za pomocą śruby mikrometrycznej;
Po skończonej pracy obiektyw immersyjny wycieramy delikatnie szmatką zwilżoną w benzynie, a następnie suchą. Centrujemy stolik, włączamy w oś optyczną mikroskopu obiektyw o najmniejszym powiększeniu i obniżamy stolik. Nakrywamy mikroskop folią i chowamy do szafki.
obecność lub liczbę żywych i martwych komórek drobnoustrojów;
kształty, wielkość i obecność otoczki oraz zdolność do ruchu;
wzajemny układ komórek w hodowli, tzn. występowanie komórek pojedynczo lub w różnych układach;
sposób rozmnażania się - przez podział, tworzenie pączków, zarodników i form przetrwalnych.
barwienie błękitem metylenowym (rozcieńczenie 1:10000) pozwala ocenić żywotność drożdży. Barwnik przenika do wnętrza martwej komórki, która barwi się na ciemnoniebiesko. Obliczając procent komórek żywych określamy żywotność drożdży, czyli ich przydatność spożywczą;
barwienie płynem Lugola umożliwia wykrycie w komórce drożdży substancji zapasowych - glikogenu. Glikogen barwi się na brunatno czerwono, a cytoplazma komórki jasno-żółto-zielono;
barwienie bakterii płynem Lugola pozwala u gatunków beztlenowych wykryć granulozę - cukier stanowiący substancje zapasową tych bakterii.
zabicie komórek drobnoustrojów;
przyklejenie się komórek do powierzchni szkiełka;
odsłonięcie w ścianach komórkowych martwych mikroorganizmów związków, z którymi łączy się barwnik.
Utrwalanie możemy wykonywać metodą:
termiczną - wyschnięty preparat przeprowadzamy 3-krotnie w pozycji poziomej (rozmazem do góry) przez płomień palnika
lub chemiczną przy użyciu alkoholu (60 - 70 %), formaliny lub mieszaniny eteru i alkoholu. W tym celu na wysuszony rozmaz nalewa się odpowiedni odczynnik. Po 5 - 10 min. zlewa się utrwalacz i barwi jedną z podanych metod.
barwienie proste, gdzie używamy jednego barwnika;
barwienie złożone, na które składa się więcej barwników;
barwienie pozytywne - polegające na zabarwieniu komórek, podczas gdy tło zostaje bezbarwne;
barwienie negatywowe - komórki bezbarwne na barwnym tle.
fiolet krystaliczny lub gencjanowy (1-3 min);
błękit metylenowy według Löfflera (5 min);
rozcieńczoną fuksynę fenolową (30 sek.).
utrwalone preparaty zalać na kuwecie barwnikiem: zielenią malachitową;
szkiełko z preparatem podgrzać 2-3 razy od dołu palnikiem do pierwszej pary;
spłukać wodą;
potraktować safraniną (około 0,5 min);
spłukać wodą, wysuszyć i oglądać pod immersją. Endospory barwią się na kolor zielony, natomiast komórki wegetatywne na kolor pomarańczowo-czerwony.
na szkiełku zegarkowym w 2 ml wody destylowanej o temp. 20ºC rozprowadzić odrobinę badanej hodowli bakterii;
zawiesinę przez 30 min inkubować w cieplarce o temperaturze 37ºC;
1-3 krople zawiesiny przenieść na dokładnie odtłuszczone szkiełko podstawowe i wysuszyć w temperaturze pokojowej;
na wysuszony preparat nanieść zaprawę (wodny roztwór kwasu taninowego, nasycony roztwór siarczanu żelazowego, nasycony roztwór alkoholowy fuksyny zasadowej) i całość delikatnie ogrzewać przez 2 minuty do pierwszej pary;
preparat spłukać wodą o temperaturze 60ºC; wysuszyć na powietrzu; zalać barwnikiem (nasycony roztwór fuksyny zasadowej, fenol) o temperaturze 65ºC na 2-3 minuty;
spłukany ciepłą wodą preparat wysuszyć i oglądać pod immersją. Rzęski barwią się na kolor czerwony.
metodą pomiaru prostego. Polega ona na dokładnym narysowaniu komórki na papierze milimetrowym, w takiej wielkości, w jakiej widzimy przy danym powiększeniu. Z rysunku odczytujemy wymiary w milimetrach, a wielkość rzeczywistą obliczamy ze wzoru:
metodą mikrometryczną. Polega na pomiarze za pomocą mikrometru okularowego i przedmiotowego. Przed przystąpieniem do obliczenia wyznacza się wartość mikrometryczną mikroskopu dla danego okularu i obiektywu. Mając mikrometr okularowy w okularze, a mikrometr przedmiotowy na stoliku szukamy obraz i ustawiamy obie skale mikrometrów w taki sposób aby ich punkty zerowe pokryły się. Następnie oblicza się, ile kresek mikrometru okularowego przypada na okular przedmiotowy. Zastosowany wzór pozwoli wyznaczyć wartość mikrometryczną:
Obliczyć powiększenie, jakie można uzyskać przy pomocy obiektywów i okularów, w które jest zaopatrzony mikroskop.
Obliczyć zdolność rozdzielczą mikroskopu dla trzech najsilniej powiększających obiektywów przyjmując, że długość fali świetlnej wynosi 0,55 ၭm (apertura numeryczna dla obiektywów 10x wynosi 0,25; 40x - 0,76; 100x - 1,30).
Z dostarczonych drożdży wykonać preparat przyżyciowy w kropli spłaszczonej i obejrzeć pod mikroskopem.
Z dostarczonych drożdży wykonać barwiony preparat przyżyciowy w kropli spłaszczonej i obejrzeć pod mikroskopem .
Z hodowli bakterii wyizolowanych na poprzednich zajęciach przygotować preparaty utrwalone do barwienia.
Utrwalone preparaty zabarwić:
metodą prostą stosując błękit metylenowy Löfflera. Preparaty oglądać pod obiektywem immersyjnym. Narysować kształt oglądanych komórek bakteryjnych.
metodą złożoną Grama. Preparaty obejrzeć pod mikroskopem za pomocą obiektywu immersyjnego. Określić kształt komórek oraz przynależność do bakterii G(+) lub G(-). Narysować obraz oglądanych bakterii.
Dokumentacja techniczno-ruchowa. Spółdzielnia Pracy Mechaników „SMS”, Warszawa, ul. Konstruktorska 8. Autoklaw pionowy typ A6. (R.2)
Drewniak E., Drewniak T. Mikrobiologia żywności, WSiP, Warszawa 1998. (R9, R12,R14, R17,R23)
Drews G. Mikrobiologisches Praktikum für Naturwissenschaftler, Springer-Verlag, Berlin - Heidelberg - New York 1968.(R24)
Gołębiowska J. Mikrobiologia rolnicza, PWRiL, Warszawa 1986.(wykres1)
Kura J. (red.). Ćwiczenia z mikrobiologii ogólnej, Wydawnictwo Politechniki Gdańskiej, Gdańsk 1993.
Izrailski W.(red.). Bakteryjne choroby roślin, PWRiL, Warszawa 1962.
Kosewska L. Analiza mikrobiologiczna w przemyśle spożywczym, WSiP, Warszawa 1986.
Kunicki-Goldfinger Wł., Frejlak S. Podstawy mikrobiologii i immunologii, PWN, Warszawa 1977.(wykres 2)
Kunicki-Goldfinger Wł. Życie bakterii, PWN, Warszawa 1994.( R1)
Libudzisz Z., Kowal K. (red.). Mikrobiologia techniczna, Tom I,II, Wydawnictwo Politechniki Łódzkiej, Łódź 2000. (R3, R 4, R5, R16,R18,R19,TOM II)
Matuszewski T. Wstęp do mikrobiologii rolniczej, PWRiL, Warszawa 1963.
Müller G. Mikrobiologie pflanzlicher Lebensmittel, VEB Fachbuchverlag Leipzig 1988.
Nicklin J., Graeme-Cook K., Paget T., Killington R. Mikrobiologia, Wydawnictwo Naukowe PWN, Warszawa 2002.
Nowak A. Mikrobiologia dla kierunków rolniczego, ogrodniczego i ochrony środowiska, Wydawnictwo Akademii Rolniczej w Szczecinie, Szczecin 1994.
Nowak A. Przewodnik do ćwiczeń z mikrobiologii dla kierunku rolniczego, ogrodniczego i ochrony środowiska, Wydawnictwo Akademii Rolniczej w Szczecinie, Szczecin 1992.
Olańczuk- Neyman K. Laboratorium z biologii środowiska, Wydawnictwo Politechniki Gdańskiej, Gdańsk 1998. (R6)
Paluch J. Podstawy mikrobiologii przemysłowej, WPLiS, Warszawa 1965 (R15)
Pliszka A. Mikrobiologia dla technikum gastronomicznego, WSiP, Warszawa 1990.(R21)
Schlegel Hans G. Mikrobiologia ogólna, Wydawnictwo Naukowe PWN, Warszawa 2001.
Singleton P. Bakterie w biologii, biotechnologii i medycynie, Wydawnictwo Naukowe PWN, Warszawa 2000.(R20)
Sobczak E. (red.). Teoria i ćwiczenia z mikrobiologii ogólnej i technicznej, Wydawnictwo SGGW, Warszawa 1993. (R7, R10, R11)
Szember A. Zarys mikrobiologii rolniczej, PWN, Warszawa 1985.
Szynkiewicz Z. Polityńska-Banaś E. Ćwiczenia z mikrobiologii dla studentów Wydziału Zootechnicznego, Wydawnictwo SGGW-AR, Warszawa 1988.
Trojanowska K., Giebel H., Gołębiowska B. Mikrobiologia żywności, Wydawnictwo Akademii Rolniczej w Poznaniu, Poznań 1996. (R6, R8,R10,R22)
Wojciechowska M. i inni. Mikrobiologia, WSE, Poznań 1969.
Zaremba M.L., Borowski J. Podstawy mikrobiologii lekarskiej, Wydawnictwo Lekarskie PZWL,Warszawa 1994.
Żakowska Z., Stobińska H. (red.). Mikrobiologia i higiena w przemyśle spożywczym, Wydawnictwo Politechniki Łódzkiej, Łódź 2000.
Pochodzenie kolonii; nr stołu |
Liczba kolonii |
Barwa kolonii |
Kształt kolonii |
Brzeg kolonii |
Wyniosłość kolonii |
Ilość bakterii |
|
|
|
|
|
|
|
Rodzaj materiału |
Sposób wzrostu |
Powierzchnia rysy |
Struktura |
Barwa i przeźroczystość |
|
|
|
|
|
Rodzaj materiału |
Sposób wzrostu |
Powierzchnia rysy |
Zapotrzebowanie na tlen |
Barwa i przeźroczystość |
|
|
|
|
|
Z podłoża na płytce Petriego wybrać dwie różniące się kolonie i przesiać je na czyste podłoże w płytce Petriego stosując metodę posiewu redukcyjnego. W tym celu płytkę Petriego na denku podzielić dermatografem na dwie części i opisać. Następnie za pomocą ezy dokonać przesiewu wybranych bakterii na odpowiadające im opisem pola. Płytki wstawić do cieplarki w temperaturze 370C na 36 godzin.
II.7. MIKROSKOP I PRZYGOTOWANIE PREPARATÓW DO OBSERWACJI MIKROSKOPOWYCH
Jak wynika z wcześniej podanej definicji drobnoustroje to organizmy mikroskopijnej wielkości, mierzonej w mikrometrach lub w nanometrach, których badanie jest możliwe za pomocą metod mikrobiologicznych, miedzy innymi mikroskopowych;
Drobnoustroje charakteryzują się zatem małymi rozmiarami. Wielkość komórki: bakteryjnej waha się w granicach: od 0,4 - 1 µm; długość od 0,5 - 10 µm; promieniowców: 1 - 1,5 (2) µm; długość 10 - 50 µm; drożdży: 2 - 8 µm; długość 3 - 10 µm. Średnica strzępki grzybów pleśniowych waha się od 3 - 10 µm a wielkość zarodni od 100-200 µm (Mucor, Thamnidium).
Sprawia to, że nie są one widoczne gołym okiem. Aby je zobaczyć należy wykonać preparaty mikroskopowe, które następnie ogląda się pod mikroskopem przy odpowiednio dobranym powiększeniu.
7.1. Mikroskop
Mikroskop jest przyrządem optycznym przeznaczonym do obserwacji bardzo małych przedmiotów lub ich szczegółów pod dużym powiększeniem. Za jego pomocą uzyskujemy informacje dotyczące morfologii mikroorganizmów, ich struktury zewnętrznej, sposobu rozmnażania, podziału komórkowego, a także zdolności ruchu. Wyróżniamy następujące typy mikroskopów:
Mikroskop elektronowy, w którym do otrzymywania obrazu zamiast światła widzialnego użyto strumień elektronów, dzięki czemu uzyskano fale długości 0,4 - 0,04Ⴔ10-4 ၭm oraz bardzo duże powiększenie badanych przedmiotów (powiększenie obrazu od kilkuset do miliona razy). Wyróżniamy mikroskopy transmisyjne i skaningowe.
Mikroskop świetlny, optyczny- na który składa się układ:
W mikroskopie tym możemy uzyskać powiększenie do 600× dla obiektywów suchych i do 2500× dla obiektywów immersyjnych.
Ryc. 25 Schemat mikroskopu optycznego
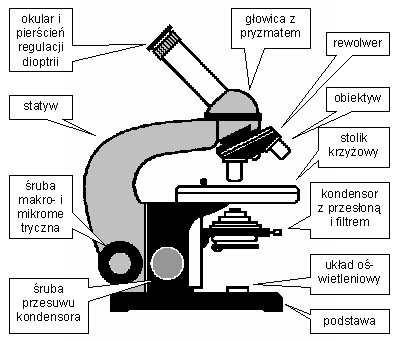
Odmianą mikroskopu świetlnego jest:
Mikroskop ultrafioletowy - źródłem światła są promienie UV o długości fali od 240 do400 nm;
Mikroskop fluorescencyjny - wykorzystuje zjawisko fluorescencji obiektów oświetlonych niewidzialnym światłem UV;
Mikroskop ciemnego pola - wykorzystuje się odbijanie i uginanie części promieni na drobnych przedmiotach, które dzięki temu stają się widoczne na ciemnym tle;
Mikroskop kontrastowo - fazowy, który umożliwia obserwacje ubogich w kontrasty obiektów i ich struktur bez potrzeby barwienia preparatów.
Wielkości charakteryzujące mikroskop:
Obliczanie zdolności rozdzielczej mikroskopu - „D”
D = ၬ/A; gdzie:
ၬ - długość fali świetlnej
A - apertura kąta - zdolność układu do przyjmowania światła
A = n × sin ၡ
n - współczynnik załamania światła
ၡ - kąt zawarty między skrajnymi promieniami światła biegnącego od przedmiot do czołowej soczewki obiektywu.
Technika korzystania z mikroskopu świetlnego
7.2. Technika wykonania preparatów mikroskopowych
W zależności od kierunku prowadzanych badań mikroskopowych wykonuje się preparaty przyżyciowe lub utrwalone. Za pomocą preparatów mikroskopowych można określić:
7.2.1. Przygotowanie preparatów przyżyciowych
Preparaty przyżyciowe służą do obserwacji ruchliwości, żywotności, sposobu rozmnażania, a czasami do wykrywania substancji zapasowych. Najczęściej prowadzi się obserwacje drożdży i pleśni ze względu na ich budowę i rozmiar. Obserwacja bakterii, ze względu na małe rozmiary, ogranicza się jedynie do oceny ich ruchliwości.
Preparaty przyżyciowe wykonuje się na szkiełku podstawowym, a w przypadku badania ruchliwości bakterii lub prowadzenia obserwacji nad sposobem rozmnażania drożdży preparaty wykonujemy na szkiełku z wgłębieniem zwanym komorą Lindnera. Wykonanie preparatu na szkiełku podstawowym określa się sposobem kropli spłaszczonej, natomiast preparat wykonany w komorze Lindnera sposobem kropli wiszącej.
Wykonywanie preparatu w kropli spłaszczonej.
Na odtłuszczone szkiełko podstawowe (wyjęte z alkoholu, dokładnie wytarte i trzykrotnie przeciągnięte nad płomieniem palnika) nanosi się kroplę płynnej hodowli drobnoustrojów i nakrywa szkiełkiem nakrywkowym, opuszczając je ukośnie w celu wyeliminowania pęcherzyków powietrza.
Przy sporządzaniu preparatu z hodowli na podłożu stałym lub z produktów o konsystencji mazistej należy nanieść na szkiełko najpierw kroplę destylowanej jałowej wody, a następnie pobrany za pomocą ezy materiał rozprowadzić w tej kropli. Całość nakryć szkiełkiem nakrywkowym.
Preparaty przyżyciowe należy oglądać bezpośrednio po przygotowaniu, żeby nie dopuścić do przeschnięcia materiału.
Wykonywanie preparatów w komorze Lindnera.
Brzegi wgłębienia komory Lindnera smaruje się wazeliną (1). W przypadku badania ruchliwości kultury na środku odtłuszczonego szkiełka nakrywkowego umieszcza się kroplę badanej hodowli (2), szkiełko szybko odwraca się i przykleja do brzegów wgłębienia w ten sposób, aby kropla wisiała w powietrzu mniej więcej na środku wgłębienia (3). Najlepiej oglądać preparat blisko brzegu kropli gdzie jest najcieńszy.
Rozmnażanie drożdży bada się w hodowli kropelkowej. Na odtłuszczone szkiełko nakrywkowe nakrapia się piórkiem od tuszu 5 kropelek hodowli w 2 lub 3 rzędach. Szkiełko z kropelkami należy następnie odwrócić i nałożyć na wgłębienie w komorze Lindnera. Po upływie dwóch godzin można zaobserwować początek pączkowania drożdży. Sposób i miejsce powstawania komórki pączka są charakterystyczne dla gatunków drożdży.
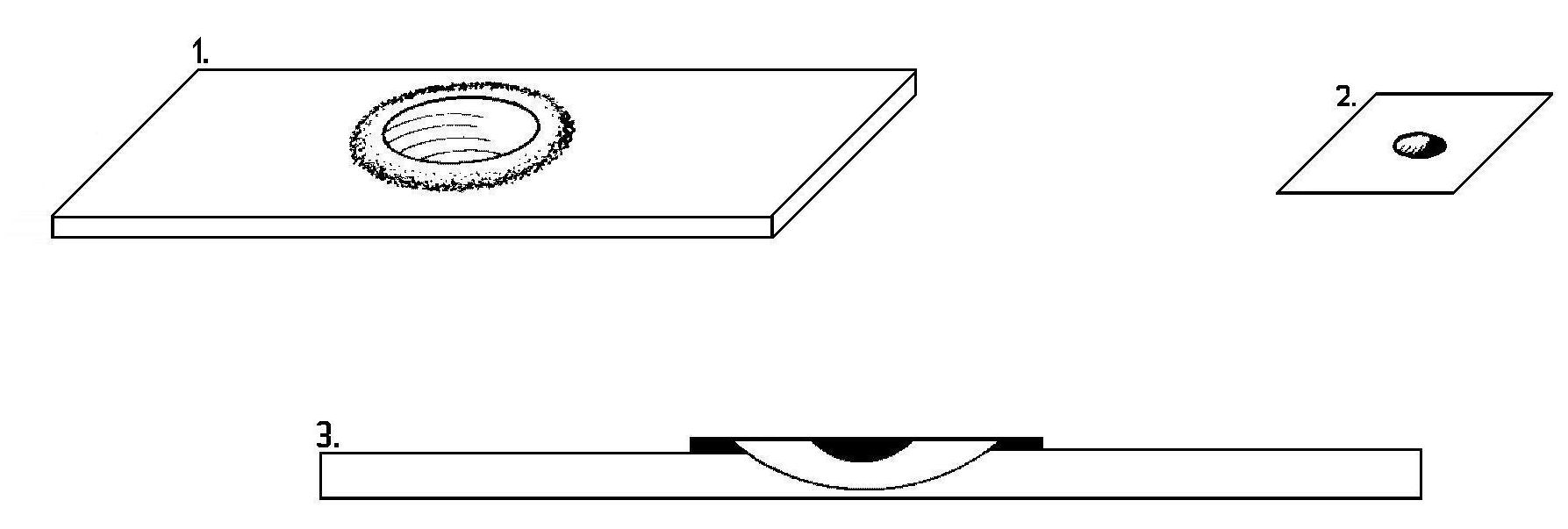
Ryc.26. Komora Lindnera - wykonywanie preparatu
Barwienie preparatów przyżyciowych
Preparat przyżyciowy może być barwiony lub nie barwiony. Chcąc wykonać barwienie obok kropli z materiałem badanym umieszcza się kroplę barwnika, miesza ezą i przykrywa szkiełkiem nakrywkowym. W przypadku nadmiernej ilości płynu usuwa się go bibułą filtracyjną, umieszczoną z jednej strony szkiełka nakrywkowego. Cel barwienia:
7.2.2 Technika wykonywania preparatów utrwalonych
Przygotowanie preparatów utrwalonych obejmuje następujące czynności: wykonanie rozmazu, utrwalenie i barwienie preparatu.
Wykonanie rozmazu. W przypadku hodowli płynnych rozprowadzamy kroplę badanego materiału cienką warstwą na odtłuszczonym szkiełku podstawowym. Gdy pobieramy materiał z hodowli stałej należy najpierw na szkiełku umieścić kroplę wody i następnie pobrany ezą materiał rozprowadzić w tej kropli.
Z mięsa, i produktów mięsnych, ryb żółtego sera wykonuje się preparaty bezpośrednio z badanych próbek. W tym celu wycięty jałowym skalpelem kawałek (np. mięsa, sera twardego, wędliny) przenieść jałową pincetą na szkiełko podstawowe i odcisnąć na nim wyraźny ślad, cienki i bez wolnych przestrzeni. Po wykonaniu rozmazu preparaty zostawiamy do wyschnięcia w temperaturze pokojowej.
Utrwalanie preparatów. Ma na celu:
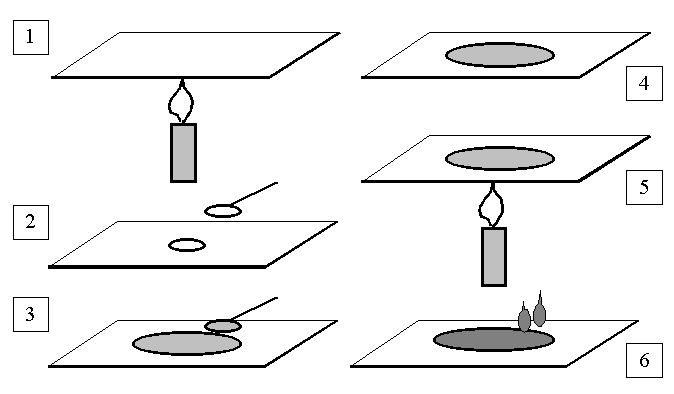
Rys.27. Wykonywanie preparatu utrwalonego
1. Odtłuszczanie szkiełka
2. Nanoszenie kropli wody
3. Wykonywanie rozmazu
4. Suszenie rozmazu
5. Utrwalanie w płomieniu
6. Barwienie preparatu.
Preparaty utrwalone barwi się, co pozwala na określenie kształtu drobnoustrojów, a także obserwację układów komórek i struktur komórkowych.
Barwienia preparatów utrwalonych.
W mikrobiologii mają zastosowanie następujące sposoby barwienia:
Barwienie proste.
Barwienie to stosujemy w celu ustalenia kształtu i układu komórek. Na utrwalony preparat, umieszczony w kuwecie do barwienia, nakrapia się jeden z niżej wymienionych barwników:
Po barwieniu preparat spłukuje się wodą, suszy i ogląda pod immersją.
Barwienie złożone.
Barwienie metodą Grama.
Jest to najczęściej stosowana metoda barwienia, która różnicuje bakterie na dwie grupy wykazujące wiele różnic w właściwościach i strukturze cytoche-micznej. Są to bakterie G (+) barwiące się na fioletowo i G (-) barwiące się na czerwono.
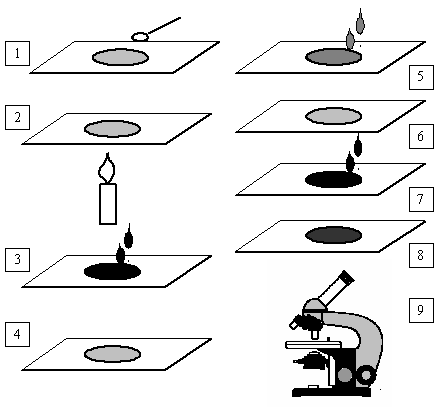
Rys.28. Barwienie metodą Grama
1 i 2. Wykonać preparat utrwalony zgodnie z wcześniejszym opisem.
3. Nanieść fiolet krystaliczny na 2-3 min.
4. Spłukać dokładnie bieżącą wodą
5. Nanieść płyn Lugola na 1-1,5 min.
6. Odbarwić alkoholem i spłukać bieżącą wodą
7 Nanieść fuksynę karbolową lub safraninę na 30 sek.
8. Preparat opłukać dokładnie bieżącą wodą, wysuszyć
9. Oglądając preparat pod immersją określić kształt i barwę komórki bakteryjnej.
W barwieniu Grama niektóre rodzaje bakterii mogą wykazywać zmiennie zabarwienie. Zjawisko to dotyczy najczęściej bakterii G(+), wytwarzających w niektórych fazach rozwojowych, a także w niedogodnych warunkach środowiskowych ścianę o cieńszej warstwie mureiny.
Barwienie przetrwalników metodą Schaeffera - Fultona
Gatunki bakterii należące do rodzaju Bacillus i Clostridium mają zdolność tworzenia form przetrwalnych (endospor). Powstają one wewnątrz komórki macierzystej i pozwalają jej przetrwać niekorzystne warunki. Kształt i umiejscowienie przetrwalników w komórce jest cechą gatunkową, a ich obserwacje umożliwia barwienie złożone Schaeffera - Fultona. Sposób postępowania podczas barwienia metodą Schaeffera - Fultona:
Barwienie rzęsek metodą Löfflera
Rzęski są narządami ruchu bakterii. Ich ilość i rozmieszczenie jest cechą diagnostyczną. Wykonania barwienia jest następujące:
7.3. Określanie wielkości mikroorganizmów
Wielkość mikroorganizmów określamy dwoma metodami:
Wielkość rzeczywista = a x 1000/ b
a -wielkość komórki w mm
b - powiększenie mikroskopu
Wartość mikrometryczna = a x 10 / b
a - liczba odczytanych jednostek mikrometru przedmiotowego
b- liczba odczytanych jednostek mikrometru okularowego
Wielkość rzeczywistą komórki w ၭm obliczamy mnożąc wartość mikrometryczną przez pomiar komórki dokonany przy użyciu mikrometru okularowego.
7.4. Zadania
LITERATURA
1
Stosowanie i przestrzeganie zasad
DOBREJ TECHNIKI MIKROBIOLOGICZNEJ (DTM)
gwarantuje obniżenie tego ryzyka do minimum
2
1
Wyszukiwarka
Podobne podstrony:
MIKROBIOLOGIA skrypt UW 2006
MIKROBOLOGIA SKRYPT 15 10 2014
praktyka skrypt mikrobiologia id 384986
1 , Biologia UMCS, IIº, I semestr, Mikrobiologia II, Ćwiczenia, Skrypty
skrypt mikrobiologia
Mikrobiologia opracowanie na podstawie części II Skryptu WAM wersja ostateczna wreszcie kurna!!! , Z
Mikrobiologia ogólna skrypt
13. oznaczanie wrażliwości na antybiotyki beta laktamowe, Biologia UMCS, IIº, I semestr, Mikrobiolog
2. symbiotyczne wiązanie azotu, Biologia UMCS, IIº, I semestr, Mikrobiologia II, Ćwiczeni
praktyka - skrypt3, MEDYCYNA, Mikrobiologia
Skrypt z mikrobiologii, mikrobiologia
praktyka - skrypt2, MEDYCYNA, Mikrobiologia
3. krzywa wzrostu, Biologia UMCS, IIº, I semestr, Mikrobiologia II, Ćwiczenia, Skrypty
praktyka skrypt mikrobiologia id 384986
06 pamięć proceduralna schematy, skrypty, ramyid 6150 ppt
więcej podobnych podstron