5.Sformułuj postulat Maxa Borna o probabilistycznej interpretacji funkcji falowej. Zapisz odpowiedni wzór. Objaśnij symbole.
Interpretacja Borna: gęstość prawdopodobieństwa znalezienia cząstki w punkcie x, w chwili t jest równa kwadratowi wartości bezwzględnej funkcji falowej
gdzie to funkcja falowa
wielkość 2 w dowolnym punkcie przedstawia miarę prawdopodobieństwa, że cząstka
znajdzie się w pobliżu tego punktu tzn. w jakimś obszarze wokół tego punktu np. w przedziale
x, x+dx. Ta interpretacja funkcji daje statystyczny związek pomiędzy falą i związaną z nią
cząstką. Nie mówimy gdzie cząstka jest ale gdzie prawdopodobnie się znajdzie.
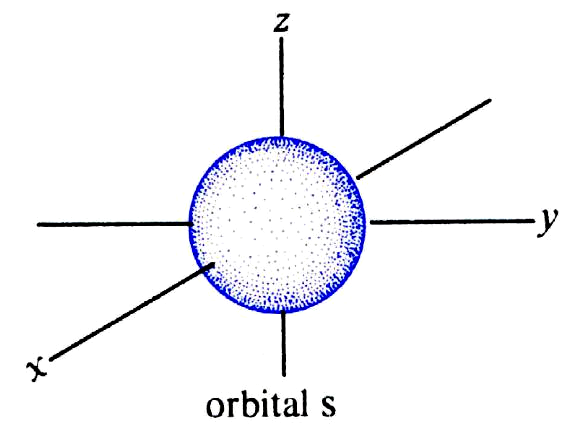
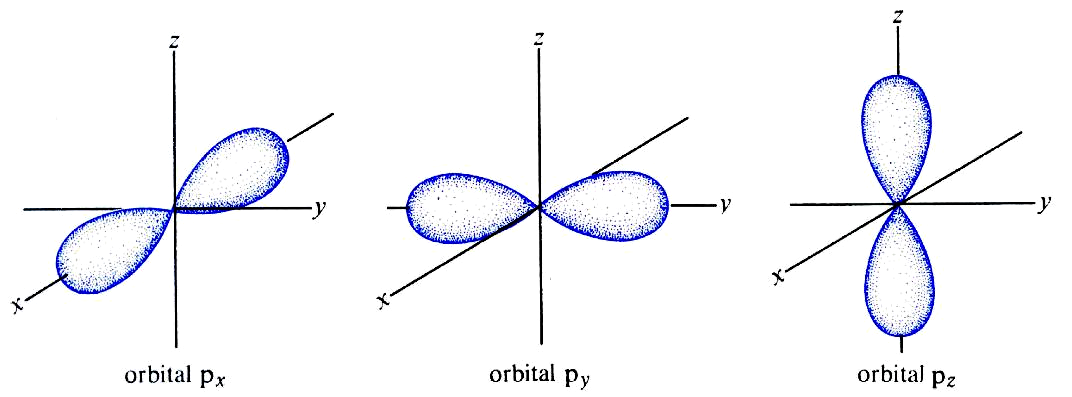
25. Naszkicuj kształty orbitali 1s i 2p. Co oznaczają te kształty? Jaki całkowity ładunek elektryczny jest zgromadzony w każdym z tych orbitali?
orbitale s - o kształcie sferycznym
orbitale p - o kształcie "hantli"
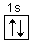
Max 2 elektrony
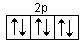
Max 6 elektronów
Kształty orbitali opisujących dany elektron w atomie lub cząsteczce zależą od usytuowania elektronów względem jąder oraz innych elektronów, które z kolei wynikają z liczb kwantowych przypisanych do danego elektronu. Kształt ten (kontur) jest najmniejszym obszarem w którym prawdopodobieństwo napotkania elektronu jest bliskie 1 (zwykle przyjmuje się wartość 0,9)
Węgiel: 1s2 2s2 2p2 4 elektrony walencyjne
Potas: 1s2 2s2 2p6 3s2 3p6 4s1 1 elektron walencyjny
Neon: 1s2 2s2 2p6 8 elektronów walencyjnych
PYTANIE 30.
Omów jak dochodzi do powstawania cząsteczek chemicznych. Naszkicuj odpowiedni rysunek (np. dla cząsteczki wodoru H2). Jaki jest związek powstałego stanu cząsteczkowego (orbitalu molekularnego) z orbitalami atomów tworzących cząsteczkę.
Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów. Atomy łączą się ze sobą tylko wtedy, gdy energia cząsteczek produktów jest mniejsza od sumy energii atomów i cząsteczek substratów. Oznacza to, że proces tworzenia się cząsteczki powinien być energetycznie korzystny, a więc powinien prowadzić do osiągnięcia przez układ minimum energii. A to oznacza, że w procesie łączenia się atomów w cząsteczkę jest uwalniana energia. Najczęściej uwalniana energia ma postać ciepła.
Z orbitali atomowych (funkcji falowych opisujących stany elektronowe w atomie) powstają orbitale molekularne opisujące stany elektronu w cząsteczce.
Omów jak dochodzi do powstawania cząsteczek chemicznych. Naszkicuj odpowiedni rysunek (np. dla cząsteczki wodoru H2). Jaki jest związek powstałego stanu cząsteczkowego (orbitalu molekularnego) z orbitalami atomów tworzących cząsteczkę?
Zapisz 1-wymiarowe równanie Schródingera dla cząstki swobodnej o masie m i energii E. Objaśnij symbole. Sprawdź bezpośrednim rachunkiem, że funkcja <p(x)=Ae'kx jest rozwiązaniem. Jaki warunek musi spełniać k? Zapisz, opisz i przedyskutuj równanie Schródingera dla elektronu o masie m znajdującego się w 1-wymiarowej nieskończonej studni potencjału o szerokości L. Podaj wzór na dozwolone wartości energii cząstki w nieskończonej studni potencjału. Zrób rysunek.
Jakie liczby kwantowe określają w pełni stan elektronu w atomie wodoru? Podaj związki między zakresami zmienności tych liczb. Od jakich liczb kwantowych (i w jaki sposób - bez szczegółów) zależy wartość energii elektronu w atomie wodoru?
Scharakteryzuj podstawowe typy wiązań chemicznych w ciałach stałych.
Na czym polega domieszkowanie półprzewodników? Wyjaśnij to na przykładzie krzemu. Zrób odpowiednie rysunki. Naszkicuj zależność przewodności elektrycznej półprzewodnika domieszkowanego od temperatury. Wykres skomentuj.
Sformułuj zasadę Pauli'ego. Dla jakich cząstek ona obowiązuje, a dla jakich nie obowiązuje? Podaj po 2 przykłady cząstek, podlegających i nie podlegających zasadzie Pauli'ego. Jaki jest wpływ tej zasady na obsadzenie stanów w atomach wieloelektronowych?
Omów (na przykładzie sodu), jak powstają pasma energetyczne, Zrób odpowiedni rysunek Naszkicuj orbitale atomowe s i p. Wyjaśnij sens fizyczny tych rysunków.
Na czym polega zjawisko tunelowe? Zapisz równanie Schródingera dla cząstki o masie m i energii E padającej na barierę o wysokości U0 i szerokości L. Zrób odpowiedni rysunek. Wskaż na podstawowe różnice między przewidywaniami klasycznymi i kwantowymi.
Zapisz konfigurację elektronową atomów węgla C (Z=6), potasu Cl (Z=17) oraz neonu Ne (Z=10). Ile elektronów walencyjnych ma każdy z tych atomów? jaki to ma wpływ na właściwości chemiczne? Zapisz równanie Schródingera dla elektronu w atomie wodoru. Objaśnij symbole. Jakie liczby kwantowe określają dozwolone stany tego elektronu?
Podaj przedziały zmienności tych liczb kwantowych. Podaj zależność na energie stanów dozwolonych. Czy energia stanu elektronu w atomie zależy czy nie zależy od liczb kwantowych l i m, przy ustalonej n? Odpowiedź skomentuj.
Wyszukiwarka
Podobne podstrony:
Spis Tematów do ściągi z Filozofii
spi do sciagi, (1)1
galwas do sciagi
pytania do ściągi
matka do sciagi z socjologii
spis treści do ściągi z fizyki
Spis treści do ściągi z folderu mikra. Sciąga mała, I rok, mikroekonomia-wykl
Metodyka - Do ściągi, metodyka
wszystko do sciagi, STUDIA, na studia, pedagogika
do ściągi, studia pedagogiczne, Rok 4, Nowoczesne tendencje w dydaktyce
egz botanika do sciagi, Botanika
Ściąga fota dane do ściągi, studia, MSU - geo gosp, sem III, CPO, od Moni
moje opracowanie tez do zaliczenia
spis tresci do sciagi
testy wszystkie razem do sciagi
spis treści do ściągi
historia reformacja, Luteranie : zapoczątkował reformację w 1517 - przybił 95 tez do kościoła w Witt
więcej podobnych podstron