AKADEMIA TECHNICZNO-ROLNICZA W BYDGOSZCZY WYDZIAŁ MECHANICZNY |
|
LABORATORIUM: fizyki
|
|
Ćwiczenie nr 20 Temat: Wyznaczanie stosunku cp /cv dla powietrza metodą Clement-Desermes'a
|
|
Imię i nazwisko: Sebastian Kęciński Studium inż. Semestr III Grupa D |
|
Tabela pomiarowa:
Część teoretyczna:
Ciepło
Jest to ilość energii, którą trzeba dostarczyć 1 kg tego ciała aby jego temperaturę podnieść o 1[K]. W układzie SI jednostką ciepła właściwego jest [ J / kg . K ]. Ciepło właściwe ciała zależy od rodzaju substancji, z której ciało jest zbudowane, temperatury a w przypadku gazów od rodzaju przemiany. Dla gazów definiujemy ciepło właściwe przy stałej objętości cv i przy stałym ciśnieniu cp.
Stała gazowa
Różnica ciepła molowego przy stałym ciśnieniu i przy stałej objętości jest dla wszystkich gazów stała I równa uniwersalnej stałej gazowej R ale pod warunkiem, że spełniają one prawa gazu doskonałego.
R = cp /cv
W teorii kinetycznej gazów korzystamy nieraz ze stosunku ciepeł molowych cp /cv oznaczonego zwykle literą κ. Jak wynika ze wzorów dla gazu doskonałego
f - stopień swobody
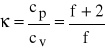
Dla gazów jednoatomowych (np. Ne, Ar) f =3 zatem κ = 1,667.
Dla gazów dwuatomowych (np. O2 , N2 ) f = 5 zatem κ = 1,4
Dla gazów trój lub więcej atomowych ( np. H2O , C2H2OH) f =6 stąd κ = 1,33
Część doświadczalna
W balonie szklanym B o objętości kilkudziesięciu litrów zamknięty jest gaz (powietrze) pod ciśnieniem p1 , wyższym od ciśnienia atmosferycznego p3 o około 10 cm H2O. Na wykresie pV stanowi temu odpowiada punkt pierwszy.
Otwieramy zawór kulkowy 2 na około 3 sekundy powodując adiabatyczne rozprężanie gazu. Ciśnienie w butli spada do ciśnienia atmosferycznego, więc Δpad = p1. Na wykresie jest to przejście z punktu 1-3 po adiabacie p.Vκ=const. Po zamknięciu zaworu gaz powoli ogrzewa się, a jego ciśnienie wzrasta do wartości p2 odpowiadającej punktowi 2. Punkty 2 i 3 leżą na tej samej izochorze ponieważ przemiana odbywa się przy stałej objętości. Ze względu na stałość temperatury otoczenia punkty 1 I 2 leżeć muszą na tej samej izotermie pV=const.
Aby znaleźć związek między k, a p2 I pad wykonujemy naastępujące działania na równaniach
ln p + k . ln V = l ln p + ln V = C1
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Ponieważ ciśnienie pI mierzymy za pomocą manometru wodnego więc zachodzi związek pI =pgh stąd
![]()
W naczyniu zamkniętym kranem I połączonym manometrem znajduje się gaz, który zostaje poddany trzem przemianom:
izotermicznej (3-1)
adiabatycznej (1-2)
izochorycznej (2-3)
1
p1
p2
p3
2
3
V
P
1
p1
p2
p3
2
3
V
P
V1
V2
Wyszukiwarka
Podobne podstrony:
laborka na za tydzień, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
WYZNACZANIE CIEP A MOLOWEGO, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
01, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
PR FALI, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
NAPI C 1, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Ćw 12 a, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Wyznaczanie równoważnika elektrochemicznego miedzi, laboratorium fizyczne, Laboratorium semestr 2 RÓ
37 - wersja 1, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Ćw. 1, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
Wahadło torsyjne, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
teoria do 6, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
ćw 5, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
fiz. 1, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
ćw. 06 lab-fiz, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
fiza5, laboratorium fizyczne, Laboratorium semestr 2 RÓŻNE
więcej podobnych podstron