nr cwicz. 12 |
data
|
Krzysztof Pittner |
Wydzial Technologii chemicznej |
Semestr II |
grupa IPC |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Rozdział przez strącanie
Wstęp teoretyczny
Jeżeli jon ![]()
reaguje z jonem ![]()
tworząc trudno rozpuszczalny związek Mato reakcje oraz równowagi tworzenia oraz rozpuszczania się osadu możemy zapisać następująco:
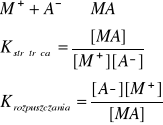
w przypadku osadów trudno rozpuszczalnych szczególnie duże znaczenie ma stała reakcji rozpuszczania, którą można uprościć do następującej postaci:
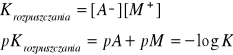
wielkość tą nazywamy iloczynem rozpuszczalności. Określa się ją jako iloczyn jonów pozostających w równowadze z osadem. Iloczyn rozpuszczalności jest stały dla określonej substancji oraz temperatury. ,czyn rozpuszczalności trudno rozpuszczalnego związku ![]()
wyraża się wzorem: ![]()
Rozpuszczalność substancji trudno rozpuszczalnych może być określona liczbowo w dwojaki sposób: albo jako iloczyn rozpuszczalności albo jako rozpuszczalność, którą podaje się jako ilość moli lub gramów substancji na litr rozpuszczalnika. Strącanie osadu w roztworze rozpoczyna się gdy iloczyn stężeń jonów przekroczy iloczyn rozpuszczalności. Najpierw strącają się związki o niższym iloczynie rozpuszczalności.
Wykonanie ćwiczenia
Strącanie soli jako funkcja Ir.
Zmieszać w probówce 5 cm3 roztworu Pb(NO3)2 z 6 cm3 1 M NaCl. Wstrząsać a następnie odwirować wytrącony osad. Do przesączu dodać roztwór Na2SO4 i powstały osad odwirować natomiast do roztworu dodać Na2S. Obserwować zjawiska zachodzące w kolejnych etapach ćwiczenia.
![]()
wytrącił się szary osad a roztwór nabrał mleczno białego koloru. Podczas mieszania roztwór stał się przezroczysty, ilość osadu się zwiększyła. Po dodaniu Na2SO4 i odwirowaniu nic się nie zmieniło. Pierwsza cześć ćwiczenia nie został a wykonana ze względu na brak odczynnika Na2S.
obliczenia iloczynu rozpuszczalności:

Przygotować 2 probówki z 1 - 2 cm3 0,01 M roztworu jonów Ba2+. Do pierwszej probówki dodać 2 - 3 cm3 buforu octanowego, a następnie 0,5 M K2CrO4. Do drugiej probówki dodać tylko roztwór chromianu potasu. To samo ćwiczenie wykonać dla 0,01 M roztworu soli Sr2+.
W probówce, w której nie było buforu reakcja zaszła natychmiast z wytrąceniem mętnego żółtego osadu.
![]()
natomiast w probówce, w której dodatkowo znajdował się również bufor octanowy można było odróżnić dwie warstwy. W pierwszej warstwie znajdowały się nie przereagowane jony Ba2+ .W drugiej warstwie znajdowały się jony chromu. Po pewnym czasie zaczął się strącać osad ale było go mniej niż w probówce z buforem.
Strącanie wodorotlenku glinu roztworem soli słabych kwasów. Przygotować 2 probówki z 1 - 2 cm3 jonów Al3+. Do pierwszej dodać roztwór, Na2CO3, a do drugiej roztwór Na2SO3.
UWAGA ! Roztwór siarczanu (IV) sodu przygotować bezpośrednio przed wykonaniem ćwiczeniem.
Po dodaniu do roztworu Na2SO3 nie zaobserwowano zmian, natomiast po dodaniu Na2CO3 roztwór zmętniał i wytrącił się osad.
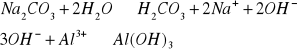
1.2.2 Rozpuszczanie osadów w wyniku reakcji kompleksowania..
Strącić osad HgS, odwirować go, przemyć i podzielić na trzy części. Do probówek zawierających osad HgS dodać:
Kwasu solnego
Wody królewskiej [mieszanina (1:3) HNO3 : HCl]
Mieszanina (1:2) HCl : KJ
Probówki lekko podgrzać i obserwować zachowanie się osadu.
W pierwszej probówce po dodaniu HCl nie zaobserwowano zmian.
W drugiej probówce po dodaniu wody królewskiej pojawiło się ciemno żółte zabarwienie, pojawiły się również bąbelki gazu, co świadczy przebiegu reakcji.
W trzeciej probówce po dodaniu HCl:KJ na początku nic się nie działo. Po podgrzaniu reakcja zaczęła zachodzić bardzo energicznie jak w probówce 2.
![]()
1.3 Amfoteryczność a reakcje strącania.
1.3.1 Do probówki wprowadzić kilka kropel roztworu jonów Al3+. Następnie dodawać po kropli roztwór 0,1 M NaOH. Po każdym dodaniu kontrolować pH roztworu nanosząc kroplę roztworu na papierek uniwersalny. Wytrącony osad rozpuścić dodając 0,1 M NaOH.
Ćwiczenie powtórzyć dla następujących jonów metali: Zn2+, Sn2+, Pb2+, Sb3+.
UWAGA ! Roztwór soli Sn2+ przygotować bezpośrednio przed ćwiczeniem.
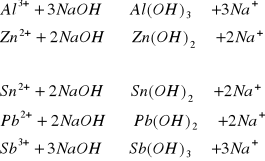
Zmiana stopnia utlenienia a strącanie osadów.
1.4.1Strącanie osadów MnO(OH)2 w wyniku reakcji redoks.
Do jednej probówki wprowadzić roztwór soli Mn2+, a następnie NaOH i 1 - 2 krople H2O2. Do drugiej probówki wprowadzić roztwór MnO4-, a następnie dodać roztwór Cr2(SO4)3 oraz 2 krople 1 M H2SO4. Lekko ogrzewać.
![]()
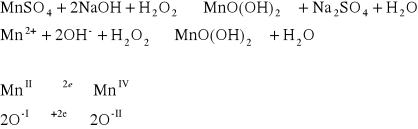
Po dodaniu NaOH do roztworu soi zawierającej jon Mn2+ (beżowa barwa roztworu), następnie dodano 2 krople H2O2 i po pewnym czasie wytrącił się dwuwarstwowy osad. Pierwsza warstwa miała kolor brązowy a druga była beżowa.
W drugiej probówce KMnO4 po dodaniu roztworu Cr2(SO4)3 nic się nie zmieniło. Następnie po dodaniu 2 kropel H2SO4 i podgrzaniu roztwór zmienił barwę na czerwono-brunatną.
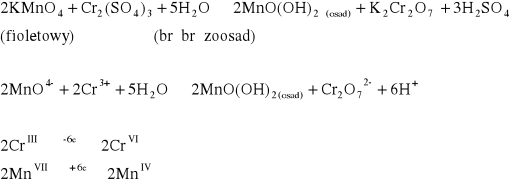
Strącanie barwnych osadów a reakcja redoks.
Do probówki wprowadzić roztwór soli Fe3+, a następnie wprowadzić parę kropli 2 M HCl i K3[Fe(CN)6]. Do otrzymanej mieszaniny wprowadzić świeżo przygotowany roztwór soli cyny(II). Obserwować zachodzące zmiany w roztworze.
Po dodaniu jonów żelaza i HCl K3[Fe(CN)6] powstał ciemno niebieski roztwór z zawiesiną (błękit pruski). Po dodaniu świeżo przygotowanej soli cyny osad się rozpuścił.
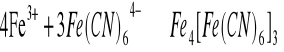
Kation |
pH występowania w postaci |
||
|
Men+ |
Me(OH)n |
hydroksokompleks |
Al3+ |
Al3+ |
Al(OH)3 |
[Al(OH)6]3- |
Zn2+ |
Zn2+ |
Zn(OH)2 |
[Zn(OH)4]2- |
Sn2+ |
Sn2+ |
Sn(OH)2 |
[Sn(OH)4]2- |
Pb2+ |
Pb2+ |
Pb(OH)2 |
[Pb(OH)4]2- |
Sb3+ |
Sb3+ |
Sb(OH)3 |
[Sb(OH)6]3- |
Wnioski
O rozpuszczalności związków decyduje iloczyn rozpuszczalności. Najpierw strącają się związki o małym iloczynie rozpuszczalności. W zależności od iloczynu rozpuszczalności możemy zaliczyć daną sól do soli słabo lub dobrze rozpuszczalnych. W ćwiczeniu 1.2.1 możemy zauważyć, że przy pH kwasowym osad chromianu baru strąca się w małych ilościach. Reakcje strącania osadów dzięki powstawaniu barwnych osadów mogą być reakcjami charakterystycznymi dla danego pierwiastka oraz pomocnymi w jego wykrywaniu. Mimo usilnych starań nie udało się ustalić produktów reakcji w ćwiczeniu 1.2.2.
Wytrącił się biały osad
Biały osad
Biały osad
Biały osad
Wyszukiwarka
Podobne podstrony:
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
sprawko cw2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z kompleksów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
sprawko z redoskow, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organ
sprawko cw1 wersja 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron