nr cwicz. 1 |
data
|
|
Wydzial Technologii chemicznej |
Semestr II |
grupa D |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Skala pH
Wstęp teoretyczny:
Zgodnie z definicją kwasów i zasad według Bronsteda kwasem jest substancja zdolna do oddania protonów a zasadą substancja do przyłączenia protonu i związane są zależnością:
![]()
gdzie HA to kwas a ![]()
sprzężona z nim zasad. Reakcja odszczepienia protonu może przebiegać tylko wtedy gdy w środowisku reakcji znajduje się zasada zdolna te proton przyjąć. Dużą rolę w określaniu siły kwasu lub zasady ma rozpuszczalnik. Rozróżniamy 4 typy rozpuszczalników:
- protonoakceptorowe: są to rozpuszczalniki zasadowe, które łatwo przyłączają protony a wiec w ich środowisku kwas będą dobrze dysocjowane
- protonodonorowe: są to rozpuszczalniki o charakterze kwaśnym. W ich środowisku zasady są dobrze dysocjowane
-rozpuszczalniki amfoteryczne np. woda: są to rozpuszczalniki, które mogą zachowywać się jak kwas bądź zasady w zależności od tego z czym reagują.
- rozpuszczalniki aprotonowe: są to rozpuszczalniki nie zdolne do przyłączenia protonu.
Podczas reakcji autoprotolizy wody zachodzi następująca reakcja:
![]()
której stechiometryczną równowagę można zapisać jako: 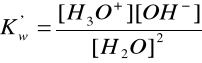
ponieważ wartość ![]()
jest stałą i wynosi ![]()
=55,5 otrzymuje się: ![]()
. Wyrażenia te określa się jako iloczyn jonowy wody, który w warunkach normalnych wynosi ![]()
.
Po zlogarytmowaniu wyrażenie otrzymujemy ![]()
a wiec pKw= pH + pOH. Analizując powyższe równania można wyciągnąć wniosek, że w roztworze obojętnym jakim jest woda pH= pOH=7 stąd wniosek, że roztwory o pH<7 mają odczyn kwaśny a o pH>7 zasadowy.
Wykonanie ćwiczenia
Skala pH
Do kolbki miarowej o pojemności 25 cm3 wprowadzić pipetą 2,5 cm3 1 M roztworu
HCl i dopełnić wodą destylowaną do kreski i po wymieszaniu roztwór wylać do zlewki na 25 cm3. Z tak przygotowanego 0,1 M roztworu HCl pobrać 2,5 cm3 i przenieść roztwór do kolbki miarowej na 25 cm3 i uzupełnić wodą destylowaną do kreski; otrzymujemy roztwór o stężeniu 0,01 M. W ten sam sposób przygotować roztwory o następujących stężeniach 0,001 M; 0,0001 M; 0,00001 M HCl.
Przed przystąpieniem do pomiarów należy pH-metr skalibrować ( do zlewki na 25 cm3 wlać około 20 cm3 roztworu wzorcowego pH; opuścić elektrodę do zlewki i ustawić pH na wartość pH roztworu wzorcowego).
Te same czynności powtórzyć z roztworem 1 M NaOH ( do rozcieńczeń używać tylko wody świeżo destylowanej i schłodzonej do temperatury pokojowej).
pH zmiany barwy wskaźników :błękitu tymolowego, oranżu metylowego, fenoloftaleiny i czerwieni metylowej.
Do zlewki o pojemności 50 cm3 wprowadzić 10 cm3 roztworu 0,1 M HCl i 5 kropli odpowiedniego wskaźnika. Następnie mieszając dodawać powoli roztwór 0,1 NaOH początkowo po 2 cm3, później mniejsze porcje jednocześnie mierząc pH roztworu w pobliżu punktu zmiany barwy wskaźnika. Dla usprawnienia wykonania ćwiczenia, przeprowadzić próbę wstępną, dodając wodorotlenek sodu w sposób ciągły kroplami i odczytać objętość wodorotlenku przy której nastąpiła zmiana barwy wskaźnika.
Opracowanie wyników
Cw 1
Stężenie molowe kwasu:HCl |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
1,6 |
2,3 |
3,2 |
4,3 |
5,4 |
|
Stężenie molowe zasady:NaOH |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
12,2 |
11,6 |
10,6 |
9,06 |
7,3 |
|
Stężenie molowe kwasu: CH3COOH lub (COOH)2 |
0,1 |
0,01 |
0,001 |
0,0001 |
0,00001 |
|
pH |
2,75 |
3,42 |
4,08 |
4,73 |
5,5 |
|
Wyszukiwarka
Podobne podstrony:
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
sprawko cw2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawko z kompleksów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
sprawko z redoskow, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organ
sprawko cw1 wersja 2, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie org
laborki cw1, Polibuda, II semestr, fizyka, FIZA, lab
Cw1 Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
więcej podobnych podstron